高三化学第一章打开原子世界的大门知识点
《打开原子世界的大门》复习
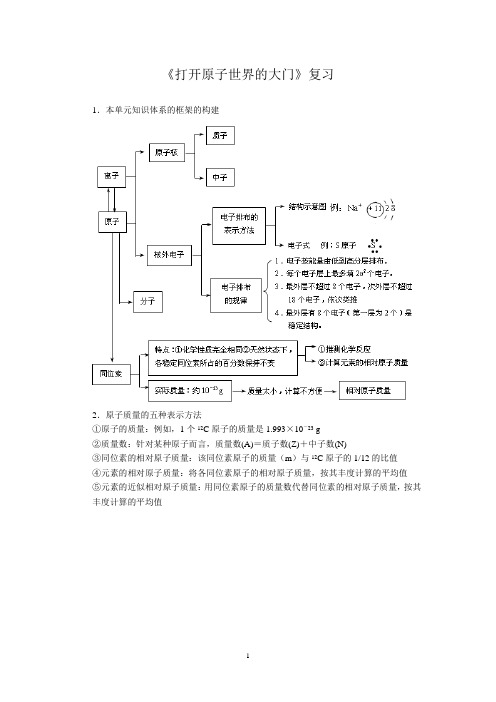
《打开原子世界的大门》复习1.本单元知识体系的框架的构建2.原子质量的五种表示方法①原子的质量:例如,1个12C原子的质量是1.993×10-23 g②质量数:针对某种原子而言,质量数(A)=质子数(Z)+中子数(N)③同位素的相对原子质量:该同位素原子的质量(m)与12C原子的1/12的比值④元素的相对原子质量:将各同位素原子的相对原子质量,按其丰度计算的平均值⑤元素的近似相对原子质量:用同位素原子的质量数代替同位素的相对原子质量,按其丰度计算的平均值例题:下表是元素周期表中核电荷数为3~10的元素的某种性质的一组数据(所列数据的单位是相同的)。
除带“……”的四种元素外,其余元素都给出了该种元素性质的全部数据。
研究这些数据:(1)每组数据可能是该元素的_________。
(A)原子得到电子所放出的能量(B)原子形成不同分子时的半径大小(C)原子逐个失去电子所吸收的能量(2)分析各元素原子的第一个数据,随原子的质子数递增:①总体变化的趋势是____(填“增大”或“减小”);②与前后元素相比,由于该元素的数值增大得较多而有反常的元素是________、________。
(3)根据以上规律,推测镁与铝的第一个数据的大小:Mg________Al。
(4)同一种元素的一组数据是约以倍比关系增大,可能的原因是_________。
(A)失去部分电子后,成为带正电荷的离子,再失去电子就难(B)失去部分电子后,微粒半径减小,再失去电子就难(C)得到部分电子后,成为带负电荷的离子,再得到电子就难(5)每种元素的一组数据中个别地方增大的比例特大,形成突跃,请找出这些数据出现的规律,你认为氧元素出现该情况的数据应该是8个数据中的第_____个。
(6)上述规律可以证明原子结构中的核外电子是_________。
(A)分层排布的(B)按原子半径递增排布的(C)能量不同的《打开原子世界的大门》复习作业班级____________学号___________姓名____________________1.具有下列电子数的微粒,能确定它的质子数的是()。
高一化学第一章打开原子世界的大门总结

一、原子结构学说的发展历程及原子结构模型的演变 1.古代朴素的原子观:我国战国时期的惠施认为物质是___________;我国战国时期的墨翟认 为物质___________;古希腊哲学家德谟克利特提出___________(原子是构成物质的微粒, 万物是由不可分割的原子构成的) 。 2.英国科学家___________提出近代原子学说——实心球模型: ①物质由原子组成; ②原子在化 学变化中不可再分割,它们在化学变化中保持本性不变。 3.英国科学家_______发现了______的存在,并由此提出了原子的“葡萄干面包”模型:原子的 正电荷均匀分布在整个原子的球体内,电子则均匀地分布在这些正电荷之间。 注: (1)德国物理学家威廉•康拉德•伦琴 1895 年发现了___________; (2)法国物理学家安东尼•亨利•贝克勒尔确认了铀盐和纯铀具有___________; 电子的发现和元素的放射性现象说明原子是可再分的。 4.英国物理学家_________提出了原子结构的行星式模型: 带负电的电子绕着带正电的原子核运 动,就像行星绕太阳运转一样。 卢瑟福的α 粒子散射实验
4
17.两种微粒含有相同的质子数和电子数,这两种微粒可能是___________________(填序号) ①两种不同的原子;②两种不同元素的原子;③一种原子和一种分子; ④一种原子和一种离子;⑤两种不同分子;⑥一种分子和一种离子; ⑦两种不同阳离子;⑧两种不同阴离子; ⑨一种阴离子和一种阳离子. 18..用正确的序号填空:①12C、13C、14C; ③H2O 和 D2O;④CH3CH2OH 与 CH3OCH3; 互为同位素的是______________________; 互为同素异形体的是_________________; 互为同分异构体的是_________________; 互为同系物的是________________________. 19.已知 A、B、C、D 均是 1~20 号元素,核电荷数依次增大。其中 B、C、D 的内层电子数为 10,原子核外只有一个未成对电子.A 原子核外有 2 个未成对电子. (1)D 离子的电子式是_______________________; (2)C 原子的核外电子排布为_______________________; (3)B 离子的结构示意图是_______________________; (4)A 元素的元素符号为_______________________. 20.(1)已知 A.质子数,B.中子数,C.核外电子数,D.最外层电子数,用序号回答下列问题. ①原子种类由_________________决定; ②元素种类由_________________决定; ③元素的化合价由______________决定. 18 18 1 (2) 2.0g 由 1 该水分子的物质的量为___________, 含中子数为__________; 1 ������ 和 8 ������构成的水 1 ������ 2 8 ������, (3)核内中子数为 N 的 R2+,质量数为 A,则该离子的核外电子数为____________________ ②红磷和白磷; ⑤CH4 和 CH3CH3;
高一化学第一章打开原子世界的大门

高一化学_第一章_打开原子世界的大门_知识点梳理【知识梳理】一、原子结构学说的发展历程及原子结构模型的演变1、古代朴素的原子观:我国战国时期的惠施认为物质是无限可分的;我国战国时期的墨翟认为物质被分割是有条件的;古希腊哲学家德谟克利特提出古典原子论(原子是构成物质的微粒,万物是由间断的、不可分割的微粒即原子构成的,原子的结合和分割是万物变化的根本原因)。
2、英国科学家道尔顿提出近代原子学说——实心球模型:①物质由原子组成;②原子不能创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变。
3、汤姆生的“葡萄干面包式”原子结构模型:①原子中存在电子,电子的质量为氢原子质量的1/1836;②原子中平均分布着带正电荷的粒子,这些粒子之间镶嵌着许多电子。
4、英国物理学家卢瑟福的“行星式”原子结构模型(核式原子结构模型):①原子由原子核和核外电子组成,原子核带正电荷,位于原子的中心,电子带负电荷,在原子核周围作高速运动;②电子的运动形态就像行星绕太阳运转一样。
5、丹麦物理学家玻尔的轨道原子结构模型:他引入量子论观点,提出原子核外,电子不是随意占据在原子核的周围,而是在固定的层面上运动,当电子从一个层面跃迁到另一个层面时,原子便吸收或释放能量。
6、现代原子结构学说——电子云模型:用电子在给定时间内在空间的几率分布的图像来描述电子的运动,这些图像就是电子云。
电子出现几率密度大的地方,“浓密”一些;几率密度小的地方,电子云“稀薄”一些。
但电子云的正确意义并不是说电子真的像云那样分散,电子云只是一种几率云。
二、原子结构和相对原子质量1、元素:具有相同核电荷数(即质子数)的同一类原子叫做元素。
2、原子的构成:3、质量数:忽略电子的质量,将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值,X)叫做质量数,用符号A表示。
(AZ注:4、构成原子或离子粒子间的数量关系①质量数(A)=质子数(Z)+中子数(N)②原子中:核电荷数(Z)=质子数=原子序数=核外电子数③阳离子中:核电荷数(Z)=质子数=原子序数=核外电子数+离子电荷数④阴离子中:核电荷数(Z)=质子数=原子序数=核外电子数-离子电荷数5、(1)同位素:具有相同质子数和不同中子数的同一种元素的原子互称为同位素。
第一章打开原子世界的大门

第一章 打开原子世界的大门§1-1从葡萄干面包模型到原子结构的行星模型一、从古典原子论到葡萄干面包原子模型1、古典原子论2、道尔顿的原子学说3、葡萄干面包原子模型二、从X 射线的发现到元素放射性的发现1、X 射线的发现2、元素放射性的发现3、α、β和γ射线的发现⑴一部分辐射偏向连接电源负极的极板~带正电荷的微粒~α辐射~α粒子是He 2+ ⑵另一部分辐射偏向连接电源正极的极板~带负电荷的微粒~β辐射~β射线是电子流 ⑶第3种辐射~不带电荷~γ射线~波长很短的电磁波结论:原子是可分的,并且具有复杂的结构。
三、原子结构的行星模型α粒子轰击金箔即α粒子的散射实验现象1:绝大部分α粒子都穿过了金箔 说明:原子是中空的现象2:极少数α粒子穿过金箔时发生了偏转,个别α粒子偏转了180°,弹了回来。
说明:原子中存在一个体积很小,正电荷集中,质量很大的核。
§1-2考古断代 同位素和相对原子量一、原子核构成原子的微粒及其性质:课本P11/表格关系式:(1)电性守恒:核电荷数=核内质子数=核外电子数=原子序数(2)质量数=质子数+中子数 (A=Z+N )元素符号角标意义:例题:35 17Cl 16 O 24 12Mg 2+ 32 16S 2- 3717Cl 2二、同位素 ±a A Z X c b ±1、 定义:具有相同质子数而不同中子数的原子互称为同位素。
2、 性质:(1)同位素的化学性质基本相同(2)对存在等同位素的元素,不论这种元素是处于化合态还是游离态,各种同位素原子所占的百分比是不变的。
三、碳-14测定考古年代1、 半衰期2、 原理3、年代的计算方法:C K =C 0(1/2)xC K —文物中C-14的浓度 C 0—大气中C-14的浓度 x —半衰期个数四、相对原子质量的求算1、同位素的相对原子质量2、元素的(精确)平均相对原子质量(即元素的相对原子质量)——该元素所含各同位素的相对原子质量按丰度(原子百分比)计算的平均值例题2:根据下列实测数据计算氧的平均相对原子质量同位素 丰度(%) 相对原子质量16 O 99.759 15.99517 O 0.037 16.99118 O 0.204 17.9913、元素的近似相对原子质量例题3:氯元素在自然界有两种同位素35 17Cl 与37 17Cl ,它们的相对原子质量分别为34.969和36.966,氯元素的相对原子质量为35.453,求35 17Cl 与37 17Cl 的丰度。
高一-高三化学知识点

高一第一学期1、打开原子世界的大门1.1从葡萄干面包模型到原子结构的行星模型1.2原子结构和相对原子质量1.3揭开原子核外电子运动的面纱2、开发海水中的卤素资源2.1以食盐为原料的化工产品2.2海水中的氯2.3从海水中提取溴和碘3、探索原子构建物质的奥秘3.1原子间的相互作用3.2离子键3.3共价键4、剖析物质变化中的能量变化4.1物质在溶解过程中有能量变化吗?4.2化学变化中的能量变化高一第二学期5、评说硫、氮的“功”与“过”5.1从黑火药到酸雨5.2认识物质的量浓度5.3硫酸5.4化学肥料中的主角第五章上课将所有知识过一遍至少需要4次课。
6、提示化学反应速率和平衡之谜6.1化学反应为什么有快有慢6.2反应物如何尽可能转变成生成物6.3化工生产能否做到又快又多。
第六章高考中大概会占到11分左右,但是不包含隐藏性的问题,这是高考的重点。
,一般仅将知识点过一遍需要至少4次课左右。
7、探究电解质溶液的性质7.1电解质的电离7.2研究电解质在溶液中的化学反应7.3盐溶液的酸碱性7.4电解质溶液在通电情况下的变化第七章一般仅将知识点过一遍需要至少4次课左右。
(只讲基本的知识)高二的上学期8走进精彩纷呈的金属世界8.1应用广泛的金属材料-钢铁8.2铝和铝合金的崛起9、初识元素周期律9.1元素周期律9.2元素周期表第九章为高考必考章节10、学习集中定量测量方法10.1测定1mol气体的体积10.2结晶水何物中结晶水含量的测定10.3酸碱滴定第十章考查机率不大,但是分值很高。
高二第二学期11、认识碳氢化合物的多样性11.1碳氢化合物的宝库—石油11.2石油化工的龙头-乙烯11.3煤化工和乙炔11.4一种特殊的碳氢化合物-苯12、初识生活中的一些含氧有机化合物12.1杜康酿酒话乙醇12.2醋和酒香12.3家庭装潢说甲醛13、检验一些无机化合物13.1离子的检验13.2混合物的检验。
有机知识在高考中的分值很高达到了24-26分,一般讲完知识点,至少需要11次课左右。
高中化学 第一册 第一章 打开原子世界的大门 1.1 从葡萄干面包模型到原子结构的行星模型素材 沪科版

第一章打开原子世界的大门 1.1 从葡萄干面包模型到原子结构的行星模型资料提供:卢瑟福α粒子散射实验:(1)实验装置:铅盒内放有少量放射性元素钋,向外发射具有一定能量的α粒子,一束α粒子射线射到金箔上。
穿过金箔的α粒子打到荧光屏上产生一个亮点,用显微镜可以观察到,整个装置放在真空容器中。
(2)实验现象:绝大部分α粒子穿过金箔后仍然沿原来方向前进;少数α粒子发生较大偏转,极少数α粒子偏转角大于90°,甚至有的α粒子原路返回。
(3)分析实验现象:绝大部分α粒子不改变运动方向,说明穿过时没受到阻碍。
少数α粒子有较大偏转。
其原因是这部分α粒子受到斥力的作用,施力者不是电子,因电子质量太小,只能是有一个带正电的大质量的“物体”、极少数α粒子方向改变180°,只能是带正电α粒子与大质量“物体”正碰的结果。
比较绝大多数、少数、极少数,可知一定有一个体积很小“物体”存在,且带正电,集中了几乎原子的全部质量,得到原子核式结构的结论。
玻尔原子理论:1913年提出。
1.原子只能处于一系列不连续的能量状态中,这些状态是稳定的叫定态。
2.原子从一种定态(设其能量为EM),跃迁到另一个定态(设其能量为EN)时,它辐射或吸收一定频率的光子。
光子的能量与两个定态能量之差的关系是:h·v=EM-EN。
3.原子的不同能量状态对应于电子的不同运行轨道,电子的可能轨道是不连续的。
卢瑟福一.生平简介:(Ernest Rutherford, 1871—1937)英国物理学家。
1871年8月30日生于新西兰纳尔逊的一个手工业工人家庭。
1895年在新西兰大学毕业后,获得英国剑桥大学的奖学金进入卡文迪许实验室,成为汤姆孙的研究生。
1919年接替退休的汤姆孙,担任卡文迪许实验室主任。
1925年当选为英国皇家学会主席。
1931年受封为纳尔逊男爵,1937年10月19日因病在剑桥逝世,与牛顿和法拉第并排安葬,享年66岁。
第一单元打开原子世界的大门

教学目标要求1. 了解各个阶段原子结构模型的要点及演变2. 理解原子的组成及同位素的概念3.掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
4.以第1-20的元素为例,掌握核外电子排布规律1.1从葡萄干面包模型到原子结构的行星模型原子结构模型的演变(1) 公元前5世纪,古希腊哲学家指出,原子是构成物质的微粒。
(2) 道尔顿(英国)的近代原子学说。
(3) 汤姆生的“葡萄干面包”原子结构模型图1.8的理解:电性,质量大小 (由学生看图分析)(4) 卢瑟福的带核原子结构模型图1.9分析说明讨论要点的正确部分和错误的部分(5) 玻尔的轨道原子结构模型补充(6) 电子云模型(现代原子结构学说)补充1.2原子结构和相对原子质量(1) 构成原子的微粒间的电性关系:核电荷数=核内质子数=核外电子数(2) 构成原子的微粒间的质量关系:质量数(A )=质子数(Z )+中子数(N )(3) 原子核质量大,体积小。
(4) 符号cZ Xb a A ±±的意义:一个质量数为A 、质子数为Z 的原子,C 为构成一个分子中的原子个数,a 为化合价,b 为离子电荷。
二.离子:带电荷的原子或原子团三.元素、核素、同位素(1) 元素:具有相同核电荷数(质子数)的同一类原子的总称。
① 决定元素种类的是核电荷数(质子数)。
② 元素只讲种类、讲质量,不讲数量。
如5g 氧元素,Cl 、S 两种元素,但不能讲几个元素。
(2) 核素:具有一定质子数和一定中子数的原子称为一种核素。
(3)同位素:①定义:质子数相同、质量数(或中子数)不同的原子互称同位素;②“同位”即在周期表中同一位置,占同一格;“同位”即质子数、电子数、电子排布、元素符号相同,化学性质几乎完全相同;③同位素各原子质量不同(决定质量的是质子数和中子数);④天然存在的稳定同位素,无论存在于游离态还是化合态中,各种同位素原子百分比(个数百分比,非质量百分比)一般是不变的;⑤小结:决定元素种类:质子数决定原子种类:质子数和中子数决定元素化学性质:主要最外层电子数(次要电子层数多少)知识拾零1.核外有10个电子的微粒:(1)分子:Ne、HF、H2O、NH3、CH4。
化学高一第1章笔记(全部)

第一章打开原子世界大门§1.1 从葡萄干面包模型到原子结构的行星模型一、从古典原子论到葡萄干面包原子模型:1、古代对物质的认识:惠施:物质是无限可分的。
墨子:物质分割是有条件的,当物质不能被分割时,这种不能分割的部分称为“端”。
古希腊德谟克利特:物质只能分割到原子,提出原子是构成物质的最小微粒。
2、近代对原子的认识:(1)19世纪初,英国物理化学家道尔顿提出原子论:①化学元素由不可再分的微粒构成,这种微粒称为原子。
(不正确)②原子在一切化学变化中均保持其不可再分性。
(不正确)③同种元素的原子质量和性质相同,不同种元素的原子质量和性质不同。
(不正确)④构成化合物的原子按简单整数比结合。
(正确)注:③中,“同种元素的原子化学性质是相同的”这一句正确。
④中,“原子与原子之间结合时,都是以简单的整数比化合的”。
(2)20世纪初,汤姆孙发现电子,指出:原子中正电荷(当时没有质子概念)所带的电量与电子所带的负电荷电量相等。
提出葡萄干面包原子模型,认为原子中的正电荷均匀地分布在整个原子的球形体内,电子则均匀地分布在这些正电荷之间。
二、从X射线到元素放射性发现:1、德国物理学家伦琴发现X射线:X射线穿透力强。
2、法国物理学家贝克勒尔发现放射性:说明原子有一定结构。
3、英国物理学家卢瑟福发现两种辐射:α辐射和β辐射。
①α辐射是粒子流,是氦正离子(He2+)。
穿透力弱。
②β射射是电子流。
穿透力弱,穿透力较强。
③γ射线是电磁波。
穿透力强,穿透力很强。
三、原子结构的行星模型:单位换算:1纳米(nm)=10-9m英国物理学家卢瑟福提出原子结构行星模型:①实验现象和结果:绝大部分粒子能直线穿过金箔,说明原子一定是中空的,极少数的粒子能被金箔偏转,有的还被直接弹回来,说明在原子中存在着很小的带正电荷的核。
②行星模型:原子是由带正电荷的质量很集中的很小的原子核和在它周围运动着的带负电荷的电子组成。
§1.2 原子结构和相对原子质量一、原子的构成:1、原子的构成:原子(原子核+核外电子);原子核(质子+中子)a)氢原子(氕、 1 1H)核内无中子,它的其它同位素都有中子( 2 1H有1个中子, 3 1H有2个中子)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学第一章打开原子世界的大门知识点
原子是目前被用来表示化学物质的最小单位,以下是第一章打开原子世界的大门知识点,请大家认真阅读。
1.1从葡萄干面包模型到原子结构的行星模型 1.2原子结构和相对原子质量
1.3揭开原子核外电子运动的面纱 1.对原子结构认识的历程:
古典原子论:惠施、墨子、德谟克利特; 近代原子论:道尔顿;
葡萄干面包模型:汤姆孙; 原子结构行星模型:卢瑟福; 电子云模型:波尔。
了解 2.重要人物及成就:
道尔顿(原子论)、汤姆孙(发现电子及葡萄干面包模型)、伦琴(X射线)、贝克勒尔(元素的放射放射性现象)、卢瑟福(粒子的散射实验及原子结构行星模型)。
3.原子的构成;(看第一章例题)
原子核的组成:质子数、中子数、质量数三者关系;原子、离子中质子数和电子数的关系; ①原子原子核质子(每个质子带一个单位正电荷)质子数决定元数种类 AZ X (+) 中子(不带电) 质子与中子数共同决定原子种类核外电子(-)(带一个单位负电荷)
对中性原子:顾电荷数 = 质子数 = 核外电子数 = 原子垿数对阳离子:核电荷数 = 质子数核外电子数,电子数=
质子数-阳离子所带电荷数如:ZAn+ e=Z-n, Z=e+n
对阴离子:核电荷数 = 质子数核外电子数,电子数=质子数+阴离子所带电荷数
如:ZBm+ e=Z+m, Z=e-m
②质量数(A)= 质子数(Z)+ 中子数(N)。
即 A = Z + N 质量数(A) (原子核的相对质量取整数值被称为质量数)。
将原子核内所有的质子和中子相对质量取近似整数值,加起来所得的数值叫质量数。
4.知道同位素的概念和判断;同素异形体;(看第一章例题) 同位素质子数相同而中子数不同
的同一元素的不同原子互称为同位素。
①同位素讨论对象是原子。
②同位素原子的化学性质几乎完全相同。
③在天然存在的某种元素里,不论是游离态还是化合态,也不论其来源如何不同,各种同位素所占的原子个数百分比保持不变。
(即丰度不变) (见1.2提纲)
5.相对原子质量:原子的相对原子质量、元素的相对原子质量(简单计算);
a (设某原子质量为a g)
①同位素原子的相对原子质量 m12c1/2 此相对质量不能代替元素的相对质量。
②元素的相对原子质量 (即元素的平均相对原子质量)
是某元素各种天然同位素的相对原子质量与该同位素原子
所占的原子个数百分比(丰度)的乘积之和。
即:M = Maa% +
Mbb% + Mcc% +
③元素的近似相对原子质量用质量数代替同位素的相对原
子质量计算,所得结果为该元素的近似相对原子质量。
(看第一章例题) 6.核外电子排布规律:能量高低;理解电子层(K、L、M、N、O、P、Q)表示的意义; ①电子按能量由低到高分层排布。
②每个电子层上最多填2n2个电子。
③最外层不超过8个电子,次外层不超过18个电子,依次类推,(第一层不超过2个) ④最外层电子数为8或第一层为2的原子为稳定结构的稀有气体元素。
7.理解原子结构示意图(1~18号元素)、电子式的含义; 原子、离子的结构示意图;
原子、离子、分子、化合物的电子式。
(见1~20号元素和第三章提纲)
第一章拓展知识点 P173
常用的稀型离子有氖型微粒(电子层结构相同微粒的含义):氖型离子:原子核外为10电子,包括N3、O2- 、F-、Na+、Mg2+、Al3+。
NH4+; 常见10电子微粒:分子(CH4、NH3、H2O、HF);原子(Ne);离子(N3、O2- 、F-、OH-、Na+、Mg2+、Al3+、NH4+ 、H3O+)
第一章打开原子世界的大门知识点的内容就分享到这里,希望对大家提高成绩有一定的帮助。
