第五章 双官能团化合物的切断1
合集下载
重要化合物的切断分析

H2 C O C CH3 + HCO2C2H5 CH3 C2H5ONa C C CH3 CH3 CHO C CH3 (不稳定) O CH3 C C CH3 (稳定) C H O OH C H O ONa
CH3
Example 1:
3-甲基色酮的合成
CH3
O
CH3
CH3
O
OH O CH3
OH
O
CH3 + HCO2C2H5
Br (3) H3O ,加热
CH3CH2O-Na CO2C2H5 HCO C H 2 2 5 OH
CHO CO2C2H5
(1)CN(2)水解 COOH
COOH
逆合成分析:
Ph Ph OH CN + OH CHO OH OH C2H5O2C OH + CH2O OH
OHC
Synthesis:
CH2O CHO K2CO3 OHC HO2C (1)CN OH (2)OH-/H2O OH Ph Ph OH OH OH OH
CO2H
某些可能的负离子片段的相对稳定性可以用来指导进 行切断
O Ph BuO2C Ph CO2Bu
O O Ph BuO2C Ph CO2Bu Ph BuO2C CO2Bu + PhCCl
Ph
Br
+ BuO2C
CO2Bu
各种各样的甲基酮可以用甲酸酯和醇钠加以酰化,产物理 应为β-酮醛,但它们与α-羟亚基甲基酮成为互变异构体, 并几乎完全以后一种形式存在。
CH3COCH3 H
+
OH H3C C CH3 CH3
-H+
OH H3C C CH2
H3C C CH2 + H3C C OH OH
CH3
Example 1:
3-甲基色酮的合成
CH3
O
CH3
CH3
O
OH O CH3
OH
O
CH3 + HCO2C2H5
Br (3) H3O ,加热
CH3CH2O-Na CO2C2H5 HCO C H 2 2 5 OH
CHO CO2C2H5
(1)CN(2)水解 COOH
COOH
逆合成分析:
Ph Ph OH CN + OH CHO OH OH C2H5O2C OH + CH2O OH
OHC
Synthesis:
CH2O CHO K2CO3 OHC HO2C (1)CN OH (2)OH-/H2O OH Ph Ph OH OH OH OH
CO2H
某些可能的负离子片段的相对稳定性可以用来指导进 行切断
O Ph BuO2C Ph CO2Bu
O O Ph BuO2C Ph CO2Bu Ph BuO2C CO2Bu + PhCCl
Ph
Br
+ BuO2C
CO2Bu
各种各样的甲基酮可以用甲酸酯和醇钠加以酰化,产物理 应为β-酮醛,但它们与α-羟亚基甲基酮成为互变异构体, 并几乎完全以后一种形式存在。
CH3COCH3 H
+
OH H3C C CH3 CH3
-H+
OH H3C C CH2
H3C C CH2 + H3C C OH OH
逆向合成分析及其应用

常见的a3-合成子主要有b-羰基正离子,相 应的合成等价体是a, b-不饱和羰基化合物、a, b-不饱和羧基化合物和a, b-不饱和腈。 烯丙基型正离子和炔丙基正离子也可以视 为a3-合成子,它们相应的合成等价体主要为3卤代丙烯、3-卤代丙炔、2-丙烯醇的磺酸酯和2丙炔醇的磺酸酯。 此外,氧杂环丁烷有时也可以充当a3-合成 子的合成等价体。
t-Bu O
t-Bu
反合成子(retron)
反合成元是反合成分析中进行某一转换所必要的结构 单元。例: 对Diels-Alder反应,双烯烃为合成子,而加成产物环 己烯则为该转换的反合成子。 对Robinson反应,产物为反合成子
+ O O
Base O Robinson Rxn
合成树(tree)
O
O
dis
O O
O
O
O
dis +
O
O
五元环
O O
dis
EtO2C O EtO2C
+
EtO2C
CO2Et
O -
O
dis
EtO2C
+
CH2CO2Et
O
CH3CH2COCH2CO2Et
ClCH2CO2Et
dis
O CHO O
CHO
FGI
CHO
dis
-
CH2Br
六元环
CO2CH3 CO2CH3 CO2CH3 CO2CH3 OH+
杂原子的交换
RCl RCH2X RCHO RCOCl R-M (M= Li, MgCl, Cu) RCH=PPh3 S S R
RCO-Fe(CO)4
杂原子的引入
O
OM
高中化学选修五第五章第一节合成高分子化合物的基本方法-课件

①二元酸和二元醇的缩聚 如合成聚酯纤维:
②羟基羧酸的酯化缩聚
(2)氨基和羧基的缩聚 ①氨基酸的缩聚 氨基酸缩聚成聚酰胺或蛋白质 如:nH2NCH2(CH2)4COOH催――化→剂
②含双氨基与含双羧基物质的缩聚 如由间苯二甲酸和间苯二胺制备Nomx纤维:
要点二 由高聚物推单体的方法——
1.判断聚合类型 若链节主链上都是碳原子,一般是加聚反应得到的产 物;若链节主链上含有 等基团时,一般是缩聚反应的产物.
(3)凡链节主链中只有碳原子并存在
键的高聚
物,其规律是“见双键,四个碳,无双键,两个碳”画
线
断开,然后将半键闭合,即将单双键互换.如:
的单体是:
3.缩聚高聚物单体的判断
(1)凡链节为
结构的高聚物,其单体必为
一种,在亚氨基上加氢,在羰基上加羟基,即得高聚物单
体:H2N—R—COOH.
(2)凡链节中间(不在端上)含有肽键(
体.如:
的单体
如下为HOOC—COOH和HOCH2—CH2OH.
由缩聚物推断单体的步骤为: (1)去掉缩聚物结构简式中的方括号与“n”,变为小分子. (2)断开分子中的酰胺键或酯基. (3)将断开的羰基碳上连接—OH;在氧或氮原子上连接—
H,还原为单体小分子.
[例2] 使用有机材料制成的薄膜,给环境造成的“白色 污染”后果十分严重.我国最近研制成功的几种可降解 塑料结构简式如下:
)结构的高
聚物,从肽键中间断开,两侧为不对称性结构的,其
单体必为两种,在亚氨基上加氢原子,羰基上加羟基
即得高聚物单体.如:
是H2NCH2COOH和H2NCH2CH2COOH.
的单体
(3)凡链节中间(不在链端上)含有
②羟基羧酸的酯化缩聚
(2)氨基和羧基的缩聚 ①氨基酸的缩聚 氨基酸缩聚成聚酰胺或蛋白质 如:nH2NCH2(CH2)4COOH催――化→剂
②含双氨基与含双羧基物质的缩聚 如由间苯二甲酸和间苯二胺制备Nomx纤维:
要点二 由高聚物推单体的方法——
1.判断聚合类型 若链节主链上都是碳原子,一般是加聚反应得到的产 物;若链节主链上含有 等基团时,一般是缩聚反应的产物.
(3)凡链节主链中只有碳原子并存在
键的高聚
物,其规律是“见双键,四个碳,无双键,两个碳”画
线
断开,然后将半键闭合,即将单双键互换.如:
的单体是:
3.缩聚高聚物单体的判断
(1)凡链节为
结构的高聚物,其单体必为
一种,在亚氨基上加氢,在羰基上加羟基,即得高聚物单
体:H2N—R—COOH.
(2)凡链节中间(不在端上)含有肽键(
体.如:
的单体
如下为HOOC—COOH和HOCH2—CH2OH.
由缩聚物推断单体的步骤为: (1)去掉缩聚物结构简式中的方括号与“n”,变为小分子. (2)断开分子中的酰胺键或酯基. (3)将断开的羰基碳上连接—OH;在氧或氮原子上连接—
H,还原为单体小分子.
[例2] 使用有机材料制成的薄膜,给环境造成的“白色 污染”后果十分严重.我国最近研制成功的几种可降解 塑料结构简式如下:
)结构的高
聚物,从肽键中间断开,两侧为不对称性结构的,其
单体必为两种,在亚氨基上加氢原子,羰基上加羟基
即得高聚物单体.如:
是H2NCH2COOH和H2NCH2CH2COOH.
的单体
(3)凡链节中间(不在链端上)含有
双官能团
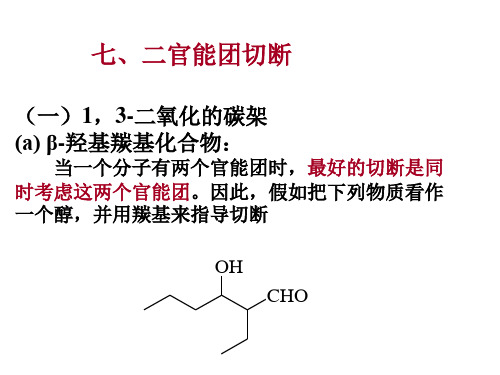
OH CHO TM84
二者的关系在1,3-位,而且分子的碳数是对称的,它正 好来自羟醛缩合:
H OH + B H
O
O H A
O
O H
合成:
O O H 碱 OH H TM84
两个官能团在1,3-位,还涉及到羰基活性的问题:
O H O TM85 H HCHO + OH O
H O A + HCHO 弱碱 TM85
O HO Ph O NMe2 TM110
• 分析如下:
O HO Ph O NMe2 FGI HO COOH + HO APh COOH + O C Ph D B NMe2
HO
COOH Ph
1,3-二氧
• 合成:缩合中需要控制,因为在烯醇化和亲电能 力两个方面,酮C都比酸D要活泼。Reformatsky反 应看来是一个好方法。
5.85
9 10. 21 11 11.2
环戊二烯
PhCOCH3 CH3COCH3 HC≡CH
16
16 20 ~25
CH3COOCH3 24. 5
CH2(CO2Et)2
(CH3SO2)2CH2 (CH3)2CHCHO EtOH
13.3
14 15.5 15.9
CH3CN
Ph3CH CH2=CH2 CH3CH3
O
5
COOEt 稳定的碳负离子
O -不饱和
CO2Et 1,5-二羰基化合物
两个组分:一般是一个活化了的碳负离子和一个αβ不饱和羰基化合物。
分析:对称,两侧切断相同, 试剂丙酮需要活化。
OMe O O 对称 O + O CHO OMe O + OMe
有机化学逆合成分析

试设计以下化合物的合成路线 分析:
合成:
试设计以下化合物的合成路线 分析:
合成:
试设计以下化合物的合成路线 分析:
合成:
试设计以下化合物的合成路线 分析:
合成:
说明:
反应的应用
O
HO
CH2COOC2H5
+ BrCH2COOC2H5
(1) Zn/苯
(2) H2O
CO
H
Ph
+
O
Br
OC2H5
OC2H5
O
Ph
HO
OC2H5
O
Ph
(1) Zn/苯
(2) H2O
H+, △
α,β-不饱和羰基化合物的拆开
本节主要讨论问题: 合成α,β-不饱和醛或酮的反应 α,β—不饱和羰基化合物的拆开通式 逆合成分析举例
例3 试设计以下化合物的合成路线
合成:
例4试设计以下化合物的合成路线 分析:
合成:
例5试设计以下化合物的合成路线 分析:
合成: 例 6 试设计以下化合物的合成路线
分析:
合成:
α-羟基酮的拆开 方法一: 例1试设计以下化合物的合成路线 分析: 合成:
例2 试设计以下化合物的合成路线 分析: 合成:
丙二酸酯参与Knoevenagel的反应 芳香醛和丙二酸酯反应: 脂肪醛和丙二酸酯反应则生成混合产物:
C 制备各种肉桂酸酯 氰乙酸参与的Knoevenagel的反应
例1. 芳醛与氰乙酸酯 例2. 脂肪醛和氰乙酸酯生成混合产物
例3 酮与氰乙酸间发生的缩合反应 例4 其他活泼亚甲基的化合物参与的反应
第五节 1,5—二羰基化合物的拆开 一、迈克尔加成反应 通式:
《官能团的切断》PPT课件
PPh3
method A
切断:1)合理。2)简单。3)原料易得
14
4 Disconnection of Aromatic Ketone
将醇切断成羰基化合物和Grignard试剂----第一种主要切割 将烯键切断成羰基化合物和Wittig试剂----第二种主要切断 将芳香环上脂肪侧链切断---第三种主要切断
7
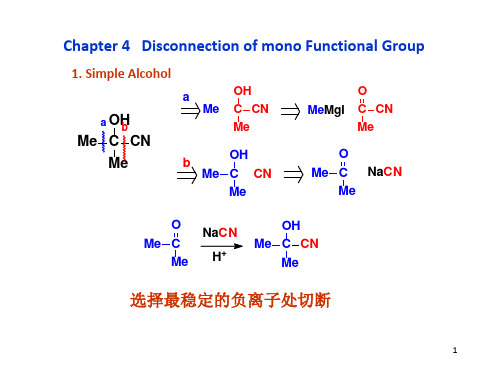
2 Derivatives of alcohol
涉及H-还原时,实际是FGI
RX
ROR
H+
PX3 HX
(O) R OH
(O)
- H2O
R'COCl (R'CO)2O
O C
O C
OH
RO2CR'
遇到上述结构,FGI到醇是一种好的思路
8
OAc
FGI
1. Mg, Ether
Br 2. HCO2Et
OH OH
Me
选择最稳定的负离子处切断
1
OH C C CH Me
O C Me
O + C Cl
Me
AlCl3
OH C C CH Me
O C Me
O
NaC CH
C Me
OH C C CH Me
通常情况是没有一个取代基能给出稳定负离子 How we do? We 怎么do?
2
OH C CH2CH3 CH3
负离子等价物
21
Br
1 Mg, Et2O HO
2.EtCHO
O
1 PBr3
2 Mg, Et2O HO
3 CO2
O HO
1 SO2Cl2
2
NH
O N
22
有机合成切断法简述

HO OH HO NHtBu HO O HO NHtBu HO O HO Br
HO O HO Cl
O
HO
HO2C HO
+ HO
实际路线:
HO2C HO
Ac2O
HO2C O O
AlCl3 HO2C
HO
O
Br2 CHCl3
HO2C HO
O Br
HNBut
Ph
HO2C HO
OH
Ph
LiAlH4
HO O HO
1、合成设计路线的例行程序: (1)分析 a.辨认并确定目标分子中有哪些官能团。 b.思考在哪里切断,用哪些已知可靠的反应切断。 c.对片段进行分析看是否需要重复切断,从而找到易得原料。 (2)合成 a.根据上面的分析写出书面的合成计划,同时写出所有试剂和反应 条件。 b.根据合成中遇到的实际情况来修改计划。 2、知识储备: (1)理解反应机理。 (2)懂得常用的反应类型。 (3)知道哪些化合物是易于取得的。 (4)了解立体化学知识。
第十一章:切断的选择
OH 1、最简化 5个切断中,1a是很好的选择。有两个原因。 a.在分子中间切断,使其切断为合理的两半分子,这比仅在分子末端切 断一个原子要好的多。 b.在分子侧链处切断,这样可以得到简单的直链起始原料。
H OH O
+ BrMg
Br
还可以把这一规则延伸应用到环与链连接处及环与环的链接处,通常这 些地方是切断处。 2、对称性 3、合理的起始原料
OH Br O CHO CHO O Br CHO
难以制备
由丙烯醛 与HBr制得
第十二章:立体选择性A 第十三章:羰基化合物
1、醛与酮的碳原子酰化法合成
O R1
R2MgBr
HO O HO Cl
O
HO
HO2C HO
+ HO
实际路线:
HO2C HO
Ac2O
HO2C O O
AlCl3 HO2C
HO
O
Br2 CHCl3
HO2C HO
O Br
HNBut
Ph
HO2C HO
OH
Ph
LiAlH4
HO O HO
1、合成设计路线的例行程序: (1)分析 a.辨认并确定目标分子中有哪些官能团。 b.思考在哪里切断,用哪些已知可靠的反应切断。 c.对片段进行分析看是否需要重复切断,从而找到易得原料。 (2)合成 a.根据上面的分析写出书面的合成计划,同时写出所有试剂和反应 条件。 b.根据合成中遇到的实际情况来修改计划。 2、知识储备: (1)理解反应机理。 (2)懂得常用的反应类型。 (3)知道哪些化合物是易于取得的。 (4)了解立体化学知识。
第十一章:切断的选择
OH 1、最简化 5个切断中,1a是很好的选择。有两个原因。 a.在分子中间切断,使其切断为合理的两半分子,这比仅在分子末端切 断一个原子要好的多。 b.在分子侧链处切断,这样可以得到简单的直链起始原料。
H OH O
+ BrMg
Br
还可以把这一规则延伸应用到环与链连接处及环与环的链接处,通常这 些地方是切断处。 2、对称性 3、合理的起始原料
OH Br O CHO CHO O Br CHO
难以制备
由丙烯醛 与HBr制得
第十二章:立体选择性A 第十三章:羰基化合物
1、醛与酮的碳原子酰化法合成
O R1
R2MgBr
第五章 消去反应

b. 底物结构的影响
CH3CH2CHCH3 Br
EtO
EtO-
CH3CH2CH CH2
(19%)
(CH3)3CCH2C(CH3)2 Br
(CH3)3CCH2C CH2 CH3
布雷特规则(Bredt)-双环化合物的消除反应, 除非环足够大,否则不能生成桥头双键化合物
HB r Br
若分子中含有不饱合键,消除反应朝新形成的双键能 与原有不饱合键共轭的方向进行。
△
Ph Ph
H H
(痕量)
CH3
CH3 CH CH CH OCOCH3 3
△
CH3 CH3 + CH3 CH C H2C CH CH CH3 CH3 (20%) (80%)
热消除主要生成霍夫曼烯烃,遵循Hofmann规则, 优先得到取代程度较低的烯烃。
(2) 磺原酸酯的热消除-楚加耶夫反应
SCH3 SCH3 C C S O 150o-250o S O H CHR H CHR CH C R R SCH3 HS C O + RCH=CHR
E2、E1、E1cb的关系:
E1
似E1
E2
似E1cb
E1cb
L首先 离去
L与H 5. 影响反应机理的因素:
(1)底物
E1机理
利于C+的 生成
Ar
R
稳定C- 的作用
C L
H C
R'
Ar (Y)
除此之外均 按E2机理
E1cb机理
(2)碱
碱越强,浓度越大,利于E1cb、E2机理。 反之,利于E1机理。
不利于消除反应,E/SN值减小
(6)反应温度 反应稳定升高有利于消除反应,消除反 应的活化过程需要拉长C-H键,E/SN值增 大
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O CO2Et
O
O
base
Ar
O
Ar
O
H2O, H +
TM
CO2Et
C2H5ONa
合成路线
OMe O CO2 Et 碱 (只 生 成一 种 产物 ) OMe CHO O CO2 Et O + H H2 O CO2 Et OMe 碱 O O CO2 Et
O
O
MeO
CO2 Et
设计合成:
CO2C2H5 +
反应机理:
O R C H+ O C HNR2" H H H+ HO C H2 NR2" H+ H2O H2C + NR"2 CH2R' H+ OH R C CH R' O R C H C R' CH2NR"2
氨基酮
Mannich base
Machanism of Mannich Reaction
O O
O OH
O
OH O
+
O
O
+
O H
例1 分析:
O
O
O
O
+
O
O
合成:
O
Br2 HBr
Br
O
O
O OC2H5
(1)NaOC2H5 (2) Br
O
O C 2H 5 O2 C O
O
(1)水解 (2)脱羧
碱
O
O
克莱森-史密特(Claisen-Schmidt)反应
CHO O H O,NaOH + H C C CH2CH3 2 C6H5CH 3
99%
CHCOCH2CH3
Easier than CH2
O CHO KOH,H2O + C6H5CHCCH3
H C6H5CH C C CH2C 6H 5
O
其它使α-氢活化的方法 (含其它强吸电子基团)
CH3CH2CH2CHO + CH3NO2 冷NaOH水溶液 71%
H3CH2CH2CHCH2 NO2 HO
反应的实质:体系中生成的亲核性的烯醇与强亲电 性亚胺鎓的亲核加成反应
O O + HCHO + (C2H5)2NH H+ CH2N(CH3)2
O R NR2
'
MeI R
O + ' NR2 Me
RHale Waihona Puke OPhH + CH2O + HNMe2
H+
Ph NMe2
Me2NH, CH2O Me2N O
Me2NH +
+ NaOC2H5
CH3COCHCOOC2H5 + Na pKa=16
HOC2H5
2、酯的分子内的缩合(Dieckmann Condensation)
O CO2CH2CH3
O OCH2CH3 CO2CH 2CH 3
O
CO2CH 2CH 3 CO2CH 2CH 3
CO 2CH2CH3
CO2CH2CH3 O
O
Ph
OH HO
Ph
O CH 3 + PhCOCl
OH
O
Ph
O CH3 O O Ph
OH
Claissen 缩合,b 路线的对称性强
Ph O Et + O
b Ph O OEt + Ph CO2 Et
b Ph a
Ph O CO2 Et
a
Ph
CO2 Et
Ph Ph CO2 Et _ EtO EtOH Ph O CO2 Et
某些可能的负离子片段的相对稳定性可以用来 指导进行切断:
O
O
Ph BuO 2C Ph CO 2Bu
Ph BuO2C
+ CO2Bu
PhCCl
Ph
Br + BuO2C
CO2Bu
例5
CH3
CH3
O 3-甲基色酮
O CH3
OH
OH
O CH3 + HCO2C2H5
O OH
H
OH
例6
O
O
O 2-苯基色酮
O OHC
O
O
H
O
O H
H
A
生成稳定的烯醇离子
白屈菜酸的合成
O
O
O
HO2C
O
CO 2H
HO2C
CO2H OH OH
HO2C
O
O
CO2H
O O O
O
C2H 5ONa
C2H5O2C
OC 2H5 C 2H5O
CO2C2H5
O
C2H 5O2C
O O
CO2C 2H 5
H2O,HCl HO2C O (76%~79%) CO2H
O
1)BrCH2CO2C2H5,Zn 2)LiAlH4
CH2OH
维生素A
练习 1、 2、
CHO O
O O
1,5-二羰基化合物的切断
1、迈克尔加成(Michael Addition) 2、曼尼希反应(Manich Reaction)
1、迈克尔加成(Michael Addition)
CO2Et CO2Et
-H+
H 3C C CH2 + H3C C OH OH
H2 H3C C C CH(CH3)2 OH -H + H2 CH 3 H 3C C C C CH3 OH O
CH3CHO+CH3COCH3
稀NaOH , 低温 CH CHCH COCH 3 2 3 25% OH
自缩合: 低产率
H3 C
CHO + H3C
例2
Ph
O
O Ph
O Ph
O Ph
O Ph OEt + Ph
O
1、相同酯间的缩合
H3C O O C CH2 C OC 2H 5
O H2C C OC2H5
O H 3C C
O H3C C OC2H5
Claisen缩合
(1)
反应机理
C2H5O
-+
CH2COOC2H5 H
+
CH2COOC2H5 O
--
O CH3 (H3C)2NH2C +
O CH3
CH2N(CH3)2
(67%)
(33%)
完成逆合成分析并写出合成路线
O Ph
CO2Et
O
Ph
HN
O N Ph
O
O
Analysis
Ph Ph O N Ph Ph CO2Et CO2Et O
PhNH2 +
CO2Et CO2Et
FGA
CH2(CO2Et )2 + Ph
CHO
OH O H
O H
β α H H3C C CH2CHO OH
O
+
H
CHO α β OH
CHO + CH2O
α,β-不饱和醛、酮的切断
β-羟基醛、酮脱水得到α,β-不饱和醛、酮的 切断。
R1 R2 R3
O
R1 O R2 + H2C
O
通过分子内的羟醛缩合的方法
环状α,β-不饱和酮 五员、六员环酮更容易形成 温和条件下羟醛缩合产生醇,在较激烈的反应条件 下则产生烯酮
Michael Addition Mechanism
O Ph Ph H O OC 2H 5 O Ph Ph CHO O C2H5O H Ph O Ph H Ph O Ph
1,5-二羰基化合物:两个中间键之一进行切断
R O
O a R
a b
O
O + R'
O b R +
O
R'
R'
有时切断中只有一种是可能的
O O COC2H5 O
O CO 2C 2H5 + O
有时我们必须在两种机理中选择合理的切断
CN CN a b C2H5O2C Ph O b C2H5O2C Ph CN C2H5O2C CN + O a C2H5O2C + Ph O PhCHO + O
+ CHO Ph
例一
分析:
O
O OC2H5
C2H5ONa
C6H5CH(CO2C2H5)2
例3
CO2CH 2CH 3 Ph CO 2CH2CH3
Ph CO2CH2CH3
+
OCH2CH3 C O
CO2CH2CH3 PhBr + CO2CH 2CH 3
例4
Α-乙草酰酯受热,放除CO(脱去羰基) 的特性在合成上有用 可以制备不能由丙二酸酯烃化得到的一系列 丙二酸类化合物
+
C2H5OH
产生碳负离子
(2)
O CH3C OC2H5 接受体 -O
CH2COOC2H5 给予体
CH3C OC2H5 CH2COOC2H5
产生氧负离子
(3) CH3C OC2H5 CH2COOC2H5
CH3COCH2COOC2H5 pKa=11
CH3COCH2COOC2H5
+ C2H5O
--
生成产物
习题
HO
O NMe2 O Ph
OH + +
O _ Ph OEt
O Br +
O OEt Ph
分析:
O
O
base
Ar
O
Ar
O
H2O, H +
TM
CO2Et
C2H5ONa
合成路线
OMe O CO2 Et 碱 (只 生 成一 种 产物 ) OMe CHO O CO2 Et O + H H2 O CO2 Et OMe 碱 O O CO2 Et
O
O
MeO
CO2 Et
设计合成:
CO2C2H5 +
反应机理:
O R C H+ O C HNR2" H H H+ HO C H2 NR2" H+ H2O H2C + NR"2 CH2R' H+ OH R C CH R' O R C H C R' CH2NR"2
氨基酮
Mannich base
Machanism of Mannich Reaction
O O
O OH
O
OH O
+
O
O
+
O H
例1 分析:
O
O
O
O
+
O
O
合成:
O
Br2 HBr
Br
O
O
O OC2H5
(1)NaOC2H5 (2) Br
O
O C 2H 5 O2 C O
O
(1)水解 (2)脱羧
碱
O
O
克莱森-史密特(Claisen-Schmidt)反应
CHO O H O,NaOH + H C C CH2CH3 2 C6H5CH 3
99%
CHCOCH2CH3
Easier than CH2
O CHO KOH,H2O + C6H5CHCCH3
H C6H5CH C C CH2C 6H 5
O
其它使α-氢活化的方法 (含其它强吸电子基团)
CH3CH2CH2CHO + CH3NO2 冷NaOH水溶液 71%
H3CH2CH2CHCH2 NO2 HO
反应的实质:体系中生成的亲核性的烯醇与强亲电 性亚胺鎓的亲核加成反应
O O + HCHO + (C2H5)2NH H+ CH2N(CH3)2
O R NR2
'
MeI R
O + ' NR2 Me
RHale Waihona Puke OPhH + CH2O + HNMe2
H+
Ph NMe2
Me2NH, CH2O Me2N O
Me2NH +
+ NaOC2H5
CH3COCHCOOC2H5 + Na pKa=16
HOC2H5
2、酯的分子内的缩合(Dieckmann Condensation)
O CO2CH2CH3
O OCH2CH3 CO2CH 2CH 3
O
CO2CH 2CH 3 CO2CH 2CH 3
CO 2CH2CH3
CO2CH2CH3 O
O
Ph
OH HO
Ph
O CH 3 + PhCOCl
OH
O
Ph
O CH3 O O Ph
OH
Claissen 缩合,b 路线的对称性强
Ph O Et + O
b Ph O OEt + Ph CO2 Et
b Ph a
Ph O CO2 Et
a
Ph
CO2 Et
Ph Ph CO2 Et _ EtO EtOH Ph O CO2 Et
某些可能的负离子片段的相对稳定性可以用来 指导进行切断:
O
O
Ph BuO 2C Ph CO 2Bu
Ph BuO2C
+ CO2Bu
PhCCl
Ph
Br + BuO2C
CO2Bu
例5
CH3
CH3
O 3-甲基色酮
O CH3
OH
OH
O CH3 + HCO2C2H5
O OH
H
OH
例6
O
O
O 2-苯基色酮
O OHC
O
O
H
O
O H
H
A
生成稳定的烯醇离子
白屈菜酸的合成
O
O
O
HO2C
O
CO 2H
HO2C
CO2H OH OH
HO2C
O
O
CO2H
O O O
O
C2H 5ONa
C2H5O2C
OC 2H5 C 2H5O
CO2C2H5
O
C2H 5O2C
O O
CO2C 2H 5
H2O,HCl HO2C O (76%~79%) CO2H
O
1)BrCH2CO2C2H5,Zn 2)LiAlH4
CH2OH
维生素A
练习 1、 2、
CHO O
O O
1,5-二羰基化合物的切断
1、迈克尔加成(Michael Addition) 2、曼尼希反应(Manich Reaction)
1、迈克尔加成(Michael Addition)
CO2Et CO2Et
-H+
H 3C C CH2 + H3C C OH OH
H2 H3C C C CH(CH3)2 OH -H + H2 CH 3 H 3C C C C CH3 OH O
CH3CHO+CH3COCH3
稀NaOH , 低温 CH CHCH COCH 3 2 3 25% OH
自缩合: 低产率
H3 C
CHO + H3C
例2
Ph
O
O Ph
O Ph
O Ph
O Ph OEt + Ph
O
1、相同酯间的缩合
H3C O O C CH2 C OC 2H 5
O H2C C OC2H5
O H 3C C
O H3C C OC2H5
Claisen缩合
(1)
反应机理
C2H5O
-+
CH2COOC2H5 H
+
CH2COOC2H5 O
--
O CH3 (H3C)2NH2C +
O CH3
CH2N(CH3)2
(67%)
(33%)
完成逆合成分析并写出合成路线
O Ph
CO2Et
O
Ph
HN
O N Ph
O
O
Analysis
Ph Ph O N Ph Ph CO2Et CO2Et O
PhNH2 +
CO2Et CO2Et
FGA
CH2(CO2Et )2 + Ph
CHO
OH O H
O H
β α H H3C C CH2CHO OH
O
+
H
CHO α β OH
CHO + CH2O
α,β-不饱和醛、酮的切断
β-羟基醛、酮脱水得到α,β-不饱和醛、酮的 切断。
R1 R2 R3
O
R1 O R2 + H2C
O
通过分子内的羟醛缩合的方法
环状α,β-不饱和酮 五员、六员环酮更容易形成 温和条件下羟醛缩合产生醇,在较激烈的反应条件 下则产生烯酮
Michael Addition Mechanism
O Ph Ph H O OC 2H 5 O Ph Ph CHO O C2H5O H Ph O Ph H Ph O Ph
1,5-二羰基化合物:两个中间键之一进行切断
R O
O a R
a b
O
O + R'
O b R +
O
R'
R'
有时切断中只有一种是可能的
O O COC2H5 O
O CO 2C 2H5 + O
有时我们必须在两种机理中选择合理的切断
CN CN a b C2H5O2C Ph O b C2H5O2C Ph CN C2H5O2C CN + O a C2H5O2C + Ph O PhCHO + O
+ CHO Ph
例一
分析:
O
O OC2H5
C2H5ONa
C6H5CH(CO2C2H5)2
例3
CO2CH 2CH 3 Ph CO 2CH2CH3
Ph CO2CH2CH3
+
OCH2CH3 C O
CO2CH2CH3 PhBr + CO2CH 2CH 3
例4
Α-乙草酰酯受热,放除CO(脱去羰基) 的特性在合成上有用 可以制备不能由丙二酸酯烃化得到的一系列 丙二酸类化合物
+
C2H5OH
产生碳负离子
(2)
O CH3C OC2H5 接受体 -O
CH2COOC2H5 给予体
CH3C OC2H5 CH2COOC2H5
产生氧负离子
(3) CH3C OC2H5 CH2COOC2H5
CH3COCH2COOC2H5 pKa=11
CH3COCH2COOC2H5
+ C2H5O
--
生成产物
习题
HO
O NMe2 O Ph
OH + +
O _ Ph OEt
O Br +
O OEt Ph
分析:
