大田一中高三化学考前训练
福建省大田县第一中学2025届高三上化学期中考试试题含解析

福建省大田县第一中学2025届高三上化学期中考试试题注意事项1.考试结束后,请将本试卷和答题卡一并交回.2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置. 3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符.4.作答选择题,必须用2B 铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案.作答非选择题,必须用05毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效. 5.如需作图,须用2B 铅笔绘、写清楚,线条、符号等须加黑、加粗.一、选择题(每题只有一个选项符合题意)1、设N A 为阿伏伽德罗常数的值。
下列说法正确的是 A .7.8gNa 2O 2中阴离子数为0.1N A B .1mol 甲基含有的电子数为7N AC .常温常压下,2.24 L 乙烯中含有的氢原子数为0.4N AD .0.1L 0.5mol ·L -1CH 3COOH 溶液中含有的氢离子数为0.05N A2、 “封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是()A .加热时,①上部汇集了固体NH 4Cl ,说明NH 4Cl 的热稳定性比较好B .加热时,②、③溶液均变红,冷却后又都变为无色C .④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅(已知:2NO 2N 2O 4△H <0)D .四个“封管实验”中所发生的化学反应都是可逆反应 3、25℃时纯水的14WK 10-=,100℃时,12W K 10-=,这说明( )A .100℃水的电离程度较小B .前者H +⎡⎤⎣⎦较后者的大C .水的电离是吸热的D .100℃时水的电离程度是室温时的100倍4、在一定条件下,用石墨电极电解0.5mol/L CuSO 4溶液(含H 2SO 4),监测到阳极附近pH 随时间变化关系如下图。
大田一中高三化学考前训练
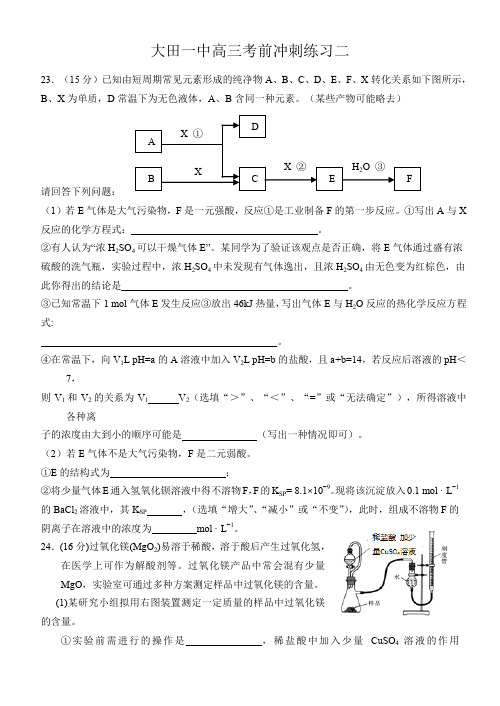
大田一中高三考前冲刺练习二23.(15分)已知由短周期常见元素形成的纯净物A 、B 、C 、D 、E 、F 、X 转化关系如下图所示,B 、X 为单质,D 常温下为无色液体,A 、B 含同一种元素。
(某些产物可能略去)请回答下列问题:(1)若E 气体是大气污染物,F 是一元强酸,反应①是工业制备F 的第一步反应。
①写出A 与X 反应的化学方程式: 。
②有人认为“浓H 2SO 4可以干燥气体E”。
某同学为了验证该观点是否正确,将E 气体通过盛有浓硫酸的洗气瓶,实验过程中,浓H 2SO 4中未发现有气体逸出,且浓H 2SO 4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol 气体E 发生反应③放出46kJ 热量,写出气体E 与H 2O 反应的热化学反应方程式:。
④在常温下,向V 1L pH=a 的A 溶液中加入V 2L pH=b 的盐酸,且a +b=14,若反应后溶液的pH <7,则V 1和V 2的关系为V 1 V 2(选填“>”、“<”、“=”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序可能是 (写出一种情况即可)。
(2)若E 气体不是大气污染物,F 是二元弱酸。
①E 的结构式为 ;②将少量气体E 通入氢氧化钡溶液中得不溶物F ,F 的K SP = 8.1×10-9。
现将该沉淀放入0.1 mol · L -1 L -1。
24.(16分)过氧化镁(MgO 2)易溶于稀酸,溶于酸后产生过氧化氢,在医学上可作为解酸剂等。
过氧化镁产品中常会混有少量MgO ,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁的含量。
①实验前需进行的操作是 ,稀盐酸中加入少量 CuSO 4溶液的作用是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:方案I :取a g 样品,加入足量稀盐酸,充分反应后再加入 NaOH 溶液至Mg 2+沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g 固体。
福建省三明市大田县2024届中考化学考试模拟冲刺卷含解析

福建省三明市大田县2024届中考化学考试模拟冲刺卷考生须知:1.全卷分选择题和非选择题两部分,全部在答题纸上作答。
选择题必须用2B铅笔填涂;非选择题的答案必须用黑色字迹的钢笔或答字笔写在“答题纸”相应位置上。
2.请用黑色字迹的钢笔或答字笔在“答题纸”上先填写姓名和准考证号。
3.保持卡面清洁,不要折叠,不要弄破、弄皱,在草稿纸、试题卷上答题无效。
一、单选题(本大题共15小题,共30分)1.化石燃料的大量使用导致我国北方地区雾霾天气明显增多,雾霾天气导致呼吸病人增多,因为雾霾可使空气中增加大量的()A.二氧化碳B.一氧化碳C.二氧化硫D.可吸入颗粒物2.将乙酸(CH3COOH)和葡萄糖(C6H12O6)溶于水得到混合溶液,测得溶液中氢元素的质量分数为a,则溶液中碳元素的质量分数为()A.1﹣9a B.1﹣8a C.12a D.8a3.如图所示实验操作中正确的是A.加热固体B.点燃另一酒精灯C.测溶液pHD.检查装置的气密性4.如图是a、b、c 三种固体物质的溶解度曲线,下列分析不正确的是()A.t2℃时,125gb 的饱和溶液中含有b 物质25gB.t3℃时,分别将等质量的a、b 饱和溶液降温至t2℃,析出的固体质量关系是:a>bC.分别将t1℃时a、c 的饱和溶液升温到t2℃,均变为不饱和溶液D.a 中含有少量b 时,可采用冷却a 的热饱和溶液的方法提纯a5.已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y 、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。
下列说法正确的是A.X氧化物的化学式只能表示为XO B.Y能将X从它的盐溶液中置换出来C.Z在自然界中只能以单质形式存在D.三种金属的活动性顺序:X>Y>Z6.某同学在测定某未知蓝色溶液的组成时,得出了以下结论,其中正确的是()A.KC1、CuSO4、NaOH B.Cu(NO3)2、K2SO4、KNO3C.CuSO4、HCl、BaC12D.FeC12、H2SO4、Na2SO47.下列叙述正确的是A.洒出的酒精在桌上燃烧,应立即用湿抹布扑盖B.氧气是一种重要的燃料,没有氧气就没有燃烧C.缓慢氧化能引起自燃,缓慢氧化都是有害的D.降低可燃物的着火点,可以有效防止火灾的发生8.生活中的很多变化都伴随着热量变化。
福建大田第一中学高三化学第一次模拟试卷(含答案)

福建大田第一中学高三化学第一次模拟试卷(含答案)液过滤 C Cl2(g) HCl(g) 饱和食盐水,浓H2SO4 洗气 D Na2CO3(s) NaHCO3(s) ﹣﹣灼烧 7.下列离子方程式书写正确的是()A.Cu(OH)2中加入硫酸:OH﹣+H+═H2OB.钠加入水中:Na+2H2O═Na++2OH﹣+H2C.FeSO4溶液中加入稀硝酸:3Fe2++4H++NO3﹣═3Fe3++2H2O+NOD.Al2(SO4)3溶液中加入足量Ba(OH)2溶液:2Al3++3SO42﹣+3Ba2++6OH﹣═2Al(OH)3+3BaSO48.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。
下列说法正确的是A.元素Y的单质比元素X的单质更容易与氢气反应B.原子半径的大小顺序为:rXrZrQC.离子Y2-和Z 3+的核外电子数和电子层数都不相同D.元素W的最高价氧化物对应的水化物的酸性比Q的强9.用下列实验装置和方法进行相应实验,能达到实验目的的是()A.用图1装置除去Cl2中混有的少量HClB.用图2装置分离水和溴苯的混合物C.用图3装置制备并收集NO气体D.用图4装置蒸干AlCl3饱和溶液制备AlCl3晶体10.下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )a b c A Al AlCl3 Al(OH)3 B HNO3 NO2 NO C Si SiO2 H2SiO3 D CO2 Na2CO3 NaHCO3 11.根据如下海水综合利用的工业流程图,下列说法正确的是()A.除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入药品的顺序为:NaOH溶液Na2CO3溶液BaCl2溶液过滤后加盐酸B.在过程④中SO2被还原C.从第③步到第⑤步的目的是为了浓缩D.从能量转换角度看,氯碱工业中电解饱和食盐水是一个将化学能转化为电能的过程12.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )选项纯净物混合物强电解质弱电解质非电解质 A 食醋胆矾晶体纯碱小苏打 HD B 青铜水煤气硝酸硫化氢乙醇 C 烧碱水玻璃硫酸钡一水合氨液氨 D C12H22O11 铝热剂三氧化硫二氧化硫二氧化硅 13.下列各组离子一定能够大量共存的是( )A.使紫色石蕊变红的溶液:Fe2+、Mg2+、NO3-、Cl-B.含有较多Fe3+的溶液:Na+、SO42-、SCN-、CO32-C.无色透明的酸性溶液:Na+、Al3+、S2-、SO32-D.无色透明的碱性溶液:ClO-、K+、Cl-、Na+14.下列依据热化学方程式得出的结论正确的是 ( )A.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJmol1,则氢气的燃烧热为241.8kJmol1B.已知C(石墨,s)=C(金刚石,s) △H0,则金刚石比石墨稳定C.已知2C(s) +2O2(g)=2CO2(g) △H1 ;2C(s) +O2(g)=2CO(g) △H2,则△H1△H2D.已知Ni(CO)4(s)=Ni(s)+4CO(g) △H= Q kJmol-1,则Ni(s) +4CO(g)=Ni(CO)4(s) △H=-QkJmol-115. 下列关于金属腐蚀的说法正确的是( )A.金属在潮湿的空气中腐蚀的实质是:M+nH2O===M(OH)n+n/2H2B.金属化学腐蚀的实质是:M-ne-=Mn+,电子直接转移给还原剂C.金属化学腐蚀必须在酸性条件下进行D.在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀16.向1L含Ba(OH)2、NaAlO2均为0.1mol的混合液中逐滴加入0.1molL-1稀硫酸时,溶液中生成沉淀的物质的量(n)与稀硫酸体积(V)的关系图正确的是( )17.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+2Pb2++2H2O下列有关新型液流式铅酸蓄电池的说法不正确的是()A.放电时,蓄电池由化学能转化为电能B.充放电时,溶液的导电能力变化不大C.放电时,负极反应式为Pb-2e-===Pb2+D.充电时,阳极反应式为Pb2++4OH-+2e-===PbO2+2H2O18.已知:C(s)+H2O(g)===CO(g)+H2(g) H=akJmol-12C(s)+O2(g)===2CO(g) H=-220kJmol-1HH、O===O和OH键的键能分别为436、496和462kJmol-1,则a为()A.-332B.-118C.+350D.+130X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如下:下列有关推断合理的是()A.根据上述连续实验不能确定溶液X中是否含有Fe3+B.沉淀H为Al(OH)3、BaCO3的混合物C.溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣、Cl﹣D.若溶液X为100 mL,产生的气体A为112 mL(标况),则X 中c(Fe2+)=0.05 molL﹣120. 有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4 mol/L和2 mol/L,取10 mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体的体积为(设反应中HNO3被还原成NO) ()A.0.448 LB.0.672 LC.0.896 LD.0.224 L二、填空题21.(10分)X、Y、Z、W、R是短周期元素,原子序数依次增大,只有一种金属,X原子核外各层电子数之比为1:2,Y 原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
福建省大田县第一中学2025届化学高一上期末学业质量监测模拟试题含解析

福建省大田县第一中学2025届化学高一上期末学业质量监测模拟试题考生须知:1.全卷分选择题和非选择题两部分,全部在答题纸上作答。
选择题必须用2B 铅笔填涂;非选择题的答案必须用黑色字迹的钢笔或答字笔写在“答题纸”相应位置上。
2.请用黑色字迹的钢笔或答字笔在“答题纸”上先填写姓名和准考证号。
3.保持卡面清洁,不要折叠,不要弄破、弄皱,在草稿纸、试题卷上答题无效。
一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、只用一种试剂区别Na 2SO 4、MgCl2、FeCl 2、Al 2(SO 4)3、FeCl 3五种溶液,这种试剂是( ) A .Ba(OH)2B .H 2SO 4C .NaOHD .AgNO 32、化学与生活、社会发展息息相关。
下列说法错误的是( ) A .“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 B .“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及氧化还原反应C .“烈火焚烧若等闲”,明代于谦的《石灰吟》中此句实指石灰石的分解反应D .“青蒿一握,以水二升渍,绞取汁”,体现了屠呦呦对青蒿素的提取属于化学变化3、不另用任何试剂就能将下列五种溶液:①CuCl 2、②Na 2SO4、③KCl 、④K 2CO 3、⑤BaCl 2鉴别出来,其正确的鉴别顺序是( ) A .①②④③⑤B .④⑤③②①C .①④⑤②③D .①②④⑤③4、500mL 的KAl (SO 4)2溶液中含有3.9g 的K +,则该溶液中c (SO 42-)为( ) A .1mol/LB .0.4mol/LC .0.2mol/LD .0.1mol/L5、下列反应的离子方程式书写正确的是( )A .钠与冷水反应:22Na H O Na 2OH H +-+=++↑ B .金属铝溶于苛性钠溶液:22Al 2OH AlO H --+=+↑C .铁跟稀硫酸反应:322Fe 6H 3Fe 3H +++=+↑D .金属铝溶于盐酸中:2Al+6H +=2Al 3++3H ₂↑6、设N A 为阿伏加德罗常数,下面叙述正确的是( ) A .标准状况下,11.2L CCl 4所含分子数为0.5N A B .1L 1mol/L 的氯化钠溶液中,所含离子数为N AC .常温下,4.4g CO 2和N 2O (不反应)混合物中所含有的原子数为0.3N AD .1mol Cl 2与足量的铁发生反应,转移的电子总数为3N A7、化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
福建省“宁化、永安、尤溪、大田、沙县一中”五校协作2023-2024学年高三上学期期中联考化学及答案

“宁化、永安、尤溪、大田、沙县一中”五校协作2023-2024学年高三11月联考化学试题命题人:宁化一中 施扬敏 刘敏华 审题人:尤溪一中 郑祥洋(考试时间:75分钟 总分:100分)第Ⅰ卷(选择题,共40分)可能用到的相对原子量 H1 C 12 O16 Cl 35.5 K 39 Mn 55一、选择题。
(本大题共10小题,每小题4分,共40分。
在每小题列出的四个选项中,只有一项是最符合题目要求的。
)1.化学与生活、生产密切相关,下列说法正确的是A .太阳电池翼采用碳纤维框架和玻璃纤维网,二者均为有机高分子材料B .华为手机mate60使用的麒麟9000s 芯片,其主要成分是二氧化硅C .“84”消毒液沾到皮肤上应立即用大量水清洗,并涂抹维生素CD .“问天”实验舱采用砷化镓太阳能电池片,该电池将化学能转化为电能2.设N A 为阿伏加德罗常数的值。
我国科学家在实验室实现了CO 2到淀粉的全合成,其合成路线为下列说法正确的是A .1mol 甲醛(HCHO)中所含共用电子对总数为3N AB .反应②另一个产物为H 2O 2,则1molO 2参与反应时转移电子数为2N AC .44g C 18O 2所含质子数为22N AD .1L 1mol ·L -1的甲醇水溶液中含有氧原子的数目为N A 3.在指定溶液中下列离子一定能大量共存的是A .透明澄清的溶液:NH +4、Fe 3+、SO 2-4、NO -3 B .能使甲基橙变红的溶液:Na +、Ca 2+、AlO -2、Cl -C .c (ClO -)=0.1mol/L 的溶液:K +、Na +、CO 2-3、S 2-D .加入Al 能放出H 2的溶液:Na +、NH +4、Cl -、NO -34.SO 2是引发酸雨的主要污染物,将工业废气中的SO 2吸收能有效减少对大气的污染、并实现资源化利用。
下列离子方程式正确的是A .硫酸型酸雨露置于空气中一段时间后溶液酸性增强:22324H SO O 2H SO +-+=+B .用过量2Ca(ClO)溶液吸收废气中的2SO :222-4Ca ClO SO H O CaSO Cl 2H +-++++=¯++C .用过量氨水吸收废气中的2SO :32243NH H O SO NH HSO +-×+=+D .用过量23Na CO 溶液吸收废气中的2SO :22322332CO SO H O SO 2HCO ---++=+5.实验室从废定影液[含()3232Ag S O -和Br -等]中回收Ag 和2Br 的主要步骤为:向废定影液中加入2Na S 溶液沉银,过滤、洗涤及干燥,灼烧2Ag S 制Ag ,制取2Cl 并通入滤液氧化Br -,用苯萃取分液。
2020年山东省青岛市平度大田镇大田中学高三化学模拟试题含解析

2020年山东省青岛市平度大田镇大田中学高三化学模拟试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 为除去CO2中混有的SO2和O2,下列试剂使用顺序正确的是①饱和的Na2CO3溶液;②饱和的NaHCO3溶液;③浓硫酸;④灼热的铜网;⑤碱石灰。
A.①③④ B.②③④ C.②④③ D.③④⑤参考答案:B略2. 下列离子方程式书写正确的是()A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑B.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2OC.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO-42-=BaSO4↓+H2OD.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O11.参考答案:D 3. 往饱和NaOH溶液中加入一定量Na2O2,充分反应后恢复到原温度,下列说法正确的是()A.有晶体析出,原溶液质量不变 B.有晶体析出,原溶剂质量不变C.溶液仍为饱和溶液,浓度增大 D.溶液仍为饱和溶液,浓度不变参考答案:答案:D4. 砹(At)是原子序数最大的卤族元素,推测砹或砹的化合物不可能具有的性质是()。
A.HAt很稳定 B.易溶于某些有机溶剂C.AgAt不溶于水 D.是有色固体参考答案:A略5. 我国稀土资源丰富。
下列有关稀土元素与的说法正确的是A. 与互为同位素B. 与的质量数相同C. 与是同一种核素D. 与的核外电子数和中子数均为62参考答案:A解析:由稀土元素可知,该元素是含有相同质子不同中子的同种元素;其中的质量数为144,中子数为82;的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知为两种核素,故C错。
6. 下列说法不正确的是A.维生素都易溶于水B.CO2和CH4都是温室气体C.加碘食盐不能使淀粉液变蓝D.灼烧法可区别纯棉和纯毛织物参考答案:A7. 2008年9月25日,“神七”成功飞天,宇航员出舱时呼吸所有需氧气主要来自太空服中的呼吸面具。
湖南省邵阳市武冈大田乡中学高三化学月考试题含解析

湖南省邵阳市武冈大田乡中学高三化学月考试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 取100 mL 0.3 mol/L和300 mL 0.25 mol/L的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )A.0.21 mol/L B.0.42 mol/L C.0.56 mol/L D.0.26 mol/L参考答案:B略2. 下列物质转化在给定条件下能实现的是()①②③④⑤A.①③⑤B.②③④C.②④⑤D.①④⑤参考答案:A略3. 气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3,若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分的下列说法正确的是( )①一定含有HBr,可能含有CO2②一定不含CO2③一定不含NH3、Cl2④可能含有Cl2、CO2A.只有①B.只有③ C.①和③ D.②和③参考答案:C略4. 向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。
在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。
下列有关说法不正确的是A. Cu与Cu2O 的物质的量之比为2:1B. 硝酸的物质的量浓度为2.6mol/LC. 产生的NO在标准状况下的体积为4.48LD. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol参考答案:B略5. 下列溶液中,微粒浓度关系正确的是A.含有NH4+、Cl-、H+、OH-离子的溶液中,其离子浓度一定是:B.pH=6的醋酸与醋酸钠的混合溶液中C. 0.lmol/L的Na2S溶液中,D. pH=3的一种酸和pH=11的一种碱等体积混和后的溶液中一定是c(OH-)=(H+)参考答案:C6. 把一小块金属钠放入下列溶液中,既能产生气体又会生成白色沉淀的是()A.稀硫酸B.氢氧化钾稀溶液C.硫酸铜溶液D.氯化镁溶液参考答案:D略7. 前20号主族元素W、X、Y、Z的原子序数依次增大。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大田一中高三考前冲刺练习二
23.(15分)已知由短周期常见元素形成的纯净物A 、B 、C 、D 、E 、F 、X 转化关系如下图所示,
B 、X 为单质,D 常温下为无色液体,A 、B 含同一种元素。
(某些产物可能略去)
请回答下列问题:
(1)若E 气体是大气污染物,F 是一元强酸,反应①是工业制备F 的第一步反应。
①写出A 与X 反应的化学方程式: 。
②有人认为“浓H 2SO 4可以干燥气体E”。
某同学为了验证该观点是否正确,将E 气体通过盛有浓硫酸的洗气瓶,实验过程中,浓H 2SO 4中未发现有气体逸出,且浓H 2SO 4由无色变为红棕色,由此你得出的结论是 。
③已知常温下1 mol 气体E 发生反应③放出46kJ 热量,写出气体E 与H 2O 反应的热化学反应方程式:。
④在常温下,向V 1L pH=a 的A 溶液中加入V 2L pH=b 的盐酸,且a +b=14,若反应后溶液的pH <
7,
则V 1和V 2的关系为V 1 V 2(选填“>”、“<”、“=”或“无法确定”),所得溶液中
各种离
子的浓度由大到小的顺序可能是 (写出一种情况即可)。
(2)若E 气体不是大气污染物,F 是二元弱酸。
①E 的结构式为 ;
②将少量气体E 通入氢氧化钡溶液中得不溶物F ,F 的K SP = 8.1×10-9。
现将该沉淀放入0.1 mol · L -1 L -1。
24.(16分)过氧化镁(MgO 2)易溶于稀酸,溶于酸后产生过氧化氢,
在医学上可作为解酸剂等。
过氧化镁产品中常会混有少量
MgO ,实验室可通过多种方案测定样品中过氧化镁的含量。
(1)某研究小组拟用右图装置测定一定质量的样品中过氧化镁
的含量。
①实验前需进行的操作是 ,稀盐酸中加入少量 CuSO 4溶液的作用
是 。
②用恒压分液漏斗的优点有:使分液漏斗中的溶液顺利滴下; 。
③实验终了时,待恢复至室温,先 ,再平视刻度线读数。
(2)实验室还可通过下列两种方案测定样品中过氧化镁的含量:
方案I :取a g 样品,加入足量稀盐酸,充分反应后再加入 NaOH 溶液至Mg 2+
沉淀完全,过滤、洗涤后,将滤渣充分灼烧,最终得到b g 固体。
方案Ⅱ:称取0.1 g 样品置于碘量瓶中,加入15 mL0.6 mol/LKI 溶液和足量盐酸,摇匀后在
暗处静置5 min ,然后用0.1 mol/L Na 2S 2O 3溶液滴定,滴定到终点时共消耗VmL
Na 2S 2O 3溶液。
(已知:I 2+2Na 2S 2O 3= Na 2S 4O 6+2NaI)
①常温下K sp [Mg(OH)2]=l×10
-11。
为使方案I 中Mg 2+完全沉淀[即溶液中c(Mg 2+)≤l ×10-5mol/L],溶液的pH 至少应调至 。
方案I 中过氧化镁的质量分数为 (用含a 、b 的表达式表示)。
②方案Ⅱ中滴定前需加入少量 作指示剂;样品中过氧化镁的质量分数为
(用含V 的表达式表示)。
25.(14分) K 2SO 4是无氯优质钾肥,Mn 3O 4是生产软磁铁氧体材料的主要原料。
以硫酸工业的尾
气联合制备K 2SO 4和Mn 3O 4的工艺流程如下:
含SO 2
2SO 44·H 23O 4
温度/℃几种盐的溶解度曲线图
(1)一般情况下,软锰矿在反应前需要粉碎,作用是 。
(2)几种盐的溶解度见图1。
反应III 中,向(NH 4)2SO 4溶液中加入KCl 溶液充分反应后,进图1 S /g 4 4)2SO 4 t /℃
行蒸发浓缩、、洗涤、干燥等操作即得K2SO4产品。
(3)检验K2SO4样品是否含有氯化物杂质的实验操作是:。
(4)反应IV的化学方程式为。
(5)Mn3O4可以用稀硫酸处理,将其转化为MnSO4和MnO2,,然后再用氧化剂将Mn2+转化为MnO2,从而制得优质MnO2。
写出Mn3O4与稀硫酸反应的化学方程
式:。
(6)图2是煅烧MnSO4•H2O时温度与剩余固体质量变化曲线。
①该曲线中B段所表示物质的化学式为。
②煅烧过程中固体锰含量随温度的升高而增大,但当温度超过1000℃时,再冷却后,测得
产物的总锰含量反而减小。
试分析产物总锰含量减小的原因:。
31.(13分) 物质结构与性质
Ⅰ.氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成
紫色配合物,其配离子结构如右图所示。
(1)此配合物中,铁离子的价电子排布式为。
(2)此配离子中含有的作用力有(填序号)。
A.离子键B.金属键C.极性键D.非极性键
E.配位键F.氢键G.σ键H.π键
(3)此配合物中碳原子的杂化轨道类型有。
Ⅱ.元素A的基态原子占据纺锤形原子轨道的电子总数为2,元素B与A同周期,其基态原子占据s轨道的电子数与p轨道相同;C是A的同族相邻元素,电负性小于A;D是B的同族相邻元素,第一电离能小于B。
则:
(4)化合物CA和DB2的晶体熔点较高的是(填化学式)。
(5)AD2分子的空间构型为。
(6)A、B和C的成键情况如下:
A和B之间易形成含有双键的AB2分子晶体,而C和B之间则易形成含有单键的CB2原子晶体,请结合数据分析其原因为_______________________________________。
32.(13分) 有
机化学基础
芳香族化
合物C的分子
式为C9H9OCl。
C分子中有一个甲基且苯环上只有一条侧链;一定条件下C能发生银镜反应;C 与其他物质之间的转化如下图所示:
(1)F中含氧官能团的名称是;B→A的反应类型是。
(2)H的结构简式是。
(3)写出下列化学方程式:D与银氨溶液反应。
(4)有的同学认为B中可能没有氯原子,你是__________(填“同意”或“不同意”),你的理由是。
(5)D的一种同系物W(分子式为C8H8O2)有多种同分异构体,则符合以下条件W的同分异构体有________种,写出其中核磁共振氢谱有4个峰的结构简式____________。
①属于芳香族化合物②遇FeCl3溶液不变紫色
③能与NaOH溶液发生反应但不属于水解反应
23.(15分)(1)①4NH3 + 5O24NO + 6H2O ②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g);△H =﹣138 kJ/mol
④<c(Cl―) >c(NH4+)>c(H+) >c(OH―) 或c(Cl―) >c(H+)>c(NH4+)>c(OH―) (2)①O=C=O②不变(1分)8.1×10 8(其余每空2分)
24.(16分) (1)①检查装置的气密性(2分) 用作催化剂(或催化H2O2的分解) (2分)
②消除滴入溶液的体积对所测气体体积的影响(2分)
③将右侧刻度管缓缓向下移动直到两侧液面相平(2分)
(2)①11(2分) 7(a-b)/2a(2分) ②淀粉溶液(2分) 2.8 V%(2分)
25.(14分) (1)增大接触面积,加快反应速率(使反应更充分) (2分)
(2)趁热过滤(2分)(3)取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液(2分)(4)MnO2+SO2=MnSO4(2分)
(5)Mn3O4+2H2SO4=2MnSO4+MnO2+2H2O(2分)(6)①Mn3O4 (2分) ②部分Mn3O4又被氧化为Mn2O3或MnO2,造成总锰含量减小(2分)
31.(13分) (1)3d5(2分) (2)CDEGH(2分)
(3)sp2 sp3 (2分)(4)SiC (2分)
(5)直线型(2分)
(6)碳与氧之间形成含有双键的分子放出的能量(803×2=1606kJ·mol-1)大于形成含单键的原子晶体放出的能量(360×4=1440kJ·mol-1),故CO2易形成含双键的分子;硅与氧之间形成含有双键的分子放出的能量(640×2=1280kJ·mol-1)小于形成含单键的原子晶体放出的能量(464×4=1856kJ·mol-1),故SiO2易形成含单键的原子晶体。
(2分)
32.(13分) (1)醛基取代反应(酯化反应)。
