药物合成反应的特点
(整理)药物合成简答题

1.什么是药物?用于诊断、治疗、预防疾病及恢复、矫正、改变器官功能的物质。
2.药物合成反应有什么特点?(1)反应条件温和、操作简便、收率高;(2)有较高的化学、位置和立体选择性;(3)适应性强、适用面广,实用性好;(4)原材料价廉易得,有丰富的来源;(5)不产生公害,不污染环境。
3.举例说明药物合成的高选择性?化学、位置和立体选择性4.什么是亲电试剂?常见的亲电试剂有哪些?在反应过程中,具有较高的活性,能从作用物得到电子而形成共价键的试剂。
常见的亲电试剂有:①正离子,如H+,C+,Cl+、Br+、I+,NO2+等;②可接收孤对电子的分子,如AlCl3、FeCl3、ZnCl2、SnCl4、SbCl3、BF3等Lewis酸;③羰基碳原子等。
5.什么是亲核试剂?常见的亲核试剂有哪些?反应中提供电子与作用物形成共价键的试剂。
常见的亲核试剂有:①负离子:如Cl-,OH-,RO-,NH2-等;②具有孤对电子的分子,如H2O,ROH,RNH2等;③具有π电子的烯键,芳烃等。
6.什么是自由基试剂?常见的自由基试剂有哪些?由共价键均裂所产生的带有独电子的中性基团。
常用的自由基引发剂有过氧化物、偶氮化合物等;高温、光照等条件也可引发自由基反应。
7什么是卤化反应?按引入的卤原子不同,卤化反应分哪几种?按反应类型分,卤化反应又可分为哪几种?各举一例说明。
在有机化合物分子中建立碳-卤(C-X)键的反应称为卤化反应。
卤化反应根据引入不同卤素的反应可分为氟化、氯化、溴化和碘化反应。
卤化反应根据反应类型还可分为加成反应、取代反应和置换反应。
8卤化反应在有机合成中的应用?(1)制备不同生理活性的含卤素药物。
(2)在官能团转化中,卤化物常常是一类重要的中间体。
(3)为了提高反应的选择性,卤原子可作为保护基、阻断基等。
9.根据反应历程的不同,讨论一下卤化反应的类型,反应机理。
①烯烃与卤素的加成类型:亲电加成反应机理:被极化的卤素作为亲电试剂向烯烃的双键进行加成②芳香环上的取代类型:亲电取代反应机理:被极化了的卤化试剂向芳环作亲电进攻,形成σ-络合物,然后很快失去一个质子得到卤代芳烃③芳香化合物侧链上的取代类型:自由基反应机理:在自由基引发剂的作用下,产生的中间体自由基得到芳环及双键的共轭作用而稳定。
药物生物合成反应类型

实 例
H 瘤胃细菌 HOOC N H O (R u m e n b a c te ria ) HOOC C H C H H C H COOH
H2N
5 -酮 基 已 内 酰 胺
谷氨酸
2. 醚的开裂
C O CH2 R COH
CH O R或 H
CH3 R或 H
CHOH
C
O
CH3
COH
实 例
HO O C H 2C O O H 分 节 孢 子 杆 菌 SP. (A rth ro b a cte riu m S P .) HO OH
生物合成反应类型:
一、氧化反应 二、还原反应 三、水解反应
五、胺化反应
六、酰基化反应
七、脱羧反应
八、脱水反应
四、缩合反应
一、氧化反应
1. 单一氧化反应
C H 2O H CHO
CHO
C H 2O H
COOH
COOH
CHOH
CO
CH3
CHO
CH3
COOH
CH2
CO
CH2
COOH
实 例
C H 2O H 1. 产 黄 青 霉 Q 176 2. 假 单 胞 菌 PI (1 . P en icilliu m ch ry so g en u m Q 176) (2 . P seu d o m o n as P I) 苄醇 苯甲醛 CHO
O C O C R COH
O C O C R COH
R
CO SR
R
COOH
实 例
H 2C C O N O COOH Cl 7 -氯 苯 乙 酰 头 孢 菌 素 C Cl 7 -氯 苯 乙 酰 -3 -脱 乙 酰 头 孢 菌 素 C C H 2O C C H 3 H N S O 大肠杆菌 (B a c te riu m c o li) O COOH H 2C C O N C H 2O H H N S
磺化反应的特点

磺化反应的特点磺化反应是一种重要的有机合成反应,在药物、染料、橡胶、塑料等化工领域中广泛应用。
本文将从磺化反应的概念、反应机理、反应条件、应用等方面进行详细阐述,希望对读者有所启发。
一、概念和分类磺化反应是将有机物中的活泼亲核试剂和亚硫酸或其衍生物进行反应,生成含有磺基的化合物的反应过程。
磺化反应可分为直接磺化和间接磺化两种。
间接磺化又分为偶联磺化和氧化磺化。
偶联磺化是指使用碱性条件下的偶联试剂反应,将两个不同的有机化合物偶联生成磺化产物。
氧化磺化则是使用氧化剂将有机化合物氧化成相应的酸,然后与亚硫酸或其衍生物反应生成磺化产物。
二、反应机理磺化反应的机理非常复杂,与反应条件、试剂选择等因素有很大关系。
下面简要介绍一下直接磺化的机理。
对于亚硫酸盐的磺化反应,其机理主要分为两个步骤:首先是有机物中的活泼亲核试剂把亚硫酸盐中的硫酸酯基取代,生成新的硫酸酯,并过渡态消失;生成的新硫酸酯参与亚硫酸盐酯化反应,生成磺化产物和硫酸酯。
总的反应方程式为:(1)ROH+HSO3R'→ROSOR'+H2O三、反应条件溶剂:磺化反应使用的溶剂从极性溶剂到非极性溶剂不一,一般根据反应物和试剂的特性选择合适的溶剂。
如催化剂催化的磺化反应,通常使用极性溶剂如N,N-二甲基甲酰胺(DMF),N-甲基吡咯烷酮(NMP)等。
而直接间接氧化磺化反应需要使用的溶剂则较多,如乙腈、丙酮、二氯甲烷、甲醇等。
反应时间:磺化反应的反应时间与温度、反应物的浓度和反应条件等因素有关。
反应时间一般在几小时到一天左右。
四、应用由于磺化反应的反应条件较为宽松,且反应的产物具有良好的物理化学性质,因此磺化反应在诸多领域有广泛应用。
例如在染料和颜料合成中,一些有机染料和颜料通过磺化反应可以改善其溶解性、抗光、耐污染等物理化学性质。
在医药领域,一些药物和激素也可以通过磺化反应进行改性,提高其生物利用度和药效等方面的性能。
在橡胶和塑料工业中,磺化反应可以增加其抗氧化、抗切断、化学稳定性等方面的性能,使其更有耐久性。
药物合成反应-卤化反应
通式
烯醇酯的卤化反应
机理
应用特点
通式
烯醇硅烷醚的卤化反应
机理 应用特点
区域性卤化 制备α卤代醛
反应通式
烯胺的卤化反应
反应机理:卤化剂对烯胺双键的亲电加成
应用特点:选择性的α卤代反应
反应通式
机理:亲电取代机理
酰卤、酸酐、腈、丙二酸及其酯的α卤取代反应
应用
饱和脂肪酸酸的α卤取代反应
羧酸的α卤取代反应
反应通式
机理:亲核取代反应
影响因素:醇的结构,卤化剂的影响
将醇转化为响应的卤化物 Vilsmeier-Haack试剂
应用特点
反应通式
机理:醇和有机磷化物生成酯或加成物,卤素负离子SN2反应,构型反转
将光学活性的仲醇转化成构型反转的卤代烃
用于酸性条件下不稳定的化合物的卤化
适用于易重排醇的卤化 适用于甾体醇卤置换
醇的卤置换 酚的卤置换 醚的卤置换
醇、酚、醚的卤置换反应
羧羟基的卤置换 羧酸的脱羧卤置换反应
羧酸的卤置换反应
卤化物的卤素交换 磺酸酯的卤置换反应 芳香重氮盐化物的卤置换反应
其他官能团的卤置换
卤化反应
卤化反应机理
电子反应机理 自由基反应机理
亲电反应 亲核反应:亲核取代
自由基加成 自由基取代
不饱和烃的卤加成反应
制备碘代烃 制备氟代烃
磺酸酯的卤置换反应
反应通式
机理:亲核取代,卤化剂为亲核试剂
应用特点
醇的间接卤置换 磺酰化-卤置换反应常比卤素置换更有效
芳香重氮盐化合物的卤置换反应
通式:可将卤素原子引入到芳烃的位置上 机理:自由基反应 应用特点:芳香重氮盐化合物的氯置换和溴置换反应 芳香重氮盐化合物的碘置换反应 芳香重氮盐化合物的氟置换反应:希曼反应
药物合成反应

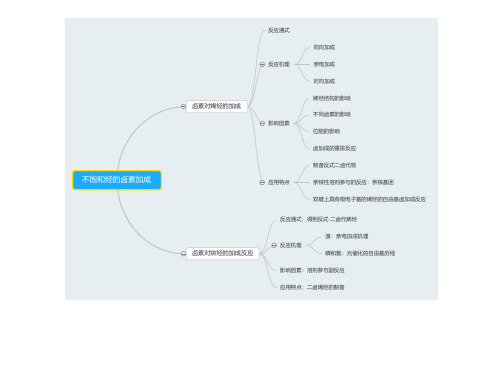
四.缩合反应定义:两个及两个以上有机化合物通过反应形成一个新的较大分子或同一分子内部发生分子内的反应形成新分子的反应称为缩合反应。
Aldol:定义:在稀酸或稀碱催化下(通常为稀碱),一分子醛(或酮)的 氢原子加到另一分子醛(或酮)的羰基氧原子上,其余部分加到羰基碳上,生成 -羟基醛(或酮),这个增长碳链的反应称为α-羟烷基化反应。
但该类化合物不稳定,易消除脱水生成α,β-不饱和醛酮,又称Aldol缩合反应。
Aldol特点:酮:活性小于醛,反应速度慢。
1. 对称酮产物较单纯。
2. 不对称酮的自身缩合,在碱性或酸性催化下,反应都发生在取代较少的羰基碳原子上。
羟醛缩合催化剂碱:弱碱(如Na3PO4、NaOAc、Na2CO3、K2CO3、NaHCO3),强碱(如NaOH、KOH、NaOEt、NaH、NaNH2)酸:盐酸、硫酸、对甲苯磺酸、三氟化硼以及阳离子交换树脂等Cannizzaro反应(歧化反应)定义:凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合或树脂化作用而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇。
甲醛的羟甲基化反应和交叉Cannizzaro反应能同时发生,是制备多羟基化合物的有效方法。
定向醇醛(酮)缩合方法:A.烯醇盐法:醛或酮与具位阻的碱如LDA(二异丙胺锂)作用,形成烯醇盐再与另一分子醛或酮作用,B.烯醇硅醚法:醛、酮转变成烯醇硅醚,在TiCl4催化下与另一分子醛、酮分子作用。
C. 醛、酮与胺形成亚胺,与LDA形成亚胺锂盐,再与另一分子醛、酮作用。
Diels-Alder反应含有一个活泼的双键或叁键的烯或炔类和二烯或多烯共轭体系发生1,4-加成,形成六员环状化合物的反应称为Diels-Alder反应。
该反应易进行且反应速度快,应用范围广,是合成环状化合物的一个非常重要的方法。
药物合成中的选择性和反应条件

药物合成中的选择性和反应条件药物合成是一项关键的科学研究领域,它涉及到合成新药物以及改进现有药物的方法和技术。
在药物合成过程中,选择性和反应条件是两个至关重要的因素。
选择性指的是在合成过程中选择特定的反应路径,以获得目标化合物。
反应条件则是指在合成过程中所需的温度、压力、溶剂等因素。
本文将探讨药物合成中的选择性和反应条件对于药物研发的重要性以及相关的研究进展。
选择性在药物合成中起着至关重要的作用。
药物分子通常具有多个官能团,因此在合成过程中需要选择特定的反应路径,以避免不必要的副反应和产物。
选择性的提高可以减少合成过程中的浪费和成本,并且有助于提高合成产物的纯度和药效。
为了实现选择性,研究人员通常会选择适当的试剂和催化剂,以及调整反应条件。
例如,选择性催化剂可以通过选择性地催化目标化合物的形成,从而减少副反应的发生。
此外,选择性还可以通过分子设计和合成路径的优化来实现。
研究人员可以通过调整反应条件、改变反应物比例以及引入保护基团等方法,来控制反应的选择性。
反应条件是药物合成中另一个重要的方面。
反应条件包括温度、压力、溶剂等因素,这些因素对于反应速率、产物选择性以及产物纯度都有重要影响。
温度是影响反应速率的重要因素之一。
通常情况下,提高反应温度可以加速反应速率,但同时也可能导致副反应的发生。
因此,在药物合成中,选择适当的反应温度是非常关键的。
此外,压力也可以影响反应速率和选择性。
高压条件下,反应物分子之间的碰撞频率增加,从而加快了反应速率。
然而,过高的压力可能导致副反应的发生,因此需要进行适当的控制。
溶剂的选择也是药物合成中的重要因素之一。
溶剂可以提供反应物的溶解度,并且可以调节反应速率和选择性。
合适的溶剂选择可以提高反应效率和产物纯度。
近年来,随着化学合成技术的不断发展,药物合成中的选择性和反应条件的研究取得了许多重要进展。
新型催化剂的开发和应用为选择性合成提供了更多的选择。
例如,金属有机催化剂在药物合成中发挥了重要作用,它们可以通过选择性催化特定的反应路径,实现高选择性的合成。
[医学]药物合成反应(闻韧)第二版
![[医学]药物合成反应(闻韧)第二版](https://img.taocdn.com/s3/m/a15c3fba5ef7ba0d4b733b20.png)
C l C l
C l O A c
+ H 3 C CCH A c O H /C l2H 3 CCCH H 3 CCCH
H
C 2 H 5 L iC l H
C 2 H 5 H
C 2 H 5
I2 /K IO 3
C H 3 -C H = C H 2
C H 3 -C H -C H 2 I
O H
9 3 %
I2/A cO A g
药物合成反应(闻韧) 第二版
定义:分子中形成C-X的反应
特点:引入卤原子可改变有机分子中的性质,同时能转化成 其它官能团。
如:制备药物中间体 糖皮质激素醋酸可的松
C H 3
CO O H
C H 2I CO
O H
O
I2/C aO C H 3O H /C aC l2
O
CH3COOK DMF O
制备具有不同生理活性的含卤素的有机药物
和影响因素 5 芳香环的卤置换反应的卤化剂的种类、反应历程和影响因素 6 醛酮羰基α -位的卤置换反应的反应历程及其影响因素 7 用于醇酚羟基的卤置换反应的卤化剂的种类、反应历程及影
响因素 8 用于羧酸的卤置换反应的卤化剂种类、特点及使用条件
第一节 不饱和烃的卤加成反应 概述
• 加卤素
CC X 2
O C H 2O C C H 3
CO O H
H2N
H NHCOCHCl2
C C CH2OH
OH H
NH
氯霉素
O
F
COOH
N
诺氟沙星
C2H5
卤化反应的类型
饱和烷烃
不饱和烃
芳香环上的卤取代
Fe +C l2
C l + H C l
药物合成学习题

《药物合成技术》习题集适用于制药技术类专业河北化工医药职业技术学院李丽娟二00六年七月第一章 概论一、本课程的学习内容和任务是什么?学好本课程对从事药物及其中间体合成工作有何意义?二、药物合成反应有哪些特点?应如何学习和掌握? 三、什么是化学、区域选择性?举例说明。
四、什么是导向基?具体包括哪些类型?举例说明。
五、药物合成反应有哪些分类方法?所用试剂有哪些分类方法?举例说明。
六、查资料写一篇500字左右的短文,报道药物合成领域的新技术及发展动态?第二章 卤化技术(Halogenation Reaction )一、简答下列问题1.何为卤化反应?按反应类型分类,卤化反应可分为哪几种?并举例说明。
2.在药物合成中,为什么常用卤化物作为药物合成的中间体?3.在较高温度或自由基引发剂存在下,于非极性溶剂中,B r 2和NBS 都可用于烯丙位和苄位的溴取代,试比较它们各自的优缺点。
4.比较X 2、HX 、HOX 对双键离子型加成的机理、产物有何异同,为什么?5.解释卤化氢与烯烃加成反应中,产生马氏规则的原因(用反应机理)。
为什么Lewis 酸能够催化该反应?6.解释溴化氢与烯烃加成反应中,产生过氧化效应的原因?7.在羟基卤置换反应中,卤化剂(HX 、SOCl 2、PCl 3、PCl 5)各有何特点,它们的使用范围如何?二、完成下列反应C CH 3CH 3CHCH 3Ca(OCl)2/AcOH/H 2O1.Ph 2CHCH 2CH 2OH PBr 2.CH 3SO 2ClCl /AIBN3.OH4CH 3CH 35.2OC O CH 3OHI 2/CaOTHF/MeOHAcOK Me 2CO?6.三、为下列反应选择合适的试剂和条件,并说明原因。
(CH 3)2CCHCH 3CHCH 2Br(CH 3)2C1.CH 3CH CH COOHCH 3CH CH COCl 2.HOCH 2(CH 2)4CH 2OH(CH 2)4CH 2I CH 2I 3.CH 3OCH 2CH 2CO 2HCH 2CHCOBrCH 3O 4.CH 3CH CH CO 2CH 3CH 2CH CH CO 2CH 3Br 5.OCH 2CH 2OH CH 2CH 2OHO2CH 2CH 2CH 2ClCl 6.CH 2OH3CH2ClOCH 37.8.BrCH 2(CH 2)9COOH CH 3CH(CH 2)8COOHBrCH 2CH(CH 2)8COOHCH 3NO 2CH 2C(COOC 2H 5)3CH 2BrNO 2CH 2C(COOC 2H 5)39.CH 22CH 2N(CH 2CH 2OH)2C(COOC 2H 5)3(抗肿瘤药消卡芥)CH 2NO 2CH 2N(CH 2CH 2Cl)2CHCOOH 2CH 2NO 2CH 2N(CH 2CH 2Cl)2C(COOC 2H 5)NHCOCH 310.CH 3(CH 2)5OCH 3C 2H 5CH 3(CH 2)5OCH 2BrC 2H 5CH3(CH 2)5OOHC 2H 5CH 3(CH 2)4CH 2OHCH 3(CH 2)4CH 2Cl CH 3(CH 2)4CH 2Cl (构型反转)(构型保持)11.OC 2H 5OC 2H 5Br12.四、分析讨论1.试预测下列各烯烃溴化(Br 2/CCl 4)的活性顺序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
药物合成反应的特点
药物合成反应是指在化学实验室或生产过程中,通过化学方法将原料转化为所需的药物分子的过程。
以下是药物合成反应的一些特点:
1.复杂性:药物合成反应通常涉及多步骤的化学反应,需要
进行精确的控制和操作。
合成过程中可能需要使用多种试剂、催化剂和溶剂,并进行特定的温度和压力条件下的反应。
2.高选择性:药物合成反应通常需要高度选择性,即在多个
可能的反应途径中选择合适的反应路径,以保证所需的目标化合物能够高产率地得到。
3.纯度要求高:药物合成反应的产物通常需要达到高纯度的
要求,以确保药物的质量和安全性。
这涉及到对反应产物进行纯化和纯化技术的运用,例如晶体化、溶剂萃取、色谱等。
4.高效性和经济性:药物合成反应的重要特点是追求高效性
和经济性。
这意味着减少反应步骤、提高反应产率、合理利用废弃物等,以降低生产成本和提高药物合成的效率。
5.安全性:在药物合成反应中,需要注意反应过程中的安全
性,例如使用合适的防护设备(如手套、护目镜等),妥善处理有害物质和废弃物,并严格遵守实验室安全操作指南。
6.优化和改进:药物合成反应是一个不断发展和改进的过程。
随着合成技术和工艺的进步,研究人员致力于开发更高效、环境友好和可持续的合成方法,以提高药物合成的质量和
效率。
总的来说,药物合成反应的特点包括复杂性、高选择性、纯度要求高、高效性和经济性、安全性以及不断优化和改进。
这些特点需要在药物合成过程中得到充分考虑和满足,以确保合成出符合药物质量标准的药物。
