药分 第十二章 药物制剂的分析
药物制剂稳定性实验方法

医学ppt
5
药物降解公式:
dC dt
= KCn
K:反应速度常数 C:反应物浓度
n:反应级数
t:反应时间
n可以等于0,1,2……称为零级、一级、二 级……反应
医学ppt
6
级第数一节微概分述式
0
dC dt
=K
积分式 C=-Kt+C0
1
dC dt
= KC
lgC=
---- 临界相对湿度(CRH)
医学ppt
27
(五)金属离子
催化氧化反应速度; 0.0002M的Cu2+可使维生素C氧化反 应加快10000倍。
避免生产过程、原辅中带入, 加螯合剂:
依地酸盐(EDTA)、枸橼酸、酒石酸等
医学ppt
28
(六)包装材料
隔绝热、光、水、氧,不与药物反应, (1)玻璃,棕色玻璃 (2)塑料:透湿、透气、吸着性 (3)金属 (4)橡胶----塞子、垫圈等 “装样试验”,
医学ppt
29
三、固体药物制剂稳定性的特点 自学
医学ppt
30
四、药物制剂稳定性的其它方法
改进剂型及生产工艺 制成固体制剂(青霉素----粉针) 制成微囊或包合物(维生素A----微囊; 薄荷油----包合物) 直接压片或包衣
医学ppt
31
四、药物制剂稳定性的其它方法
制成难溶性盐 青霉素G钾盐--普鲁卡因青霉素G (1:250)
阳光下10分钟分解13.5%, 室内光线下,半衰期为4小时。
医学ppt
23
(三)空气(氧气)
溶液中、容器中(氧化药物) (1)排除氧气 溶液中:煮沸(100℃水中不含氧气),
2021年药物分析试题库

药物分析试题库第一章绪论第二章药物杂质检查第三章药物定量分析与分析办法验证第四章巴比妥类药物分析第五章芳酸及其酯类药物分析第六章胺类药物分析第七章杂环类药物分析第八章生物碱类药物分析第九章维生素类药物分析第十章甾体激素类药物分析第十一章抗生素类药物分析第十二章药物制剂分析第十三章生化药物与基因工程药物分析概论第十四章中药及其制剂分析概论第十五章药物质量原则制定第十六章药物质量控制中当代分析办法与技术第一章绪论一、填空题1.国内药物质量原则分为和两者均属于国家药物质量原则,具备等同法律效力。
2.中华人民共和国药典重要内容由、、某些构成。
3.当前公认全面控制药物质量法规有、、、。
4.“精密称定”系指称取重量应精确至所取重量;“称定”系指称取重量应精确至所取重量;取用量为“约”若干时,系指取用量不得超过规定量。
5.药物分析重要是采用或等办法和技术,研究化学合成药物和构造已知天然药物及其制剂构成、理化性质、真伪鉴别、纯度检查以及有效成分含量测定等。
因此,药物分析是一门办法性学科。
二、问答题1.药物概念?对药物进行质量控制意义?2.药物分析在药物质量控制中担任着重要任务是什么?3.常用药物原则重要有哪些,各有何特点?4.中华人民共和国药典()是如何编排?5.什么叫恒重,什么叫空白实验,什么叫原则品、对照品?6.惯用药物分析办法有哪些?7.药物检查工作基本程序是什么?8.中华人民共和国药典和国外惯用药典现行版本及英文缩写分别是什么?第二章药物杂质检查一、选取题:1.药物中重金属是指()A Pb2+B 影响药物安全性和稳定性金属离子C 原子量大金属离子D 在规定条件下与硫代乙酰胺或硫化钠作用显色金属杂质2.古蔡氏检砷法测砷时,砷化氢气体与下列那种物质作用生成砷斑()A 氯化汞B 溴化汞C 碘化汞D 硫化汞3.检查某药物杂质限量时,称取供试品W(g),量取原则溶液V(ml),其浓度为C(g/ml),则该药杂质限量(%)是()A %100⨯C VWB %100⨯V CWC %100⨯W VCD %100⨯CVW 4.用古蔡氏法测定砷盐限量,对照管中加入原则砷溶液为( )A 1mlB 2mlC 依限量大小决定D 依样品取量及限量计算决定5.药物杂质限量是指( )A 药物中所含杂质最小容许量B 药物中所含杂质最大容许量C 药物中所含杂质最佳容许量D 药物杂质含量6. 氯化物检查中加入硝酸目是( )A 加速氯化银形成B 加速氧化银形成C 除去CO 2+3、SO 2-4、C 2O 2-4、PO 3-4干扰 D 改进氯化银均匀度7.关于药物中杂质及杂质限量论述对的是( )A 杂质限量指药物中所含杂质最大容许量B 杂质限量普通只用百万分之几表达C 杂质来源重要是由生产过程中引入其他方面可不考虑D 检查杂质,必要用原则溶液进行比对8.砷盐检查法中,在检砷装置导气管中塞入醋酸铅棉花作用是( )A 吸取砷化氢B 吸取溴化氢C 吸取硫化氢D 吸取氯化氢9.中华人民共和国药典规定普通杂质检查中不涉及项目( )A 硫酸盐检查B 氯化物检查C 溶出度检查D 重金属检查10.重金属检查中,加入硫代乙酰胺时溶液控制最佳pH 值是( )A 1.5B 3.5C 7.5D 11.5二、多选题:1.用对照法进行药物普通杂质检查时,操作中应注意( )A 供试管与对照管应同步操作B 称取1g 以上供试品时,不超过规定量±1%C 仪器应配对D 溶剂应是去离子水E 对照品必要与待检杂质为同一物质2.关于药物中氯化物检查,对的是()A 氯化物检查在一定限度上可“批示”生产、储存与否正常B 氯化物检查可反映Ag+多少C 氯化物检查是在酸性条件下进行D 供试品取量可任意E 原则NaCl液取量由限量及供试品取量而定3.检查重金属办法有()A 古蔡氏法B 硫代乙酰胺C 硫化钠法D 微孔滤膜法E 硫氰酸盐法4.关于古蔡氏法论述,错误有()A 反映生成砷化氢遇溴化汞,产生黄色至棕色砷斑B 加碘化钾可使五价砷还原为三价砷C 金属新与碱作用可生成新生态氢D 加酸性氯化亚锡可防止碘还原为碘离子E 在反映中氯化亚锡不会铜锌发生作用5.关于硫代乙酰胺法错误论述是()A 是检查氯化物办法B 是检查重金属办法C 反映成果是以黑色为背景D 在弱酸性条件下水解,产生硫化氢E 反映时pH应为7-86.下列不属于普通杂质是()A 氯化物B 重金属C 氰化物D 2-甲基-5-硝基咪唑E 硫酸盐7.药物杂质限量基本规定涉及()A 不影响疗效和不发生毒性B 保证药物质量C 便于生产D 便于储存E 便于制剂生产8.药物杂质来源有()A 药物生产过程中B 药物储藏过程中C 药物使用过程中D 药物运送过程中E 药物研制过程中9.药物杂质会影响()A 危害健康B 影响药物疗效C 影响药物生物运用度D 影响药物稳定性E 影响药物均一性三、填空题:1.药典中规定杂质检查项目,是指该药物在___________和____________也许具有并需要控制杂质。
河北科技大学物理药剂学12药物制剂的稳定性

易氧化物
固体药物稳定性
各种产品
(一)温度的影响
Van’t Hoff规则:一般来说,温度升高,反 应速度加快。温度每升高 10C ,反应速度约 增加2~4倍。 • 不同反应增加的倍数可能不同,上述规则只是 一个粗略的估计。 Arrhenius 方程:定量地描述了温度与反应 速度之间的关系,是药物稳定性预测的主要理 论依据。
• pH调节要同时考虑稳定性、溶解度和疗效三个方面。 • 如大部分生物碱在偏酸性溶液中比较稳定,故注射剂常 调节在偏酸范围。但制成滴眼剂,就应调节在偏中性范 围,以减少刺激性,提高疗效。
尽量采用与药物本身具有相同离子的酸或碱进行调节
(二)广义酸碱催化的影响
• 按照Bronsted-Lowry酸碱理论,给出质子 的物质叫广义的酸,接受质子的物质叫广义的 碱。 • 有些药物也可被广义的酸碱催化水解。这种催 化作用叫广义的酸碱催化(一般酸碱催化)。 • 许多药物处方中,往往需要加入缓冲剂。 • 缓冲剂对某些药物的水解有催化作用 (如醋酸盐、磷酸盐、枸橼酸盐、硼酸盐)
普鲁卡因盐酸盐
第四节
影响药物制剂降解的因素及 稳定化方法
一、处方因素
• 制备任何一种制剂,由于处方的组成对制剂稳 定性影响很大,因此,首先要进行处方设计。 • pH、广义的酸碱催化、溶剂、离子强度、表 面活性剂、某些辅料等因素
(一)pH的影响
专属酸碱催化(或特殊酸碱催化) : H+ 或 OH-
• 氧化过程一般都比较复杂,有时一个药物,氧化、 光化分解、水解等过程同时存在。
1.酚类药物
• 这类药物分子中具有酚羟基,如肾上腺素、左 旋多巴、吗啡、去水吗啡、水杨酸钠等。
肾上腺素
第十二章药物制剂的稳定性

有人在研究杆菌肽的热分解实验中,存在平衡。 维生素A胶丸和维生素E片剂存在平衡现象
采用45℃ 、55℃ 、70℃ 、85℃四个温度进行 实验,测定各个温度下产物和反应物的平衡浓度, 然后求出平衡常数K。按Van’t Hoff方程:
H ln K RT
H:反应热;:常数。以lgK对1/T作图,得一
避免金属离子的影响,应选用纯度较高的原辅料, 不使用金属器具,加入螯合剂。
7
(五)湿度和水分的影响
湿度与水分对固体药物制剂稳定性的影响较大 无论是水解反应,还是氧化反应,微量 的水均能加速一些药物(氨苄青霉素钠、对 氨基水杨酸钠、乙酰水杨酸、青霉素G钠盐) 的分解。
药物是否容易吸湿,取决其临界相对湿度 (CRH%)的大小。 临界相对湿度(critical relative humidity):
14
2.
药物分子相对固定,不均匀性;一些易氧化的 药物,氧化作用往往限于固体表面,以致表里变化 不一。
固体剂型的特点: ①系统不均匀性;②多相系统,包括气相、液相 和固相,当进行实验时,这些相的组成和状态能 够发生变化。特别是水分的存在,对实验造成很 大的困难,因水分对稳定性影响很大,由于这些 特点,研究固体药物剂型稳定性,是一件十分复 杂的工作。
13
例如青霉素钾盐,可制成溶解度小的普鲁卡因青
霉素G,稳定性显着提高。青霉素还可与N, N-双
苄乙二胺生成苄星青霉素G(长效西林),其溶解
度进一步减小,稳定性增强,可以口服。
第五节 固体药物制剂稳定性的特点 及降解动力学
一、固体药物制剂稳定性的特点
(一)固体药物与固体剂型稳定性的一般特点
《药物分析》课程课后答案

《药物分析》课程课后答案第一章绪论一、选择题(一)单项选择题1.D2.D3.B4.C5.C6.C7.C8.B9.C 10.C11.C 12.A二、问答题(略)第二章药物的性状与鉴别试验一、选择题(一)单项选择题1.B2.B3.A4.B5.D6.B7.E8.B(二)多项选择题1.AE2.ABCDE3.ABDE二、问答题(略)第三章药物的杂质检查一、选择题(一)单项选择题1.E2.E3.D4.A5.D6.E7.B8.D9.E 10.D11.E 12.A 13.C 14.B 15.B 16.B 17.C 18.D 19.E 20.D(二)配伍选择题1.D2.A3.B4.C5.E(三)多项选择题1.ABD2.ABCDE3.BCE4.AB5.BDE二、问答题(略)三、计算题1.0.1%2.2g3.2ml第四章常用定量分析方法及计算一、选择题(一)单项选择题1.B2.A3.D4.B5.C6.C7.B8.B9.D 10.C 11.C(二)多项选择题1.ABC2.ABCDE3.AB4.ABCDE5.ABCDE二、问答题(略)三、计算题1.98.8%。
2.101.1%,符合规定。
第五章药物制剂检验技术一、选择题(一)单项选择题1.A2.B3.B4.C(二)多项选择题1.ABCDE2.BC3.ABCE二、问答题(略)第六章巴比妥类药物的分析一、选择题(一)单项选择题1.D2.B3.A4.A5.E(二)多项选择题1.AB2.ABD3.ABCD4.ACD5.AD二、问答题(略)第七章芳酸及其酯类药物的分析一、选择题(一)单项选择题1.D2.B3.D4.A5.D6.C7.C8.C9.C 10.A 11.B 12.C 13.D 14.D 15.B(二)多项选择题1.ABDE2.BCDE3.ACD4.ABC5.ABCDE二、问答题(略)三、计算题99.8%。
第八章胺类药物的分析一、选择题(一)单项选择题1.C2.C3.B4.D5.D6.A7.E8.D9.A 10.B(二)多项选择题1.AB2.ABCD3.CD4.ABCD5.ACD二、问答题(略)三、计算题102.8%,符合规定。
第十二章 药物制剂的稳定性 经典恒温法
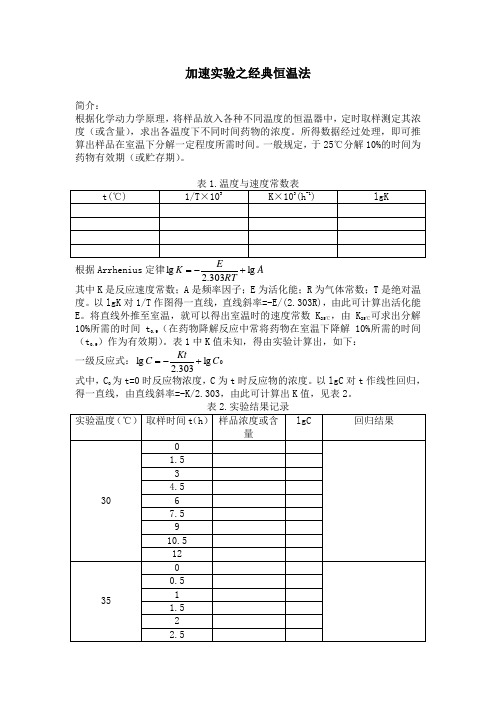
加速实验之经典恒温法简介:根据化学动力学原理,将样品放入各种不同温度的恒温器中,定时取样测定其浓度(或含量),求出各温度下不同时间药物的浓度。
所得数据经过处理,即可推算出样品在室温下分解一定程度所需时间。
一般规定,于25℃分解10%的时间为药物有效期(或贮存期)。
根据Arrhenius 定律A RTK lg 303.2lg +-= 其中K 是反应速度常数;A 是频率因子;E 为活化能;R 为气体常数;T 是绝对温度。
以lgK 对1/T 作图得一直线,直线斜率=-E/(2.303R),由此可计算出活化能E 。
将直线外推至室温,就可以得出室温时的速度常数K 25℃,由K 25℃可求出分解10%所需的时间t 0.9(在药物降解反应中常将药物在室温下降解10%所需的时间(t 0.9)作为有效期)。
表1中K 值未知,得由实验计算出,如下:一级反应式:0lg 303.2lg C Kt C +-= 式中,C 0为t=0时反应物浓度,C 为t 时反应物的浓度。
以lgC 对t 作线性回归,得一直线,由直线斜率=-K/2.303,由此可计算出K 值,见表2。
度高,则间隔时间短,反之亦然。
)的取样测定。
此法较准确,但分析测定工作量大。
例子:银黄注射液稳定性预测黄芩苷测定数据处理方法:在每一实验温度内,将lgC对t作线性回归,结果如表3。
再将实验温度有摄氏温度改换为热力学温度T,调整如表5:lgIK=-64031/T+16.02将室温25℃(T=298K)代入直线方程,得室温反应速度常数K25℃=3.4075×10-6/h,代入公式t0.9=0.1045/K25℃=30660h=3.5年,即黄芩苷于25℃的有效期为3.5年。
药剂学第12章药物制剂的稳定性

pH 4左右产生外消旋化作用,外消旋以后, 只有50%的活性。因此,应选择适宜的pH。 左旋莨菪碱也可能外消旋化。外消旋化反应 经动力学研究系一级反应。
(1)光学异构化
差向异构化指具有多个不对称碳原子上的
基团发生异构化的现象。四环素在酸性条 件下,在4位上碳原子出现差向异构形成4 差向四环素,治疗活性比四环素低。毛果 芸香碱在碱性pH时,-碳原子也存在差向 异构化作用,生成异毛果芸香碱,为伪一 级反应。麦角新碱也能差向异构化,生成 活性较低的麦角袂春宁(ergometrinine)。
三、其他反应
1.异构化
异
构 化 一 般 分 光 学 异 构 (optical isomerization) 和 几 何 异 构 (geometric isomerization)二种。
通常药物异构化后,生理活性降低甚至
没有活性。
(1)光学异构化
光学异构化可分为外消旋化作用
(racemization)和差向异构(epimerization)。
2. 酰胺类药物的水解
酰胺类药物水解以后生成酸与胺。属这
类的药物有氯霉素、青霉素类、头孢菌 素类、巴比妥类等药物。此外如利多卡 因、对乙酰氨基酚(扑热息痛)等也属 此类药物。
(1)氯霉素
氯霉素水溶液在pH7以下,主要是酰胺水解, 生成氨基物与二氯乙酸。
H NHCOCHCl2 C C CH2OH OHH
(2)几何异构化
有些有机药物,反式异构体与顺式几何
异构体的生理活性有差别。维生素A的活 性形式是全反式(all-trans)。在多种维生 素制剂中,维生素A除了氧化外,还可异 构化,在2, 6位形成顺式异构化,此种异 构体的活性比全反式低。
第十二章药物制剂分析

第十二章药物制剂分析基本要求掌握片剂、注射剂、胶囊剂、颗粒剂和软膏剂的一般检查项目和特殊检查项目;制剂含量测定结果的表示方法和计算方法。
熟悉常用附加剂对含量测定的干扰和排除方法。
了解复方制剂的分析。
第一节药物制剂分析的特点1.方法:制剂分析是利用物理、化学、物理化学、甚至微生物测定方法,对不同剂型的药物制剂进行分析,以检验被检测的制剂是否符合质量标准规定的要求。
2.区别:制剂除含主药外,还含有赋形剂、稀释剂和附加剂(包括稳定剂、抗氧剂、防腐剂和着色剂等),这些附加成分的存在,常常会影响主药的测定,致使制剂分析复杂化。
3.检查:通常是符合药物规定要求的各种原料,按照一定的生产工艺制备而成的。
因此,在制剂分析中对所有原料所做过的检查项目,不必重复。
制剂中如需进行杂质检查,主要来源于制剂中原料药物的化学变化和制剂的制备过程。
4.制剂特殊检查:除对某些不稳定的药物制剂需增加必要的检查项目外,一般对小剂量片剂(或胶囊)等需检查均匀度;对具有某种物理特性的片剂(或胶囊)需检查溶出度;对某些特殊制剂(缓释、控释剂肠溶制剂)需检查释放度等等,以保证药物的有效、合理及安全。
5.与原料药含量测定方法的区别:专属性和灵敏度要求更高。
(考虑性质、含量以及赋形剂、附加剂的影响;同时考虑复方制剂中其他成分的影响)。
6.计算:按标示量计算的百分含量表示,而不采用原料药的百分含量的表示方法。
1)采用滴定分析时,含量测定结果用下式进行计算:(1)片剂:相当于标示量的百分含量=W测×W/n//W样×S标×100%式中,W测为采用某种滴定方法测得的量(g);Wn/n为平均片(胶囊)重(g/片),W样为称取样品量(g);n为所称取片(胶囊)的个数;S标为标示量(g/片)(2)注射剂含量测定结果的计算:相当于标示量的百分含量= W测/V×S×100%式中V准确量取样品的体积(ml);W测为采用某种滴定方法测得V(ml)样品中被测组分的量(mg);S为标示量(mg/ml)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(一)用容量法测定片剂含量
1.片剂的取样方法
一般片剂取20片或按规定取样(糖衣片取10 片或按规定取样,除去糖衣),精密称定重量 后,计算出平均片重,将已称量的20片药片 研细,精密称取适量(约相当于规定的主要含 量),按药典方法测定含量。
注意:测定前,应使样品溶解完全!
比色法、紫外可见分光光度法
3.滑石粉、硫酸钙等干扰及排除
片剂中赋形剂:滑石粉、硫酸钙、淀粉
溶液发生浑浊
不溶于水
比色法、旋光法测定含量干扰
如何排除干扰? 根据主药的溶解性
水溶
脂溶
溶解、过滤 有机溶剂提取
四、片剂分析示例
片剂分析项目:外观检查、鉴别试验、常规
检查、杂质检查、含量测定。
(注意事项、结果计算)
检查装置
二、片剂含量均匀度和溶出度的检查
(一)片剂含量均匀度的检查
含量均匀度:指小剂量片剂、膜剂、胶囊剂或注射 用无菌粉末等制剂中的每片(个)含量偏离标示量 的程度。凡检查含量均匀度的制剂不再检查重(装) 量差异。
两次抽检法(中国药典收载):以标示量为参照值, 以标示量(100)和样本均值( )X之差的绝对值 A及标准差(S)这两个统计参数为判定标准的计量 抽检法。
溶出度是控制固体制剂内在质量的重要指标之一, 是观察生物利用度的一种体外试验法。
目前片剂溶出度的测定主要用于一些难溶于水的药 物,溶解度<0.1%~1%。溶出度与药物在体内药 效的真实情况有一定的相关性。
具体检查方法、结果判断和实例祥见讲义。
三、片剂中常见附加剂的干扰及排除
常见附加剂:淀粉、糊精、蔗糖、乳糖、硬脂酸镁、硫
W 为平均片重(g/片)。
例题:谷氨酸片的含量测定
取本品10片,精密称定其重量 6.5980g,研细,精密称取片粉 0.5275g,加沸水50ml溶解,放冷,加溴麝香草酚蓝指示液 0.5ml,用氢氧化钠滴定液(0.1023mol/L)滴定,到达滴定终 点时消耗滴定液的体积为25.98ml。本品规格为0.5g,每1ml的 氢氧化钠滴定液( 0.1mol/L )相当于14.71mg的谷氨酸 (C5H9NO4)。中国药典规定,本品含谷氨酸应为标示量的 95.0%-105.0%,试问该样品是否合格?
外观、色泽、臭味
鉴别试验
常规检查、杂质检查
(重量差异、崩解时限)
含量测定
常规检查项目
重量差异:按规定称量方法测得每片的重量
与平均片重之间的差异程度。
平均重量
0.30 g以下 0.30 g或以上
重量差异限度
±7.5% ±5.0%
崩解时限:指固体制剂在规定的液体介
质中,以规定的检查方法进行测定,崩解 溶散至小于2.0mm碎粒(或溶化、软化) 所需时间的限度。
酸钙、羧甲基纤维素、滑石粉。
糖类的干扰及排除 硬脂酸镁(片剂润滑剂)的干扰及排除 滑石粉、硫酸钙等的干扰及排除
注意事项:附加成分理化性质附加成分量与主药量
的配比测定主药方法的选择,测定方法专属性强,附加成 分的干扰就小主药量小时 灵敏度高的色谱法、分光光 度法。
1.糖类的干扰及排除
淀粉、糊精、蔗糖、乳糖 水解产物 葡萄糖
药物制剂分析的特点
(一)药物制剂分析的复杂性
主药的结构和性质,附加成分对测定干扰,如何消除?
(二)分析项目要求不同
药物制剂由合格的原料药经过一定生产工艺而制成 一 般不需重复原料药已经检查的项目。例:制剂的杂质检查,主要
检查药物在制成制剂的过程或贮存过程中发生化学变化产生的杂质。小
剂量片剂或胶囊剂 含量均匀度、溶出度;缓释、控释及肠溶制剂
释放度
(三)含量测定结果的表示方法
原料药
含量百分率
制剂
含量占标示量(规格值)的百分率
第二节 片剂的分析
片剂:药物与适宜的辅料通过制剂技术制成
片状或异形片状的制剂。
片剂的常规检查项目 片剂含量均匀度和溶出度的检查 片剂中常见附加剂的干扰及排除 片剂分析示例
一、片剂的常规检查项目
片剂分析步骤:
氧化剂
葡萄糖酸 氧化还原滴定法测含量,结果偏高。
硫酸亚铁
原料 片剂
高锰酸钾法 铈量法
2.硬脂酸镁的干扰及排除
Mg2+
干扰
配位滴定 Mg2+~EDTA 结果偏高
干扰排除: 选用合适指示剂 掩蔽剂
硬脂酸根离子
干扰
非水滴定
主药含量较少,硬脂酸根消耗
Hale Waihona Puke 高氯酸,结果偏高有机溶剂提取 草酸、酒石酸作掩蔽剂
镁盐沉淀、硬脂酸(在冰醋酸、醋酐不呈酸性)
抽取10片,逐一测定含量,计算此10片的均值和标准差S, 标示量与均值之差的绝对值A,根据下列公式判断:
A+S>15.0
不合格产品
A+1.80S15.0 合格产品
A+1.80S > 15.0 且 A+S 15.0 另取20片(个)复试
片剂含量均匀度和溶出度的检查
(二)片剂溶出度的检查
溶出度:指药物从片剂或胶囊剂等固体制剂在规定 溶剂中溶出的速度和程度。凡检查溶出度的制剂, 不再进行崩解时限的检查。
糖衣片怎么做?
胶囊剂怎么做?
2.片剂含量测定结果的计算
片剂的含量测定结果用含量占标示量的百分 率表示,含义为:
含量占标示量的百分率= 测得每片中药物的实际含量 100%
标示量
含量占标示量的百分率= V T F W 100% W 标示量
V消耗滴定液的ml数; T为每ml滴定液相当于测定组分的毫克数,即滴定度; F为浓度的校正因子; W为供试品的称量(g);
两次抽检法
药典规定:
第一次抽检 初试(取小样本10片) 判定是否合格
判定不了
第二次抽检 复试(初试量2倍样本20片)
一般含量均匀度很好或很差的药品,在第一次检查时
就能作出判定,如果含量均匀度介于好坏之间的中等
产品
复试
小剂量:
片剂、胶囊剂或注射用无菌粉末,每片(个)标示量小于 10mg或主药含量小于每片(个)重量5%者;其他制剂, 每个标示量小于2mg或主药含量小于每个重量2%者
第十二章 药物制剂的分析
概述 片剂的分析 注射剂的分析 复方制剂的分析
第一节 概述
药物制剂分析的概念:利用化学的、物理化学
的或生物学的方法对不同剂型的药物进行分析,检
验其是否符合质量标准的规定。
药物制剂分析的必要性:临床使用的药物一般
都不是原料药物,而是各种各样的药物制剂。为了 更好地发挥药物的疗效,降低毒副作用,便于使用, 贮藏和运输,控制药物制剂的质量是非常必要的。
