大学有机方程式总结_有机反应总结
有机化学方程式最全总结

有机反应方程式总结(一)烷烃1.甲烷与氯气在光照条件下反应生成氯仿:2.烷烃燃烧通式:(二)烯烃1.乙烯的制取:2.乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应:3.乙烯与溴的四氯化碳溶液反应:4.乙烯的催化加氢:5.乙烯的加聚反应:6. 1,3-丁二烯与溴(1:1)的反应:1,4加成:1,2加成:7.丙烯加聚:8. 2-甲基-1,3-丁二烯加聚:9.丙烯与氯气加热条件下反应(α-H的取代):(三)炔烃1.乙炔的制取:2.乙炔与足量溴的四氯化碳溶液反应:3.乙炔制聚氯乙烯:(四)芳香烃1.甲苯与酸性KMnO4溶液反应:2.苯的催化加氢:3.苯与液溴催化反应:4.苯的硝化反应:5.苯的磺化反应:6.甲苯与浓硝酸、浓硫酸的混合酸加热时获得三硝基甲苯:(五)、卤代烃1.溴乙烷在氢氧化钠水溶液中加热反应:2.溴乙烷在氢氧化钠醇溶液中加热反应:3. 2-甲基-2-溴丁烷消去溴化氢:4. 溴乙烷制备丙酸:(六)、醇类1.乙醇与钠反应:2.乙醇的催化氧化:3.乙醇制乙烯:4.乙醇制乙醚:5.乙醇和浓的氢溴酸加热反应制溴乙烷:(七)、酚类1.苯酚与氢氧化钠溶液反应:2.苯酚钠与CO2反应:3.苯酚与溴水反应:4.制备酚醛树脂:(八)、醛类1.乙醛的催化加氢:2.乙醛的催化氧化:3.乙醛与银氨溶液反应:4.乙醛与新制氢氧化铜反应:5.乙醛与HCN溶液反应:(九)、羧酸1.乙酸与乙醇发生酯化反应:2.乙酸与氨气加热条件下发生反应:3.乙酸发生还原反应生成乙醇:4.乙酸与氯气催化剂条件下反应(α-H被取代):5.两分子乳酸脱去两分子水:(十)、酯类1.乙酸乙酯与H2O混合加入稀硫酸水解:2.乙酸乙酯碱性水解:3.油脂的皂化反应(以硬脂酸甘油酯为例) :(十一)、高分子化合物1.苯乙烯合成聚苯乙烯:2.异戊二烯合成聚异戊二烯(天然橡胶):3.甲基丙烯酸甲酯合成聚甲基丙烯酸甲酯(有机玻璃):4.己二酸与己二胺脱水缩合合成纤维聚酰胺-66(尼龙-66):5.乳酸合成聚乳酸6.两分子乳酸成环。
大学有机方程式总结_有机反应总结

基本有机反应:烷烃的化学反应:⒈卤代(F2,I2不可作卤化剂)CH4+Cl2CH3Cl+CH2Cl2+CHCl3+CCl4+HClCH3CH2CH3+Cl2 CH3CHClCH3(57%)+CH3CH2CH2Cl(43%)⒉硝化,磺化,氧化(略)烯烃的化学反应:⒈加卤素:CH3CH=CH2+Br2CH3CHBr-CH2Br⒉加氢卤酸:CH3CH=CH2+HBr→CH3CHBr-CH3 有区域选择,符合马氏规则⒊与无机酸:CH3CH=CH2+H2SO4→CH3CH(OSO3H)-CH3CH3CH=CH2+HOCl→CH3CH(OH)-CH2Cl⒋与水加成:CH3CH=CH2CH3CH(OSO3H)-CH3CH3CH(OH)CH3⒌与硼烷加成:CH3CH=CH2(CH3CH2CH2)3BCH3CH2CH2OH顺式加成,反马氏取向生成1︒醇⒍过氧化物存在下,反马氏取向:CH3CH=CH2+HBr→CH3CH2CH3BrHCl无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni等⒏高锰酸钾氧化:碱性:CH3CH=CH2+KMnO4CH3CH(OH)CH2OH+MnO2+KOH酸性:CH3CH=CH2+KMnO4CH3COOH+CO2↑⒐臭氧化: R ORRC=CHR’ C CHR’→可根据产物推断反应物结构R O-O 故多用于双键位置判定RCOR+R'COOHRCOR+R’CHORRCHOH+R’CH2OH⒑催化氧化:CH2=CH2+O2CH2-CH2OCH2=CH2+O2CH3CHO 多用于工业生产⒒α—取代反应:氯代:CH2=CHCH3CH2=CH-CH2Cl溴代:CH2=CHCH3CH2=CH-CH2Br两个反应均为自由基取代反应,NBS即N-溴代琥珀酰亚胺⒓重排:(CH3)3CCH=CH2(CH3)2CClCH(CH3)2(主)+(CH3)3CCHClCH3(次)这一重排是由于分步加成和第一步中,由H+对双键的加成生成碳正离子,其稳定性3︒>2︒〉1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
有机方程式总结

光照 光照 光照 光照 Δ 有机反应方程式总结1、甲烷的燃烧反应:CH 4+2O 2 CO 2+2H 2O2、甲烷与氯气的取代反应:CH 4+Cl 2 CH 3Cl+HCl CH 3Cl+Cl 2 CH 2Cl 2+ HCl CH 2Cl 2+Cl 2 CHCl 3+ HCl CHCl 3+Cl 2 CCl 4+ HCl3、乙烯的燃烧反应:CH 2=CH 2+3O 2 2CO 2+2H 2O4、乙烯的加成反应:CH 2=CH 2+Br 2CH 2=CH 2+H 2 CH 3—CH 3 CH 2=CH 2+HClCH 2=CH 2+Cl 2CH 2=CH 2+H —OH CH 3—CH 2—OH 5、乙烯的加聚反应:nCH 2=CH 2 [ CH 2—CH 2 ]n 5、 苯的燃烧反应:2 +15O 2 12CO 2+6H 2O 6、苯的取代反应: +Br 2 +HBr +HO —NO 2 +H 2O 8、苯的加成反应: +3H 29、乙醇的置换反应:2CH 3—CH 2—OH+2Na 2CH 3CH 2ONa+H 2↑ 10、乙醇的燃烧反应:2CH 3—CH 2—OH+3O 2 2CO 2+3H 2O 11、乙醇的催化氧化:2CH 3—CH 2—OH+O 2 2CH 3—C —H+2H 2O12、乙醇的酯化反应:CH 3—C —OH+CH 3—CH 2—OH CH 3—C —OCH 2CH 3+H 2O13、验证乙酸的酸性:CH 3—C —OH+CaCO 3 CO 2↑+H 2O+(CH 3—C —OH)2Ca14、乙酸的中和反应:CH 3—C —OH+NaOH CH 3—C —ONa+H 2O15、乙烷的取代反应:CH 3—CH 3+Cl 2 +H 2 点燃 点燃 点燃 CH 2—CH 2 Br Br Ni Δ 催化剂 CH 2—CH 2 Cl CH 2—CH 2 Cl Cl 催化剂 加热、加压 催化剂 — — 点燃 FeBr 3 —Br Δ 浓H 2SO 4 —NO 2 Δ Ni 点燃 Δ Cu 或Ag ==O ==O Δ 浓H 2SO 4 ==O ==O ==O ==OCH 2—CH 2 Cl Cl。
大学有机化学方程式汇总

大学有机化学方程式汇总
有机化学是研究碳化合物及其衍生物的化学性质和反应机理的学科。
在大学有机化学课程中,学生需要掌握各种有机反应的方程式。
本文档汇总了一些常见的有机化学反应方程式,供大家参考和研究。
烷烃的燃烧反应
烷烃是一类只含有碳和氢的有机化合物。
它们在氧气存在下可以发生燃烧反应,生成二氧化碳和水。
例如,甲烷的燃烧反应方程式如下:
CH4 + 2O2 -> CO2 + 2H2O
烷烃的卤代反应
烷烃可以与卤素(如氯、溴、碘)发生卤代反应,生成相应的烷基卤化物。
例如,甲烷与氯气发生卤代反应的方程式如下:
CH4 + Cl2 -> CH3Cl + HCl
醇的脱水反应
醇是含有羟基(OH)的有机化合物。
它们可以通过脱水反应,去除一个或多个水分子,生成烯烃或烷烃。
例如,环戊醇的脱水反应方程式如下:
C5H11OH -> C5H10 + H2O
烯烃的加成反应
烯烃是含有碳碳双键的有机化合物。
它们可以发生加成反应,
通过加入其他物质,形成新的化学键。
例如,乙烯与氢气发生加成反应生成乙烷的方程式如下:
C2H4 + H2 -> C2H6
酮的氧化反应
酮是含有羰基(C=O)的有机化合物。
它们可以发生氧化反应,其中羰基上的氧原子被还原,生成醇。
例如,乙酮的氧化反应方程式如下:
CH3COCH3 + [O] -> CH3COCH2OH
以上是一些大学有机化学中常见的反应方程式。
希望本文档对
您的学习有所帮助。
(完整版)大学有机化学反应方程式总结(较全)
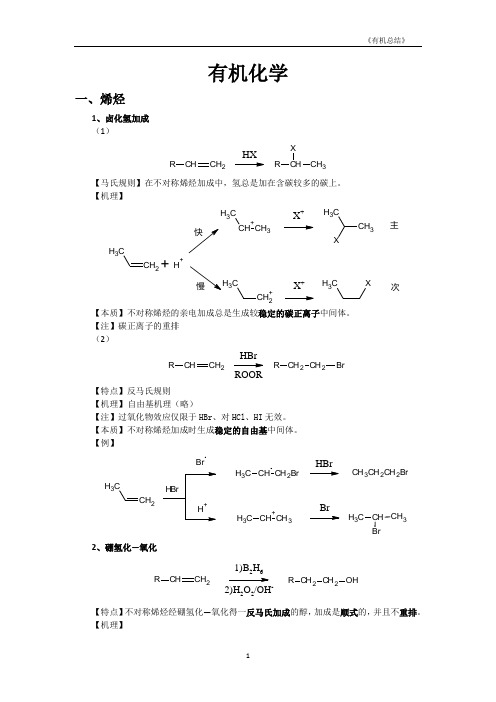
有机化学一、烯烃1、卤化氢加成 (1)CHCH 2RHXCH 3RX【马氏规则】在不对称烯烃加成中,氢总是加在含碳较多的碳上。
【机理】CH 2CH 3+CH 3CH 3X +CH 3CH 3+H +CH 2+C3X +CH 3X主次【本质】不对称烯烃的亲电加成总是生成较稳定的碳正离子中间体。
【注】碳正离子的重排 (2)CHCH 2RCH 2CH 2R BrHBrROOR【特点】反马氏规则 【机理】 自由基机理(略)【注】过氧化物效应仅限于HBr 、对HCl 、HI 无效。
【本质】不对称烯烃加成时生成稳定的自由基中间体。
【例】CH 2CH3BrCH CH 2BrC H 3CH +CH 3C H 3HBrBrCH 3CH 2CH 2BrCH CH 3C H 32、硼氢化—氧化CHCH 2R CH 2CH 2R OH1)B 2H 62)H 2O 2/OH-【特点】不对称烯烃经硼氢化—氧化得一反马氏加成的醇,加成是顺式的,并且不重排。
【机理】2CH33H323H32 CH CH2CH3HBH2CH CH=CH(CH3CH2CH2)3-H3CH2CH2C22CH3CH2B OCH2CH2CH3H3CH2CH2C2CH2CH3+O H-OHB-OC H2CH2CH3CH2CH2CH3H3CH2CH2B OC H2CH2CH3CH2CH2CH3H2CH2CH3HOO-B(OCH2CH2CH3)3 B(OCH2CH2CH3)3+3NaOH3NaOH3HOC H2CH2CH33+Na3BO32【例】CH31)BH32)H2O2/OH-CH3HHOH3、X2加成C CBr/CClC CBr【机理】CCC CBrBr CBr+C CBrOH2+-H+C CBrOH【注】通过机理可以看出,反应先形成三元环的溴鎓正离子,然后亲和试剂进攻从背面进攻,不难看出是反式加成。
不对称的烯烃,亲核试剂进攻主要取决于空间效应。
大学有机化学方程式总结

大学有机化学方程式总结
1. 碳氢化合物的烷烃类反应
1.1 卤代烃和氢化钠的反应
碳氢化合物(卤代烃)与氢化钠反应生成相应的烷烃,并释放出相应的卤化钠。
反应方程式如下:
R-X + NaH -> R-H + NaX
1.2 卤代烃和氢化亚铜的反应
碳氢化合物(卤代烃)与氢化亚铜反应生成相应的烷烃,并释放出相应的卤化铜。
反应方程式如下:
R-X + 2Cu2O + 2Cu -> R-H + 3Cu2X2
2. 醇类的酯化反应
2.1 醇与羧酸的酯化反应
醇与羧酸反应生成相应的酯,并释放出相应的水。
反应方程式如下:
R-OH + R'-COOH -> R'-COOR + H2O
2.2 醇与酸酐的酯化反应
醇与酸酐反应生成相应的酯,并释放出相应的酸。
反应方程式如下:
R-OH + R'-COO-CO-R'' -> R'-COOR + R''-COOH
3. 烯烃的加成反应
3.1 烯烃与卤素的加成反应
烯烃与卤素反应生成相应的二卤代烃。
反应方程式如下:
R-CH=CH2 + X2 -> R-CH2-CHX-CH2-X
3.2 烯烃与负氧化剂的加成反应
烯烃与负氧化剂反应生成相应的环氧化合物。
反应方程式如下:
R-CH=CH2 + [O] -> R-CH2-CH2-O-CH2-CH2-R
以上是一些大学有机化学方程式的总结,希望对您有帮助。
参考文献:
1. 有机化学方程式实验室手册,XX大学化学系,20XX年。
大学有机方程式总结_有机反应总结

化学竞赛有机方程式总结烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%) ⒉氧化(略)烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 符合马氏规则⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−O H 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62H B (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH顺式加成,反马氏取向生成1︒醇 ⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 、 HI 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等⒏高锰酸钾氧化:碱性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH酸性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑⒐臭氧化: R O RRC=CHR ′−→−3OC CHR ′→ 可根据产物推断反应物结构R O -O 故多用于双键位置判定′COOH′CHO′CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−→︒C 300-CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl~PdCl CH 3CHO 多用于工业生产 ⒒α-取代反应: 氯代:CH 2=CHCH 3−−−−→−︒C600-/400Cl 2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBS CH 2=CH -CH 2Br ⒓重排:(CH 3)3CCH=CH 2−−→−HCl (CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3︒>2︒>1︒,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基本有机反应:烷烃的化学反应:⒈卤代(F 2,I 2不可作卤化剂)CH 4+Cl 2−→−γh CH 3Cl+CH 2Cl 2+CHCl 3+CCl 4+HCl CH 3CH 2CH 3+Cl 2 −−−→−︒)25(h C γCH 3CHClCH 3(57%)+CH 3CH 2CH 2Cl(43%) ⒉硝化,磺化,氧化(略) 烯烃的化学反应:⒈加卤素:CH 3CH=CH 2+Br 2−−→−4CCl CH 3CHBr -CH 2Br⒉加氢卤酸:CH 3CH=CH 2+HBr →CH 3CHBr -CH 3 有区域选择,符合马氏规则⒊与无机酸:CH 3CH=CH 2+H 2SO 4→CH 3CH(OSO 3H)-CH 3 CH 3CH=CH 2+HOCl →CH 3CH(OH)-CH 2Cl⒋与水加成:CH 3CH=CH 2−−→−42SO H CH 3CH(OSO 3H)-CH 3−−→−OH 2CH 3CH(OH)CH 3 ⒌与硼烷加成:CH 3CH=CH 2−−→−62HB (CH 3CH 2CH 2)3B −−−→−)O(OH H -2CH 3CH 2CH 2OH 顺式加成,反马氏取向生成1?醇⒍过氧化物存在下,反马氏取向:CH 3CH=CH 2+HBr →−−−→−过氧化物CH 3CH 2CH 3Br HCl 无此反应⒎催化加氢成烷烃:用Pt,Pd,Ni 等 ⒏高锰酸钾氧化:碱性:CH 3CH=CH 2+KMnO 4−−→−-OH CH 3CH(OH)CH 2OH+MnO 2+KOH 酸性:CH 3CH=CH 2+KMnO 4−−→−∆+/H CH 3COOH+CO 2↑ ⒐臭氧化: R ORRC=CHR’−→−3OC CHR’→ 可根据产物推断 反应物结构R O -O 故多用于双键位置判定−−−→−O 璈O H 222RCOR+R’COOH−−→−O H -Zn 2RCOR+R’CHO −−→−4LiAlH RRCHOH+R’CH 2OH⒑催化氧化:CH 2=CH 2+O 2−−−−→−︒C300-Ag/200CH 2-CH 2 OCH 2=CH 2+O 2−−−−→−22CuCl~PdCl CH 3CHO 多用于工业生产 ⒒?-取代反应:氯代:CH 2=CHCH 3−−−−→−︒C 600-/400Cl2CH 2=CH -CH 2Cl 溴代:CH 2=CHCH 3−−→−NBSCH 2=CH -CH 2Br 两个反应均为自由基取代反应,NBS 即N-溴代琥珀酰亚胺⒓重排:(CH 3)3CCH=CH 2−−→−HCl(CH 3)2CClCH(CH 3)2(主)+(CH 3)3CCHClCH 3(次) 这一重排是由于分步加成和第一步中,由H +对双键的加成生成碳正离子,其稳定性3?>2?>1?,故在可能的情况下,它将以重排的方式趋于更稳定的状态。
⒔聚合反应:含二聚和多聚(略) 共轭双烯的反应:⒈1,2-加成和1,4-加成:CH=CH -CH=CH −→−2BrBrCH 2CH=CHCH 2Br+BrCH 2-CHBr -CH=CH 21,4-产物 1,2-产物 不同反应条件下主要产物不同室温以上或极性溶剂: CH=CH -CH=CH+Br 2→BrCH 2CH=CHCH 2Br (1,4) 0℃以下或非极性溶剂CH=CH -CH=CH+Br 2→BrCH 2-CHBr -CH=CH 2 (1,2)⒉与等摩尔的H 2加成:CH=CH -CH=CH −−−→−+Na EfOH CH 3CH=CHCH 3 (1,4) CH=CH -CH=CH −−→−/P dH 2CH 3CH 2CH=CH 2 (1,2) ⒊双烯加成(Diels-Alder 反应): 合成六元环的良好反应 炔烃的反应:⒈加氢①催化加氢:CH 3C ≡CH −−→−/P dH 2CH 3CH 2CH 3 ②部分加氢:CH 3C ≡CCH 3−−−−→−-Pd BaSO H42/ CH 3CH=CHCH 3(顺式) CH 3C ≡CCH 3−−−→−-)(3l NH Na CH 3CH=CHCH 3(反式) ⒉亲电加成:① 加卤素:CH 3C ≡CH −−→−2)(Br A CH 3CBr=CHBr −−→−)(2B Br CH 3CBr 2-CHBr 2 反应B 远难于A ,故可停留在第一步产物阶段②双键优先于叁键加成: CH 2=CH -CH 2-C ≡CH −→−2BrBrCH 2-CHBr -CH 2C ≡CH③加氢卤酸:CH 3C ≡CH+HBr →(A)CH 3CBr=CH 2+HBr →(B)CH 3CBr 2CH 3 反应亦可停留在A 阶段 ⒊与亲核试剂加成:①与水加成:CH 3C ≡CH+H 2O −−→−4HgSO[CH 3C(OH)=CH 2]−−→−重排 CH 3COCH 3 中间步骤称为烯醇式重排②加HCN :CH ≡CH+HCN −−−−−→−-ClNH Cl Cu 422CH 2=CH -CN 产物为制取聚丙烯腈的原料③与其他亲核试剂的加成:CH ≡CH+ROH →CH 2=CH -ORCH ≡CH+NH 3→CH 2=CH -NH 2 CH ≡CH+CH 3COOH →CH 2=CH -OOCCH 3 ⒋作为酸的反应:① 与碱金属反应:CH 3C ≡CH+Na[NH 3(l)]→CH 3C ≡C -Na② 与重金属(盐)反应:CH 3C ≡CH +Ag/NH 3-H 2O →CH 3C ≡C -Ag ↓ CH 3C ≡CH+Cu/NH 3-H 2O →CH 3C ≡C -Cu ↓⒌氧化反应:①高锰酸钾氧化:RC ≡CR’+KMnO 4/H +→RCOOH+R’COOH②臭氧化:RC ≡CR’−−−−−→−B A OH ./CCl O .243RCOOH+R’COOH ⒍聚合反应:① 线型低聚:2CH ≡CH →Cu 2Cl 2-NH 4Cl/H +→CH 2=CH -C ≡CH 产物是制取丁二烯和氯丁二烯的原料② 环型低聚:3CH ≡CH −−−→−︒-C500400⒎制备高级炔:CH 3C ≡CNa+CH 3CH 2CH 2Br →CH 3C ≡C -CH 2CH 2CH 3 卤代烷的反应: ⒈亲核取代反应: RX+NaOH-H 2O →ROH RX+NH 3→RNH 2RX+R’ONa→ROR’ RX+NaCN →RCN RX+H 2S →RSHRX+NaC ≡CR’→RC ≡CR’ RX+CH 3COONa →CH 3COORRX+NaI-丙酮→RI+NaX ↓ (X:Cl,Br) RX+AgNO 3-C 2H 5OH →RNO 3+AgX ↓ 后一个反应常用于RX 的鉴别 ⒉消除反应:CH 3CH 2CHClCH 3+KOH-ROH →CH 3CH=CHCH 3(主要)+ CH 3CH 2CH=CH 2 遵守查依采夫规则主要生成含取代基较多的双键产物 ⒊生成金属有机化合物:RCl+MgEt 2O →RMgCl RCl+Li →RLi ⒋被还原:RCl+LiAlH 4,THF →RH RCl+Zn/HCl →RH RCl+Pt/H 2→RH⒌卤素置换:RCl(Br)+NaI-丙酮→RI+NaCl 醇的性质:⒈醇的酸性:与活泼金属反应CH 3CH 2OH+Na →CH 3CH 2ONa+H 2↑ 酸性ROH(3?<2?<1?<CH 3OH)<HOH<RCOOH 碱性RO -(3?>2?>1?>CH 3O -)>OH ->RCOO - ⒉成酯反应:① 与硫酸成酯:CH 3OH+H 2SO 4→(CH 3O)2SO 2+H 2O 产物(CH 3O)2SO 2是常用的甲基化试剂 ② 与硝酸成酯:CH 2OHCHOHCH 2OH+HNO 3−→−+HCH 2ONO 2CHONO 2CH 2ONO 2 产物称硝酸甘油可作为炸药或用于医药③与有机酸成酯:CH 3CH 2OH+CH 3COOH −→−+HCH 3COOCH 2CH 3 ⒊卤代反应:① 与氢卤酸反应:ROH+HX →RX+H 2O产物亦可视为氢卤酸的酯HX:HI>HBr>HCl CH 3CH 2OH+HCl/ZnCl 2→CH 3CH 2Cl+H 2O试剂HCl/ZnCl 2称Lucas 试剂,用于鉴别醇的级别 ROH 反应活性:烯醇式~3?>2?>1?② 重排反应:(CH 3)3C -CH 2OH+HCl →(CH 3)2CClCH 2CH 3 ③ 与卤化磷反应:ROX+PX 3→RX+H 3PO 4 (PBr 3.PCl 3)ROH+I 2−→−P RI ⒋消除反应:与硫酸共热CH 3CH 2CHOHCH 3−−−→−∆/SO H 42CH 3CH=CHCH 3(主要)+CH 3CH 2CH=CH 2 ROH 的反应活性:3?>2?>1?(CH 3)3C -OH −−−−→−︒C/87SO H 42(CH 3)2C=CH 2 CH 3CH 2CHOHCH 3−−−−−→−︒C/100SO ?60%H42CH 3CH=CHCH 3 CH 3CH 2CH 2CH 2OH −−−−−→−︒C/140SO ?75%H42CH 3CH 2CH=CH 2 ⒌氧化反应:① CrO 3-H 2SO 4氧化:RCHOH −−−−→−423SO H -CrORCH=OROH 2?ROH 氧化成酮 3?ROH 不易氧化② HIO 4氧化:RRCOH -CHOHR’ −−→−4IO HRRC=O+R’CH=O ⒍醇制法①烯烃的硼氢化:CH 3CH=CH 2−−−−−−→−B A -2262OH-O .H H .B CH 3CH 2CH 2OH ③ 格氏试剂法:是合成指定结构的醇的最好方法RCH=O+CH 3CH 2MgBr →RCHOMgBrCH 2CH 3+H 2O(H +)→RCHOHCH 2CH 3 ④ 羰基化合物还原法:RCH=O →RCH 2OH羰基化合物还可以是 醛 酮 酯 酰卤 羧酸 还原剂可以是LiAlH 4 √ √ √ √ √ NaBH 4 √ √ × √ × H 2/Ni √ √ √ √ × 羰基化合物的反应: 亲核加成反应:⒈NaHSO 3加成:RCH=O+NaHSO 3→RCHOH -SO 3Na ↓产物为结晶状,反应物不同结晶不同,可用于鉴别⒉HCN 加成:RCH=O+HCN/OH -→RCHOHCN +H 2O/H +→RCHOH -COOH ⒊格氏试剂加成:RCH=O+R’MgX→RCHOHR’ 使用不同的羰基化合物可分别得到1?,2?,3?醇 ⒋胺的加成:RCH=O+NH 2R’→RCHOHNHR’→RCH=NR’产物可水解(H 2O-H +)复原,故可用于保护羰基,亦可经还原制取1?,2?胺⒌胲(羟胺)的加成:RCH=O+NH 2-OH →RCH=N -OH(肟)产物可发生重排,工业上用于尼龙-6单体生产 =O → =N -OH → =O⒍肼的加成:RCH=O+H 2N -NH 2→RCH=NH 2(腙)⒎醇的加成:RCH=O+CH 3OH −−−−−→←O H HCl 2/)(无水RCH< −−−−→←OH OH CH 23/RCH< 生成半缩醛(酮)及缩醛(酮),可用于羰基保护⒏炔的加成:RCH=O+ CH ≡CH/Na-NH 3(l)→RCHOH -C ≡CH ⒐Wittig 加成:RCH=O+Ph 3P=CHR’→RCH=CHR’ ⒑Michael 加成:CH 2=CHCH=O+HCN →[CH 2CNCH=CH -O -H]→CH 2CNCH 2CH=O 羰基?-H 引起的反应: ⒈羰醛缩合反应:2RCH 2CH=O −−→−-OHRCH 2CHOH -CHRCH=O −−→−-OH 2RCH 2CH=CRCH=O 接长碳链的重要反应,用途广泛① Claisen-Sehmidt 反应:芳醛和含?-H 的醛缩合 -CH=O+CH 3CH=O/OH -→ -CH=CHCH=O ② Perkin 反应:芳醛和酸酐缩合-CH=O+(CH 3CO)2O/AcONa → -CH=CHCOOH ③ Tollen’s 反应,可以制取一个有趣的化合物 3H 2C=O+CH 3CH=O →⒉碘仿反应:RCOCH 3+I 2-NaOH →[RCOCI 3]→RCOOH+CHI 3凡含有RCO -结构,或经氧化后可生成此结构的化合物均可发生此反应,它既可用于该结构的鉴定,也可在合成过程中作切断碳链用. 醛酮的氧化还原反应:⒈氧化反应:①银镜反应:RCH=O+2[Ag(NH 3)2]++2OH -→2Ag ↓+RCOO -NH 4++3NH 3+HOHTollen 也称反应,适用于醛,但?-羟基酮有时也给出正反应,类似的反应还有与新制氢氧化铜的反应。
