有机化学方程式总结一
有机化学方程式最全总结

有机反应方程式总结(一)烷烃1.甲烷与氯气在光照条件下反应生成氯仿:2.烷烃燃烧通式:(二)烯烃1.乙烯的制取:2.乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应:3.乙烯与溴的四氯化碳溶液反应:4.乙烯的催化加氢:5.乙烯的加聚反应:6. 1,3-丁二烯与溴(1:1)的反应:1,4加成:1,2加成:7.丙烯加聚:8. 2-甲基-1,3-丁二烯加聚:9.丙烯与氯气加热条件下反应(α-H的取代):(三)炔烃1.乙炔的制取:2.乙炔与足量溴的四氯化碳溶液反应:3.乙炔制聚氯乙烯:(四)芳香烃1.甲苯与酸性KMnO4溶液反应:2.苯的催化加氢:3.苯与液溴催化反应:4.苯的硝化反应:5.苯的磺化反应:6.甲苯与浓硝酸、浓硫酸的混合酸加热时获得三硝基甲苯:(五)、卤代烃1.溴乙烷在氢氧化钠水溶液中加热反应:2.溴乙烷在氢氧化钠醇溶液中加热反应:3. 2-甲基-2-溴丁烷消去溴化氢:4. 溴乙烷制备丙酸:(六)、醇类1.乙醇与钠反应:2.乙醇的催化氧化:3.乙醇制乙烯:4.乙醇制乙醚:5.乙醇和浓的氢溴酸加热反应制溴乙烷:(七)、酚类1.苯酚与氢氧化钠溶液反应:2.苯酚钠与CO2反应:3.苯酚与溴水反应:4.制备酚醛树脂:(八)、醛类1.乙醛的催化加氢:2.乙醛的催化氧化:3.乙醛与银氨溶液反应:4.乙醛与新制氢氧化铜反应:5.乙醛与HCN溶液反应:(九)、羧酸1.乙酸与乙醇发生酯化反应:2.乙酸与氨气加热条件下发生反应:3.乙酸发生还原反应生成乙醇:4.乙酸与氯气催化剂条件下反应(α-H被取代):5.两分子乳酸脱去两分子水:(十)、酯类1.乙酸乙酯与H2O混合加入稀硫酸水解:2.乙酸乙酯碱性水解:3.油脂的皂化反应(以硬脂酸甘油酯为例) :(十一)、高分子化合物1.苯乙烯合成聚苯乙烯:2.异戊二烯合成聚异戊二烯(天然橡胶):3.甲基丙烯酸甲酯合成聚甲基丙烯酸甲酯(有机玻璃):4.己二酸与己二胺脱水缩合合成纤维聚酰胺-66(尼龙-66):5.乳酸合成聚乳酸6.两分子乳酸成环。
高一有机化学方程式总结1
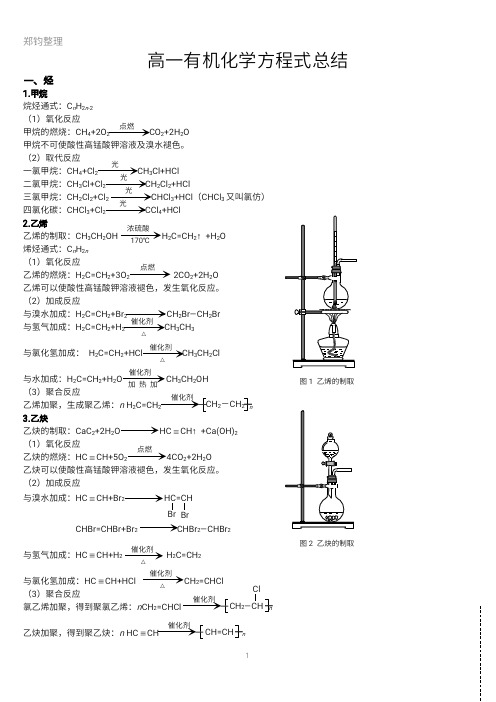
高一有机化学方程式总结一、烃1.甲烷烷烃通式:C n H 2n -2(1)氧化反应甲烷的燃烧:C H 4+2O 2C O 2+2H 2O 甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:C H 4+C l 2C H 3C l +H C l 二氯甲烷:C H 3C l +C l 2C H 2C l 2+H C l 三氯甲烷:C H 2C l 2+C l 2C H C l 3+H C l (C H C l 3又叫氯仿)四氯化碳:C H C l 3+C l 2C C l 4+H C l 2.乙烯乙烯的制取:C H 3C H 2O H H 2C =C H 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C =C H 2+3O 22C O 2+2H 2O 乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C =C H 2+B r 2C H 2B r —C H 2B r 与氢气加成:H 2C =C H 2+H 2C H 3C H 3与氯化氢加成:H 2C =C H 2+H C l C H 3C H 2C l 与水加成:H 2C =C H 2+H 2O C H 3C H 2O H (3)聚合反应乙烯加聚,生成聚乙烯:n H 2C =C H 2n 3.乙炔乙炔的制取:C a C 2+2H 2O H C C H ↑+C a (O H )2(1)氧化反应乙炔的燃烧:H C C H +5O 24C O 2+2H 2O 乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H C C H +B r 2H C =C H B r C H B r =C H B r +B r 2C H B r 2—C H B r 2与氢气加成:H C C H +H 2H 2C =C H 2与氯化氢加成:H C C H +H C l C H 2=C H C l (3)聚合反应氯乙烯加聚,得到聚氯乙烯:n C H 2=C H C l n 乙炔加聚,得到聚乙炔:n H C C Hn点燃光光光光浓硫酸170℃点燃催化剂△催化剂加热加催化剂C H 2-C H 2图1乙烯的制取点燃图2乙炔的制取催化剂△催化剂△B r催化剂C H 2—C H C l催化剂C H =C H催化剂△4.苯苯的同系物通式:C n H 2n -6(1)氧化反应苯的燃烧:2C 6H 6+15O 212C O 2+6H 2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
高中有机化学方程式总结(绝对全)

光照 光照 光照 光照 催化剂 催化剂 △ 催化剂 △浓硫酸 △催化剂 △ △NO 2 NO 2 O 2NCH 3 CH 3催化剂 H 2O 浓硫酸 140℃ OH BrBr Br OH 一、取代反应1. CH 4 + Cl 2 CH 3Cl + HCl2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl3. CH 2Cl + Cl 2 CHCl 3 + HCl4. CHCl 3 + Cl 2 CCl 4+ HCl22. + HO -NO 2 NO 2 +H 2O 23. + HO -SO 3H SO 3H+H 2O25. +3HO -NO 2 +3H 2O28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 37. +3Br 2 ↓ +3HBr二、加成反应8. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2 + H 2O CH 3CH 2OH10. CH 2 = CH 2 + HBr CH 3—CH 2Br 11. CH 2 = CH 2 + H 2 CH 3—CH 3 15. CH ≡CH + Br 2 CHBr = CHBr16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl催化剂 催化剂醇 △催化剂 △催化剂 △ 浓硫酸 170℃ 催化剂 △△△ 催化剂 △24.+ 3H 238. CH 3CHO + H 2 CH 3CH 2OH三、加聚反应12. nCH 2 = CH 2 [ CH 2—CH 2 ] n13. nCH 2=CH-CH=CH 2 [CH 2-CH=CH-CH 2] n18. nCH 2 = CH [ CH 2-CH ] nCl Cl四、消去反应29. CH 3CH 2Br+ NaOH CH 2 = CH 2 ↑+ NaBr +H 2O32. CH 3CH 2OH CH 2 = CH 2↑+ H 2O五、置换反应30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑六、氧化反应39. 2CH 3CHO + O 2 2CH 3COOH40. CH 3CHO+2Ag(NH 3)2OH CH 3COONH 4+2Ag ↓+3NH 3+H 2O41CH 3CHO+2Cu(OH)2 CH 3COOH+Cu 2O ↓+2H 2O31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O浓硫酸 △ 七、复分解反应34. OH+NaOH ONa+H 2O36. ONa+H 2O+CO 2 OH+ NaHCO 343.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑44. CH 3COOH+NaHCO 3 CH 3COONa+H 2O+CO 2↑45. CH 3COOH + NaOH CH 3COONa + H 2O46. 2CH 3COOH + Cu(OH)2 (CH 3COO)2Cu + 2H 2O八、酯化反应47.CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3 +H 2O 九、水解反应48. CH 3COOCH 2CH 3+NaOH CH 3COONa+CH 3CH 2OH十、缩聚反应49. nOHCH 2CH 2COO H → [ OCH 2CH 2C ] n +H 2O高中有机化学知识点总结1.需水浴加热的反应有:(1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
有机化学基础方程式总结

有机化学基础方程式总结一、脂肪烃1.烷烃化学性质:不与强酸、强碱、强氧化剂和强还原剂反应,不能使溴的四氯化碳溶液或酸性高锰酸钾溶液褪色。
(1)取代反应CH3CH3 + Cl2→ CH3CH2Cl + HCl (光照条件)(2)氧化反应—可燃性C n H2n+2 + (3n+1)/2O2→ nCO2 + (n+1)H2O (点燃)(3)分解反应烷烃在隔绝空气的条件下加热或加催化剂可发生裂化或裂解。
C8H18→ C4H10 + C4H8 , C4H10→ CH4 + C3H62.烯烃(1)烯烃通入酸性高锰酸钾溶液中会使溶液褪色(2)催化氧化2CH2=CH2 + O2→ 2CH3CHO (催化剂,加热)(3)可燃性烯烃燃烧火焰明亮,伴有黑烟C n H2n + 3n/2O2→ nCO2 + nH2O (点燃)(4)烯烃与H2,X2,HX,H2O发生加成反应○1溴水,卤素单质(X2)CH2==CH2 + Br2→ CH2Br—CH2Br 常温下使溴水褪色○2氢气(H2)CH2==CH2 + H2→ CH3—CH3 (催化剂,加热)○3水CH2==CH2 + H—OH → CH2(OH)—CH3或CH3—CH2OH (催化剂,加热,加压)○4氯化氢CH2==CH2+ HCl → CH2Cl—CH3或CH3—CH2Cl (催化剂,加热)3.炔烃物理性质:无色无味,密度比空气略小,微溶于水,易溶于有机溶剂.有特殊难闻臭味.化学性质:能发生加成反应、氧化反应和聚合反应。
但比烯烃困难。
(1)乙炔的制取CaC2 (俗名电石)+ 2H2O → Ca(OH)2 + C2H2↑收集方法:排水集气法(2)使酸性高锰酸钾溶液褪色(3)可燃性2C2H2 + 5O2→ 4CO2 + 2H2O (点燃)火焰明亮,伴有浓烈黑烟(4)加成反应氢气:HC≡CH + 2H2→ CH3CH3 (催化剂,加热)水:HC≡CH + H2O → CH3CHO (催化剂,加热)卤素:HC≡CH + 2Br2→ CHBr2—CHBr2 (1,1,2,2 –四溴乙烷)(5)加聚反应n HC≡CH →[CH==CH]n二、卤代烃1.物理性质(1)气味:具有一种令人不愉快的气味且蒸汽有毒。
有机化学方程式总结

高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O乙烯可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n 3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔可以使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBr CHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O点燃光光光光浓硫酸170℃ 高温催化剂△2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△Br2—CHCl CH=CH点燃苯不能使溴水和酸性高锰酸钾溶液褪色。
大学有机化学方程式总结

大学有机化学方程式总结
1. 碳氢化合物的烷烃类反应
1.1 卤代烃和氢化钠的反应
碳氢化合物(卤代烃)与氢化钠反应生成相应的烷烃,并释放出相应的卤化钠。
反应方程式如下:
R-X + NaH -> R-H + NaX
1.2 卤代烃和氢化亚铜的反应
碳氢化合物(卤代烃)与氢化亚铜反应生成相应的烷烃,并释放出相应的卤化铜。
反应方程式如下:
R-X + 2Cu2O + 2Cu -> R-H + 3Cu2X2
2. 醇类的酯化反应
2.1 醇与羧酸的酯化反应
醇与羧酸反应生成相应的酯,并释放出相应的水。
反应方程式如下:
R-OH + R'-COOH -> R'-COOR + H2O
2.2 醇与酸酐的酯化反应
醇与酸酐反应生成相应的酯,并释放出相应的酸。
反应方程式如下:
R-OH + R'-COO-CO-R'' -> R'-COOR + R''-COOH
3. 烯烃的加成反应
3.1 烯烃与卤素的加成反应
烯烃与卤素反应生成相应的二卤代烃。
反应方程式如下:
R-CH=CH2 + X2 -> R-CH2-CHX-CH2-X
3.2 烯烃与负氧化剂的加成反应
烯烃与负氧化剂反应生成相应的环氧化合物。
反应方程式如下:
R-CH=CH2 + [O] -> R-CH2-CH2-O-CH2-CH2-R
以上是一些大学有机化学方程式的总结,希望对您有帮助。
参考文献:
1. 有机化学方程式实验室手册,XX大学化学系,20XX年。
高中有机化学方程式总结(默写版)

高中有机化学方程式总结(默写版) 高中有机化学方程式默写一、烃1.甲烷烷烃通式:1) 氧化反应甲烷燃烧产生二氧化碳和水:CH4 + 2O2 -。
CO2 + 2H2O甲烷不能使酸性高锰酸钾溶液和溴水褪色。
2) 取代反应一氯甲烷:CH3Cl二氯甲烷:CH2Cl2三氯甲烷:CHCl3四氯化碳:CCl42.乙烯烯烃通式:乙烯的制取:1) 氧化反应乙烯燃烧产生二氧化碳和水:C2H4 + 3O2 -。
2CO2 + 2H2O乙烯能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H4 + Br2 -。
C2H4Br2 与氢气加成:C2H4 + H2 -。
C2H6与氯化氢加成:C2H4 + HCl -。
C2H5Cl 与水加成:C2H4 + H2O -。
C2H5OH 3) 聚合反应乙烯加聚,生成聚乙烯。
3.乙炔乙炔的制取:1) 氧化反应乙炔燃烧产生二氧化碳和水:C2H2 + 5/2O2 -。
2CO2 + H2O乙炔不能使酸性高锰酸钾溶液褪色。
2) 加成反应与溴水加成:C2H2 + Br2 -。
C2H2Br2与氢气加成:C2H2 + H2 -。
C2H4与氯化氢加成:C2H2 + HCl -。
C2H3Cl3) 聚合反应氯乙烯加聚,得到聚氯乙烯。
乙炔加聚,得到聚乙炔。
4.苯苯的同系物通式:1) 氧化反应苯燃烧产生二氧化碳和水:2C6H6 + 15O2 -。
12CO2 + 6H2O苯能使溴水和酸性高锰酸钾溶液褪色。
2) 取代反应①苯与溴反应②硝化反应3) 加成反应5.甲苯1) 氧化反应甲苯燃烧产生二氧化碳和水:C7H8 + 9O2 -。
7CO2 + 4H2O甲苯能使溴水褪色和酸性高锰酸钾溶液褪色。
2) 取代反应甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯(TNT)。
二、烃的衍生物烃的衍生物的重要类别和主要化学性质:类别通式代表性物质分子结构特点主要化学性质卤代烃 R—X 溴乙烷 C-X键有极性,易断裂 1.取代反应 2.消去反应醇 R—OH 乙醇有C-O键和O-H键,有极性;-OH与链烃基直接相连 1.与钠反应,生成醇钠并放出氢气 2.氧化反应:生成乙醛 3.脱水反应:乙醚、乙烯 4.酯化反应酚 -OH 苯酚 -OH直接与苯环相连取代反应醛 O || CH3-C-H C=O双键有极性,具有不饱和性氧化反应:生成酮羧酸 COOH 乙酸有C=O双键和C-OH单键,有极性 1.与碱反应,生成盐 2.酯化反应酯 R-COOR' 乙酸乙酯 C=O双键和O-C单键,有极性 1.水解反应:生成醇和羧酸 2.酸催化下的加成反应注:删除了明显有问题的段落,对每段话进行了小幅度的改写。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4
《有机总结》
四、芳香烃
1、苯的亲电取代反应 1)卤代
+
2)硝化
Br2
FeBr3
Br
+
NO2
HBr
+
3)磺化
浓 HNO3
浓H2SO4
+
H2 O
+
SO3 H H2 SO4 ( 7%SO3 )
+
H2 O
SO3 H
H+
4)傅-克(Friedel-Crafts)反应 ①傅-克烷基化反应
+
【机理】
R Cl
R
+ -
R2MgX
R2 R C R1 OMgX
H3O+
R2 R C R1 OH
O
CH
C
CH
H2O H+
C OH
CH
NH3
ONa
13
《有机总结》
(4)与氨衍生物的反应
R O (H)R1
H2NY
R (H)R1 C OH NHY
-H2O
R NY (H)R1
2、α碳与α氢的反应 1)羟醛缩合 【描述】碱催化下的羟醛缩合:在稀碱的作用下,两分子醛(酮)相互作用,生成α、 β不饱和醛(酮)的反应。
H
H
【特点】环烷烃都有抗氧化性,可用于区分不饱和化合物。 【注】遵循马氏规则 【例】
CH3 HBr CH2 CH2 CH CH3 H Br
二、烯烃
1、烯烃的亲电加成反应 1)X2 加成
C C Br2/CCl4 Br C C Br
【机理】
1
《有机总结》
C
C
Br Br
C
+
Br C
C+C
Br
Br
-
Br C C Br
Cl
AlCl3
R
+
+
AlCl3
AlCl4
+
+
R H
CH2
+
R
CH2
+
H
+ +
R
R
+ +
R
+
AlCl4
+
+
HCl
+
AlCl3
【注】碳正离子的重排,苯环上带有第二类定位基不能进行傅-克反应。
5
《有机总结》
②傅-克酰基化反应
O Cl AlCl3 R O O O O R
+ +
【例】
R O
AlCl3
R
R
+
RCOOH
《有机总结》
有机化学方程式总结一
一、烷烃与环烷烃
1、烷烃的自由基取代反应
hv H—C—H + Cl2 H—C—Cl + HCl or heat
H H
2、环烷烃的化学反应 【描述】三元环由于张力而不稳定,易发生加成反应开环,类似碳碳双键。
H2/Ni Br2/CCl4 H2SO4 HX(X=Br,I) CH2 CH2 CH2 H H CH2 CH2 CH2 Br Br CH2 CH2 CH2 H OH CH2 CH2 CH2 H X
CH2—CH— CH2 + HNO3 H2SO4 CH2 —CH — CH2 + H2O 10℃ OH OH OH ONO2 ONO2 ONO2
4、脱水反应
CH 3 CH 2 OH
浓 H 2 SO 4
170 ℃
CH 2 =CH 2
+
H2O
【注】分子内脱水成烯由易到难:叔丁醇 > 异丙醇 > 乙醇 遵循 Saytzeff 规律,即主要产物是双键上连有最多烃基的烯烃。
Br H3C CH2 HBr H
+
H3C CH CH2 Br
HBr
CH3 CH2 CH2 Br
H3C CH CH3
+
Br
H3C
CH CH3 Br
4、烯烃的氧化反应 1)稀冷高锰酸钾氧化成邻二醇
H3C H3C H3C CH3 稀 冷 KMnO 4 CH3 H3C CH3 CH3
-
H2O H3C
H3C OH OH
CH3I + CH3OH
HI CH3I + H2O
3、过氧化物的生成
CH3CH2 O CH2CH3 + O2
4、酸催化开环
CH3CH2 O CHCH3 O O H
H+, H2O HCl H + , CH 3 OH
5、碱催化开环
H 2 C CH 2 OH OH H2C CH 2 OH Cl
乙二 醇 2-氯 乙醇
《有机总结》
3)氧化反应
2 CH3CH2CH2SH + H2O2
七、酚
1.弱酸性
CH3CH2CH2S-SCH2CH2CH3 + 2 H2O
OH + NaO H
O - Na+ + H 2O
O - Na + + CO 2 + H 2 O
2.亲电取代反应 1)卤代
OH + NaHCO 3
OH
Br + 3 Br2 ~100%
O
H2C CH 2 2- 甲氧 基乙醇 OH OCH 3
OH , H2O NH3 O CH3OH CH3 ONa
H2 C CH2 OH OH H2 C CH2 OH NH2
乙二醇 2-氨基乙醇
H2C CH2 2-甲氧基乙醇 OH OCH3
12
《有机总结》
九、醛和酮
1、羰基上的亲核加成 (1)加氢氰酸
CH3 CH3
O
O Mn O O O
2)热浓酸性高锰酸钾氧化
R C R1 C H R2
KMnO4 H
+
R
C
R1
+
O R2 C OH
3)臭氧氧化
R C R1 C H R2
1)O3 2)Zn/H2O
R
O C R1
+
O
O R2 C H
4)过氧酸氧化
R C R1 C H R2
ROOOH
R R1
R2 H
3
《有机总结》
S
R
1
(4)氨解
R X
NH3 NH3
R
NH2
R X
R3 N
【反应机制】 ①SN1 机制: (1)单分子反应,反应速率仅由卤代烷决定 (2)反应分两步进行 (3)有正碳离子中间体生成 ②SN2 机制: (1)双分子反应,反应速率与卤代烃和和亲核试剂浓度都有关 (2)旧键的断裂和新键的形成同时进行 (3)反应伴随构型转化
三、炔烃
1、催化加氢
HC CH + H 2
2、亲电加成 1)加 X2
Pt
H 2 C CH 2
Pt H2
H 3 C CH 3
Br2
R1 R2
R1 Br
Br R2
2)加 HX
R
CH
2HBr
Br H3C
R H
C Br
CH3
Br R
R
R
HBr
3)加 H2O
R
CH
H2 O HgSO4/H2SO4
R CH2 HO
OH
Br
+ 3 HBr
Br
2)硝化
OH 20%HNO 3
25 ℃
OH NO 2
+
OH
O2N
3)磺化
OH
浓 H 2 SO 4
25 ℃
OH SO 3 H
100 ℃
HO
SO 3 H
3、与三氯化铁的显色反应 具有烯醇式结构的化合物(-C=C-OH),大多数能与 FeCl3 水溶液呈现颜色反应。 4、氧化反应
OH
K 2 Cr 2 O 7 H 2 SO 4
11
O
O
《有机总结》
八、醚和环氧化合物
1、醚的质子化
CH3CH2 O CH2CH3 + H2SO4 CH3CH2 O CH2CH3 HSO4 H
R O R H
2、醚键的断裂
HSO 4 + H 2 O
R O R + H 3 O + HSO 4
CH3 O CH3 + HI
+
R1
O R1
+
OR1
HOR1
R C H
OH
+
-H+
R
OR1 C H OR1
H
OR1
【特点】缩醛具有胞二醚的结构,对碱、氧化剂稳定,所以可用此法在合成中做羰基的 保护。同样的方法也可制备缩酮,机理相同。 【例】 O O O O
HOCH2CH2OH H+
H2 Ni
H+
(3)加金属有机化合物
R O (H)R1 Na C
R δ+ δO
(H)R1
+
H CN
+
-
R (H)R1 C
OH CN
(2)与醇加成 ①缩醛的生成
R O H
HOR1 H
+
OH R C H OR1
HOR1 H+
OR1 R C H OR1
半缩醛
【机理】
R O H H
缩醛 R1 R1
R C OH H O OH2
+
H
+
R
OH
+
HOR1
R C H
OH
