有机化学方程式书写竞赛
初中化学手写教案比赛活动

初中化学手写教案比赛活动
时间:XX月XX日
地点:学校化学实验室
活动主题:探索化学世界,创意无限
活动内容:
1. 开幕式:简短的开场致辞,介绍比赛规则和活动安排。
2. 赛前准备:参赛选手领取比赛材料,准备工具和设备。
3. 比赛环节:
- 第一轮:完成指定的实验操作,记录实验所需的化学物质和步骤。
- 第二轮:设计和完成一项创意实验,展示化学原理和反应过程。
4. 评审环节:评委老师对参赛者的手写教案进行评分,包括实验步骤的清晰度、化学原理的准确性和创意实验的创新性。
5. 颁奖环节:根据评分结果,颁发一、二、三等奖以及优秀奖。
6. 闭幕式:总结活动收获,鼓励学生继续探索化学知识,展示化学爱好者的风采。
活动目的:通过化学手写教案比赛活动,激发学生对化学的兴趣,培养他们的实验能力和创新思维,促进化学教学的发展和提升学生的综合素质。
欢迎各位老师和同学参加此次活动,共同探索化学世界,创意无限!。
高二有机化学基本反应方程式书写训练(150分)

高二有机化学基本反应方程式书写训练(150分)班级姓名学号成绩
1.实验室中以乙醇为原料来制取乙烯:
2.用乙醇为原料来制备乙醛:
3.实验室用CaC2和水制乙炔:
4.用1,2-二氯乙烷为原料来制取乙炔:
5.乙醇和CH3CO18OH在浓硫酸作用下加热制乙酸乙酯:
6.乙醇为原料制备乙醚:
7.CH3CHO发生的银镜反应:
8.2-丙醇的催化氧化反应:
9.甲烷在光照时与氯气发生反应,生成气态有机产物:
10.丙烯使溴的四氯化碳溶液褪色:
11.苯的硝化反应:
12.苯的溴代反应:
13.苯酚的溴代反应:
14.苯酚与氢气的加反应:
15.溴乙烷的水解反应:
16.甘油与硝酸的酯化反应:
17.甲醛与足量的新制的氢氧化铜浊液在加热反应:
18.烃(CxHy)在氧气中完全燃烧:
19. 烃的含氧衍生物(CxHyOz)在氧气中完全燃烧:
20.乙醇的分子间脱水反应:
21.环己醇的催化氧化反应:
22.硬脂酸甘油酯的皂化反应:
23.向苯酚钠溶液中通入CO2气体:
24. 用甲苯制备TNT的反应:
25.乙烯水化法制乙醇:
26.乙烯催化氧化制乙醛:
27.乙炔的水化法制乙醛:
28.2-丁烯的加聚反应:
29.加热条件下,用乙醇和浓氢溴酸来制备溴乙烷:
30.乙二酸和乙二醇反应生成聚酯:。
《有机化学反应方程式》书写练习

《有机化学反应方程式》书写练习一、取代反应1.卤代反应(1)4与2在光照下反应:。
(2)苯、液溴在铁屑催化下反应:。
(3)苯酚溶液中加入过量浓溴水:。
2.硝化反应(1)由苯制硝基苯:。
(2)由甲苯制:。
3.磺化反应由苯和浓硫酸共热制苯磺酸:。
4.醇与氢卤酸共热下反应例如:乙醇与氢溴酸反应:。
5.醇分子间脱水成醚例如:由乙醇制乙醚:。
6.卤代烃的水解例如:溴乙烷与溶液共热:。
7.酯的水解(1)乙酸乙酯与稀H24共热:。
(2)乙酸乙酯与溶液共热:。
8.酯化反应(1)乙酸与乙醇在浓硫酸下共热制乙酸乙酯:。
(2)苯甲酸、甲醇、浓硫酸三者混合后共热:。
二、加成反应1.烯烃的加成(1)C2H4加成H2:。
(2)C2H4加H2O:。
(3)C2H4通入溴水中:;现象为:。
2.炔烃的加成(1)C2H2与足量H2加成:。
(2)C2H2通入溴水中:。
(3)C2H2水化法制乙醛:。
(4)C2H2与制氯乙烯:。
3.芳香烃的加H2例如:苯加成H2:。
4.乙醛加成氢气:。
5.丙酮(33)加成氢气:。
6.油脂的硬化(或氢化):。
三、消去反应1.部分卤代烃的消去反应结构要求为:;条件为:。
例如:溴乙烷、乙醇、三者混合共热:。
2.部分醇的消去反应结构要求为:;条件为:。
例如:(1)由乙醇制乙烯:。
(2)符合分子组成为C7H15、不能发生消去反应的物质有种,其结构简式为:。
四、氧化反应1.有机物的燃烧反应(1)烃()完全燃烧的通式为:。
①天然气的完全燃烧:。
②乙烯完全燃烧:;现象为:。
③乙炔完全燃烧:;现象为:。
④苯完全燃烧:;现象为:。
(2)含氧衍生物()完全燃烧的通式为:。
例如:酒精作燃料完全燃烧:。
葡萄糖的生理氧化:。
2.得氧或失氢方式的氧化反应(1)乙烯氧化法制乙醛:。
(2)由乙醇制乙醛:。
(3)乙醛发生银镜反应:。
(4)乙醛与新制氢氧化铜悬浊液共热:。
(5)乙醛与氧气的催化氧化:。
(6)葡萄糖发生银镜反应:。
(7)葡萄糖与新制氢氧化铜悬浊液共热:。
化学竞赛真题:第35届国初江苏卷

第35届中国化学奥林匹克(初赛)试题(江苏卷)第1题(10分)书写反应方程式(要求系数为最简整数比)。
1-1钒铁(FeV)用Cl2充分氯化。
1-2CrO3与KClO3固体混合物高温下熔融,放出的气体均为黄绿色。
1-3TiCl3溶液与CuCl2溶液反应。
1-4雌黄用SnCl2的盐酸溶液还原为雄黄(已知雌黄和雄黄中砷含量分别为60.91%和70.03%)。
1-5Mg2C3与足量水反应。
第2题(10分)回答下列问题:2-1请解释为什么在DNA分子中,腺嘌呤与胸腺嘧啶含量相等,鸟嘌呤与胞嘧啶含量相等。
图1碱基结构2-2钾氩定年法可用于分析火星矿物形成的年代。
已知40K衰变时,10.5%为β+衰变生成40Ar,89.5%为β—衰变生成40Ca,40K的半衰期为12.5亿年。
试求40K发生β+衰变和β—衰变的速率常数k1和k2。
2-3写出与N2H4质子总数相同且含有非极性键的物质的分子式。
2-4画出分子式为C3O3Cl3中所有Cl原子等价的物质的结构式。
2-5一般化学交联的聚合物难以进行二次利用,但如图2所示的A、B、C三种单体共聚后经紫外光照射可以形成交联聚合物,且该交联聚合物能够实现回收热塑加工。
请简述该交联聚合物可热塑加工的基本原理。
图2三种单体结构第3题(11分)磷的混合卤化物磷的混合卤化物在药物合成、阻燃等领域有广泛应用。
某磷的混合卤化物M中磷的质量百分含量为19.49%,其熔、沸点分别为148.2K和290.2K,在CH3CN中的导电能力很弱。
M很容易转化为白色固体N,N是共价型离子化合物,在CH3CN中的导电能力很强,303K下升华并部分转化为M。
3-1通过计算和分析,确定M的化学式,并画出M的结构,在图上标注中心原子的杂化方式。
3-2画出N的结构,在图上标注中心原子的杂化方式。
3-3写出N的阳离子中所有的对称元素的种类和数量。
第4题(8分)多金属氧酸盐多金属氧酸盐(POMs)是由前过渡金属元素所形成的一类重要的无机功能化合物,由于其阴离子的结构和尺寸具有可调性,且具有表面氧原子丰富、热稳定性好等优点,使其在光、电、磁材料及催化方面具有广阔的应用前景。
有机化学方程式的书写练习

1. 2-甲基-2-丁烯被酸性KMnO4溶液氧化的产物:2. 2-溴丙烷的水解反应消去反应3. 环己醇发生下列反应:(1)催化氧化反应:(2)消去反应:(3)与乙酸的酯化反应:4. 对甲基苯酚发生下列反应(1)与碳酸钠反应:(2)与浓溴水反应:(3)向对甲基苯酚钠溶液中通入CO2气体:有机化学方程式练习2 1. 1-溴环己烷的水解反应:消去反应:2.CH3-CH-COOH发生下列反应①与金属钠反应:②与NaOH反应③催化氧化反应:④消去反应:⑤单分子酯化成环:⑥两分子酯化成链⑦两分子酯化成环⑧缩聚反应3.苯甲酸甲酯在NaOH溶液中的水解4.苯甲醛的银镜反应1.(1)实验室制乙烯(2)工业酒精的制备(3)TNT的制备(4)氯乙烷的制备2. 溴乙烷→乙二醇:3. 由乙醇制备聚氯乙烯:有机化学方程式练习5 1. 乙醇→:2. 由苯酚制备1,2-环己二醇1.HOCH2CH2COOH在浓硫酸、加热条件下的反应:生成C3H4O2的反应①②生成C6H10O5的反应:③生成C6H10O5的反应:④生成高聚物的反应:⑤⑥与NaOH水溶液的反应2.①BrCH2CH2COOH与NaOH水溶液的反应②BrCH2CH2COOH与NaOH醇溶液的反应③BrCH2- -OH与NaOH水溶液的反应④HO- -COOH与NaOH水溶液的反应⑤HO- -COOCH3与NaOH水溶液的反应⑥HO- -OOC-CH3与NaOH水溶液的反应⑦与NaOH水溶液的反应⑧与NaOH水溶液的反应⑨与NaOH醇溶液的反应。
2022年高考化学有机转化关系及反应方程式书写
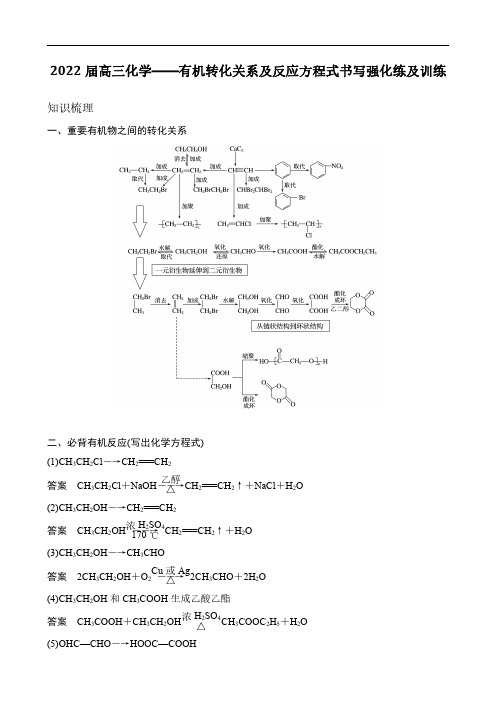
2022届高三化学——有机转化关系及反应方程式书写强化练及训练知识梳理一、重要有机物之间的转化关系二、必背有机反应(写出化学方程式)(1)CH 3CH 2Cl ―→CH 2===CH 2答案CH 3CH 2Cl +NaOH ――→乙醇△CH 2===CH 2↑+NaCl +H 2O(2)CH 3CH 2OH ―→CH 2===CH 2答案CH 3CH 2OH ――→浓H 2SO 4170℃CH 2===CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO 答案2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O(4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC—CHO ―→HOOC—COOH答案OHC—CHO +O 2――→催化剂△HOOC—COOH(6)乙二醇和乙二酸生成聚酯答案n HOCH 2—CH 2OH +n HOOC—COOH――→一定条件+(2n -1)H 2O (7)乙醛和银氨溶液的反应答案CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O(9)答案(10)答案(11)和饱和溴水的反应答案(12)和溴蒸气(光照)的反应答案(13)和HCHO 的反应答案+(n -1)H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应三、常考有机物的检验1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
九年级化学式默写竞赛

九年级化学式默写竞赛班级姓名
写出下列对应的化学式(共50个总分100分)A卷
(1)氧气(2)氖气(3)锌
(4)铜(5)硫(6)氧化锌(7)氢气(8)二氧化锰(9)氧化铜(10)乙醇(俗名酒精)(11)二氧化碳
(12)双氧水(13)盐酸(14)硫酸(15)甲烷(16)硫酸铁(17)氯酸钾(18)碳酸镁(19)石灰石(20)碳酸钠(21)硫酸锌(22) 水(23)硫酸铜(24)硫酸钠(25)硝酸钡(26)硝酸钾(27)硝酸钠(28)氯化亚铁(29)氯化铁(30)氢氧化钠(31)氢氧化铜(32)氯化锌(33)氢氧化镁(34)氢氧化铁(35)氨气(36)食盐(37)氯化银(38)氯化钙(39)铁(40)硫酸铵(41)氧化铁(42)胆矾(43)硫酸钡(44)硫酸亚铁(45)氯化铝(46)高锰酸钾(47)四氧化三铁(48)氧化钙(生石灰)(49)硝酸
(50)氢氧化钙(熟石灰、消石灰)。
化学竞赛-第二届XChO试题答案

第二届学而思XChO化学竞赛北京联考2017年12月10日9:00-12:00命题人:周坤、周振兴、刘曦廷第1题(10分)根据条件书写化学反应方程式。
第2题(19分)2-1-1 B(OH)3是一种很弱的一元酸,但是其酸性的来源与一般的质子酸有所不同,请写出硼酸在水中体现酸性的化学方程式。
2-1-2于H3BO3溶液中加入多羟基醇(甘油、甘露糖醇),硼酸的酸性会显著提升,请写出涉及的反应方程式。
多羟基醇可用下图代替:(2)硼酸H3333244的话,请写出反应方程式。
3得到无色的氧化物B。
已知A、B中O元素质量分数分别为0.2310、0.3336,且A中X元2-2-2 Y在BrF5溶剂中可与SbF5反应得到一阴阳离子均带一个电荷的离子化合物C,C中的Sb原子均为6配位。
阳离子具有线性结构,阴离子中Sb元素的质量分数为0.5458,且尔比Ti:HF=1:3的比例进行反应,产物中有2种含Ti物种。
反应过程中有无色气体生成,4是6配位。
请画出Ti(OEt)4322448-n n44亚胺结构。
第3题(6分)将某无机盐X的纯样品置于空气中加热到220℃,从热重分析图上可以观察到样品开始失重。
当有66.7%(物质的量分数)的X反应完时,将温度迅速提高至240℃,剩余物质相互作用,样品则会按照另一种反应进行失重。
加热至恒重时,样品中仅存在一种无机盐。
继续提高温度至315℃,样品开始进入新的失重平台,平台结束时,最终样品质量为初始质量的86.76%。
(1)已知失重过程中,减少的质量仅以H2O分子形式脱去。
(2)315℃失重平台结束后,残余固体中不含有H元素。
(3)X中仅含有一种金属元素。
第4题(5分)设在某一温度下,有一定量的PCl 5(g) 解离后的混合气体在100 kPa 压力下的体积为31 dm ,在该条件下PCl 5(g)的解离度0.5α=。
如果在上述过程达到平衡后,再通入Cl 2(g),使体积维持在1 dm 3,而平衡压力增加到400 kPa 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
15、有机化学方程式书写竞赛2
书写有机反应的化学方程式时:○1有机物用结构简式表示○2一般打“→”而不打“=”○3要特别注意反应条件,因为反应条件往往会导致反应产物不同、反应类型不同。
○4书写有机反应方程式时,要能理解典型反应的断键部位。
1、丙烯与Cl2加热时发生一取代:
2、丙烯与Cl2的CCl4溶液作用:
(对比1、2两个反应,理解反应条件影响到反应类型)
3、乙炔与足量溴的CCl4溶液作用:
4、乙烯水化制乙醇:
5、写出2-甲基-1,3-丁二烯(异戊二烯)与Br21:1加成的所有产物结构简式:
6、丙烯加聚:异戊二烯加聚:
(对比7、8两个反应,理解单烯烃与二烯烃加成产物的不同)
7、乙酸乙烯酯加聚:
8、丁二烯与苯乙烯加聚:
9、电石与水反应制乙炔:
10、由乙炔制聚氯乙烯:
11、乙炔制乙醛(已淘汰,了解烯醇式结构的不稳定性):
12、乙炔制聚乙炔(新型导电塑料):
13、苯与液溴发生卤代:
14、苯酚与溴水取代:
(注意与前一反应条件对比,理解基团之间相互影响)
15、苯的硝化反应:
16、甲苯硝化制TNT:
(注意与前一反应产物的不同,理解基团之间相互影响。
)
17、用NaOH溶液除去溴苯中Br2:
18、苯加氢制环己烷:
(苯分子和环己烷分子均为六元环,但分子中键角不同哦!)19、甲苯与Cl2光照(一取代):
20、甲苯与Cl2在Fe作催化剂时(一取代):
(条件不同,虽反应类型相同,但取代位置不同。
)
21、氯代乙酸与足量NaOH溶液共热:
22、一溴环己烷制1,3-环己二烯的3步反应:,
,
23、与NaOH的水溶液共热:
(偕二醇不稳定,易脱水)
24、氯苯在300℃、28MPa下,以铜作催化剂,与NaOH溶液共热:
(工业上制苯酚的方法之一)
25、向苯酚钠溶液中通入少量CO2:
26、向NaOH溶液中通入少量CO2(离子方程式):
27、向NaAlO2溶液中通入少量CO2(离子方程式):
28、向中加入NaHCO3溶液:
(酸性强弱:羧酸>碳酸>苯酚>HCO3-)
29、向中加入Na2CO3溶液:
(酸性强弱:苯酚>水>乙醇,理解不同取代基对羟基的影响)
30、苯酚加氢得环己醇:
31、写出钠与水、乙二醇反应式(醇中羟基里氢原子没有水中氢原子活泼):
32、乙醇钠与水反应:
33、将铜丝放在空气中加热,表面变,趁热伸入乙醇中,表面重新变成。
依次发生反应为:
、
34、甲醇催化氧化:
35、环己醇催化氧化:
36、1,2-丙二醇催化氧化:
37、实验室制乙烯:
38、环己醇与浓硫酸共热,生成不饱和烃:
39、苯甲醇与氢溴酸共热:(可用于制卤代烃)
40、实验室制乙烯,需迅速加热至170℃的原因是(用反应式表示):
41、苯甲醛与足量氢气反应:
42、环己酮与氢气加成:
43、丙酮与氢氰酸加成:
44、苯甲醛与丙酮发生羟醛缩合反应:
45、丙烯醛发生银镜反应:
(银氨溶液是弱氧化剂,碳碳双键得到保留)
46、乙二醛发生银镜反应:
47、苯甲醛与新制Cu(OH)2共热:
48、甲醛与新制Cu(OH)2共热:
(甲醛结构的特性性,让它有“以一当二”的实力!HCHO~4Ag~2Cu2O)
49、丙酮醛催化氧化:(酮难被氧化,幸存哦!)
50、乙烯氧化法制乙醛:(此乃乙醛之工业制法)
51、甲酸电离:(羧酸或无机含氧酸电离出的都是-OH中氢原子)
52、乙二酸电离:
53、用食醋除去水垢(离子方程式):
(醋酸酸性强于碳酸的一个例证)
54、制备苯甲酸苯甲酯:
55、制备乙二酸二乙酯:
56、两分子乳酸分子间酯化成环:
57、4-羟基戊酸分子内酯化成环:58、1个乙二酸与1个乙二醇分子间脱去1分子水:
59、1个乙二酸分子与1个乙二醇分子间脱去2分子水:
60、乙二酸与乙二醇缩聚:
61、己二酸与己二胺缩聚:
(类似于二元酸与二元醇之间的酯化)
62、乳酸缩聚成聚乳酸:
63、甘油与浓硫酸、浓硝酸的混合酸作用制硝化甘油:
64、苯甲酸苯甲酯与稀硫酸共热:
65、软脂酸甘油酯与NaOH溶液共热(皂化反应):
66、与足量NaOH溶液共热:
67、与NaOH溶液共热:。
