中国药典2010年版微生物检验增修订内容培训班回执单.
合集下载
2010年微生物限度检查法修订

11、增加了白色念珠菌控制菌检查
• 白色念珠菌在沙氏葡萄糖琼脂培养基上生长的菌落呈乳白 色偶见淡黄色,表面光滑有浓酵母气味,培养时间稍久则 菌落增大,颜色变深、质地变硬或有皱摺。若平板上无菌 落生长或生长的菌落与上述菌落形态特征不符,判供试品 未检出白色念珠菌。如平板上生长的菌落与上述菌落形态 特征相符或疑似,应挑选2~3个菌落分别接种至念珠菌显 色培养基平板上,培养24~48小时(必要时延长至72小 时)。若平板上无绿色或翠绿色的菌落生长,判供试品未 检出白色念珠菌。 • 若平板上生长的菌落为绿色或翠绿色,挑取相符或疑似的 菌落接种于1%吐温80玉米琼脂培养基上,培养24~48小 时。取培养物进行染色,镜检及芽管试验。
2010年版微生物限度检查 法 增修订内容简介
——以《中国药典》一部为例
2008.10
一、增加的内容
• 1、增加了贴剂 的微生物检查方法 • 检查方法: • 取规定量供试品,去掉贴剂的保护层,放置在无 菌玻璃或塑料片上,粘贴面朝上。用适宜的无菌 多孔材料(如无菌纱布)覆盖贴剂的粘贴面以避 免贴剂粘贴在一起。然后将其置于适宜体积并含 有灭活剂(如聚山梨酯80或卵磷脂)的稀释剂中, 用力振荡至少30分钟,或以其他方法制备成供试 液。贴膏剂应采用薄膜过滤法进行细菌、霉菌及 酵母菌计数。
8、增加了薄膜过滤法每张滤膜 冲洗量的规定
• 每张滤膜每次冲洗量不超过100ml,总冲洗 量不得超过1000ml • 滤膜直径一般为50mm,若采用其它直径的 滤膜,冲洗量应进行相应的调整。
9、增加了选择滤膜材质的原则
• 选择滤膜材质时应保证供试品及其溶剂不 影响微生物的充分被截留。滤器及滤膜使 用前应采用适宜的方法灭菌。使用时,应 保证滤膜在过滤前后的完整性。水溶性供 试液过滤前先将少量的冲洗液过滤以润湿 滤膜。油类供试品,其滤膜和过滤器在使 用前应充分干燥。为发挥滤膜的最大过滤 效率,应注意保持供试品溶液及冲洗液覆 盖整个滤膜表面。
《中华人民共和国药典》2010年版培训 PPT课件

2019/1/29
• 药品质量可控性有效性提升(重金属有害元素检 查体系完善,中药专属性检测方法,液相色谱专 属性,原材料要求提高) • 标准内容更趋科学规范合理(药品名,辅料要求, 可见异物抽样要求,检测次数和时限) • 技术创新,国际协调(中药一测多评,特征图谱, 指纹图谱,杂质控制,无菌检查)
2019/1/29
• • • • • • •
装量(注射液,注射用浓溶液) 装量差异(注射用无菌粉末未检含量均一度者) 渗透压摩尔浓度(静脉输液和椎管注射用注射液) 可见异物 不溶性微粒 无菌 细菌内毒素/热原
2019/1/29
附录-药用辅料
• 药用辅料系指生产药品和调配处方时使用的赋形 剂和附加剂;是除活性成分以外,在安全性方面 已进行合理的评估,且包含在药物制剂中的物质 • 可能影响药品质量、安全性和有效性 • 制剂生产用pH调节剂属于辅料 • 生产药品所用辅料必须符合药用要求;注射剂用 药用辅料应符合注射用质量要求
2019/1/29
凡例-说明书、包装、标签
• 符合法律法规 • 内包材应无毒、洁净,与药品相容 • 麻醉药品,精神药品,医疗用毒性药品、放射性 药品和非处方药的说明书和包装标签,应有规定 标识
2019/1/29
附录-注射剂
• 注射剂所用原辅料应控制来源和工艺并符合注射 用质量要求,所用溶剂安全无害不影响疗效质量 • 注射剂用容器应用适宜方法验证密封性 ,符合国 标规定,胶塞有足够弹性和稳定性 • 生产过程尽可能缩短注射剂配制时间,防止微生 物热源污染和药物变质 • 注射剂应遮光储存 • 注射剂用辅料应在标签或说明书中标明名称和所 用溶剂,抑菌剂应标明浓度
2019/1/29
凡例-总则
• • • • 药典依据:《中华人民共和国药品管理法》 《中国药典》指的是药典现行版 凡例和附录对药典以外国家标准具同等效力 药典规定针对符合GMP的产品
《中国药典》2010年版一部增修订情况介绍

植物油脂、提取物 中成药 小计 总计
16
22
499
253
1019
634
2165
2005版药 典收载
551(其中 单列饮片标 准13个)
31一)中药材及饮片
鉴别
检查
含量测定
重金 毒
显 微
TLC
HPL C
GC
理 化
通则
属有 害元
性 成
其 他
HPLC
TLCS UV GC
全面提高和完善中药材(包括民族药)、中药饮 片质量标准,重点研究道地药材与非道地药材、 野生与栽培药材品质的特异性和常用中药材专属 性检测方法,深入研究并建立能有效控制中药材 及中药饮片质量的方法。
二、编制目标
2.建立符合中医药特点的质量标准体系,逐步 由单一指标性成分定性定量向活性、有效 成分及生物测定的综合检测过渡,向多成 分及和指纹或特征图谱整体质量控制模式 转化。
气相色谱法
相对平均偏差 不得大于2% 不得大于3% 对照品比较法不得大于2%; 比色法不得大于3%; 不得大于5% 不得大于2%; 蒸发光散射检测不得大于5%; 不得大于2%
(4)中药指纹图谱分析方法的建立要能体现 中药的整体特征。在满足表征中药化学成 分群整体性质的前提下,要求有较好的重 现性。
(5)对原专属性不强的测定方法(紫外、重量法、 容量法)修改为HPLC、GC等专属性强的方法。
• 戊已丸 05版:UV法测定黄连总生物碱含量 10版:HPLC法测定盐酸小檗碱和芍药苷含量
• 黄氏响声丸 05版:TLC-S法测定贝母素乙含量 10版:HPLC法测定贝母素甲和贝母素乙含量
三、标准制定的技术要求
其 他
素分
05 版 收 339 347 5 载
02 2010年版《中国药典》微生物检查法

11
2010年版微生物限度检查法修订
9、附录109页,修订:供试品检查(法) • (取按验证的方法制备的均匀供试液,)按计数方法的验 证试验确认的程序进行供试液制备。用pH7.0无菌氯化钠蛋白胨缓冲液稀释成1∶10、1∶102、1∶103等稀释级。 • 1.平皿法 • (采用平皿法进行菌数测定时,应取适宜的连续2~3个稀 释级的供试液。)
10
2010年版微生物限度检查法修订
8、附录109页,增加: • 若没有适宜的方法消除供试品中的抑菌作用,那么验证试验中微生物 回收的失败可看成是因供试品的抗菌活性引起的,同时表明该供试品 不能被试验菌污染。然而,供试品也可能仅对试验用菌株具有抑制作 用,而对其他菌株没有抑制作用。因此,根据供试品须符合的微生物 限度标准和菌数报告规则,在不影响检验结果判断的前提下,应采用 能使微生物生长的更高稀释级的供试液进行方法验证试验。若验证试 验符合要求,应以该稀释级供试液作为最低稀释级的供试液进行供试 品检验。 • 计数方法验证时,若采用上述计数方法总存在一株或多株试验菌的回 收率达不到要求,那么选择回收情况最接近要求的方法和试验条件进 行供试品的检测。
16
二、培养基适用性实验的实施与操作
• 1.计数培养基的适用性检查
(一)应用范围;细菌、霉菌及酵母菌计数用的培养基应进行培养基的适 用性检查,包括成品培养基、由脱水培养基或按培养基处方配制的培 养基均应检查。 (二)菌种及菌液制备 验证试验所用的菌株传代次数不得超过5代(从 菌种保存中心获得的冷冻干燥菌种为第0代),并采用适宜的菌种保 藏技术,以保证试验菌株的生物学特性。 大肠埃希菌(Escherichia coli)〔CMCC(B) 44 102〕 金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B) 26 003〕 枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B) 63 501〕 白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕 黑曲霉(Aspergillus niger)〔CMCC(F) 98 003〕 菌液制备同微生物限度检查方法学验证
2010年版《中国药典》微生物检验技术(崔学文)

2010年版《中国药典》微生物 检验技术
崔学文 四川省食品药品检验所 2010年3月
主要内容
一、药品微生物检验现状
二、中国药典2010年版微生物检验增修订 内容简介
三、微生物检查方法验证试验
(一)药品微生物检验现状
药品微生物检验概况
药品质量标准 【性状】 【鉴别】 【检查】 无菌/微生物限度 【含量测定】
CH3
CH3
OCH3
CHF3
加替沙星
卡德沙星
头孢类抗生素无菌检查
通过400ml稀释液的溶解,滤过,采用0.1%蛋白胨溶液冲洗 (表7),阳性对照菌均可正常生长。
几种头孢菌数无菌检查冲洗量
样品名 头孢拉定 头孢呋辛钠 头孢替安 头孢曲松钠 头孢哌酮钠 头孢哌酮钠舒巴坦钠 头孢匹罗 冲洗量(ml) 大肠 铜绿 生孢 金葡 枯草 白念 黑曲霉
药典 名称 目的 培养条件 配方 USP29 Fluid Thioglycollate Medium 硫乙醇酸盐流体培养基 培养需氧、厌氧和微需氧微生物 (主要是厌氧菌) EP-2001 Fluid Thioglycollate Medium 硫乙醇酸盐流体培养基 培养需氧、厌氧和微需氧微生物 (主要是厌氧菌) 14天于30-35 °C Pancreatic Digest of Casein(胰酪蛋白胨)....................15.0 g Yeast Extract(酵母浸出粉) ..................................5.0 g Dextrose(葡萄糖)............................................5.5 g Sodium Chloride(氯化钠).....................................2.5 g L-Cystine( L-胱氨酸) .......................................0.5 g Sodium Thioglycollate (硫乙醇酸钠)..........................0.5 g Agar( 琼脂).................................................0.75 g Resazurin( 刃天青) .........................................1.0 mg 中国药典-2005 Fluid Thioglycollate Medium 硫乙醇酸盐流体培养基 培养需氧、厌氧微生物
崔学文 四川省食品药品检验所 2010年3月
主要内容
一、药品微生物检验现状
二、中国药典2010年版微生物检验增修订 内容简介
三、微生物检查方法验证试验
(一)药品微生物检验现状
药品微生物检验概况
药品质量标准 【性状】 【鉴别】 【检查】 无菌/微生物限度 【含量测定】
CH3
CH3
OCH3
CHF3
加替沙星
卡德沙星
头孢类抗生素无菌检查
通过400ml稀释液的溶解,滤过,采用0.1%蛋白胨溶液冲洗 (表7),阳性对照菌均可正常生长。
几种头孢菌数无菌检查冲洗量
样品名 头孢拉定 头孢呋辛钠 头孢替安 头孢曲松钠 头孢哌酮钠 头孢哌酮钠舒巴坦钠 头孢匹罗 冲洗量(ml) 大肠 铜绿 生孢 金葡 枯草 白念 黑曲霉
药典 名称 目的 培养条件 配方 USP29 Fluid Thioglycollate Medium 硫乙醇酸盐流体培养基 培养需氧、厌氧和微需氧微生物 (主要是厌氧菌) EP-2001 Fluid Thioglycollate Medium 硫乙醇酸盐流体培养基 培养需氧、厌氧和微需氧微生物 (主要是厌氧菌) 14天于30-35 °C Pancreatic Digest of Casein(胰酪蛋白胨)....................15.0 g Yeast Extract(酵母浸出粉) ..................................5.0 g Dextrose(葡萄糖)............................................5.5 g Sodium Chloride(氯化钠).....................................2.5 g L-Cystine( L-胱氨酸) .......................................0.5 g Sodium Thioglycollate (硫乙醇酸钠)..........................0.5 g Agar( 琼脂).................................................0.75 g Resazurin( 刃天青) .........................................1.0 mg 中国药典-2005 Fluid Thioglycollate Medium 硫乙醇酸盐流体培养基 培养需氧、厌氧微生物
中国药典2010年版增修订情况

二、2010年版中国 药典一部增修订情 况简单介绍
(一)本版药典解决了长期以来饮 片缺乏国家标准的问题
2005年版收载的饮片品种只有23个,2010 年版通过新建和明确分类定位方法,饮片 标准达到822个,完全覆盖了中医临床常用 饮片目录,基本构建了以《中国药典》为 中药饮片标准主体,各省《饮片炮制规范》 或省级饮片标准仅为满足辖区内中医用药 特点而设,为国家饮片标准的补充形式的 饮片标准体系框架。
三部:
收载生物制品,共计 131种,新增37种,修 订94种。
1、本版药典更注重附录 的创新,一、二、三部共 新增附录47个,修订154 个,一、二、三部共同采 用的附录分别在各部中予 以收载;附录中扩大了对 成熟新技术的收载。例如:
☆新增了离子色谱、核磁共振波谱法、 拉曼光谱等;
☆将液质联用、DNA分子鉴定、薄层生 物自显影技术应用到中药材、中药饮片 中以解决常规方法无法解决的问题;
(1)第一法:增加了丙管,即供试品加 标准铅溶液。丙管不得浅于标准管(甲 管),如丙管浅于甲管,应重新按第二 法检查。
(2)第二法:勘误:供试品管应为乙管, 标准管为甲管,以与第一法对应。
(3)删去了2005年版的第四法,铅斑法。
12、附录Ⅷ L 干燥失重测定法
对于供试品未达到规定的干燥 温度即融化时,本版药典明确 了检查方法,即在供试品熔点 低5~10℃的温度下干燥至大 部分水除去后按规定条件检查。
生产药品所用的辅料必须符合药用要求;注 射用辅料应符合注射用质量要求。根据不同 的生产工艺和用途,药用辅料的残留溶剂、 微生物限度或无菌应符合规定;注射用药用 辅料的热原或细菌内毒素、无菌等应符合规 定。
6、附录Ⅲ 一般鉴别试验
钠盐鉴别取消了醋酸氧铀锌产生 沉淀的鉴别,修改为欧洲药典的 方法。
2010年版中国药典增补本修订内容
工艺规程、成品检验标准操作规程
14
银黄片
新增品种
工艺规程、成品检验标准操作规程
15
石斛夜光丸
(重大变更)
P118修改“处方”和“制法”,修订鉴别(2)(3),增订鉴别(4);修订鉴别(5);删除原鉴别(5),修订鉴别(6);修订“含量测定”项(流动相、对照品配制、含量限度0.33变更为0.27)
工艺规程、成品检验标准操作规程、处方文件、包装材料相关文件及备案
P555订正“检查法”
QC文件
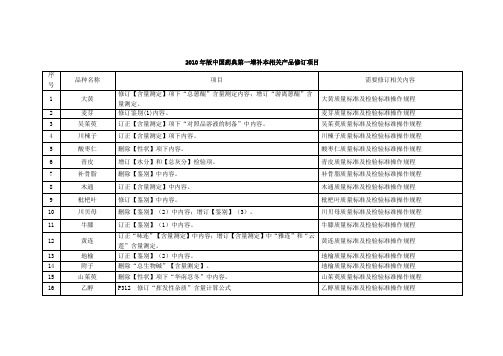
2010年版中国药典第二增补本相关产品修订项目
序号
品种名称
项目
需要修订相关内容
1
干姜
修订饮片项下的【浸出物】
干姜质量标准及检验标准操作规程
2
山药
药材及饮片品种项下增订“二氧化硫残留量”检查项目,限度为“二氧化硫残留量不得过400mg/kg
山药质量标准及检验标准操作规程
3
4
川楝子
订正【含量测定】项下内容。
川楝子质量标准及检验标准操作规程
5
酸枣仁
删除【性状】项下内容。
酸枣仁质量标准及检验标准操作规程
6
青皮
增订【水分】和【总灰分】检验项。
青皮质量标准及检验标准操作规程
7
补骨脂
删除【鉴别】中内容。
补骨脂质量标准及检验标准操作规程
8
木通
订正【含量测定】中内容。
木通质量标准及检验标准操作规程
QC文件
药材项下订正【含量测定】项
黄连质量标准及检验标准操作规程
12
酸枣仁
订正饮片项下的【炮制】项、【鉴别】项、【检查】中的水分项、【含量测定】项。
酸枣仁质量标准及检验标准操作规程
14
银黄片
新增品种
工艺规程、成品检验标准操作规程
15
石斛夜光丸
(重大变更)
P118修改“处方”和“制法”,修订鉴别(2)(3),增订鉴别(4);修订鉴别(5);删除原鉴别(5),修订鉴别(6);修订“含量测定”项(流动相、对照品配制、含量限度0.33变更为0.27)
工艺规程、成品检验标准操作规程、处方文件、包装材料相关文件及备案
P555订正“检查法”
QC文件
2010年版中国药典第二增补本相关产品修订项目
序号
品种名称
项目
需要修订相关内容
1
干姜
修订饮片项下的【浸出物】
干姜质量标准及检验标准操作规程
2
山药
药材及饮片品种项下增订“二氧化硫残留量”检查项目,限度为“二氧化硫残留量不得过400mg/kg
山药质量标准及检验标准操作规程
3
4
川楝子
订正【含量测定】项下内容。
川楝子质量标准及检验标准操作规程
5
酸枣仁
删除【性状】项下内容。
酸枣仁质量标准及检验标准操作规程
6
青皮
增订【水分】和【总灰分】检验项。
青皮质量标准及检验标准操作规程
7
补骨脂
删除【鉴别】中内容。
补骨脂质量标准及检验标准操作规程
8
木通
订正【含量测定】中内容。
木通质量标准及检验标准操作规程
QC文件
药材项下订正【含量测定】项
黄连质量标准及检验标准操作规程
12
酸枣仁
订正饮片项下的【炮制】项、【鉴别】项、【检查】中的水分项、【含量测定】项。
酸枣仁质量标准及检验标准操作规程
《中国药典》2010年版(二部)

283
158 23 1871
261 / 15
144 / 24 0 1448
92.2%
91.1% 0 77.4%
化学药中由于未找到样品而未修订的品种有306个,占保留上版品种21.8%
2010年版与2005年版药典主要项目收载情况比对表
增修订项目 红外光谱鉴别 有关物质 残留溶剂 渗透压摩尔浓度 溶出度或释放度 含量均匀度 无菌检查方法 细菌内毒素 含量测定 HPLC法 原料 制剂 HPLC方法 2005年版 530 2 142 24 4 315 165 107 216 359 2010年版 580 73 707 97 45 414 219 132 372 694
依法进行该项检查外,其他未在“残留溶剂”项下明确列出的有机溶
剂与未在正文中列有此项检查的品种,如生产过程中引入或产品中残 留有机溶剂,均应按本版药典附录“残留溶剂测定法”检查并应符合
相应溶剂的限度规定。
主要内容
1 3 2 3 4 5 3 二部特点及品种收载情况
凡例的增修订情况
各论的增修订情况 现代分析技术的应用
脏器均应来自经检疫的健康动物,涉及牛源的应取自无牛海绵状脑病
地区的健康牛群;来源于人尿提取的药品,均应取自健康人群。上述 药品均应有明确的病毒灭活工艺要求以及质量管理要求。
凡例的增修订情况
项目与要求
• 十七、(第二段)对于生产过程中引入的有机溶剂,应在后续的生产 环节予以有效去除。除正文已明确列有“残留溶剂”检查的品种必须
Байду номын сангаас
应关注晶型和药效的关系。如确需利用熔点作为控制晶型的手段,则 标准中应收入。
各论的增修订情况(1):名称与性状
比旋度(原料药)
