2012-2013高二化学期中考试卷(修正稿)
2012—2013学年高二化学上学期期中考试题

2012—2013学年度上学期期中考试高二化学试题【新课标】第I卷(共计50分)一、选择题(本题包括10小题,每小题2分,共20分,每小题只有一个正确答案)1.下列有关说法,正确的是A.电解质溶于水一定放出热量B.在一个确定的化学反应中,反应物总能量总是高于生成物总能量C.可逆反应在加热时正逆反应速率都增大D.在25℃时,0.01mol/L的氢氧化钠溶液中,水电离的c(H+)与水电离的c(OH-)的积为10-142.关于强、弱电解质的叙述不正确的是A.强电解质在溶液中完全电离,不存在电离平衡B.强电解质溶液导电能力一定很强,弱电解质溶液导电能力一定很弱C.同一弱电解质同浓度的溶液,温度不同时,导电能力不同D.强电解质在固态或液态时,可能不导电3.已知:H2(g)+F2(g)== 2HF(g)△H=-270kJ/mol,下列说法正确的是A.2L氟化氢气体分解成1L的氢气和1L的氟气吸收270kJ热量B.1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量小于270kJC.在相同条件下,1mol氢气与1mol氟气的能量总和大于2mol氟化氢气体的能量D.1个氢气分子与1个氟气分子反应生成2个氟化氢分子放出270kJ热量4.沼气是一种能源,它的主要成分是CH4。
0.5molCH4完全燃烧生成CO2气体和液体H2O 时,放出445kJ热量,则下列热化学方程式中正确的是A.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890kJ·mol-1B.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ·mol-1C.CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890k J·mol-1D.1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(l)△H=-890kJ·mol-15.有三支试管,分别加入下列物质后甲:10mL 0.01mol·L-1 FeCl3溶液和10 mL 0.01 mol·L-1 KSCN溶液乙:5mL水10mL 0.01mol·L-1 FeCl3溶液 5mL 0.01mol·L-1 KSCN溶液丙:10mL 0.1mol·L-1 FeCl3溶液和10mL 0.1mol·L-1 KSCN溶液观察这三支试管的颜色,其中颜色最浅的是A.甲试管 B.乙试管 C.丙试管D.无法判断6.将常温下pH=12的氢氧化钠溶液与pH=2的硫酸溶液分别加热,溶液PH的变化是A.前者减少后者不变 B.前者减小后者增大 C.都不变D.都减小7.下列不能减慢锌与稀盐酸的反应速率的措施是A.降低温度 B.加入氯化钠溶液C.加入少量CH3COONa固体D.增大锌的用量8.液氨与水相似,存在着微弱的电离:2NH3NH4++NH2-。
20122013学年度第一学期高二化学期中考试卷

2012-2013学年第一学期高二化学选修2期中考试卷(考试时间:120分钟总分:100分)出题人:胡文靖审题人:李生辉可能用到的相对原子质量:H:1 O:16 S:32一、选择题(每小题只有一个正确答案,每小题2分,共40分)1.有关接触法制硫酸,下列说法中不正确的是A.用硫和硫铁矿均可做为原料B.SO2转化为SO3,需在催化剂和加热条件下进行C.SO3可用水直接吸收D.热交换器可对生成气体冷却,对原料气体加热2.属人工固氮的化学反应是A.N2与H2在一定条件下反应生成NH3 B.由NH3转变成NH4HCO3C.NO与O2反应生成NO2 D.豆科植物的根瘤菌将氮的化合物转变成植物蛋白3.在NH3、HNO3、H2SO4的工业生产中,具有的共同点是A.使用吸收塔设备B.使用尾气吸收装置C.使用H2作原料D.使用催化剂4.根据平衡移动的原理,能说明提高氨的产量的措施是A.及时把生成的氨液化分离B.升温有利于氨的生成C.使用催化剂促进氮的转化D.增大压强,不利于氨的生成5.下列广告用语在科学上没有错误的是A.这种饮料中不含任何化学物质 B.这种蒸馏水绝对纯净,其中不含任何离子C.这种口服液含丰富的氮、磷、锌等微量元素 D.没有水就没有生命6.下列关于硬水的叙述中不正确的是A.硬水中的Ca2+、Mg2+可与肥皂的主要成分结合而生成沉淀,从而浪费肥皂B.凡含有Ca2+、Mg2+离子的水都是硬水C.水的硬度是用CaO的量为标准的D.1L水中含10 mg CaO(或相当于10 mg CaO)称为1度7.下列石油分馏产物中,沸点范围最高的是A.汽油B.煤油C.柴油D.润滑油8.分子分离膜可以让某些物质有选择地通过而将物质分离,下列应用不属于高分子分离膜的应用范围的是A.胶体的渗析 B.分离工业废水,回收废液中的有用成分C.海水的淡化 D.食品工业中,浓缩天然果汁、乳汁品加工和酿酒9.工业上电解食盐水的阴极区产物是A.氯气 B.氢气和氯气 C.氢气和氢氧化钠 D.氯气和氢氧化钠10.为减少大气污染,许多城市推广清洁燃料。
2012-2013年高二下学期化学期中考试卷

同安一中2012-2013学年下学期期中考高二化学试卷本卷满分100分,考试时间100分钟可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Fe-56 Cu-64第Ⅰ卷 选择题一、选择题(每小题只有一个选项正确,每题3分共45分)1.废电池必须进行集中处理的主要原因是( ) A .利用电池外壳的金属材料B .防止电池中汞、镉和铅等重金属离子对土壤和水源的污染C .防止电池中渗漏的电解液腐蚀其他物品D .回收其中的石墨电极2.下列溶液一定呈中性的是( ) A .pH=7的溶液B .c (H +) = c (OH -)的溶液C .由强酸、强碱等物质的量反应制得的溶液D .非电解质溶于水得到的溶液 3.下列事实不能用电化学原理解释的是( )A .铝片不需要特殊的保护方法B .炒过菜的铁锅未清洗易生锈C .轮船水线以下的船壳上镶有一定数量的锌D .镀锌铁比镀锡铁耐腐蚀4.某化学反应其△H =–122 kJ·mol -1,∆S=231 J·mol -1·K -1,则此反应在下列哪种情况下可自发进行( )A .在任何温度下都能自发进行B .在任何温度下都不能自发进行C .仅在高温下自发进行D .仅在低温下自发进行5.常温下,在0.01 mol·L —1的H 2SO 4溶液中,由水电离出来的c(H +)是( ) A .5×10-13 mol·L —1;B .0.02 mol·L —1C .1.00×10-7 mol·L —1;D .1.00×10-12 mol·L —16.过量..铁粉与200mL 5mol·L -1 H 2SO 4反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )A .NaNO 3溶液B .NaOH 溶液C .K 2CO 3溶液D .水 7.电解氯化铜溶液时,要求满足下列三点要求:①阳极质量逐渐减少;②阴极质量逐渐增加;③电解液中铜离子浓度不变。
1213学年上学期高二期中考试化学(附答案)
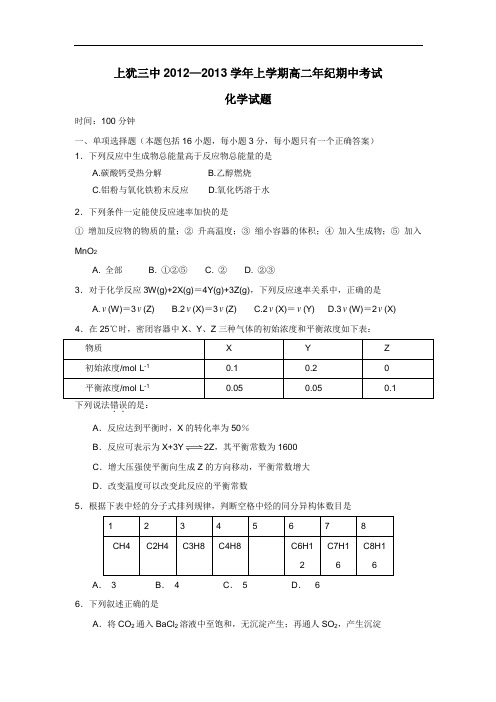
上犹三中2012—2013学年上学期高二年纪期中考试化学试题时间:100分钟一、单项选择题(本题包括16小题,每小题3分,每小题只有一个正确答案)1.下列反应中生成物总能量高于反应物总能量的是A.碳酸钙受热分解B.乙醇燃烧C.铝粉与氧化铁粉末反应D.氧化钙溶于水2.下列条件一定能使反应速率加快的是①增加反应物的物质的量;②升高温度;③缩小容器的体积;④加入生成物;⑤加入MnO2A. 全部B. ①②⑤C. ②D. ②③3.对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是A.v(W)=3v(Z)B.2v(X)=3v(Z)C.2v(X)=v(Y)D.3v(W)=2v(X) 4.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:下列说法错误..的是:A.反应达到平衡时,X的转化率为50%B.反应可表示为X+3Y2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数5.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是A.3 B.4 C.5 D. 66.下列叙述正确的是A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通人SO2,产生沉淀B .在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO 3)2固体,铜粉仍不溶解C .向AlCl 3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO 4溶液,沉淀消失D .纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO 4固体,速率不改变 7.根据碘与氢气反应的热化学方程式(i) I 2(g)+ H 2(g) 2HI(g),ΔH=— 9.48 kJ (ii) I 2(S)+ H 2(g)2HI(g) ,ΔH=+26.48 kJ下列判断正确的是A .254g I 2(g)中通入2gH 2(g),反应放热9.48 kJB .1 mol 固态碘与1 mol 气态碘所含的能量相差17.00 kJC .反应(i)的产物比反应(ii)的产物稳定D .反应(ii)的反应物总能量比反应(i)的反应物总能量低 8.COCl 2(g )CO(g)+ Cl 2(g ), △H<0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO 的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl 2转化率的是A .①②④B .①④⑥C .②③⑥D .③⑤⑥ 9.已知反应3A(g)+2B(g)C(g)+4D(g);△H<0,下图中a 、b 表示一定条件下,D的体积分数随时间t 的变化情况。
20122013学年第一学期期中考试高二级化学试题

2012-2013学年第一学期期中考试高二化学(理科)试题可能用到的相对原子质量:H -1O -16C -12一、选择题(每小题只有一个选项符合题意。
每题3分,共30分) 1.CH 3CH(C 2H 5)CH(CH 3)2的名称是()A.1,3-二甲基戊烷B .2-甲基-3-乙基丁烷C .3,4-二甲基戊烷D .2,3-二甲基戊烷 2.下列物质的核磁共振氢谱图中,有5个吸收峰的是()A.CH 3CCH 2ClCH 3CH 3B .CHCH 3Cl C.CH 3CHCH 2CH 3BrD.CH 33.二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调.冰箱和冷冻库等中的致冷剂。
试判断二氟甲烷的结构简式() A.有4种 B.有3种C.有2种D.只有1种4.下列分子式表示的物质一定是纯净物的是() A.C 5H 10B.C 7H 8O C.CH 4O D.C 2H 4Cl 25.下列物质既能发生消去反应,又能氧化生成醛的是()A.CH 3CH 2CHCH 3B.(CH 3)3CCH 2OHC.CH 2CHCH 3BrOH D.CH 2OH6.草药莪术根茎中含有一种色素,它的结构如右图,用它制成的试纸可以检验酸碱性,能够跟1mol 该化合物起反应的Br 2(水溶液)或H 2的最大量分别为()A.3mol ,3molB.3mol ,5molC.6mol ,8mol D.6mol ,10mol 7.下列有机物中属于醇的是()A.HOCH OB .CH 2OHC.CH 3OCH 3D.OH8.绿色农药——信息素的推广使用,对环保有重要意义。
有一种信息素的结构简式为CH 3(CH 2)5CH=CH(CH 2)9CHO 。
下列关于检验该信息素中官能团的试剂和顺序正确的是() A .先加入酸性高锰酸钾溶液;后加银氨溶液,微热 B .先加入溴水;后加酸性高锰酸钾溶液C .先加入新制氢氧化铜悬浊液,加热;再加入溴水D .先加入银氨溶液;再另取该物质加入溴水9、将铜丝放在酒精灯火焰上加热后,分别再将其放入下列溶液中,取出洗涤、干燥后铜丝质量减轻的是()A .苯B .盐酸C .乙醇D .乙醛10.下列关于有机物的叙述正确的是() ()A .凡是能起银镜反应的物质一定是醛B .1,2—二氯乙烷在NaOH 水溶液中发生消去反应得到乙炔C .由CH 2CH -COOCH 3合成的聚合物[-CH 2-CH -COOCH 3]n -D .石油液化气、汽油的主要成分都是碳氢化合物二、选择题(每小题只有2个选项符合题意。
2—13学年上学期高二期中考试化学(附答案)

辽宁省实验中学分校2012-2013学年上学期高二期中考试化学试题时间:90分钟满分:100分第Ⅰ卷选择题一、选择题(本题包括20道小题,每小题3分,共60分)1.铁粉与足量1 mol/L盐酸反应,为了加快反应速率且不影响产生氢气的量可以加入( )①2 mol/L的硝酸溶液②少量CuSO4(s)③少量铜粉④少量CH3COONa(s)⑤对溶液加热⑥向反应液中通入HCl气体⑦加入过量铁粉⑧将铁粉改为铁片A.②③④⑤⑥B.③⑤⑥C.①③⑤⑥⑦D.③⑤⑥⑧2.下列说法中不正确的是( )A.对于任何化学反应来说,反应速率越大,反应现象就越明显B.在其他条件不变时,升高温度一定会加快化学反应的反应速率C.使用合理的催化剂,可以改变化学反应速率,但不能改变化学平衡状态D.增大反应物浓度,可使单位体积内活化分子数增加,反应速率加快3.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+xB(g)2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如图。
下列说法中正确的是( )A.8 min时表示正反应速率等于逆反应速率B.前20 min A的反应速率为0.05 mol/L·minC.反应方程式中的x=1,30 min时表示增大压强D.40 min时改变的条件是升高温度,且正反应为吸热反应4.在体积固定的密闭容器中进行可逆反应2NO22NO+O2,下列能作为反应达到平衡状态标志的是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率之比为2∶2∶1④混合气体的颜色不再改变⑤混合气体的密度不再改变⑥混合气体的压强不再改变 ⑦混合气体的平均相对分子质量不再改变A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部5.已知:C(s)+CO 2(g)2CO(g) ΔH >0。
2012_2013第二学期化学期中试卷

山西省实验中学2012-2013学年度第二学期期中考试考试试题(卷)高二年级化学命题人:傅亮张俊杰校对人:陈俊英可能用到的相对原子质量:C:12 N:14 O:16 P:31 Ba:137 Ti: 48 Si: 28第I卷(选择题,共40分)一、选择题(本题共20小题,每题2分,共40分。
每小题只有一个正确答案)1. 下列分子中的δ键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是A.H2l4C.Cl2D.F22. 下列各项叙述中,正确的是A.钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态B.价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素C.2p和3p轨道形状均为哑铃形,能量也相等D.氮原子的价电子排布图:3. 如图所示是两个甲分子发生反应生成丙分子和乙分子的过程,则下列判断正确的是A.该反应为置换反应B.一个丙分子内有两对共用电子对C.乙分子中存在非极性键D.乙的摩尔质量=2倍甲的摩尔质量-丙的摩尔质量4. 美国《科学》杂志报道,在40GPa高压下,用激光器加热到1800 K,科学家成功合成出CO2原子晶体。
下列有关这种CO2晶体推断最不可能的是A.晶体中每摩尔碳原子与4 mol氧原子形成共价键B.具有很高的熔点、沸点和硬度C.硬度很大,可用作耐磨材料D.容易液化,可用作制冷材料5. 下列各组物质的沸点,按由低到高顺序排列的是A.NH3、CH4、NaCl、NaB.H2O、H2S、MgSO4、SO2C.CH4、H2O、NaCl、SiO2D.Li、Na、K、Rb、Cs6. 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一。
其中下图是已经合成的最著名的硫-氮化合物的分子结构。
下列说法正确的是A.该物质的分子式为SNB.该物质具有很高的熔、沸点C.该物质的分子中既有极性键又有非极性键D.该物质与化合物S2N2互为同素异形体7. A、B属于短周期中不同主族的元素,A、B原子的最外层电子中,成对电子和未成对电子占据的轨道数相等,若A元素的原子序数为a,则B元素原子序数为A. a-4B. a-5C. a-6D. a+48. 已知[Co(NH3)6]3+的立体结构如图,其中数字处的小圆圈表示NH3分子,且各相邻的NH3分子间的距离相等,Co3+离子位于八面体的中心。
2012--2013高二化学上期中试卷

2012-2013学年度上学期期中考试高二化学试卷考试时间:90分钟 试题分数:100分第Ⅰ卷一、选择题(本题包括10小题,每小题2分,只有一个选项符合题意,共20分)1、一定温度下,在某体积不变的密闭容器中,对可逆反应A(g)+2B(g) 3C(g)的下列叙述中,能说明反应已达到平衡的是A 、C 的生成速率与C 的分解速率相等B 、单位时间内消耗amolA ,同时生成3amolCC 、混合气体的平均密度保持不变D 、混合气体的平均摩尔质量保持不变2、氧气(O 2)和臭氧(O 3)是氧元素的两种同素异形体,已知热化学方程式:4Al(s)+3O 2(g)=2A12O 3(s) △H 1 4Al(s)+2O 3(g)=2A12O 3(s) △H 2 3O 2(g)=2O 3(g)△H 3则A .△H 1-△H 2=△H 3B .△H 1+△H 2=△H 3C .△H 2-△H 1=△H 3D .△H 2+△H 1+△H 3=03、室温下,柠檬水的pH 是3,其中水电离的c(H +-)是A 、0.1mol/LB 、1×10-3 mol/LC 、11×0-7 mol/LD 、1×10-11mol/L4、对于反应A+B=C ,下列条件的改变一定使化学反应速率加快的是A .增加A 的物质的量B .升高体系的温度C .减少C的物质的量D .增加体系的压强5、关于可逆反应A(s)+ B(g)2C(g);△H <0,平衡常数为K ,下列说法正确的是A .K =)()()(2B c A c C c B .K 值越大表示达到平衡时,正反应进行程度越大 C .其它条件不变时,温度升高,K 值增大 D .其它条件不变时,压强减小,K 值减小6、已知:(1)H 2(g)+1/2O 2(g)=H 2O(g) △H 1=a kJ/mol (2)2H 2(g)+O 2(g)=2H 2O(g) △H 2=b kJ/mol(3)H 2(g)+1/2O 2(g)=H 2O(l) △H 3=c kJ/mol (4)2H 2(g)+O 2(g)=2H 2O(l) △H 4=d kJ/mol下列关系式中正确的是 A 、a <c <0 B 、b >d >0 C 、2a =b <0 D 、2c =d >07、下列各组反应(表中的物质均为反应物)开始时,放出H 2速率最大的是A 、60°C ,将0.1mol 镁粉加入到10mL 3mol·L -1 的醋酸溶液中B 、60°C ,将0.1mol 镁粉加入到10mL 3mol ·L -1的盐酸溶液中C 、60°C ,将0.1mol 铁粉加入到10mL 3mol ·L -1的盐酸溶液中D 、60°C ,将0.1mol 镁条加入到10mL 1.5mol ·L -1的硫酸溶液中8、下列离子方程式中,不正确的是A 、HCOOH+H 2O HCOO — + H 3O +B 、CO 2+H 2O HCO 3— + H +C 、NaHCO 3 =Na ++H ++CO 32—D 、HS — + H 2O S 2— + H 3O +9、已知25℃时,下列酸的电离常数(K1):HA :1.75×10-5 、H 2B :4.93×10-10 、H 2C :7.2×10-4 、H 3D :1.77×10-4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3. 可逆反应达到平衡的根本原因是()
A.反应混合物中各组分的浓度相等B.正逆反应都还在继续进行
C.正逆反应的速率均为零 D.正逆反应的速率相等
4.仅改变下列一个条件,通过提高活化分子的百分率来提高反应速率的是 A
A.加热 B.加压 C.加负催化剂 D.加大反应物浓度
7.某温度下,N 2O4(g) 2 NO2(g);△H>0。
在密闭容器中达到平衡,下列说法不正确的是 B
A.加压时(减小体积),将使正、逆反应速率增大,平衡向逆反应方向移动
B.保持体积不变,加入少许NO2,将使正反应速率减小,逆反应速率增大,平衡向逆反应方向动
C.保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D.保持体积不变,升高温度,再达平衡时颜色变深
8. 当下列反应达到平衡时,保持温度不变,向容器中充入氩气,平衡一定不移动的是()
A. N2(g)+3H2(g) 2NH3(g)
B. 2HI(g) H2(g)+I2(g)
C.PCl5(g) PCl3(g)+Cl2(g)
D. 2SO2(g)+O2(g) 2SO3(g)
9. 298K下,将1mol蔗糖溶解在1L水中,此溶解过程中体系的∆G = ∆H-T∆S和∆S的变化情况是()
A. ∆G>0,∆S<0
B. ∆G<0,∆S>0
C. ∆G>0,∆S>0
D. ∆G<0,∆S<0
11. 右图是关于反应A2(g)+3B2(g)2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( C )
A.升高温度,同时加压
B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度
D.增大反应物浓度,同时使用催化剂
12.已知反应2CO(g)=2C(s)+O2(g)的△H为正值,△S为负值,设△H和△S不随温度改变,对于该反应下列说法正确的是( D )
A. 低温下是自发变化
B 高温下是自发变化
C. 任何温度下都是自发变化
D. 任何温度下都是非自发变化
14. 试验证明,多数能自发进行的反应是放热反应。
下列叙述中正确的是( C )
A. 所有的放热反应都是自发进行的
B. 所有的自发反应都是放热的
C. 焓变是影响反应是否具有自发性的一种重要因素
D. 焓变是决定反应是否具有自发性的判据
15. 在密闭容器中,A、B、C 三种气体建立化学平衡,它们的反应为A+B C ,在相同温度下若体积缩小2/3,则平衡常数为原来的( D )
A. 3倍
B. 2倍
C. 9倍
D. 不变
16.在容积不变的密闭容器中,注满NO 2气体,298K时,建立下列平衡:2NO2(g)N2O4(g)△H<0。
把该容器置于沸水中,下列性质或数值不会改变的是( D )
①颜色②质量③压强④密度
A. ①②
B. ②③
C. ③④
D. ②④
17.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。
现向一密闭容
器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。
下列有关说法正确的是(C)
A. 达到化学平衡时,N2将完全转化为NH3
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
18.可逆反应:2NO22NO+O2 在容积固定的密闭容器中反应,达到平衡状态的标志是:
( B )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
A. ①④
B.②③⑤
C.①③④
D. ①②③④⑤
20.对于有气体参加的反应,在右图坐标中纵坐标表示反应速
率,横坐标表示的是(B
) A.温度
B.反应时间
C.反应物浓度
D.压强
22. 对于可逆反应:M + N
Q 达到平衡时,下列说法正确的是( C )
A .M 、N 、Q 三种物质的浓度一定相等 B. M 、N 全部变成了Q
C .反应中混合物各成分的百分组成不再变化 D. 反应已经停止
2SO 3 达到平衡后,通入218O 一定时间后,O 18
存在于( C )23.当2SO 2+O 2 A .SO 3 、O 2 B. SO 2 、SO 3 C. SO 2 、SO 3 、O 2 D. SO 2 、O 2
二、选择题(共5题,总分52分)
25.(6分)对于下列反应:2SO 2 + O 2 2SO 3 , (1)如果2min 内SO 2的浓度由6 mol/L 下降为2 mol/L ,那么,用SO 2浓度变化来表示的化学反应速率为____________,用O 2浓度变化来表示的反应速率为_____________。
(2)如果开始时SO 2浓度为4mol/L ,2min 后反应达平衡,若这段时间内v(O 2)为0.5mol/(L · min),那么2min 时SO 2的浓度为_____________。
26.(8分)在一定条件下,将3molA 和1mol B 两种气体混合于固定容积为2L 的密闭容器中,发生如下反应:3A (g )+B (g )
xC (g )+ 2D (g )。
2min 末该反应达到平衡,生
成0.8mol D ,并测得C 的浓度为0.2mol ·L -1。
请填空:
(1)x=__________
(2)温度降低,K 值增大,则正反应是_________(填“放热”或“吸热”)反应。
(3)B 的转化率为_________。
(4)能判断该反应达到平衡状态的依据是________(填编号)
A. 混合气体的密度不变
B. 容器中的压强不再变化
C. 生成D 的反应速率是生成B 的反应速率的2倍
D. 单位时间内生成3molA ,同时生成1molB
27.(6分)汽车尾气(含烃类、CO 、NO 与SO 2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO 与CO 反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)
N 2(g)+2CO 2(g),在298 K 、100 kPa 下,ΔH =-113 kJ/mol ,
ΔS =-145 J/(mol·K)。
(1)为了提高该反应的速率和NO 的转化率,采取的正确措施为________。
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”)。
28. (12分)已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g) C(g) △H<0。
达到平衡时,C的体积分数为40%。
试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡_______。
A. 一定向正反应方向移动
B. 一定向逆反应方向移动
C. 一定不移动
D. 不一定移动
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_______。
29.(8分)在一定条件下的下列可逆反应达到平衡时,试填出:a A+b B c C
(1)若A、B、C都是气体,在减压后平衡向逆反应方向移动,则a、b、c关系是________;(2)若C是气体,并且a + b =c,在加压时化学平衡可发生移动,则平衡必定是向_____方向移动;
(3)已知B、C是气体,现增加A物质的量,平衡不移动,说明A是______(填状态);(4)如加热后,C的百分含量减小,则正反应是________热反应。
18.(12分)在一固定容积的密闭容器中,进行如下化学反应:
(g);△H= Q KJ/mol其化学平衡常数K和温度t的关系如下:CO 2(g)+H2(g)CO(g)+H
2O
请回答:
(1)上述反应中Q 0 (选填“>”或“<”)
(2)能判断该反应已达到化学平衡状态的依据是。
a. 容器中压强不变
b. 反应热不变
c. v正(H2) =v逆(CO)
d. CO2的质量分数不变。
