化学工艺学(第3章)
合集下载
化工工艺学-第三章ppt课件

.
表观停留时间
tR
包括惰性稀释别)的实际体积流量, L,反应管长度; S,反应管截面积, VR,反应器容积。
平均停留时间:
t A
VR dV 0 VV
tA
VR V V
V╹,原料气(包括水蒸气)在平均反应温 度和平均反应压力下的体积流. 量
3.烃分压和稀释剂的影响 烃分压是指进入裂解反应管的物料中气相碳氢化合物
的分压。 热力学: a降低压力有利于抑制二次反应。裂解反应的一次反应是 摩尔数增加的反应,所以压力降低有利于提高一次反应的 平衡转化率。二次反应,尤其是聚合、缩合、结焦等二次 反应是摩尔数减少的反应 b压力对反应速度和反应选择性的影响:
脱氢反应反应式为:
.
烃类裂解过程的二次反应
(1)烯烃裂解 如大分子烯烃裂解为小分子烯烃 2)烯烃聚合、环化、缩合反应
.
(3)烯烃加氢和脱氢反应,如 (4)烯烃分解生碳反应,如
.
烃类裂解反应机理
(1)链引发:烷烃引发主要是断裂C—C键,而对C一H键的引发较小。 链引发反应的活化能较大,290~330KJ/mol范围。 (2)链的增长反应:自由基的分解反应和自由基的夺氢反应。分 解反应的活化能在120~178KJ/mol范围内,夺氢反应的活化能在29 ~45KJ/mol的范围内。两种链传递反应的活化能都比链引发的活化 能小,而反应是生成烯烃的反应,能使小分子烯烃的收率增多,还 可提高裂解反应的转化率。 (3)链终止反应:自由基与自由基结合成分子的反应。
a提高温度有利于—次反应。 b温度升高,二次反应速度也加快,所以升高温度也能使 焦的量增加。因此,当采用高温时必须相应减少停留时间, 以减少结焦的量和生成乙炔的量。
.
2.停留断间的影响 (1) 停留时间的选择
表观停留时间
tR
包括惰性稀释别)的实际体积流量, L,反应管长度; S,反应管截面积, VR,反应器容积。
平均停留时间:
t A
VR dV 0 VV
tA
VR V V
V╹,原料气(包括水蒸气)在平均反应温 度和平均反应压力下的体积流. 量
3.烃分压和稀释剂的影响 烃分压是指进入裂解反应管的物料中气相碳氢化合物
的分压。 热力学: a降低压力有利于抑制二次反应。裂解反应的一次反应是 摩尔数增加的反应,所以压力降低有利于提高一次反应的 平衡转化率。二次反应,尤其是聚合、缩合、结焦等二次 反应是摩尔数减少的反应 b压力对反应速度和反应选择性的影响:
脱氢反应反应式为:
.
烃类裂解过程的二次反应
(1)烯烃裂解 如大分子烯烃裂解为小分子烯烃 2)烯烃聚合、环化、缩合反应
.
(3)烯烃加氢和脱氢反应,如 (4)烯烃分解生碳反应,如
.
烃类裂解反应机理
(1)链引发:烷烃引发主要是断裂C—C键,而对C一H键的引发较小。 链引发反应的活化能较大,290~330KJ/mol范围。 (2)链的增长反应:自由基的分解反应和自由基的夺氢反应。分 解反应的活化能在120~178KJ/mol范围内,夺氢反应的活化能在29 ~45KJ/mol的范围内。两种链传递反应的活化能都比链引发的活化 能小,而反应是生成烯烃的反应,能使小分子烯烃的收率增多,还 可提高裂解反应的转化率。 (3)链终止反应:自由基与自由基结合成分子的反应。
a提高温度有利于—次反应。 b温度升高,二次反应速度也加快,所以升高温度也能使 焦的量增加。因此,当采用高温时必须相应减少停留时间, 以减少结焦的量和生成乙炔的量。
.
2.停留断间的影响 (1) 停留时间的选择
第三章第二节:氢化和脱氢

4
氢解示例
粉煤和重油氢解制轻质油
下午11时25分
化学工艺学
5
脱氢示例
① 乙烷脱氢制乙烯
C2H6 C2H4
+
H2
② 丁烷或丁烯脱氢制丁二烯
C4H10 or C4H8 H2C C H C H CH2
+
H2
③ 甲醇脱氢制甲醛
CH3OH HCHO
+
H2
④ 异丙醇脱氢制丙酮
CH3CHOHCH3
下午11时25分 化学工艺学
3.2氢化和脱氢 氢化和脱氢
一、基本概念 二、氢气来源 三、NH3合成 苯加H制环己烷 四、苯加 制环己烷
下午11时25分
化学工艺学
1
一、基本概念
氢化和脱氢的概念 氢化 脱氢
下午11时25分
化学工艺学
2
1.氢化和脱氢的概念 氢化和脱氢的概念
氢化:氢气和化合物间进行的化学反应。 氢化 加氢:氢气进入化合物使之还原或提高不饱和有 加氢 机物的饱和度。 氢解:在加氢的同时有机物分解,氢分子一部分 氢解 进入生成物大分子中,另一部分进入裂解所得小 分子中。 (氢解:破坏加氢,含N、S、O的有机化合物经 氢解变为烃、S化物,H2O、NH3等) 脱氢:从化合物除去氢原子的过程。 脱氢
பைடு நூலகம்
下午11时25分
化学工艺学
3
氢化示例
(1). H2、N2合成NH3 (2). CO、H2合成CH3OH (CO + 2 H 2 → CH 3 OH ) (3). 苯(苯酚)加氢生成环己烷(环己醇)
+ 3 H2
(4).硝基苯加氢生成苯胺
NO2 NH2
+ 3 H2
化学工艺学第3章烃类热裂解过程(三烯)

衡量裂解结果的指标
转化率(单程转化率、总转化率)
转化率=参加反应的原料量/通入反应器的原料量(%)
产气率(一般小于C4的产物为气体)
产气率=气体产物总质量/原料质量(%)
选择性
选择性= 转化为目的产物的原料量/反应掉的原料量(mol%)
收率和质量收率
收率=转化为目的产物的原料量/通入反应器的原料量(mol%) (wt%)
可判断原料可能达到的裂解深度,及C4 及 C4以下轻烃的收率
用元素分析法测得,是用于各种原料,用以关联 烃原料的乙烯潜在产率
氢含量高则乙烯产率越高
裂解原料含氢量≤低 于13%时,可能达到 的乙烯收率将低于 20%。
特性因数
表征烃类和石油馏分化学性质的参数 反映烃的氢饱和程度
主要用于液体燃料,K值可以通过下式算出:
K 1.216(TB)1/3 d1155..66
n
TB ( ViTi1/3)3 i1
K值以烷烃最高,环烷烃次之,芳烃最低
原料烃的K值越大则乙烯产率越高。乙烯和丙烯 总体收率大体上随裂解原料K值的增大而增加
芳烃指数
即美国矿务局关联指数(Bureau of Mines Correlation Index),简称BMCI。
液体焦油 固体沥青质 焦炭
焦和碳的区别
形成过程不同:烯烃经过炔烃中间阶段而生碳; 经过芳烃中间阶段而结焦
氢含量不同:碳几乎不含氢,焦含有微量氢 (0.1-0.3%)
各族烃裂解生成乙烯、丙烯能力的规律:
正构烷烃在各族烃中最利于乙烯、丙烯的生成 大分子烯烃裂解为乙烯和丙烯 环烷烃生成芳烃的反应优于生成单烯烃的反应 无烷基的芳烃基本上不易裂解为烯烃,有烷基的芳烃,主要
反应部分 芳烃
第3章天工化学制艺

化学工艺学
3.1 热裂解过程的化学反应 3.1.3 裂解反应的热力学
和动力学
化学工艺学
3.1.3.1 裂解反应的热力学分析
裂解反应的热效应
强吸热过程
∑ ∑ Qpt = ΔHt = (ΔHΘf )产物− (ΔHΘf )原料
t2
∫ ΔH t 2 = ΔH t1 + ΔC p dt t1
基尔霍夫公式:
化学工艺学
裂解原料性质及评价
z 族组成---PONA值 z 氢含量 z 特性因数 z 芳烃指数
化学工艺学
族组成-PONA值
z 适用于表征石脑油、轻柴油等轻质馏分油
烷烃P (paraffin)
烯烃O (olefin)
环烷烃N (naphthene) 芳烃A (aromatics)
化学工艺学
PONA值
lg⎜⎜⎝⎛
ki k5
⎟⎟⎠⎞
=
1.51lg
Ni
− 1.05
z 考虑存在二次反应,实际反应速率常数:
k=
k0
1 + Xa
化学工艺学
化学工艺学
3.2 裂解过程的工艺参数和操作指标
化学工艺学
z 原料性质及评价
z 原料烃组成 裂解温度、烃分 压、停留时间 对裂解结果的影 响
z 裂解深度
化学工艺学
衡量裂解结果的指标
化学工艺学
原料氢含量与乙烯收率的关系
化学工艺学
特性因数
反映裂解原料芳香性的强弱
表征石脑油和轻柴油等轻质油化学组成特 性的一种因数,用K表示。
主要用于液体燃料,K值可以通过下式算
出:
K = 1.216(TB )1/3 d1155..66
n
3.1 热裂解过程的化学反应 3.1.3 裂解反应的热力学
和动力学
化学工艺学
3.1.3.1 裂解反应的热力学分析
裂解反应的热效应
强吸热过程
∑ ∑ Qpt = ΔHt = (ΔHΘf )产物− (ΔHΘf )原料
t2
∫ ΔH t 2 = ΔH t1 + ΔC p dt t1
基尔霍夫公式:
化学工艺学
裂解原料性质及评价
z 族组成---PONA值 z 氢含量 z 特性因数 z 芳烃指数
化学工艺学
族组成-PONA值
z 适用于表征石脑油、轻柴油等轻质馏分油
烷烃P (paraffin)
烯烃O (olefin)
环烷烃N (naphthene) 芳烃A (aromatics)
化学工艺学
PONA值
lg⎜⎜⎝⎛
ki k5
⎟⎟⎠⎞
=
1.51lg
Ni
− 1.05
z 考虑存在二次反应,实际反应速率常数:
k=
k0
1 + Xa
化学工艺学
化学工艺学
3.2 裂解过程的工艺参数和操作指标
化学工艺学
z 原料性质及评价
z 原料烃组成 裂解温度、烃分 压、停留时间 对裂解结果的影 响
z 裂解深度
化学工艺学
衡量裂解结果的指标
化学工艺学
原料氢含量与乙烯收率的关系
化学工艺学
特性因数
反映裂解原料芳香性的强弱
表征石脑油和轻柴油等轻质油化学组成特 性的一种因数,用K表示。
主要用于液体燃料,K值可以通过下式算
出:
K = 1.216(TB )1/3 d1155..66
n
(完整word版)化学工艺学教案6(化工12本)-胡江良

④二次上吹制气阶段:自炉底吹水蒸气,将炉中水煤气排出,为重新进行空气吹风做准备,同时回收炉内残存的半水煤气,防止直接送入空气引起爆炸;
⑤空气吹净阶段:将空气从炉底吹入,把炉内残存的半水煤气和含氮吹风气一起吹出并送入气柜。持续时间更短。
五个阶段为一个循环,每个循环需3~4min。生产出的半水煤气中:
H2%=38~42%;CO%=27~31%;N2%=19~22%;CO2%=6~9%。
教学重点及难点:
重点:固体燃料气化的原理、固定床间歇气化法制半水煤气工艺条件
难点:固体燃料气化的原理
教学基本内容
方法及手段
第3章合成氨
3.2合成氨原料气的制备
3.2.1固体燃料气化制备合成氨原料气
固体燃料气化是指用氧或含氧气化剂对固体燃料(煤、焦炭或水煤浆)进行加热,使碳转变为可燃性气体的过程,在合成氨厂简称造气。气化所得的可燃气体称为煤气,进行气化的设备称为煤气发生炉(固体燃料气化器)。
③以空气和适量的水蒸气为气化剂,碳与氧、水蒸气同时反应,当空气和适量的水蒸气混合通过高温燃料层时,在气化层理同时发生碳与氧和碳与水蒸气的反应,虽然此时反应过程更加复杂,但是其反应过程、反应式及影响基本上与碳与氧和碳与水蒸气分别发生的情况一致。
(3)半水煤气的制造
半水煤气是生产合成氨的原料气,其生产方法可采用固定层间歇气化法或固定床连续气化法制备获得。当无论哪种方法,最终必须满足(CO+H2)/N2(体积比)为3.1~3.2的工艺要求。
碳与空气发生放热反应、与水蒸气发生吸热反应。
当系统维持自热平衡时,空气与水蒸气同时进行气化反应时,如不提供外部热源,则气化产物中 的含量大大低于合成氨原料气配比要求。
为解决气体成分与热量平衡这一矛盾,可采用下列方法。
⑤空气吹净阶段:将空气从炉底吹入,把炉内残存的半水煤气和含氮吹风气一起吹出并送入气柜。持续时间更短。
五个阶段为一个循环,每个循环需3~4min。生产出的半水煤气中:
H2%=38~42%;CO%=27~31%;N2%=19~22%;CO2%=6~9%。
教学重点及难点:
重点:固体燃料气化的原理、固定床间歇气化法制半水煤气工艺条件
难点:固体燃料气化的原理
教学基本内容
方法及手段
第3章合成氨
3.2合成氨原料气的制备
3.2.1固体燃料气化制备合成氨原料气
固体燃料气化是指用氧或含氧气化剂对固体燃料(煤、焦炭或水煤浆)进行加热,使碳转变为可燃性气体的过程,在合成氨厂简称造气。气化所得的可燃气体称为煤气,进行气化的设备称为煤气发生炉(固体燃料气化器)。
③以空气和适量的水蒸气为气化剂,碳与氧、水蒸气同时反应,当空气和适量的水蒸气混合通过高温燃料层时,在气化层理同时发生碳与氧和碳与水蒸气的反应,虽然此时反应过程更加复杂,但是其反应过程、反应式及影响基本上与碳与氧和碳与水蒸气分别发生的情况一致。
(3)半水煤气的制造
半水煤气是生产合成氨的原料气,其生产方法可采用固定层间歇气化法或固定床连续气化法制备获得。当无论哪种方法,最终必须满足(CO+H2)/N2(体积比)为3.1~3.2的工艺要求。
碳与空气发生放热反应、与水蒸气发生吸热反应。
当系统维持自热平衡时,空气与水蒸气同时进行气化反应时,如不提供外部热源,则气化产物中 的含量大大低于合成氨原料气配比要求。
为解决气体成分与热量平衡这一矛盾,可采用下列方法。
化工工艺学答案

化工工艺学主编邓建强副主编张早校赵小玲北京大学出版社部分答案一览第三章硫酸工业一、1、C2、B3、A4、D5、C6、B第四章一、1、B2、C3、 D4、 C5、 B6、 A7、 C8、 A 二、4、反应热回收氨分离、惰性气体排放第五章1、A(题目有误,加“不”字)2、C3、D二、1、五氧化二磷转化率磷酸稳定、颗粒大2、二水硫酸钙半水硫酸钙3、磷酸??4、热能利用率高节能效果明显利用低品位5、五氧化二磷磷酸盐7水解作用络合作用催化作用高分子性8、四聚》三聚》络合》正磷酸盐第六章1、D2、A3、C4、B5、C6、D7、B8、C二、1、制备铵盐水制备碳酸化煅烧氨回收2、制碱合成氨7、合成冷却吸收第七章1、B2、C3、C4、B5、B6、D二、1、石蜡基、环烷基、中间基、超低硫、低硫、含硫、高硫、(?忘了)5、汽油产品质量芳烃9、均聚物、共聚物、均聚物第八章1、C2、B3、D4、C5、(不知道)6、A7、C二、1、气化炉、气化剂、供给热量2、气流床3、水蒸气、氧气4、真空闪蒸、离心分离器5、费托合成反应器、流化床反应器资料来源于个人作业答案,仅供参考,望能给各位同学以最大帮助。
2010.11.30。
2化学工艺学课件第三章1

同样的转化率,不受原料变化的影响。
③采用不同的工艺, n(O2)/n(SO2)值与总转化率 的对应关系不同; ④即同一个n(O2)/n(SO2)值,采用“3+2”流程对 应的总转化率大于“3+1”流程;而“3+1”流程大 于“2+2”流程。
●不同流程的转化率与起始原料浓度的关系
⑤同样要达到相同的总转化率,各工艺流 程所需的n(O2)/n(SO2)值不同。 ⑥例如总转化率达到99.7%时: ●“3+2”流程n(O2)/n(SO2)值为0.78; “3+1”流程n(O2)/n(SO2)值为1.06; “2+2”流程n(O2)/n(SO2)值为1.18; 即各流程允许的SO2浓度逐渐降低。
⑻.炉气组成不同选择流程的依据:
①当进转化炉的炉气中SO2<8.5%时, 选用“3+1”流程为宜。 ②若炉气SO2的浓度在8.5~11%或更高时, 选用“3+2”流程为宜。 ③对于SO2的浓度在22%以上时,应先 将其稀释至12%左右,再采用“3+2”流 程生产硫酸。
⑼.n(O2)/n(SO2)值对转化率影响: ①“二转二吸”工艺比“一转一吸”工艺允许 SO2的起始浓度可大幅提高。 ②在一定条件下,固定n(O2)/n(SO2)值,可获得
5.反应热的合理利用
⑴高废热能利用:利用反应热生产中、高压水蒸 气,带动空气压缩机和其他大功率泵作功,及用 来发电。 ⑵低废热能利用:利用其作为换热热源;作为高温 分离塔塔顶冷凝器的冷却剂,汽化后用作低温分离 塔塔釜再沸器的供热源,起到节能的效果 ⑶氧化尾气热能利用:其具有一定压力,放空前使 用膨胀透平机利用其热能带动鼓风机或泵做功。
xe
Kp Kp 1 p O2
化工工艺学3章
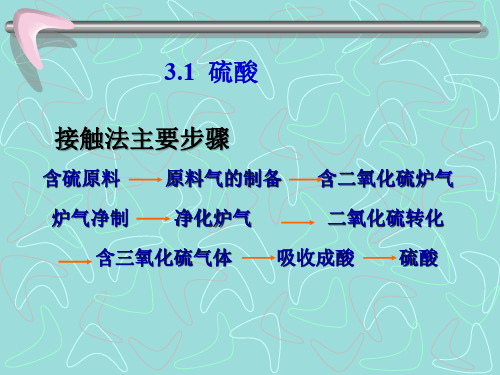
• 通常处理办法有: • 加碱中和:加石灰石等碱性物质中和并将砷氟等有害物质除去。 • 硫化中和:主要用于冶炼烟气产生的污酸处理。一般要先除去铅
再经硫化除去铜和砷,最后再中和清液达标排放。
3.2 硝 酸 (Nitric acid)
3.2.1 概 述
纯硝酸(100%HNO3)为无色液体,可使动物窒 息,有刺激性气味,常温下能分解:
2HNO3+NO = 3NO2+H2O
(12)
当气体中NO的氧化度达到70%80%时,即可进行吸收制酸
操作。
3.2.2.3 氮氧化物气体的吸收
• SO2催化氧化成SO3后,送入吸收工序用发烟硫酸或浓硫酸吸收,吸 收过程可写为:
• nSO3(g) + H2O(l) = H2SO4(aq) + (n-1)SO3(aq) • n>1时生成发烟硫酸, n=1时生成无水硫酸, n<1时生成含水硫酸。
• 3.1.5.1 发烟硫酸吸收过程的原理和影响因素
• 吸收过程中,(NH4)2SO3浓度下降,吸收能力下降,因此要不断补充氨, 保持操作稳定。
•
NH3(g) + NH4HSO3 = (NH4)2SO3
• 为了保持亚硫酸铵和亚硫酸氢铵的比例稳定,要移出部分母液去分解。
3.1.6.3 污酸污水污液的处理
• 前面已谈到,生产过程中必定有废酸、废水和废液,并且其中可 能含有少量砷、硒、氟等。绝不能随便排放,必须处理达标后才 能排放。若污水量大,治理成本较高,所以目前都推广环保型两 转两吸工艺。
3.1.4 二氧化硫的催化氧化 Catalyze-oxidation of SO2
3.1.4.1 化学平衡和平衡转化率
化学反应: SO2(g) + 0.5O2(g) = SO3(g) 3.1.4.2 二氧化硫催化氧化动力学 催化剂 目前主要用钒催化剂作二氧化硫催化氧化反应的催 化剂。其主要成份为V2O5(6~12%) ,另外还有氧化 钾、氧化钠作助催化剂,以二氧化硅作载体。
再经硫化除去铜和砷,最后再中和清液达标排放。
3.2 硝 酸 (Nitric acid)
3.2.1 概 述
纯硝酸(100%HNO3)为无色液体,可使动物窒 息,有刺激性气味,常温下能分解:
2HNO3+NO = 3NO2+H2O
(12)
当气体中NO的氧化度达到70%80%时,即可进行吸收制酸
操作。
3.2.2.3 氮氧化物气体的吸收
• SO2催化氧化成SO3后,送入吸收工序用发烟硫酸或浓硫酸吸收,吸 收过程可写为:
• nSO3(g) + H2O(l) = H2SO4(aq) + (n-1)SO3(aq) • n>1时生成发烟硫酸, n=1时生成无水硫酸, n<1时生成含水硫酸。
• 3.1.5.1 发烟硫酸吸收过程的原理和影响因素
• 吸收过程中,(NH4)2SO3浓度下降,吸收能力下降,因此要不断补充氨, 保持操作稳定。
•
NH3(g) + NH4HSO3 = (NH4)2SO3
• 为了保持亚硫酸铵和亚硫酸氢铵的比例稳定,要移出部分母液去分解。
3.1.6.3 污酸污水污液的处理
• 前面已谈到,生产过程中必定有废酸、废水和废液,并且其中可 能含有少量砷、硒、氟等。绝不能随便排放,必须处理达标后才 能排放。若污水量大,治理成本较高,所以目前都推广环保型两 转两吸工艺。
3.1.4 二氧化硫的催化氧化 Catalyze-oxidation of SO2
3.1.4.1 化学平衡和平衡转化率
化学反应: SO2(g) + 0.5O2(g) = SO3(g) 3.1.4.2 二氧化硫催化氧化动力学 催化剂 目前主要用钒催化剂作二氧化硫催化氧化反应的催 化剂。其主要成份为V2O5(6~12%) ,另外还有氧化 钾、氧化钠作助催化剂,以二氧化硅作载体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
煅烧
工业应用:
制备气\固原料 制碱工业.煅烧石灰石 CaO、CO2 生成产品 制碱工业.煅烧NaHCO3 Na2CO3 工业催化剂制造 使催化剂的组分转化为氧化物
煅烧物化基础
不可逆化学反应过程。
A(s)= S(s)+G(g)
分解反应的自由能表达为温度的函数,最
低分解温度产物的分压力达0.1MPa的分解 温度.
焙烧
分类与工业应用 氧化焙烧:硫铁矿、硫化铜、硫化锌 4FeS2+11O2=Fe2O3+8SO2
空气过剩系 数大
3FeS2+8O2=Fe3O4+6SO2
温度 高
硫酸化焙烧:
2MeS+3O2 == 2MeO+2SO2 2MeO+SO2+O2 == MeO.MeSO4 MeO. MeSO4+SO2+O2 == 2MeSO4 挥发焙烧:
BaSO4+ZnS
硝酸钾的生产
硝酸钾的生产
HNO3+KHCO3 KNO3 NaNO3+KCl KNO3+NaCl
贵
经剂效益差
NH4NO3+KCl
便宜
KNO3+NH4Cl
农用化肥
HNO3+KCl
KNO3+HCl
90
CaF2 H 2 SO4 2HF CaSO4
200 250
Na2Cr2O7 H 2 SO4 (浓) 2CrO3
190
BaCl2生产 BaSO (重晶石) BaS 热水 BaS(ag) HCl BaCl2 4
硼砂生产
2(MgO.B2O3 ) Na2CO3 CO2 Na2 B4O7 2MgCO3
1400˚C
水骤冷
Δ
→
干燥磨细
氟磷灰石
→ 羟基磷灰石 → Ca3(PO4)2
用硫酸分解磷矿制磷酸(湿法)
混酸 分两步:
生产工艺
三种硫酸钙的水合物结晶
总收率≤93%-97%
二水物法DH
总收率98%-98.5%
半水物-二水物法
总收率99%
二水物-半水物法 半水物HH法
硫酸
无回浆
工艺流程
氯化焙烧:氯化法制造钛白粉
还原焙烧:重晶石(硫酸钡)制硫化钡 BaSO4+2C 1000~1200˚C BaS+2CO2 还原剂常用的有:C、CO、H2 此外,还有S、N0、CH4 氧化钠化焙烧:
焙烧物化基础
优势区域相图确定 产物相区
焙烧速率影响的因素
温度
温度越高,焙烧速率也越快(控制在一定范围内,受 到焙烧物的熔结和设备损坏的限制)
煅烧设备
煅烧实例:
纯碱制造 NaHCO3 Na2CO3+CO2+H2O K=PH2O.PCO2
重碱、 小苏打
温度控制在165一190℃之间,完全分解所需时间为 30-50min
氨碱法苏尔维(S0lvay)法
1)CO2气和石灰乳的制备。煅烧石灰石制得石灰 和CO2,石灰消化制得石灰乳,合成氨厂提供 2)盐水的制备、精制和氨化,制得氨盐水; 3)氨盐水经碳化制重碱。氨盐水在碳化塔中与来 自石灰窑及重碱煅烧炉的CO2作用生成重碱: 原料的 NaCl十NH4OH十CO 2=NaHCO3十NH4Cl 准备 4)重碱的过滤和洗涤; 5)重碱煅烧制纯碱成品和CO2 6)母液中氨的蒸馏回收: 主体工艺 2NH4Cl十Ca(OH)2=2NH3 十CaCl2十H 2O
分类
按 溶 剂 种 类
①酸浸取 ②碱浸取 ③水浸取 ④盐浸取
浸取剂:硫酸、盐酸、硝酸、亚硫酸及其他 无机酸与有机酸 浸取剂:氢氧化钠、氢氧化钾、碳酸钠、 氨水、硫化钠、氰化钠及有机碱类 浸取剂:氯化钠、氯化铁、硫酸铁、氯化 铜等无机盐类
硼矿化学加工 莹石化学加工 铬酸酐生产
硼矿 H2SO 4 H3BO3
磷矿的磨碎
→浸取
→料浆的冷却
→过滤
→回磷酸系统
→浓缩→含氟气体源自吸收→再结晶工艺要求
最大的P2O5利用率 最低的H2SO4用量
生产工艺条件
(1)液相S03浓度
二水物制湿法磷酸:so3控制在ρ(so3 )=0.015~0.025g/mL
(2)反应温度
二水物流程反应:65—80℃ 半水物:95—105℃
几点
某些物质先热处理后再浸取 提高易溶组分的溶解度和扩散速率 浸取剂的影响 逆流操作
浸取设备
工艺实例:磷酸的制备(湿法)
热法制 磷酸?
烧结工业应用: 烧结脱氟磷肥 热法磷肥 烧结钙钠磷肥
烧结钙镁磷肥
1350-1500˚C
1.钙镁磷肥
磷矿+MgSiO3
2.脱氟磷肥
→熔融 →
粒度
焙烧速率在很大程度上取决于气—固相间接触表面的 大小
氧含量
平均粒度O.07—3.0 mm
焙烧设备
焙烧工艺实例
主体设备
由硫酸纳制取硫化纳(sodium sulfide)
Na2SO4十CH4=Na2S十2CO2+2H2O Na2SO4十4CO=Na2S十4CO2 Na2SO4十4H2=Na 2S十4H2O
硼矿
可熔性硼盐 不溶性碳酸盐
泡化碱生产
SiO2 NaOH Na2 SiO3 H 2O
NaF
CaF2 Na2CO3 SiO2 2NaF CaSiO3 CO2
浸取剂的选择
选择性 溶解度大 物性 价格 安全
浸取速率的影响因素
温度 浸取剂 粒径 浓度 孔隙率 搅拌
第三章
无机化工单元工艺
无 机 化 工 工 艺
硫酸工业 (三酸) 纯碱工业 Na2CO3 氯碱工业
H2SO4 HNO3 HCL H3PO4
NaOH CL2 H2
NH3
无机化学工业
合成氨工业 化肥工业
N、P、K 肥及复合肥复混肥料、稀土、
生物等;
化工矿物的加工
无机盐工业
本章主要:化工矿物固相加工单元工艺
工业应用:钾肥、复肥、无机盐工业
KCl+NaNO3 KNO3+NaCl
K2SO4+2MgSO4+4KCl
无水钾镁矾 KCL 反应器
K2SO4
K2SO4+2MgCl2
水
干燥
过滤 蒸发 结晶
KCl+钾镁矾
过滤
MgCl2母液
四元体系相图
利用四元体系相图对复分解过程中的溶解、结晶、加 热、冷却、蒸发、稀释等操作进行分析,确定合理流 程和操作条件。 N K D1 D
KNO3
KCl
n(k) n(k+Na)
E
75℃ 25℃
A A1
O
F F1
n(水l) n(总盐量)
E1
C a b
C
E1
y C
b
25℃ x 75℃
·
E
F1
F
NO3-
NaCl
B1
n(Cl) n(Cl+NO3)
L
NaNO3 M Cl干盐图
B
O
水图
复分解实例
锌钡白的生产
BaSO4.ZnS
(用量最大的白色颜料)
湿法化学加工:用酸、碱对化学矿的 浸取
固相化学加工 单元工艺类型
热法化学加工:焙烧、煅烧、烧结
复分解或置换反应:复分解或者置 换反应工艺,对固相原料化学转化。
无机化工生产流程
化学矿物的固相加工生产一般包括:
原料准备 化学矿的热处理: 化学矿的浸取: 过滤 溶液的精制:
提纯。蒸馏、吸附、萃取、离子交换、沉淀、结晶
浸取
浸取:应用溶剂将固体原料中可溶组分
提取出来的单元过程。
不溶固体
浸取剂 工业应用 浸取剂的选择 预处理 浸取条件、速率 浸取设备
载体、惰性物质
工业应用
无机盐工业 磷肥工业 有机化工 医药工业
用硫酸或氨溶液从含铜矿物中得到铜, 金属矿物 ----金属 用氰化钠溶液从含金矿石中提取金. 低品位磷矿粉---磷酸盐 铬,硼,钛,钡等盐类均需从矿石中浸取 亚麻籽壳放入水中----酮 米糠浸取植酸钙制取植酸 用极性溶剂从茶叶中浸取生产茶多酚
破碎、磨细、筛分、精选 焙烧、煅烧、烧结 物理浸取或化学浸取,有效组分进溶液
蒸发
结晶 干燥 哪些是物理 过程?化学 过程?
焙烧、煅烧、烧结
焙烧:矿石、精矿在低于熔点的高温下,与空气、 氯气、氢气等气体或添加剂起反应,改变其化学 组成与物理性质的过程。 煅烧:将固体物料在低于熔点的温度下加热分解, 除去CO2、水分或SO3等挥发性物质的过程。 烧结:固相化学矿物配加其他氧化和还原剂,并 添加助熔剂,(石灰、纯碱、硫酸钠、亚硫酸钠等 烧结剂)在高于炉料熔点下发生化学反应的过程。 注意三者之间区别?
循环工艺
纯碱生产流程图
循环
循环
制原料、煅烧
烧结
工业应用: 热法磷肥
烧结脱氟磷肥
烧结钙钠磷肥 烧结钙镁磷肥 熔融 水骤冷 干燥
1.钙镁磷肥 磷矿+MgSiO3 磨细
1350-1500˚C
2.脱氟磷肥 氟磷灰石
1400˚C
羟基磷灰石
Δ
Ca3(PO4)2
熔融
比烧结更高的温度下进行 石英玻璃 石英制品 矾土 电融刚玉 耐火材料 熔剂 烧结剂 作用:降低炉料形成熔体的温 度,节能作用
