铁盐和亚铁盐的相互转化习题
亚铁盐与铁盐的相互转化

亚铁盐与铁盐的相互转化
亚铁盐和铁盐是两种常见的铁化合物,在一定条件下,它们可以相互转化。
亚铁盐指的是铁的+2氧化态,例如亚铁离子(Fe2+)。
铁盐包括铁的不同氧化态,如三价铁(Fe3+)的盐,例如三氯化铁(FeCl3)。
在适当的条件下,亚铁盐和铁盐之间可以通过氧化还原反应相互转化。
以下是一些常见的亚铁盐和铁盐的相互转化示例:
1.亚铁盐氧化为铁盐: 2Fe2+ + O2 -> 2Fe3+
在有氧条件下,亚铁盐可以被氧气氧化为三价铁盐。
这是一个电子转移过程,其中亚铁离子(Fe2+)失去电子变为三价铁离子(Fe3+)。
2.铁盐还原为亚铁盐: 2Fe3+ + 2e- -> 2Fe2+
在还原条件下,三价铁盐可以接受电子并还原为二价亚铁盐。
这个反应是亚铁离子(Fe2+)接受电子,将三价铁(Fe3+)还原为二价亚铁(Fe2+)。
需要注意的是,亚铁盐和铁盐的相互转化取决于氧化还原反应的条件和环境。
例如,氧气、光、温度和pH值等因素都可以影响这些反应的进行。
此外,不同的铁化合物可能在不同的条件下发生转化,因此具体的反应条件需要根据具体的化合物和反应进行调整。
铁盐和亚铁盐的相互转换
• [资料在线] 亚硝酸盐在血液中能与Fe2+反应 生成Fe3+使血红蛋白丧失携氧功能,导致组 织缺氧,最后使呼吸中枢麻痹、窒息死亡。
• [问]发生亚硝酸盐中毒,如何急救?请给出 急救方案
中毒的早期,毒物还在胃内,可以洗胃。呼吸 困难时可以输氧、输液和补充维生素C等。
含铁食品
实验桌上放有一瓶久置的待测液,为验证FeCl2 溶液的变质情况,请同学们利用实验桌上已有
C、H2、CO等
认真观察右图硫酸亚铁溶液的试剂瓶底 部,你觉得是什么?为什么这样子做?
答:底部放的是铁粉。 目的:防止Fe2+被氧化成Fe3+
Fe+2Fe3+=3Fe2+
• 硫酸亚铁片 【主要成分】乳酸亚铁、维生素C
维生素C作用是:作还原剂。
使较难被吸收的三价铁 还原为易吸收的二价铁, 促进肠道内铁的吸收。
的实验试剂及仪器进行鉴别,并完善以下猜测:
猜测1:溶液没有变质,没有 离子,其使用的试剂
是
,现象为
。
猜测2:溶液已变质,含有 离子,其使用的试剂
是
,现象为
。
猜测3:溶液已部分变质,含有 、 离子,其使用的
试剂及顺序是
,现象为
。
阅读:资料卡片——铜盐
图 3-21 出土的古代铜制品上往往覆盖着一层 铜绿[主要成分是Cu2(OH)2CO3]
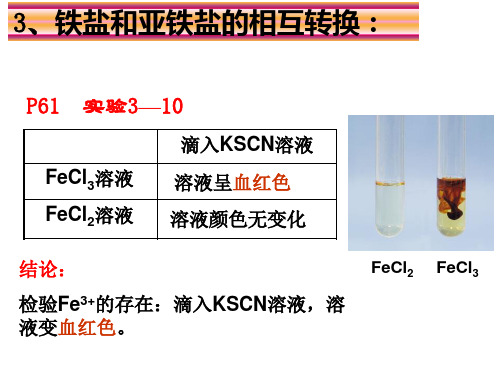
3、铁盐和亚铁盐的相互转换:
P61 实验3—10
滴入KSCN溶液
FeCl3溶液 FeCl2溶液
溶液呈血红色 溶液颜色无变化
结论:
检验Fe3+的存在:滴入KSCN溶液,溶 液变血红色。
FeCl2
FeCl3
高中化学(新人教版)必修第一册课后习题:铁盐和亚铁盐(课后习题)【含答案及解析】

铁盐和亚铁盐课后篇素养形成合格考达标练1.将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是()A.稀硫酸B.高锰酸钾C.氯化锌D.氯化铜Fe2+,选项中物质只有高锰酸钾能将Fe2+氧化成三价铁(Fe3+)。
2.某溶液中,滴加KSCN溶液时无明显现象发生,再滴入少量氯水,溶液立即显红色。
则原溶液中一定含有的是() A.Fe2+ B.Fe3+ C.K+ D.N H4+解析某溶液中加入KSCN溶液无明显现象,再滴加氯水,溶液立即变为红色,说明原溶液含有亚铁离子,加入氯水发生反应2Fe2++Cl22Fe3++2Cl-,生成的铁离子和SCN-生成红色溶液。
3.(2020江苏南通高一检测)下列各组物质反应后,再滴入KSCN溶液,显红色的是()A.过量铁与稀盐酸B.过量氯水与FeCl2溶液C.过量铁粉与CuCl2溶液D.过量铁粉与FeCl3溶液,生成的是亚铁离子,滴入KSCN溶液,溶液不会显红色,故A错误;氯水能将亚铁离子氧化成铁离子,滴入KSCN溶液,显红色,故B正确;铁粉过量,铁置换出铜,同时生成亚铁离子,滴入KSCN溶液,溶液不会显红色,故C错误;过量铁粉与氯化铁溶液反应生成的是氯化亚铁,溶液中不存在铁离子,滴入KSCN溶液,溶液不会显红色,故D错误。
4.下列物质反应后一定有+3价铁生成的是()①过量的Fe与Cl2反应②Fe与过量稀硫酸反应③FeCl2溶液中通入少量Cl2④Fe和Fe2O3的混合物溶于盐酸中A.只有①B.只有①③C.只有①②③D.①②③④中Cl2氧化性较强,它能将铁由0价氧化为+3价,由于不是在溶液中反应,因此过量的铁不会将氯化铁还原。
②中Fe与稀硫酸反应只能生成Fe2+。
③在溶液中Fe2+被Cl2氧化生成Fe3+。
④中发生Fe与盐酸生成FeCl2、Fe2O3与盐酸生成FeCl3的反应,但题中未给出反应物间相对量的关系,若铁是过量的,则能将生成的FeCl3全部还原为FeCl2。
5.下列除杂的操作正确的是()A.MgCl2溶液中混有少量FeCl3:加入足量Fe充分反应后过滤B.FeCl2溶液中混有少量FeCl3:加入过量铁粉充分反应后过滤C.CuCl2溶液中混有少量FeCl3:加入NaOH溶液充分反应后过滤D.CuCl2溶液中混有少量FeCl3:先加入过量Cu粉将Fe3+还原成Fe2+,再过滤3溶液中加入足量Fe,能除去Fe3+,但引入Fe2+,A错误;加入过量铁粉,FeCl3与Fe反应生成FeCl2,充分反应后过滤除去剩余铁粉,从而达到除杂的目的,B正确;C项中加入NaOH溶液,Cu2+、Fe3+均转化成氢氧化物沉淀,不符合除杂要求,C错误;D项中Cu与Fe3+反应生成Fe2+和Cu2+,但无法除去Fe2+,D错误。
铁盐和亚铁盐的相互转化习题

其中F是一种红褐色的物质,试解答下列各题: Fe3O。 ⑴写出下列物质的化学式:A Fe ,B 4 ⑵用化学方程式表示下列转化过程: (SO4)3+4H2O ①B+G: Fe3O4+4H2SO4=FeSO4+Fe2 。 ②I→F:4Fe(OH)2+O2+2H2O=4Fe(OH)3 。 ⑶G是 ;每生成1molE同时生成与其相对应的H 稀硫酸 的物质的量为 mol。 1/2
有200mL氯化镁和氯化铝的混合溶液,其中
c c
(Mg2+)为0.2mol· L-1,
(Cl-)浓度为1.3mol· L-1。要使Mg2+ 全部转化为沉淀分离出来,至少需加 4mol· L-1NaOH溶液的体积为
将单质Fe、Cu与FeCl3、FeCl2、CuCl2一起放进某 容器,根据下列不同情况填写:
(1)充分反应后如果Fe 有剩余, 则容器中不可能 3+、Cu2+ Fe 含有________ (2)充分反应后如果Cu有剩余,溶液中还有较多 3+、Fe Fe 的Cu2+。则容器中不可能含有________ (3)溶液中Fe3+有剩余,则容器中还含有 2+、Fe2+ Cu Fe 、 Cu ________,一定无________.
不能通过化合反应制取的是 (B ) A.Fe(OH)3 B.Fe(SCN)3 C.Fe(NO3)2 D.FeI2
将适量铁粉放入氯化铁溶液中 ,完全反应后,溶液中Fe3+和 Fe2+浓度相等,则已反应的Fe3+ 和未反应的Fe3+的物质的量之比 为( ) A A.2:3 B.3:2 C.1:2 D.1:1
某溶液中有NH4+、Mg2+、Fe2+和Al3+ 四种离子,若向其中加入过量的氢 氧化钠溶液,微热并搅拌,再加入 过量盐酸,溶液中大量减少的阳离 子是( AC ) A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
高中化学必修一 专题第3章第1节 铁盐与亚铁盐解析版)

第三章铁金属材料第一节铁及其化合物第3课时铁盐与亚铁盐一、单选题1.能将溶液中的转化成的物质是()A.B.NaOH C.D.【答案】A【解析】A. 与铁离子发生氧化还原反应生成亚铁离子和铜离子,A选;B. NaOH与铁离子反应生成氢氧化铁沉淀,得不到亚铁离子,B不选;C. 与铁离子不反应,C不选;D. 与铁离子反应生成络合物,溶液显红色,得不到亚铁离子,D不选;答案选A。
2.工业盐酸常因混有杂质而呈黄色,该杂质是( )A.NaCl B.MgCl2C.FeCl3D.ZnCl2【答案】C【解析】盐酸有可能与管道反应生成Fe2+,Fe2+易被氧化为Fe3+呈黄色,工业盐酸常因混有FeCl3杂质而呈黄色,答案选C。
3.关于铁及其化合物,下列说法正确的是( )A.灼热的Fe与Cl2反应生成FeCl2B.FeO不能被任何还原剂还原C.向溶液中滴加KSCN溶液可检验溶液中是否含有Fe3+D.向FeSO4溶液中滴加NaOH溶液可得到纯净的Fe(OH)2沉淀【答案】C【解析】A.Cl2氧化性强,灼热的Fe与Cl2反应生成FeCl3,故A错误;B.FeO可被CO等还原剂还原,故B错误;C.向溶液中滴加KSCN溶液,溶液变成血红色,可确定溶液中含有Fe3+,故C正确;D.Fe(OH)2还原性较强,因为空气中的氧气、溶液中溶解的氧气等因素,向FeSO4溶液中滴加NaOH溶液很难得到纯净的Fe(OH)2沉淀,故D错误;故选C。
4.下列除杂方法或对应方程式错误的是【答案】C【解析】A.过量的Fe粉能与CuCl2溶液反应生成氯化亚铁溶液和铜,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确;B.水溶后通过量CO2,发生反应:Na2CO3+CO2+H2O= 2NaHCO3,结晶,过滤可以除去固体NaHCO3中的少量Na2CO3,故B正确;C.会引入新杂质氢氧化钠,应直接加热,故C错误;D.过量的Fe粉能与FeCl3溶液反应生成氯化亚铁溶液,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故D正确;故选C。
高二化学亚铁盐与铁盐的相互转化专题辅导

高二化学亚铁盐与铁盐的相互转化+3Fe 具有氧化性:+-+→+23Fe e Fe ;+2Fe 具有还原性:+-+→-32Fe e Fe一、铁盐与还原性物质反应可转化为亚铁盐1. 铁盐可与金属反应转化为亚铁盐金属活动性顺序表中铜以前的金属都可以与铁盐溶液反应。
但要注意非常活泼的金属(K 、Ca 、Na )是与水反应。
如:++++=+223Cu Fe 2Cu Fe 2;++=+23Fe 3Fe Fe 2;++++=+223Zn Fe 2Zn Fe 2;++++=+223Mg Fe 2Mg Fe 22. 铁盐可与某些金属阳离子反应转化为亚铁盐铁盐只有与还原性很强的金属阳离子反应才能生成亚铁盐。
如:+++++=+4223Sn Fe 2Sn Fe 23. 铁盐可与某些阴离子反应转化为亚铁盐铁盐能与还原性很强的阴离子反应生成亚铁盐。
卤素阴离子中只有-I 可与铁盐反应。
223I Fe 2I 2Fe 2+=++-+;↓+=++-+S Fe 2S Fe 22234. 铁盐可与某些氧化物反应转化为亚铁盐+-++++=++H 4SO Fe 2O H 2SO Fe 22422235. 铁盐可与某些氢化物反应转化为亚铁盐 ++++↓+=+H 2S Fe 2S H Fe 2223二、亚铁盐与氧化性物质反应可转化为铁盐1. 亚铁盐可与某些非金属单质反应转化为铁盐卤素单质中的2F 虽可与亚铁盐溶液反应,但首先是与水反应;2I 不能氧化+2Fe 。
-+++=+Cl 2Fe 2Cl Fe 2322;-+++=+Br 2Fe 2Br Fe 2322;O H 2Fe 4H 4O Fe 42322+=+++++;O H 3Fe 6H 6O Fe 62332+=+++++2. 亚铁盐可与某些酸反应转化为铁盐↑++=++++-+NO O H 2Fe 3H 4NO Fe 323323. 亚铁盐在酸性条件下可与某些阴离子反应转化为铁盐 O H 7Fe 6Cr 2H 14O Cr Fe 62332722++=+++++-+;O H 4Fe 5MnH 8MnO Fe 523242++=+++++-+ 4. 亚铁盐可与某些化合物反应转化为铁盐O H 2Fe 2H 2O H Fe 223222+=+++++三、亚铁盐与铁盐转化题例解析例1:除去3FeCl 溶液中混有的少量2FeCl 的试剂为_________,化学方程式为________。
高中化学必修一:铁的多样性-铁盐和亚铁盐的相互转变(考点卡片+练习题)

3.1 铁的多样性-铁盐和亚铁盐的相互转变考点卡片1.铁盐和亚铁盐的相互转变【考点归纳】一、Fe2+、Fe3+离子Fe2+[FeSO4]Fe3+[Fe2(SO4)3] 溶液中颜色浅绿色棕黄色化学性质氧化剂HNO33Fe2++4H++NO﹣3=3Fe3++2H2O+NO↑不反应O3、H2O2将Fe2+氧化成Fe3+还原剂Na2S Fe2++S2﹣=FeS↓2Fe3++S2﹣(少)=2Fe2++S↓2Fe3++3S2﹣(过)=2FeS↓+S↓H2S不反应2Fe3++S2﹣(少.过)=2Fe2++S↓小结①FeS能溶于硫酸、盐酸②CuS不溶于稀硫酸、盐酸;但能溶于具有强氧化性的硝酸HI不反应2Fe3++2I﹣=2Fe2++I2不反应总结①Fe2+具有还原性,易被氧化;加入氧化剂,溶液由浅绿色变为棕黄色②Fe3+具有强氧化性,可以氧化还原性较强的物质③Cu2+相对稳定,不具有强氧化性,也不具有强还原性NaOH溶液反应Fe2++2OH﹣=Fe(OH)2↓4Fe(OH)2+O2+2H2O=4Fe(OH)3Fe3++3OH﹣=Fe(OH)3↓现象先生成白色沉淀,迅速变成灰绿色,最终变成红褐色生成红褐色沉淀水溶液中稳定性水解水解;易被氧化变质水解Fe2++2H2O Fe(OH)2+2H+如绿矾净水(再被氧化为Fe(OH)3)Fe3++3H2O Fe(OH)3+3H+Fe(OH)3胶体具有吸附性,可用于净化水讨论若将它们的水溶液蒸干得到什么物质?灼烧呢?双水解CO32﹣、AlO2﹣、HCO3﹣离子共存①酸性:MnO4﹣、NO3﹣、ClO﹣等不能共存;②与OH﹣、S2﹣等①与S2﹣、SO32﹣、I﹣;②与OH﹣;③与CO32﹣、HCO3﹣、AlO2﹣;④与SCN﹣.保存①加入少量铁粉,防止被氧化②滴入少量硫酸(对应酸)抑制水解滴入少量硫酸(对应酸)抑制水解离子的检验、鉴别观察法溶液呈浅绿色溶液呈棕黄色碱液法(NaOH、氨水等)先生成白色沉淀,又迅速转变为灰绿色,最后变成红褐色生成红褐色沉淀SCN﹣法无明显现象溶液呈血红色H2S法有浅黄色沉淀析出(或变浑浊)苯酚法溶液呈紫色淀粉﹣KI法淀粉﹣KI试纸变蓝色KMnO 4溶液(溴水)法能使紫色(橙红色)褪去 不褪色 铜片法无明显现象 溶液逐渐变为蓝绿色、铜片逐渐减小2、“铁三角”:3、反应网络四、涉及铁及其化合物的几个与量有关的离子方程式1.铁与稀HNO 3反应:(1)Fe+4HNO 3=Fe (NO 3)3+NO ↑+2H 2O ①(2)3Fe+8HNO 3=3Fe (NO 3)2+2NO ↑+4H 2O ②(3)2Fe (NO 3)3+Fe =3Fe (NO 3)2 ③1°当时,按反应①进行;2°当时,按反应②进行;3°当时,则反应①、②都发生.上述反应可以认为先发生反应①,若有Fe剩余则发生③,合并①、③即可得到反应②,所以无论是反应①还是反应②,被还原的HNO3都占参与反应HNO3的.5.硫酸亚铁的制备【知识点的知识】一、硫酸亚铁的制备实验1.硫酸亚铁的制备原理稀硫酸与铁屑反应,经沉淀结晶,脱水即得到硫酸亚铁,其反应式如下:Fe+H2SO4═FeSO4十H2↑2.硫酸亚铁的制备实验步骤1)将废铁屑放入盛有热烧碱液的烧杯中洗涤2次,用玻璃棒搅拌,滤去碱液,用蒸馏水洗净。
铁盐与亚铁盐

铁盐和亚铁盐学习目标:1.了解铁盐与铝盐的净水原理,识记铜绿的生成方程式。
2.掌握Fe2+、Fe3+的检验方法及相互转化,能够熟练书写相关离子化学方程式。
3.形成探索化学奥秘的科学素养,能够体会化学学科之美。
预学案(相信聪明的你15分钟可以自主完成)一、按要求写出下列离子化学方程式:1.Fe3O4与盐酸反应: 1.Fe3O4+8H+=2Fe3++Fe2++4H2O2. Fe(OH)3与盐酸反应: 2. Fe(OH)3+3H+=Fe3++3H2O3.FeCl3溶液与KSCN溶液反应: 3.Fe3++3SCN-=Fe(SCN)34. FeCl3溶液与铁粉反应: 4. 2Fe3++ Fe=3 Fe2+5. FeCl3溶液与铜粉反应: 5. 2Fe3++ Cu=2 Fe2++ Cu2+二、关于铜盐的性质:1.物理性质:铜绿的主要成分是2.化学性质:①铜的化学性质②使蛋白质③识记形成铜绿的化学方程式:2Cu+O2+CO2+H2O=Cu2(OH)2CO33.根据下面离子方程式分析铝盐和铁盐的净水原理,并总结二者异同点:Al3+ + 3H 2O Al(OH)3(胶体) + 3H+Fe3+ + 3H 2O Fe (OH)3(胶体) + 3H+3.Al(OH)3(胶体)和Fe (OH)3(胶体)都具有吸附作用,可用于沉淀净水,另外,Fe3+还由于具有强氧化性,还有消毒作用。
探究案(有疑问就有进步)探究一:请用以下药品设计一个可以证明Fe2+与Fe3+可以相互转化的实验:FeCl3溶液、KSCN溶液、氯水、铁粉。
探究二:请用以下药品设计一个可以证明Fe3+可以与铜反应的实验:FeCl3溶液、KSCN溶液、铜粉。
探究三:如何验证一瓶溶液中既有Fe2+又有Fe3+(提示:可利用酸性高锰酸钾的强氧化性及本身的颜色):随堂练习(相信你一定可以轻松完成这些题目):1.配制FeSO4溶液时,为什么要往溶液中加入少量铁粉和稀硫酸?2.总结检验Fe2+和Fe3+的常用方法:3.要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作的最佳顺( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
下列物质反应后一定会有+3价铁生成的是:
①过量的铁与Cl2反应
√ √
②Fe与过量稀硫酸反应再向其中加入 KNO3
③Fe(NO3)2溶液中加入少量盐酸
④Fe和Fe2O3的混合物溶于盐酸中
单质A在适宜条件下有如下流程图所示的一系列转化:
有200mL氯化镁和氯化铝的混合溶液,其中
c c
(Mg2+)为0.2mol· L-1,
(Cl-)浓度为1.3mol· L-1。要使Mg2+ 全部转化为沉淀分离出来,至少需加 4mol· L-1NaOH溶液的体积为
鉴 别方 法
Fe
2
Fe
3
棕 黄 色 直接观色 浅绿色 显 利 色 与KSCN 不显红色,再通 血 红 色 Cl2出现血红色。 用反 应 利的 与铜片 Cu腐蚀溶液绿色 无明显现象 氧 用 化 淀 粉KI 试 纸 试纸不变蓝 试纸变蓝色 3 Fe 性 酸性 不褪色 紫色褪去
KMnO4
利用沉淀反应
某溶液中有NH4+、Mg2+、Fe2+和Al3+ 四种离子,若向其中加入过量的氢 氧化钠溶液,微热并搅拌,再加入 过量盐酸,溶液中大量减少的阳离 子是( AC ) A.NH4+ B.Mg2+ C.Fe2+ D.Al3+
下列离子方程式正确的是 ( ) A.Fe3++3SCN- = Fe(SCN)3↓ B.FeBr2溶液中通入足量氯气 2Fe2++2Br-+2Cl2 = 2Fe3++Br2+4ClC. Fe3O4与HCl Fe3O4+8H+=2Fe3++Fe2++4H2O D. Fe2O3与HI Fe2O3+6H+=2Fe3++3H2O
不能通过化合反应制取的是 (B ) A.Fe(OH)3 B.Fe(SCN)3 C.Fe(NO3)2 D.FeI2
将适量铁粉放入氯化铁溶液中 ,完全反应后,溶液中Fe3+和 Fe2+浓度相等,则已反应的Fe3+ 和未反应的Fe3+的物质的量之比 为( ) A A.2:3 B.3:2 C.1:2 D.1:1
将单质Fe、Cu与FeCl3、FeCl2、CuCl2一起放进某 容器,根据下列不同情况填写:
(1)充分反应后如果Fe 有剩余, 则容器中不可能 3+、Cu2+ Fe 含有________ (2)充分反应后如果Cu有剩余,溶液中还有较多 3+、Fe Fe 的Cu2+。则容器中不可能含有________ (3)溶液中Fe3+有剩余,则容器中还含有 2+、Fe2+ Cu Fe 、 Cu ________,一定无________.
其中F是一种红褐色的物质,试解答下列各题: Fe3O。 ⑴写出下列物质的化学式:A Fe ,B 4 ⑵用化学方程式表示下列转化过程: (SO4)3+4H2O ①B+G: Fe3O4+4H2SO4=FeSO4+Fe2 。 ②I→F:4Fe(OH)2+O2+2H2O=4Fe(OH)3 。 ⑶G是 ;每生成1molE同时生成与其相对应的H 稀硫酸 的物质的量为 mol。 1/2
