超氧阴离子产生速率测定
抗氧化酶(SOD、POD、CAT)活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)L磷酸缓冲液(PBS,:A母液:L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量)71.7g;B母液:L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量)31.2g。
分别用蒸馏水定容到1000ml。
L PBS()的配制:分别取A母液(Na2HPO4) ,B母液(NaH2PO4) ,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)甲硫氨酸溶液:取 Met用磷酸缓冲液()定容至1000ml。
(3)30μM EDTA-Na2溶液:取用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)氮蓝四唑(NBT)溶液:取 NBT用PBS定容至100ml,避光保存。
酶液制备:取(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入 50mmol/L预冷的磷酸缓冲液()在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液,磷酸缓冲液,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
(4)以不照光的对照管(只有缓冲液并置于暗处)调零后,避光测OD560(出现颜色即可测定)。
(5)酶活性计算:SOD活性单位以抑制NBT光化还原50%所需酶量(测的样品值要在最大管的一半左右才合适,否则要调整酶量)为1个酶活单位(u)。
抗氧化酶(SOD、POD、CAT)活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)14.5mM甲硫氨酸溶液:取2.1637g Met用磷酸缓冲液(pH7.8)定容至1000ml。
(3)30μM EDTA-Na2溶液:取0.001gEDTA-Na2用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取0.0023g核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)2.25mM 氮蓝四唑(NBT)溶液:取0.1840g NBT用PBS定容至100ml,避光保存。
酶液制备:取0.2g(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入1.6ml 50mmol/L预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液0.6ml,磷酸缓冲液5.4ml,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
巯基乙胺修饰电极法测定植物体内超氧阴离子自由基

巯基乙胺修饰电极法测定植物体内超氧阴离子自由基王燕*陈蓁蓁(山东师范大学化学化工与材料科学学院,济南250014)摘 要 盐酸羟胺与超氧阴离子自由基反应生成NO -2,通过检测NO -2的生成量,可间接测定超氧阴离子自由基。
基于上述原理,建立了一种用巯基乙胺自组装修饰金电极测定生物体系中超氧阴离子自由基的新方法。
实验结果表明,在p H 4.8的HA c -N a A c 缓冲溶液中,修饰电极对NO -2的氧化具有良好的电催化作用,差分脉冲溶出伏安法测定其氧化峰电流与NO -2的浓度在5.0@10-8~1.0@10-4m o l/L 范围内呈线性关系,其线性回归方程为i pa (L A )=3.726C (L mo l/L)+0.0257,相关系数为0.9983;检出限为1.0@10-8m ol/L 。
该法用于玉米幼苗和叶片中超氧阴离子自由基产生速率的测定,结果令人满意。
关键词 超氧阴离子自由基,化学修饰电极,巯基乙胺,差分脉冲溶出伏安法2008-04-02收稿;2008-05-28接受本文系山东省自然科学基金(No .Y2006B28)资助项目*E-m ai:l f agong @sdu .edu .cn1 引 言在生物体的氧化代谢过程中会产生大量的活性氧自由基,它们具有很强的氧化能力,可以损伤生物膜的结构及功能,引起核酸及蛋白质变性,从而对细胞及组织产生十分有害的生物学效应。
其中超氧阴离子自由基(O 2#-)是生物体中第一个生成的氧自由基,它既能与体内的活性物质直接作用,又能经过一系列反应转化生成H 2O 2、羟自由基(#OH )、单线态氧(1O 2)等其它的氧自由基,具有更大的危害性,可引起各类疾病[1]。
因此,生物体系中超氧阴离子自由基的检测,对于研究自由基的生物学作用及其清除机理具有重要意义。
目前超氧阴离子自由基的检测方法有电子自旋共振法、荧光法、光度法、电化学法和化学发光法等[2~7]。
一定强度的UVC辐射对玉米幼苗活性氧成分及抗氧化系统的影响

一定强度的UVC辐射对玉米幼苗活性氧成分及抗氧化系统的影响卜婷;刘灵霞;杨建霞;鲜盼盼【摘要】Through a certain intensity UVC irradiation,we detected the change of some reactive oxygen species and antioxidant enzyme activity in corn leaves,then explored the possible mechanism for the corn seeding response to UVC irradiation. Corn seeding was continuously exposed to UVC for 5 days (5hrs/d),O2- generation rate,H2 O2 content,SOD activity,CAT activity and POD activity were measured as follows:when the corn seeding was irradiated by UVC alone,O2- generation rate promoted significantly(P﹤0. 01),SOD activity,H2O2 content and POD activity all reduced significantly(P﹤0 . 01 ),CAT activity had no obvious change;when the corn seeding was exposed to daylight and UVC simultaneously,O2- generation rate kept promoting(P ﹤0. 01),SOD activity kept reducing(P ﹤0.01),H2O2content and POD activity suggested promotion(P﹤0. 01),CAT activity reduced signifi-cantly( P﹤0 . 01 ). The results indicated that the damage in corn seedlings caused by UVC irradiation mainly comes fromO2-,mixed light can aggravate the damage. The mixed light can inducedH2 O2 con-tent promotion which would be removed by CAT. The mixed light radiation is not an effective measure to reduce the negative effect in corn seeding caused by UVC.%通过一定强度UVC照射,对玉米幼苗叶片内几种活性氧成分及几种抗氧化酶的活性变化进行检测,以探究玉米幼苗对UVC照射进行应答的可能机理。
抗氧化酶SODPODCAT活性测定方法

抗氧化酶(SOD、POD、CAT)活性测定方法一、超氧化物歧化酶(SOD)活性测定(氮蓝四唑光化还原法)1、试剂的配制(1)0.05mol/L磷酸缓冲液(PBS,pH7.8):A母液:0.2mol/L磷酸氢二钠溶液: 取Na2HPO4·12H2O(分子量358.14)71.7g;B母液:0.2mol/L磷酸二氢钠溶液:取NaH2PO4·2H2O(分子量156.01)31.2g。
分别用蒸馏水定容到1000ml。
0.05mol/L PBS(pH7.8)的配制:分别取A母液(Na2HPO4) 228.75ml,B母液(NaH2PO4) 21.25ml,用蒸馏水定容至1000ml。
参考文献:李合生主编:植物生理生化实验原理和技术.高等教育出版社,2000:267~268。
(2)14.5mM甲硫氨酸溶液:取2.1637g Met用磷酸缓冲液(pH7.8)定容至1000ml。
(3)30μM EDTA-Na2溶液:取0.001gEDTA-Na2用磷酸缓冲液定容至100ml。
(4)60μM核黄素溶液:取0.0023g核黄素用磷酸缓冲液定容至100ml,避光保存。
(5)2.25mM 氮蓝四唑(NBT)溶液:取0.1840g NBT用PBS定容至100ml,避光保存。
酶液制备:取0.2g(可视情况调整)样品(新鲜叶片或根系)洗净后置于预冷的研钵中,加入1.6ml 50mmol/L预冷的磷酸缓冲液(pH7.8)在冰浴上研磨成匀浆,转入离心管中在4℃、12000g下离心20min,上清液即为酶液。
2、酶活性测定(1)反应混合液配制(以60个样为准):分别取Met溶液162ml,EDTA-Na2溶液0.6ml,磷酸缓冲液5.4ml,NBT溶液6ml,核黄素溶液6ml,混合后摇匀;(2)分别取3ml反应混合液和30μl酶液于试管中(3)将试管置于光照培养箱中在4000 lux光照下反应20min;同时做两支对照管,其中1支试管取3ml反应混合液加入30μl PBS(不加酶液)照光后测定作为最大光还原管,另1支只加缓冲液置于暗中测定时用于调零。
超氧阴离子含量测定
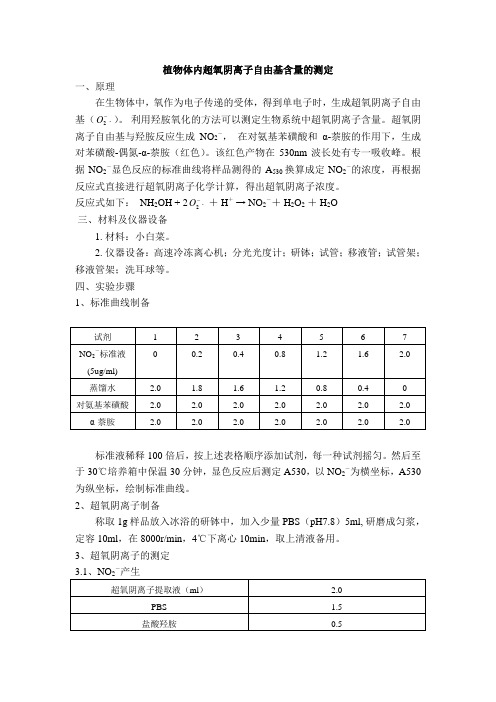
植物体内超氧阴离子自由基含量的测定一、原理在生物体中,氧作为电子传递的受体,得到单电子时,生成超氧阴离子自由基(⋅-2O )。
利用羟胺氧化的方法可以测定生物系统中超氧阴离子含量。
超氧阴离子自由基与羟胺反应生成NO 2-, 在对氨基苯磺酸和α-萘胺的作用下,生成对苯磺酸-偶氮-α-萘胺(红色)。
该红色产物在530nm 波长处有专一吸收峰。
根据NO 2-显色反应的标准曲线将样品测得的A 530换算成定NO 2-的浓度,再根据反应式直接进行超氧阴离子化学计算,得出超氧阴离子浓度。
反应式如下: NH 2OH + 2⋅-2O + H + → NO 2-+ H 2O 2 + H 2O 三、材料及仪器设备1. 材料:小白菜。
2. 仪器设备:高速冷冻离心机;分光光度计;研钵;试管;移液管;试管架;移液管架;洗耳球等。
四、实验步骤 1、标准曲线制备标准液稀释100倍后,按上述表格顺序添加试剂,每一种试剂摇匀。
然后至于30℃培养箱中保温30分钟,显色反应后测定A530,以 NO 2-为横坐标,A530为纵坐标,绘制标准曲线。
2、超氧阴离子制备称取1g 样品放入冰浴的研钵中,加入少量PBS (pH7.8)5ml, 研磨成匀浆,定容10ml ,在8000r/min ,4℃下离心10min ,取上清液备用。
3、超氧阴离子的测定 -25℃保温20min-上述反应液(ml) 2.0对氨基苯磺酸(ml) 2.0α-萘胺(ml) 2.030℃恒温箱中保温30min4、含量计算从标准曲线中计算出测定液对应NO2-的浓度,并换算成超氧阴离子的浓度(X),再算出超氧阴离子的含量。
超氧阴离子的含量(μg-1FW)=2X·V t·n/g·FW·V sV t为样品提取液总体积;n为稀释倍数;V s为显色时取样品体积;X为从标准曲线上计算出的浓度。
五、实验结果5.1 标准曲线y = 19.025xR2 = 0.973145.2 样品测定样品A530=0.046NO2-的浓度=0.046/19.025=0.0024ug/ml超氧阴离子的含量(μg·g-1FW)=2X·V t·n/g·FW·V s=2*0.0024*10*6/(1*2)=0.144 六、注意事项如果样品中含有大量叶绿素将干扰测定,可在样品液与羟胺温浴后,加入等体积乙醚提取叶绿素。
植物组织超氧阴离子自由基含量测定
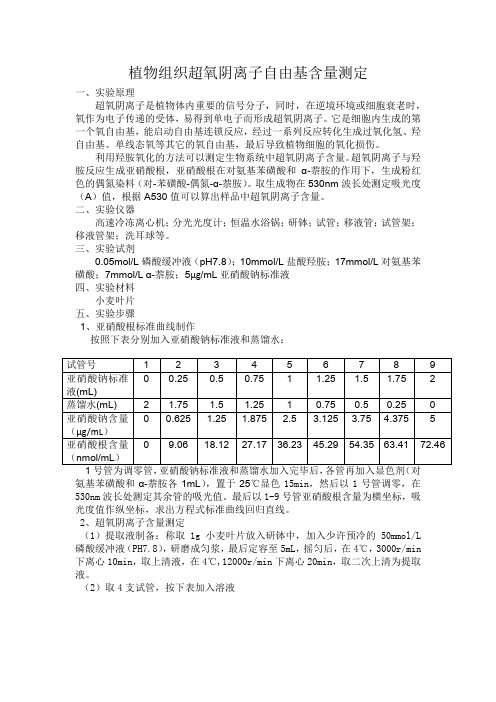
植物组织超氧阴离子自由基含量测定一、实验原理超氧阴离子是植物体内重要的信号分子,同时,在逆境环境或细胞衰老时,氧作为电子传递的受体,易得到单电子而形成超氧阴离子。
它是细胞内生成的第一个氧自由基,能启动自由基连锁反应,经过一系列反应转化生成过氧化氢、羟自由基、单线态氧等其它的氧自由基,最后导致植物细胞的氧化损伤。
利用羟胺氧化的方法可以测定生物系统中超氧阴离子含量。
超氧阴离子与羟胺反应生成亚硝酸根,亚硝酸根在对氨基苯磺酸和α-萘胺的作用下,生成粉红色的偶氮染料(对-苯磺酸-偶氮-α-萘胺)。
取生成物在530nm波长处测定吸光度(A)值,根据A530值可以算出样品中超氧阴离子含量。
二、实验仪器高速冷冻离心机;分光光度计;恒温水浴锅;研钵;试管;移液管;试管架;移液管架;洗耳球等。
三、实验试剂0.05mol/L磷酸缓冲液(pH7.8);10mmol/L盐酸羟胺;17mmol/L对氨基苯磺酸;7mmol/L α-萘胺;5µg/mL亚硝酸钠标准液四、实验材料小麦叶片五、实验步骤1、亚硝酸根标准曲线制作按照下表分别加入亚硝酸钠标准液和蒸馏水:氨基苯磺酸和α-萘胺各1mL),置于25℃显色15min,然后以1号管调零,在530nm波长处测定其余管的吸光值。
最后以1-9号管亚硝酸根含量为横坐标,吸光度值作纵坐标,求出方程式标准曲线回归直线。
2、超氧阴离子含量测定(1)提取液制备:称取1g小麦叶片放入研钵中,加入少许预冷的50mmol/L 磷酸缓冲液(PH7.8),研磨成匀浆,最后定容至5mL,摇匀后,在4℃,3000r/min 下离心10min,取上清液,在4℃,12000r/min下离心20min,取二次上清为提取液。
(2)取4支试管,按下表加入溶液各1mL混匀,置于25℃下显色15min,最后以1号管调零,在530nm波长处测定其余管吸光值。
六、实验结果及计算求平均值得A530为0.073。
通过标准曲线回归方程求得亚硝酸根含量为2.36nmol/mL ,反应体系中提取液为1mL,故反应体系中中亚硝酸根含量为2.36nmol。
抗氧化酶活性等测定方法

叶绿体的提取一、试剂配置1、PBS提取液:每L水依次加入MES(195.2×0.05=9.76g)、山梨糖醇(0.33×182.2=60.126g)、NaCl (0.010×58.5=0.585g)、MgCl(0.002×95=0.19g)、EDTA(292.25×0.002=0.5845g)、KH2PO4(200×0.0005=0.1g);使用时加入ASA-Na(198.1×0.002=0.3962g);2、悬浮液:将PBS提取液中的MES换为238.3×0.05=11.915g的HEPES(238.3×0.05=11.915g);3、80%Percol:80ml原液+20ml水;40%Percol:40ml原液+60ml水;实际配制:PBS提取液2000ml(3个处理*2个品种*3个重复*20ml*3次=1080ml),悬浮液100ml(3个处理*2个品种*3个重复*1ml*3次=54ml);80%Percol 200ml; 40%Percol 200ml.(3个处理*2个品种*3个重复*3ml*3次=162ml)二、提取步骤1、10g鲜样加20ml提取PBS(50mM MES PH6.1,含0.33M山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)2、快速研磨,使叶片碎成绿豆粒大小,4层纱布过滤,去除残渣(注意过滤时不可用力挤压,以免叶绿体膜破碎)3、滤液2000g 3min,小心倒出上清液,将离心管放入离心机后,使离心机的加速很快上升到预定值(水平转头,加速度调到9),约经30s后很快使其下降停止,整个离心持续大约2-3min左右完成;4、沉淀用1ml提取液漂洗表面悬浮物;5、用1ml悬浮液(50mM HEPES pH 7.6,含0.33 mM山梨糖醇,10mM NaCl,2mM MgCl2,2mM EDTA,0.5 mMKH2PO4,2mM ASA-Na,ASA-Na使用前现配现加)将沉淀悬浮,在分散叶绿体时宜用毛笔轻轻刷,或者用手握住离心管在冰块之间搅动,使叶绿体由于震动分散开来,不要用棉球吸滤,以防被膜压破。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
超氧阴离子产生速率测定
羟氨氧化法
(王爱国,罗广华.植物的超氧物自由基与羟胺的反应[J].植物生理学通讯,1990,(6):55-57) 一、原理
植物组织器官的衰老总是伴着细胞内膜结构的破坏,表现为细胞内的电解质大量渗漏出来。
很多研究结果表明,细胞衰老过程中膜的破坏是由细胞中(特别是线粒体和叶绿体)产生的自由基(如O2·¯、OH·、O2等)使膜脂中的不饱和脂肪酸发生过氧化作用而造成的。
膜脂过氧化作用中产生的自由基,它不仅能连续诱发膜脂过氧化作用,而且还可以使蛋白质脱H+而产生蛋白质自由基,使蛋白质分子发生链式聚合,从而使细胞膜变性,最终导致细胞损伤、衰老和死亡。
二、材料、仪器设备与试剂
(一)材料
植物叶片、花瓣等器官
(二)仪器设备
低温高速离心机、微量加样器(1mL、20uL)、精密电子天平、分光光度计、试管、
研钵、剪刀、镊子、烧杯、试管架
(三)试剂
(1)0.05 mol·L-1磷酸缓冲液PH=7.8(0.66304g的NaH2PO4.2H2O和16.3849g的
Na2HPO4.12H2O定溶1000mL,校正PH)
(2)10m mol·L-1盐酸羟胺(NH2OH·HCl,69.49,溶于水)0.3475g定溶到500mL,(冷)
(3)17m mol·L-1对氨基苯磺酸(C6H7NO3S 173.19 1.4721g) 或者(C6H7NO3S·H2O 191.21 1.6253g)定溶到500mL,(冷,磁)
(4)7m mol·L-1α-萘胺,0.5012g定溶到500mL,(乙醇溶解,定溶,溶解完全)
三、试验步骤
(1)制做亚硝酸根标准曲线
2mL系列浓度的NaNO2(5,4,3,2,1,0.5μg/L)加入4mL对氨基苯磺酸和4mLa-萘胺于25℃保温20min,然后测定OD530以[NO2-]和测得的OD530值互为函数作图,制的亚硝酸根标准曲线
(2)取0.2g植物材料,加入1.0mL 0.05 mol·L-1磷酸缓冲液(PH7.8)于冰浴研磨
(3)研磨物以12000r/min离心15min,取上清液0.5mL加入0.5mL磷酸缓冲液和1mL 10m
mol·L-1盐酸羟胺,25℃静置1h
(4)加入1mL17m mol·L-1对氨基苯磺酸和1mL7m mol·L-1α-萘胺,25℃静置20min,测其
530处OD值
四、计算
根据测得的OD值,查标准曲线将花瓣中氧自由基含量的OD值转换成[NO2-],依据羟胺与O2-的反应式:
NH2OH+2O2-+H+→NO2-+H2O2+H2O
从[NO2-]对[O2-]进行化学计算,将[NO2-]乘以2得到[O2-]。
五、注意:
加样的顺序不能颠倒,25℃是它的反应温度。
