胞内羟基自由基和超氧阴离子自由基测定
羟基自由基的产生与测定

特征荧光消失 ,使 360nm 处的荧光峰发生改变 ,因此 通过测定 Ce3 + 的荧光强度变化可间接测定羟基自由 关系 [ 7 ] 。 基产生量 。其测定原理可表示为 : 在 HPL C 法中用来捕集 HO ・ 的化合物还有苯丙 Ce3 + + HO・ + H + Ce4 + + H2 O 氨酸 、 酯类物质等 。 根据实验结果 ,认为这种方法操作简便 ,测定快速 ,有 ] 较好的重现性 [ 10 。 3 分光光度法 袁倬斌等利用脱氧核糖与在 Fenton 反应中产生 在难以采用 ESR 、 HPL C 等测试手段的情况下 , 的羟基自由基作用 ,在酸性条件下经过降解生成丙二 用分光光度法测定 HO ・ 被认为是简便实用的方法 。 醛 ,丙二醛再与甲醛 、 氨相互作用 ,生成具有电化学活 由于 HO ・ 本身不能由分光光度法检测 , 因此需先选 性的产物 3 ,5 - 二甲酰 - 1 ,4 - 二氢吡啶 , 其反应原 择合适的化合物与 HO ・ 反应 , 生成在紫外 — 可见光 理为 : 区内能产生特征吸收的产物 。上述 HPL C 法中用以 脱氧核糖 + HO ・ → 碎片 → 酸化 、 加热 → 丙二 捕集 HO ・ 的二甲基亚砜和水杨酸 , 同样可以用于分 醛 光光度法测定 。徐向荣等用 DMSO 捕集 Fenton 反 丙二醛 + CH2 O + N H3 → 3 ,5 - 二甲酰 - 1 ,4 应体系中的 HO ・ , 产生的甲基亚磺酸与坚牢蓝 BB 二氢吡啶 盐反应 ,生成的重氮化合物经甲苯 : 正丁醇 ( 3 :1) 混合 通过用电化学分析法检测产物 3 ,5 - 二甲酰 物萃取后 ,用分光光度法在 420nm 处进行比色测定 , 1 ,4 - 二氢吡啶的形成和变化 , 可得到丙二醛的产生 ] 认为这种方法用来研究羟基自由基的产生与清除准 量和变化 ,进而推断出羟基自由基的量及变化 [ 11 。 ] 确可靠 ,有较好的重现性 [ 8 。贾之慎等用水杨酸捕集 上述的方法值得我们在制浆化学的研究领域中 Fenton 反应体系中的 HO ・ , 生成的 2 ,3 - 二羟基苯 参考和借鉴 ,特别是在高温过氧化氢漂白等与羟基自 甲酸用乙醚萃取 ,用钨酸钠和亚硝酸钠显色 , 然后用 分光光度计测定其 510 nm 处的吸光度 ,结果显示吸 光度随水杨酸浓度 、 Fe2 + 浓度及 H2 O2 的浓度增加而 上升 ,认为这体现了 HO・ 生成的变化规律 ,这种方法 ] 是一般实验室可采用的简便实用的方法 [ 9 。 由基反应有关的机理研究之中 。需要注意的是 , 除 ESR 法可直接测定自由基外 , 其余的均只能间接测 定 。由于 HO・ 的寿命短 , 即使是与自旋捕捉剂反应 的产物寿命也很有限 ; 同时在有些捕集反应的过程中 反应步骤较多 ,产物较复杂 , 因此无论是直接测定方
羟基自由基检测技术方法概述

( ES R ). Hi g h er P er f o r ma n c e L i qu i d Ch r oma t o g r a p h y (HL P C) , Sp e c t r o p h o t o me t r y, F l u o r e s c e n c e Sp e c t op r h o — t o me t r y( F D)an d S O on . Th e s e me t h o d s wi l l p r o v i d e a t e c h n o l o g y a s s i s t a n t f o r d e t e c t i n g h y d r o x y l r a di c a l s a n d
技术 是 F e n t o n法 J 。 目前 , 科 研 工 作 者认 定 羟 基 自
自旋捕集 法 ( E S R) 、 高效 液 相 色 谱法 ( H P L C ) 、 分 光
光度法 、 荧光光度法 ( F D ) 、 化学发光法 ( C L ) 、 电化 学 检测 法 ( E C D) 等。
究。列举 了羟基 自由基的检测方法 , 包括 : 电子 自旋捕 集法 ( E S R) 、 高效 液相 色谱 法 ( HP L C) 、 分光光度 法、 荧光光 度 法( F D) 等 方法 , 这些方法对科研 工作 者检 测羟基 自由基提供 了一定 的技 术支持 , 并对今后 的研 究方 向起 到一定
2 检 测 方 法
2 . 1 电子 自旋捕 集 法 ( E S R) 电子 自旋共 振法 ( E l e c t r o n S p i n R e s o n a n c e ) 是从
1 9 4 5年发展 起来 的 , 主要 研究 对 象 为具 有 未 成对 电
羟基自由基检测方法的研究进展

羟基自由基检测方法的研究进展刘建伟 杨长河(南昌大学建筑工程学院,南昌330031)摘 要:羟基自由基氧化是高级氧化技术重要的机理之一,也是研究的难点之一。
本文归纳总结了测定羟基自由基的几种方法,并探讨了各种方法存在的问题,提出了新的检测方法所应具备的特点。
关键词:水处理 高级氧化技术 羟基自由基1 前言随着经济的快速发展,环境污染问题越来越严峻,传统水处理方法难以有效处理成分日益复杂的污水,水处理新技术的研究与应用成为环保领域的重要研究课题。
以臭氧氧化、光催化氧化、电化学氧化、超声技术、湿式氧化等为代表的高级氧化工艺(Advanced Oxi2dati on Pr ocess,AOP)处理污染物技术的形成,为我们提供了处理水体中污染物的新思路。
高级氧化工艺具有反应速度快、处理完全、无公害、适用范围广等优点。
这一概念由Glaze等[1]于1987年提出,被定义为能够产生羟基自由基(·OH)的氧化过程。
目前水处理中能产生·OH的高级氧化技术主要有臭氧氧化、Fent on均相催化氧化、湿式氧化、光催化氧化、电催化氧化、光电催化氧化、超声空化氧化[2]、高压脉冲放电等离子体技术[3,4]等。
随着对其反应机理研究的深入,逐渐认识到反应过程中·OH的行为的重要性。
·OH具有一个未成对电子,使其具有极强的氧化能力(2.80V),仅次于氟(2.87V),并能引发诱导产生链反应,主要通过电子转移、亲电加成、脱氢反应等途径无选择性地与各种有机化合物直接作用并最终将其降解为C O2、H2O等无害物质。
由此,准确的·OH的检测特别是在线检测已被认为是此项研究的重要方面,也是目前各种高级氧化反应机理研究的难点之一。
由于自由基是化学反应的中间体,大部分自由基寿命极短。
在水相反应体系中的·OH的寿命仅大约10-9s[5],直接对其进行检测受到仪器操作方面的限制很大,而且其存在依赖于特定的反应环境,因而关于自由基的行为方面,推测和间接证明的为多,直接测量的为少。
植物组织超氧阴离子自由基含量测定
植物组织超氧阴离子自由基含量测定一、实验原理超氧阴离子是植物体内重要的信号分子,同时,在逆境环境或细胞衰老时,氧作为电子传递的受体,易得到单电子而形成超氧阴离子。
它是细胞内生成的第一个氧自由基,能启动自由基连锁反应,经过一系列反应转化生成过氧化氢、羟自由基、单线态氧等其它的氧自由基,最后导致植物细胞的氧化损伤。
利用羟胺氧化的方法可以测定生物系统中超氧阴离子含量。
超氧阴离子与羟胺反应生成亚硝酸根,亚硝酸根在对氨基苯磺酸和α-萘胺的作用下,生成粉红色的偶氮染料(对-苯磺酸-偶氮-α-萘胺)。
取生成物在530nm波长处测定吸光度(A)值,根据A530值可以算出样品中超氧阴离子含量。
二、实验仪器高速冷冻离心机;分光光度计;恒温水浴锅;研钵;试管;移液管;试管架;移液管架;洗耳球等。
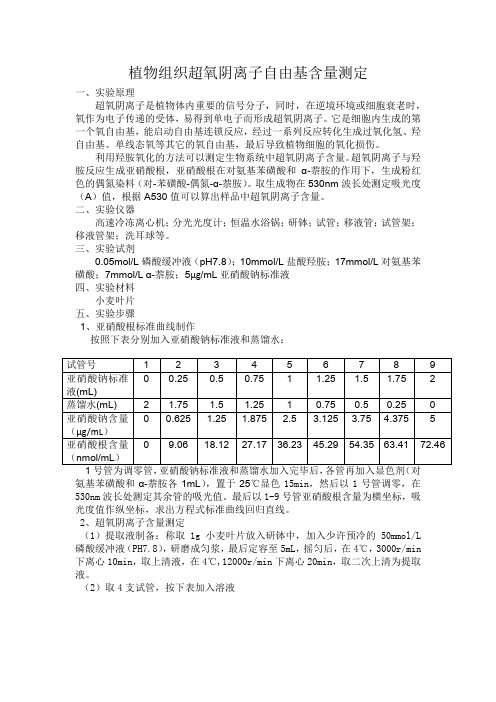
三、实验试剂0.05mol/L磷酸缓冲液(pH7.8);10mmol/L盐酸羟胺;17mmol/L对氨基苯磺酸;7mmol/L α-萘胺;5µg/mL亚硝酸钠标准液四、实验材料小麦叶片五、实验步骤1、亚硝酸根标准曲线制作按照下表分别加入亚硝酸钠标准液和蒸馏水:氨基苯磺酸和α-萘胺各1mL),置于25℃显色15min,然后以1号管调零,在530nm波长处测定其余管的吸光值。
最后以1-9号管亚硝酸根含量为横坐标,吸光度值作纵坐标,求出方程式标准曲线回归直线。
2、超氧阴离子含量测定(1)提取液制备:称取1g小麦叶片放入研钵中,加入少许预冷的50mmol/L 磷酸缓冲液(PH7.8),研磨成匀浆,最后定容至5mL,摇匀后,在4℃,3000r/min 下离心10min,取上清液,在4℃,12000r/min下离心20min,取二次上清为提取液。
(2)取4支试管,按下表加入溶液各1mL混匀,置于25℃下显色15min,最后以1号管调零,在530nm波长处测定其余管吸光值。
六、实验结果及计算求平均值得A530为0.073。
通过标准曲线回归方程求得亚硝酸根含量为2.36nmol/mL ,反应体系中提取液为1mL,故反应体系中中亚硝酸根含量为2.36nmol。
羟基和超氧自由基的检测研究进展

第29卷,第4期 光谱学与光谱分析Vol 129,No 14,pp1093-10992009年4月 Spectro sco py and Spectr al AnalysisA pril,2009羟基和超氧自由基的检测研究进展张 昊,任发政*中国农业大学食品科学与营养工程学院,教育部-北京市功能乳品实验室,北京 100083摘 要 活细胞在必需的新陈代谢过程中会产生自由基,越来越多的研究证据表明,这些自由基涉及到许多体内调控系统,然而一旦有过多的自由基生成便会氧化细胞脂膜、蛋白质、DN A 和酶,进而对细胞造成致命性的损伤。
此外,研究还表明许多疾病与自由基密切相关,例如,有研究报道海氏默症病人脑中生物分子的氧化损伤程度明显高于正常值,另外癌症可能也是DN A 受到氧化损伤的结果。
因此,测定自由基的方法就显得十分必需和重要。
文章重点对羟基和超氧自由基检测技术的发展情况进行了讨论,涉及的自由基检测技术主要有分光光度法、荧光法、化学发光法和电子自旋共振技术,并评价了各种方法的优缺点。
关键词 羟基自由基;超氧自由基;检测技术;评述中图分类号:O 65713 文献标识码:A DOI :1013964/j 1issn 11000-0593(2009)04-1093-07收稿日期:2007-11-28,修订日期:2008-03-06基金项目:国家/十一五0科技支撑项目(2006BAD05A16)资助作者简介:张 昊,1984年生,中国农业大学食品科学与营养工程学院硕士研究生 e -mail:david1hao@sina 1com*通讯联系人 e -mail:r enfaz heng@2631n et引 言羟基自由基(O H #)和超氧自由基(O 2-#)是生物体内活性氧代谢产生的物质,其中O 2-#经一系列反应最终会生成OH #,而OH #是一种氧化性很强的自由基,可以引发不饱和脂肪酸发生脂质过氧化反应,使糖类、蛋白质、核酸及脂类等发生氧化损伤。
P-26如何用捕获剂-DMPO检测超氧阴离子和羟自由基

info@ 400-823-9388 800-988-0083P -26同仁化学研究所 (Dojindo) 的DMPO没有杂质 (*) 检出 以羟自由基的Fenton反应(黑色)和空白(蓝色)为例同仁化学研究所(Dojindo)的峰更清晰,S/N比例更高Ⅰ. 概述活性氧具有调节许多重要细胞功能的作用,它和人体衰老、多种人类疾病,如癌症、糖尿病有关。
自旋捕捉ESR技术是一种检测活性氧的最可靠的办法,它能提供具有特征的ESR信号。
DMPO采用一种特殊的敏感方法,可以捕捉超氧阴离子和羟自由基等,分别产生独特的ESR光谱。
因此它是探测生物系统内ROS的强有力工具。
同仁化学研究所的DMPO具有很高的纯度,和其他产品相比,它的最大优点是使用前不需要再纯化,使您的ESR检测变得更容易。
Ⅱ. 常规参数名称:5,5-Dimethyl -1-pyrroline N -oxide 性状:无色液体纯度:≥99% (GC)分子量:113.16,C 6H 11NO保存条件:-20℃,防潮,避光运输条件:蓝冰CAS:3317-61-1Ⅲ. 纯度对比Ⅳ. 操作步骤常规检测步骤 (*本数据仅供参考,具体参数可能因仪器厂家的不同而适当调整)SOD清除超氧阴离子的活性检测1. 将15 μl的DMPO溶液和 50 μl的5 mM的次黄嘌呤加入到35 μl的0.1 M的磷酸盐缓冲液 (pH 7.8) 中。
2. 加入50 μl的待测SOD标准品或待测样品,涡旋振荡 1-2 s。
3. 加入50 μl的0.4 U/ml的黄嘌呤氧化酶之后立即涡旋振荡。
4. 放置一段时间 (例如 1 min) 将溶液转入ESR样品管中检测。
5. 通过峰值计算相对强度(DMPO-O 2-/Mn 2+)。
V. 实验例C -,N -,S -基自由基的检测1. 制备100 mM含有25 μM Diethylenetriaminepentaacetic Acid (DTPA)的磷酸盐缓冲液 (pH 7.4),作为过渡金属螯合剂。
羟基和超氧自由基的检测研究进展

羟基和超氧自由基的检测研究进展作者:张昊, 任发政, ZHANG Hao, REN Fa-zheng作者单位:中国农业大学食品科学与营养工程学院,教育部-北京市功能乳品实验室,北京,100083刊名:光谱学与光谱分析英文刊名:SPECTROSCOPY AND SPECTRAL ANALYSIS年,卷(期):2009,29(4)被引用次数:8次1.Nicholas S;Quinton J C查看详情[外文期刊] 1989(04)2.金鸣;蔡亚欣;李金荣查看详情 1996(06)3.Barry H;John MCG;Okezie I A查看详情[外文期刊] 19874.刘德启;顾钧;丁梅香萃取-催化氧化光度法测定H2O2的羟基自由基 (Ⅱ)[期刊论文]-分析科学学报 2002(02)5.马茜;孙丽红亮绿褪色光度法检测Fenton反应产生的羟自由基[期刊论文]-分析试验室 2006(12)6.吴南;任凤莲;吴心传BPR光度法检测Fenton反应产生的羟自由基[期刊论文]-理化检验-化学分册 2001(01)7.秦延河罗丹明B-Mn2+-H2O2体系光度法测定水果的抗氧化性[期刊论文]-江西师范大学学报(自然科学版)2005(06)8.李方;郑怀礼黄酮配合物抗自由基活性的亚甲基蓝光谱测定体系的研究[期刊论文]-光谱学与光谱分析 2006(12)9.杨明惠;刘满红;何丽仙褪色光度法测定Fenton反应产生的羟自由基及其应用[期刊论文]-分析试验室 2006(12)10.吴南;任凤劳;吴心传茜素紫显色剂检测Fenton反应产生的@OH[期刊论文]-化学试剂 2001(01)11.徐向荣;王文华;李华斌比色法测定Fenton反应产生的羟自由基及其应用[期刊论文]-生物化学与生物物理进展1999(01)12.Glebska J;Koppenol W H查看详情[外文期刊] 200513.Bielski B H J;Shiue G G;Bajuk S查看详情 198014.Koppenol W H;Van Buuren K J H;Butler J查看详情 197615.Lin J M;Yamada M查看详情 199916.Sutherlan M W;Learmonth B A查看详情 199717.田益玲;陈冠华;崔同动力学分光光度法测定中药对超氧阴离子自由基的清除率[期刊论文]-光谱学与光谱分析2005(04)18.Marklund S;Marklund G查看详情 197419.庞战军;周玫;陈瑗自由基医学研究方法 200020.Misra H P;Ffidovich I查看详情 1972(10)21.方光荣;刘立明;李玲羟基自由基的流动注射荧光法测定[期刊论文]-分析科学学报 2004(01)22.梁爱惠;蒋治良;周苏梅罗丹明6G缔合微粒光度法检测羟自由基及其在离体筛选抗氧化剂中的应用[期刊论文]-光谱学与光谱分析 2006(11)23.任凤莲;吴南;司土辉水杨基荧光酮荧光法测定钴(Ⅱ)-过氧化氢体系产生 的羟自由基[期刊论文]-分析化学2001(01)24.臧运波;张爱梅荧光素钠-Mn2+-H2O2体系荧光法测定常见水果的抗氧化活性[期刊论文]-分析科学学报2005(01)25.张爱梅;臧运波查看详情 2006(06)26.张海容;王文艳荧光法研究高粱红色素清除羟自由基活性[期刊论文]-光谱学与光谱分析 2007(13)27.谷学新;邰超;邹洪一个新的测定Fenton反应产生的·OH及清除的荧光方法[期刊论文]-分析科学学报 2002(06)28.He Y Y;Hader D P查看详情 200229.Tang B;Zhang L;Zhang L L查看详情 200430.Tang B;Zhang L;Hu J X查看详情 2004(01)31.Goto H;Lin J M;Yamada M查看详情 199932.Zhao Y P;Yu W L;Wang D P查看详情[外文期刊] 200333.Albrecht H O查看详情 192834.Goto H;LinJ M;Yamada M;Bunseki Kagaku查看详情 1998(07)35.Goto H;Lin J M;Yamada M;Bunseki Kagaku查看详情 1999(10)36.Hanaoka S;Lin J M;Yamada M查看详情 200137.Gleu K;Petsch W查看详情 193638.Sugiura S;Kakoi H;lnoue S查看详情 197039.Nakano M;Sugioka K;Ushijima Y查看详情 198640.Osman A M;Laane C;Hilhorst R查看详情 2001(01)41.Lundqvist H;Dahlgren C查看详情 1996(06)42.Koga S;Nakano M;Uehara K查看详情 199143.Fujimori K;Nakajima H;Akutsu K查看详情 199344.Boveris A;Oshino N;Chance B查看详情 197245.Clapp P A;Evans D F查看详情 199146.郑国灿;肖尚友;穆小静自由基检测技术进展[期刊论文]-广州化学 2006(03)47.Li Y;Wang Q;Guo J L查看详情 199948.Kohno M;Mizuta Y;Kusai M查看详情 199449.Hojo Y;Okado A查看详情 2000(01)50.Roubaud V;Sankarapandi S;Kuppusamy P查看详情 199751.Rhodes C J;Tran T T;Morris H查看详情 200452.Takeshita K;Fujii K;Anzai K查看详情 2004(09)53.Qian S Y;Kadiisha M B;Qiong G查看详情 200554.Kuppusamy P;Wang P;Zweier J L查看详情 1996(22)55.Shin-ichi I;Seiji M;Hidekatsu Y查看详情 1992(01)56.Togashi H;Shinzawa H;Ogata T查看详情 1998(01)57.Masumizu T;Fujii K;Kohno M查看详情 1998(04)58.Panagiotelis I;Nicholson I;Foster M A查看详情 2001(06)1.彭妹.庞丽.张艳华.王立升.薛井中.刘帅兵花红片中七种中草药抗氧化活性研究[期刊论文]-广西大学学报(自然科学版) 2013(3)2.朱敏.马宏跃四物汤及其组方的抗氧化活性研究[期刊论文]-江西中医药 2012(9)3.刘立.段金廒.唐于平.马宏跃.宿树兰.李晓曦桃红四物汤抗氧化效应物质基础研究[期刊论文]-中国中药杂志2011(12)4.肖家军.王云.戴仕奎.方晓阳苍耳叶挥发油的提取及抑菌和抗氧化性研究[期刊论文]-食品工业科技 2011(7)5.胡一鸿.叶龙.朱术超.金文龙.莫亿伟番荔枝种子粗多糖抗氧化能力研究[期刊论文]-热带作物学报 2011(6)6.赵桦.王慧娜.徐皓开口箭多糖含量测定及生物学活性研究[期刊论文]-陕西理工学院学报(自然科学版)2013(3)7.赵虹.骆庆和.殷明.赵文娟氧化应激与阿尔茨海默病[期刊论文]-中国老年学杂志 2013(16)8.钱海峰.宋佳.马越.张超.赵晓燕芦笋老茎中多糖的纯化及其特性研究[期刊论文]-农业工程技术·农产品加工业 2011(5)9.熊何健.吴国宏.王莉芳.乔小瑞山竹多酚的分离制备及清除自由基活性研究[期刊论文]-河南工业大学学报(自然科学版) 2010(5)10.杜君.李海兰.李慧.战吉宬.黄卫东铜对葡萄酒酿酒酵母的氧化胁迫机制[期刊论文]-中国农业科学 2011(2)本文链接:/Periodical_gpxygpfx200904051.aspx。
大鼠组织中超氧阴离子自由基的提取和化学发光测定

大鼠组织中超氧阴离子自由基的提取和化学发光测定超氧阴离子自由基是一种强氧化剂,它能够与细胞中的生物分子发生反应,导致氧化损伤和细胞死亡。
因此,测定组织中超氧阴离子自由基的含量对于研究氧化应激和细胞损伤等生理过程具有重要意义。
本文将介绍一种提取和测定大鼠组织中超氧阴离子自由基含量的方法。
实验材料和方法实验材料:1. 大鼠肝脏组织2. 磷酸盐缓冲液(PBS)3. 甲醛4. 乙酸5. 左旋多巴(L-DOPA)6. 马来酸氢钠7. 硝酸银8. 氨水实验步骤:1. 取大鼠肝脏组织约1克,用PBS洗涤3次,去除多余的血液和组织液。
2. 将组织切成小块,加入4%甲醛和1%乙酸的混合液中,固定4小时。
3. 取出固定的组织,用PBS洗涤3次,去除多余的固定液。
4. 将组织放入针管中,加入300μL的PBS和30μL的L-DOPA 溶液(10mg/mL),混合均匀。
5. 在37℃下孵育30分钟,取出后加入50μL的马来酸氢钠溶液(10mg/mL),混合均匀。
6. 加入50μL的硝酸银溶液(10mg/mL),混合均匀。
7. 加入50μL的氨水,混合均匀,放置5分钟。
8. 用化学发光仪测定样品的化学发光值。
实验结果和分析使用上述方法提取和测定了大鼠肝脏组织中超氧阴离子自由基的含量。
结果显示,大鼠肝脏组织中超氧阴离子自由基的含量为0.83±0.05μmol/g。
这表明,该方法能够有效地提取和测定大鼠组织中超氧阴离子自由基的含量。
讨论和结论本文介绍了一种提取和测定大鼠组织中超氧阴离子自由基含量的方法。
该方法利用了L-DOPA的氧化反应和化学发光技术,能够快速、准确地测定组织中超氧阴离子自由基的含量。
此外,该方法还具有操作简单、稳定可靠等优点,适用于大规模的实验研究和临床应用。
总之,测定组织中超氧阴离子自由基的含量对于研究氧化应激和细胞损伤等生理过程具有重要意义。
本文介绍的提取和测定方法能够有效地测定大鼠组织中超氧阴离子自由基的含量,为相关研究提供了重要的实验技术支持。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
活性氧(ROS)在许多致病过程中起关键作用,包括致癌作用、炎症、缺血再灌注损伤和信号转导。
目前开发的几种方法包括电子自旋共振法和化学荧光法。
其中,荧光检测在高灵敏度和实验方便性方面是优越的。
细胞溶质Ca2+的荧光指示剂,极大地促进了细胞中Ca2+依赖性信号转导的实验研究。
然而,几种用于检测ROS的荧光探针(包括2,7-二氢二氢荧光素(DCFH))可与各种ROS(超氧化物,过氧化氢等等)发生反应。
此外,DCFH易于自氧化,导致暴露在光下时荧光自发增加。
因此,将这些探针视为检测细胞中特定的氧化物质(例如过氧化氢)是不合适的。
胞内羟基自由基测定机理:
2-[6-(4-羟基)苯氧基-3H-黄嘌呤-3-酮基-9-基]苯甲酸(HPF)被设计并合成为新型荧光探针,用于检测选择性高活性氧(hROS),即羟基。
这种新开发的ROS指示剂HPF比二氯二氢荧光素二乙酸酯(H2DCFDA)具有更高的特异性和稳定性,因此被广泛用于更精确的胞内ROS 定性测量。
尽管HPF本身几乎不发荧光,但HPF选择性地和剂量依赖性地在与hROS反应时产生强荧光化合物,但不与其他活性氧物质(ROS)反应。
因此,通过单独使用HPF,可以将hROS 与过氧化氢,一氧化氮和超氧化物区分开来。
此外,HPF对光诱导的自动氧化具有抗性。
胞内羟基自由基测定方法:
在本研究中,用PBS洗涤500 μL藻类培养物,并在黑暗条件和室温下于10 μM HPF (Invitrogen,美国)的终浓度下温育40 min。
用PBS洗涤一次后,通过FL1通道检测胞内羟基自由基水平。
胞内超氧阴离子自由基测定机理:
一种名为二氢乙锭(DHE)的荧光素被广泛用于测量细胞内超氧阴离子自由基。
DHE可自由透过活细胞膜进入细胞内,并被细胞内的ROS氧化,形成氧化乙啶,氧化乙啶可掺入染色体DNA中,产生红色荧光。
根据活细胞中红色荧光的产生,可以判断细胞ROS含量的多少和变化,二氢乙啶在细胞内主要被超氧阴离子型ROS氧化,用流式细胞仪可直接观察。
胞内超氧阴离子自由基测定方法:
在本研究中,用PBS洗涤1 mL藻类培养物,并在黑暗条件和室温下于20 μM DHE(Invitrogen,美国)的终浓度下温育30 min。
用PBS洗涤一次后,通过FL2通道检测胞内超氧阴离子自由基水平。
