实验五转基因植物的检测
PCR扩增检测转基因大豆、玉米

【实验步骤】 基因组DNA浓度和纯度的鉴定
取5μL样品溶于95μL三重蒸馏水中,用 Biophotometer分 析DNA的浓度,通过它对提取大豆DNA测OD值。并记 录数据。由OD260nm/OD280nm判定基因组DNA的浓度, 其比值在1.7~2.0之间较好,符合PCR检测要求。
聚合酶链式反应(Polymerase Chain Reaction, PCR)是 一种选择性体外扩增DNA的方法,其基本原理类 似 于 DNA 的 天 然 复 制 过 程 。 它 包 括 : 变 性 (Denature) 、 退火(Anneal)和延伸(Extension)三个基
外源基因( EPSPS)特异性扩增 12 3 4567M 12
外源终止子(NOS) 特异性扩增
外源启动子(CaMV35S)特 异性扩增
1 未加模板对照 2 转基因大豆、玉米 3~7 非转基因大豆、玉米
PCR假阳性结果 1. 引物设计不当,应调换引物 2. 循环参数不合适,导致非特异性扩增 3. 靶序列的交叉污染
大豆凝集素(Lectin)基因、玉米特异性内源基
因IVR为内参 ?
西医学是最近三四百年来建立在解 剖学、 生物学 及现代 科学技 术基础 上、发 展起来 的一门 以“解 剖人、 肉体人 ”为概 念的、 新兴的 现代医 学科学 理论体 系。主 要采用 科学实 验方法 ,从宏 观到微 观,直 至目前 的分子 基因层 次水平 ,发展 极为迅 速,超 过其它 任何一 门医学 科学, 成为世 界医学 史上的 主流。 医学、比较医学、后现代医学、行为 医学等 所谓“ 医学” ,都称 不上一 门独立 的医学 科学, 关于这 一点在 灵魂医 学有关 章节中 将有相 关点评 。
【实验步骤】
大豆、玉米DNA 提取--改良的CTAB法
10实验转基因食品

三、材料 转基因烟草
四、设备 移液器,冷冻高速离心机,低温冰
箱,台式高速离心机,1.5ml离心管。
五、试剂
• 蛋白质提取液:300ml • 1、1M Tris-HCl
(PH8.0) 45ml • 2、甘油(Glycerol) 75ml • 3、聚乙烯吡咯烷酮
(Polyvinylpolypyrrordone)6g • 4、 0.07%的β-巯基乙醇
• 样品经细胞破碎后,各种蛋白质被释放 出来。根据不同蛋白质的特性,选择不 同的溶剂进行抽提:
• 例如:水溶性蛋白质可以用中性缓冲 溶液抽提,
• 酸性蛋白质用稀碱性溶液抽提
• 脂溶性蛋白则可用有机溶剂抽提等
• 得到的粗抽提物,经离心除去固体杂 质后,在通过盐析,等电点沉淀或有 机溶剂沉淀等方法处理,即得到蛋白 质粗产品。
研磨后加入1.5ml离心管中。 2、根据样品重量(0.5g样品加入
400ul提取液,可根据材料不同适当加 入),静置10-30min。 3、用离心机离心8000rpm40min4℃ 或11100rpm20min4℃
4、提取上清液,样品制备完成。
二、植物组织蛋白质提取方法
丙酮沉淀法
1、在液氮中研磨叶片
• Tris-HCl:构建平衡缓冲体系,保证溶液 一定的pH值;
• β-巯基乙醇:a、使多酚氧化酶失活,防止 酚类氧化; b、使目的蛋白变性可溶;
• TritonX-100:可增大蛋白的可溶性; • PVP:吸附色素及可防止蛋白氧化,若材
料易被氧化或色素含量高可适当多加; • PMSF:抑制蛋白酶,防止蛋白降解。
2、加入样品体积3倍的冰浴丙酮在-20℃Байду номын сангаас 条件静置10-30min ,然后离心4℃ 12000rpm 10min,弃上清。
植物基因组dna的提取实验报告

植物基因组dna的提取实验报告植物基因组DNA的提取实验报告。
植物基因组DNA的提取是分子生物学实验中的一项重要步骤,对于研究植物的遗传特性和基因表达具有重要意义。
本实验旨在通过提取植物细胞中的DNA,为后续分子生物学实验提供基础支持。
在本次实验中,我们选择了小麦叶片作为实验材料,采用CTAB法提取植物基因组DNA,并对提取的DNA进行质量评估。
首先,我们收集了新鲜的小麦叶片样品,并将其置于液氮中迅速冷冻保存,以保持DNA的完整性。
接着,将叶片样品磨成细末状,并加入预冷的CTAB提取液中,进行细胞破裂和DNA的溶解。
随后,通过酚/氯仿提取法分离DNA与蛋白质,最终得到DNA的沉淀物。
在实验过程中,我们注意到了一些关键的操作细节。
首先,样品的冷冻保存和研磨过程需要迅速进行,以防止DNA的降解。
其次,在加入CTAB提取液后,充分混合样品并保持恒温,有助于细胞破裂和DNA的溶解。
最后,在进行DNA的沉淀时,需要注意避免将上清液一同转移,以保证提取得到的DNA纯度。
提取得到的DNA样品经过紫外分光光度计检测,结果显示其纯度较高,吸光比值(A260/A280)约为1.8,符合DNA的纯度要求。
随后,我们进行了琼脂糖凝胶电泳实验,观察到明显的DNA条带,并通过对照DNA分子量标准品的迁移情况,初步评估了提取得到的DNA片段大小。
通过本次实验,我们成功地提取到了小麦叶片样品中的基因组DNA,并对其质量进行了评估。
下一步,我们将利用提取得到的DNA样品,开展进一步的分子生物学实验,包括PCR扩增、基因克隆等,以深入研究小麦的遗传特性和基因表达。
本次实验为我们提供了可靠的DNA样品,为后续实验奠定了坚实的基础。
总之,植物基因组DNA的提取是分子生物学研究中的重要步骤,本次实验通过CTAB法成功提取了小麦叶片样品中的DNA,并对其进行了质量评估。
提取得到的DNA样品具有较高的纯度和完整性,为后续实验提供了可靠的基础支持。
实验4转基因植物PCR基因扩增及电泳检测

实验4转基因植物PCR检测四、转基因植物PCR基因扩增及电泳检测一、实验目的1.学习转基因植物PCR基因扩增的基本原理。
2.掌握转基因植物PCR基因扩增的基本操作技术以及琼脂糖凝胶电泳技术。
二、原理PCR检测技术的基本原理是根据食品中待检的外源基因核酸序列设计合适引物,经PCR反应使待检靶标DNA序列得以扩增放大,最后经凝胶电泳分析靶标PCR产物的有无,从而对食品中是否含有靶标转基因序列成分进行判定。
由于目前商品化的绝大多数转基因食品普遍含有CaMV35S启动子和NOS终止子这两种基因表达调控序列或其中之一,而CaMV35S启动子和NOS终止子的DNA序列早已公开。
故在对食品样品的转基因背景一无所知的情况下,根据CaMV35S启动子和NOS终止子的DNA序列设计合适引物,通过PCR反应检测食品中是否含有CaMV35S启动子和NOS终止子基因序列,来判定该食品是否为转基因食品。
三、试验材料提取的甘薯基因组DNA。
四、试剂4.1 PCR反应引物序列35S:5,-GCT CCT ACA AAT GCC ATC A-3,//5,-GAT AGT GGG ATT GTG CGT CA-3,;NOS:5,-GAA TCC TGT TGC CGG TCT TC-3,//5,-TTA TCC TAG TTT GCG CGC-3,。
4.2 PCR反应试剂:无菌去离子水;模板DNA;20 μmol / LPCR 引物;5U/μL Taq DNA 聚合酶;2.5 mmol / L dNTPs;10×PCR 缓冲液;25 mmol / L MgCl2,25 mmol / L KCl , 20 μg / mL 灭菌无核酸酶的牛血清白蛋白4.2 核酸电泳相关试剂(见实验6)五、仪器5.1 PCR扩增仪。
5.2 微量移液器。
5.3 吸头。
5.4 电泳仪。
5.5 电泳槽。
5.6 凝胶成像仪。
5.7 PCR管。
六、实验步骤6.1 转基因植物PCR基因扩增6.1.1.1 按待检样品数(每一个样品分设35S和NOS两个检测反应)并加空白对照、阴性对照、阳性对照,取一定数量的无菌无污染的洁净干燥PCR管,按下表用记号笔在管壁上编号:6.1.1.2 之后按上述顺序依次加入各PCR反应液。
转基因筛选实验报告

转基因筛选实验报告1. 实验目的本实验旨在通过转基因技术筛选出具有目标基因的转基因植物,并验证其功能表达。
同时,对转基因技术的应用进行探究与分析。
2. 实验方法2.1. 材料准备- 野生型植物种子- 目标基因载体- 转化载体(包含选择标记基因)- 催化剂(如乙酰丙酮)- 局部细菌感染试剂2.2. 实验步骤1. 制备植物组织培养基,包括必需的无机盐、营养物质以及植物激素。
2. 将野生型植物种子在无菌条件下在培养基上培养,保持温湿度合适。
3. 将目标基因载体和转化载体分别在乙酰丙酮的催化作用下加入植物组织培养基中。
4. 收取转基因植株,将其转移到相应的培养基中继续培养。
5. 利用PCR等方法对转基因植株进行基因分析,验证是否成功转化目标基因。
6. 进行型和酶解析实验,验证目标基因的功能表达情况。
3. 实验结果经过一段时间的培养和筛选,我们成功获得了若干转基因植株。
通过PCR实验验证,其中的部分植株确实成功转化了目标基因。
进一步的酶解析实验结果显示,这些转基因植株中的目标基因被成功表达,产生了相应的功能酶。
4. 实验分析通过转基因技术的应用,我们成功地筛选出了具有目标基因的转基因植物。
这为进一步研究和应用提供了重要的基础。
转基因技术的应用不仅可以用于改良作物品种,提高农作物的抗病虫能力和产量,还可以用于生物医学研究,产生用于疾病治疗的蛋白质等。
然而,转基因技术也面临一些争议和风险。
一方面,转基因植物可能对环境产生不可逆转的影响,对生态系统造成潜在风险。
另一方面,转基因植物可能引发食品安全问题,对人体健康构成潜在威胁。
因此,在推广应用转基因技术的过程中,需要更加严格的监管和安全评估。
5. 结论通过转基因筛选实验,我们成功获得了具有目标基因的转基因植物,并验证了目标基因的功能表达。
这为转基因技术的应用提供了实验依据和理论基础。
转基因技术具有广阔的应用前景,但也需要高度重视风险评估和监管措施,确保其安全使用。
转基因大豆检测实验设计

转基因大豆的检测实验设计生物技术安全评估 092012年5月目录前言........................................................................3. 实验一大豆样品的准备 (4)实验二大豆DNA的提取和纯化 (4)实验三靶标基因的扩增 (6)实验四反应产品检测 (10)实验五结果分析 (12)参考文献 (12)前言随着转基因工程技术的迅速发展与在生物改良及遗传育种中的大规模应用,转基因生物(Genetically Modified Organism)及其产品的种类越来越多,含有的外源基因类型也越来越多。
抗草甘膦(glyphosate)大豆(商品名,roundup ready soybean)是在传统大豆株Variety A5403中转入外源基因CAMV-35S启动子、抗草甘膦基因CP4-EPSPS和NOS终止子而得到。
它是目前使用最广的转基因作物之一,每年至少有800万吨转基因大豆进入我国市场。
因此,研究抗草甘膦大豆的快速检测方法具有重要意义。
基于核酸的检测技术主要有PCR 方法和基于PCR 原理的其他检测方法如多重PCR、巢式PCR 等等。
普通PCR 方法已经成为转基因检测中常用的方法,通常是作为定性检测方法,早在2003 年就成为出入境检验检疫系统的行业标准。
这些标准涉及的转基因作物有大豆(SN/T 1195-2003)、玉米(SN/T 1196-2003)、棉花(SN/T 1199-2003)、油菜籽(SN/T 1197-2003)、烟草(SN/T 1200 -2003) 和马铃薯(SN/T 1198 -2003)。
目前广泛应用于进出口商品的转基因成分检测。
随后在2004 年又制定了转基因定性检测的国标(GB/T 19495.4-2004),该国标中用的方法还是普通PCR。
因此,普通PCR 方法的研究主要在于新的转基因作物的鉴定研究。
大学《基因工程学》教学大纲
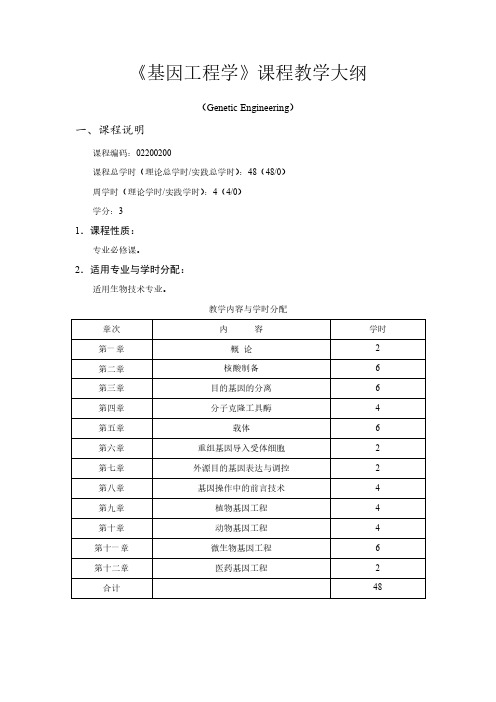
《基因工程学》课程教学大纲(Genetic Engineering)一、课程说明课程编码:02200200课程总学时(理论总学时/实践总学时):48(48/0)周学时(理论学时/实践学时):4(4/0)学分:31.课程性质:专业必修课。
2.适用专业与学时分配:适用生物技术专业。
教学内容与学时分配3.课程教学目的与要求:本课程的授课对象是生物技术专业的本科生。
课程简介:《基因工程》是生物技术专业的专业必修课程。
其以分子遗传学理论为基础,以分子生物学和微生物学的现代方法为手段而建立起来的一门技术学科。
基因工程兴起于20世纪70年代初,它的问世带动了生物技术的兴起和发展,是现代生物技术的核心内容。
基因工程课程的主要内容包括基因的分离、基因的克隆、基因的表达、植物基因工程、动物基因工程、药物基因工程和基因治疗等。
它是生命科学学院生物技术专业本科生的主干专业课程之一,它是生物工程(包括基因工程、细胞工程、酶工程、发酵工程)中最重要的课程,其它三大工程是建立在基因工程基础之上的,同时也为生物技术制药等后继学科奠定了重要的理论基础。
课程目标:设置本课程是为了让生物技术专业的学生理解和掌握基因工程的技术原理,通过本课程学习,掌握基因操作的工具酶,基因克隆常用载体,目的基因的分离与合成,重组体的构建,重组体向宿主细胞的导入,重组体克隆的筛选与鉴定以及克隆基因的表达,同时了解基因工程在生物学领域中的应用与发展前景。
对学生达到毕业要求贡献如下:1)了解基因工程学的历史、发展和前沿知识。
2)掌握基因工程学的基础理论、基本知识和基本技能;教学要求:学完基因工程学后,学生将具备以下能力:1)具有良好的自学能力;2)综合运用所掌握的基因工程学理论知识和技能、从事生物科学及其相关领域科学研究的能力。
4.本门课程与其它课程关系:先修课程为生物化学、微生物学、分子生物学、细胞学等,具备基础理论知识及实验能力是基因工程学课程的基础。
实验五 转基因植物的RT-PCR检测

利用凝胶成像分析仪对电泳结果进行拍照和结果记录; 观察胶上是否有预扩增的主要产物带。对比目的基因产物的 电泳谱带分子量和谱带的特异性,确定和描述谱带特征。
RT-PCR扩增得到的810bp的目的基因产物的电泳结果
实验报告
1、将实验结果粘到实验报告上。 2、 如何选择RT-PCR的反转录引物。 3、结合实验结果,试论应用RT-PCR研究 外源基因转录表达的优缺点。
实验四、转基因植物的多重PCR检测
实验三、侵染菌种对除菌抗生素的敏 感性
头孢酶素 头孢唑啉钠
头孢哌酮钠 头孢曲松钠 头孢噻肟钠
100 -
200 + -
300 +++ ++
400 ++++ +++
500 ++++ ++++
600 ++++ ++++
-:表示无抑制作用;+:表示抑菌圈在8-10mm不透明;++:表示抑菌圈在 10-15mm不透明;+++:表示抑菌圈在15-25mm透明;++++:表示抑菌圈大 于25mm透明;+++++:表示菌板透明,无菌落。
溶菌酶的作用作用?沸水加热的作用? 利用溶菌酶和TritonX-100破坏细胞壁,加热 可使蛋白质和染色体DNA变性. 将实验电泳结果粘到实验报告上,并对结果 分析。 比较三种提取 方法的区别?
实验二、醋酸锂法转化酵母细胞
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、检测外源基因在植物细胞中的转录,对外 源基因表达调控进行研究,掌握引物的选择 、cDNA的合成、RT-PCR检测的原理与方法。
。
实验材料、设备及试剂
1、材料: 转基因植物的RNA或mRNA制备物。 非转化的植株材料总RNA或mRNA制备物
2、设备:PCR仪、移液器、PCR管等。 3、试剂:10×RT缓冲液、dNTP、逆转录酶、 引物
300
400
500
600
头孢唑啉钠 -
-
-
-
-
-
头孢哌酮钠 -
-
-
-
-
-
头孢曲松钠 -
+
+++
++++
++++
++++
头孢噻肟钠 -
-
++
+++
++++
++++
-:表示无抑制作用;+:表示抑菌圈在8-10mm不透明;++:表示抑菌圈在 10-15mm不透明;+++:表示抑菌圈在15-25mm透明;++++:表示抑菌圈大 于25mm透明;+++++:表示菌板透明,无菌落。
4 μl
ห้องสมุดไป่ตู้
灭菌蒸馏水
9μl
10 mM dNTP
2.5 μl
Taq酶
0.1 μl
上游特异Primer (20 μM)*1
0.2 μl
下游特异Primer (20 μM)*2
0.2μl
Total
16 μl
将(1)的反应结果稀释20倍,取10 μl 加入到(2)管中,
轻轻摇匀。
反应条件:
94℃ 2min 94 ℃ 30s 55 ℃ 30s 72 ℃ 1min 72 ℃ 7min
(随机引物,Oligo dT; 特异引物)、 10×One Step RNA PCR Buffer、25 mM MgCl2、10 mM
dNTP、RNase Inhibitor (40 U/μl)、AMVOptimized Taq1 μl、AMV RTase XL (5 U/μl)
、上游特异Primer (20 μM)*1、下游特异 Primer (20 μM)*2、RNase Free H2O。
0.25 μl
AMV RTase Transcriptase
0.5 μl
oligo dT-Adaptor primer
0.5 μl
RNA
1μl
Total
10μl
反应条件:
42 ℃ 30min 99 ℃ 5min 5 ℃ 5min
3、PCR反应
取一个0.2ml的PCR管,依次加入下列试剂:
10×PCR Buffer
30Cycles
目前研究转基因植物外源基因 转录表达的常用方法
1、RT-PCR (RNA)
2、Northern blot (RNA)
3、real-time PCR (RNA )
结果与分析
• 利用凝胶成像分析仪对电泳结果进行拍照和结果记录; • 观察胶上是否有预扩增的主要产物带。对比目的基因产物的
电泳谱带分子量和谱带的特异性,确定和描述谱带特征。
RT-PCR扩增得到的810bp的目的基因产物的电泳结果
实验报告
1、将实验结果粘到实验报告上。 2、 如何选择RT-PCR的反转录引物。 3、结合实验结果,试论应用RT-PCR研究外
源基因转录表达的优缺点。
实验一、质粒三种提取方法的比较
为什么要用对数期的菌液提取质粒 ? 因为对数期菌的 生长状况和数量最佳,有利于提取质粒 溶液Ⅱ、溶液Ⅲ的作用? • 溶液Ⅰ 50mM 葡萄糖 / 10mM EDTA / 25mM Tris-HCl,pH=8.0 • 葡萄糖增稠,使悬浮后的大肠杆菌不会快速沉积到管子的底部;EDTA 抑 制DNase的活性。这一步溶液中还可以加入RNase,不受EDTA影响,并 且可以在后续步骤中被除去 • 溶液Ⅱ 0.2M NaOH / 1% SDS • 破细胞的主要是碱,而不是SDS,所以才叫碱法抽提。 • 溶液Ⅲ 3M 醋酸钾 / 2M 醋酸 • 这一步的K置换了SDS(十二烷基磺酸钠)中的Na,得到PDS(十二烷基 磺酸钾)沉淀;SDS易与蛋白质结合,平均两个氨基酸上结合一个SDS分 子,钾钠离子置换所产生的大量沉淀自然就将绝大部分蛋白质也沉淀了 ,同时基因组DNA也被PDS共沉淀
实验操作步骤:
1)RNA提取:
关键 防止RNA降解
RNA提取的成功与否 是RT-PCR检测中最 重要的步骤。
实验步骤
2、cDNA第一链的合成:
取1个0.2ml的PCR管,依次加入下列试剂:
10×PCR Buffer
1 μl
RNase Free dH2O dNTP
5.75 μl 1 μl
RNase Inhibitor
• 穿梭质粒是指一类人工构建的具有两种不同复制起点和选择
标记,因而可以在两种不同类群宿主中存活和复制的质粒载 体。 比如说通常能够在哺乳动物,酵母或者其他细菌复制表 达的质粒,同时可以在大肠杆菌内复制。这样利于对质粒的 分子生物学操作和大量制备。
实验三、侵染菌种对除菌抗生素的敏 感性
头孢酶素 100 200
溶菌酶的作用作用?沸水加热的作用? 利用溶菌酶和TritonX-100破坏细胞壁,加热可 使蛋白质和染色体DNA变性.
将实验电泳结果粘到实验报告上,并对结果 分析。
比较三种提取
方法的区别?
实验二、醋酸锂法转化酵母细胞
• 观察并描述培养状况,统计单菌落个数。 • 比较酵母细胞转化与大肠杆菌细胞转化的区别。 • 酵母菌属于真核生物 ,大肠杆菌是细菌属于原核生物 . • 酵母转化在室温,大肠杆菌转化在冰上 • 酵母转化用醋酸锂,大肠杆菌转化用氯化钙 • 酵母转化用穿梭质粒,大肠杆菌转化用普通质粒
