最新专题四硫氮和可ppt
硫和氮及其化合物的性质

4、硝酸的化学性质
⑪不稳定性:
4HNO3
hν,
4NO2 + O2 + 2H2O
浓硝酸应保存在棕色瓶中并置于阴凉处。
⑫强氧化性
③硝酸能氧化很多低价态的化合物,如S2- 、 SO32- 、I- 、Fe2+ 在酸性条件下NO3 - 与S2- 、SO32- 、 I - 、Fe2+ 因发生氧化还原反应不能共存于同一溶液中。
(3)装置D的目的是探究SO2 与品红作用的可逆性, 请写出实验操作及现象 ; 品红溶液褪色后,关闭分液漏斗的旋塞,点燃酒精 灯加热,溶液恢复为红色 。
例4.某化学兴趣小组为探究SO2的性质,按下图所示 装置进行实验。请回答下列问题:
(4)尾气可采用
NaOH
溶液吸收。
(2)还原性
在水溶液中二氧化硫是一种还原性较强的物质, 能使氯水(溴水、碘水)、三价铁盐溶液、酸性 高锰酸钾溶液褪色。 ①SO2+ X2+2H2O =4H++2X-+ SO42-(X=Cl、Br、I) ②SO2+2Fe3++2H2O=SO42-+2Fe2++4H+; ③5SO2+ 2MnO4-+2H2O =2Mn2++ 5SO42-+4H+
例2. [2012年普通高等学校招生全国统一考试
(山东卷)]下列由相关实验现象所推出的结论正 确的是 A . Cl2 、 SO2 均能使品红溶液褪色,说明二者 均有氧化性 B .向溶液中滴加酸化的 Ba(NO3)2 溶液出现白 色沉淀,说明该溶液中一定有SO42-
例2. [2012年普通高等学校招生全国统一考试
NO2 ⑤ ① NH4Cl ② NH3 ③ ⑨ N2 ④ NO ⑧ ⑩ HNO3 ⑥ ⑦
人教版高中化学高一化学必修一PPT课件硫和氮的氧化物

NO能使人中毒,其原理与CO相似,是通过 呼吸道被人体吸入后与血红蛋白结合生成 一氧化氮血红蛋白,使其失去携带O2的能力, 导致中毒。
2、NO2
(1)物理性质:
一种红棕色、有刺激性气味的有毒气体 密度比空气的大 易液化 易溶于水
(2)化学性质:
3NO2+H2O=2HNO3+NO
实验:请你设计实验,要求尽可能多地使 NO2被水吸收。
*据市场调查,市售一次性筷子 在制作时为了增白、防腐,也是 用硫磺熏蒸,因此多数一次性筷 子含二氧化硫量超标,提醒消费 者使用前先闻一下是否有酸味。
北京市场黄白两种银耳对比 中央电视台《生活》栏目
思考与交流:
SO2能使溴水、KMnO4溶液褪
色与SO2使品红褪色,实质相同吗?
我们知道SO2 和Cl2都具有漂白性。 为了使漂白性更强,有人提出将两 者混合使用,你认为这种做法能达 到预期目的吗?
实验步骤
1 将一支充满 NO2的试管 倒立在盛有 水的水槽中 制取少量的 氧气
现象
解释
红棕色气体逐渐消失, 3NO2+H2O=2HNO3 水位上升,最后充满试 +NO 管的2/3,无色气体充 满试管上部的1/3 2H2O2=2H2O+2O2↑
2
3
将氧气慢慢 无色气体变为红棕色气 2NO+O2=2 NO2 的通入步骤 体,又变为无色气体, 3NO2+H2O=2HNO3 1的试管中 气体体积减少,液面不 +NO 断上升
1.硫 (1)物理性质 黄色晶体,质脆。不溶于水,微溶于 酒精,易溶于二硫化碳。 (2)化学性质
S + O2 == SO2
S + Fe == FeS
△
点燃
二 氧 化 硫 的 化 学 性 质
高中化学专题-质量检测四硫氮和可持续发展

专题质量检测(四)硫、氮和可持续发展时间:60分钟满分:100分一、选择题(本题包括12小题,每小题5分,共60分)1.下列有关酸雨的说法不正确的是( )A.空气中的SO2溶于水,最终形成酸雨B.汽车排放的尾气、硝酸厂和化肥厂的废气都含有氮氧化物C.工业废水任意排放是造成酸雨的主要原因D.为了减少酸雨的形成,必须减少SO2的排放量,对燃料脱硫处理解析:选C 工业废水任意排放引起江河湖泊污染,而酸雨是由SO2和NO2引起的。
2.下列关于SO2和NO2的叙述中正确的是( )A.SO2可使紫色石蕊溶液褪色B.SO2与水作用生成H2SO4C.可用排水法收集NO2D.实验室可用NaOH溶液处理NO2和SO2废气解析:选D SO2不能漂白酸碱指示剂,不能使紫色石蕊溶液褪色,A错误;SO2与水作用生成H2SO3,B错误;NO2与水反应:3NO2+H2O===2HNO3+NO,C错误。
3.下列关于Cl、N、S等非金属元素单质及其化合物的说法正确的是( )A.漂白粉的成分是次氯酸钙B.实验室可用浓硫酸干燥硫化氢C.将浓氨水滴到氢氧化钠固体中可以制取氨气D.单质氯气及单质硫与铁反应生成的产物中,铁的化合价相同解析:选C A项,漂白粉的有效成分是次氯酸钙,主要成分有次氯酸钙和氯化钙,错误;B项,硫化氢有还原性,浓硫酸有强氧化性,二者发生氧化还原反应,不能用浓硫酸干燥硫化氢;C项,氢氧化钠具有吸水性,可以用浓氨水和氢氧化钠制取氨气,正确;D项,氯气和铁反应生成氯化铁,硫和铁反应生成硫化亚铁,铁的化合价不同。
4.下列关于浓硝酸和浓硫酸的叙述中正确的是( )A.常温下都可用铝制容器贮存B.露置在空气中,容器内酸液的质量都减轻C.常温下都能与铜较快反应D.露置在空气中,容器内酸液的浓度都增大解析:选A 浓H2SO4吸水增重,B错误;浓H2SO4常温下与Cu不反应,C错误;浓H2SO4吸水、浓HNO3挥发都会使酸液的浓度减小,D错误。
硫和氮的化合物课件2013年12.13
2.以下气体能用NaOH固体干燥的是( A ) A.NH3 B.SO2 C.CO2 D.HCl 3.下列气体中,不能用排空气法收集的使 ( C ) A.H2 B.CO2 C.NO D.O2 4.下列哪种方法可以鉴别CO2和SO2( B ) A.澄清石灰水 C.烧碱 B.品红溶液 D.盐酸
2.下列物质不属于“城市空气质量日报” 报道内容的是( ) C A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒 解析:城市空气质量日报的内容是二氧化 硫、氮氧化物和悬浮颗粒,而二氧化碳不 属于此报道内容。
2、一氧化氮(NO):
2)、NO的化学性质:
2NO + O2 = 2NO2(红棕色)
(工业制硝酸的第二步)
Байду номын сангаас
3、二氧化氮(NO2):
1)、NO2的物理性质:
毒气体 ② 密度比空气大 ③易液化(20℃)易溶于水并与 水反应 ④污染大气的有害物质之一
①红棕色、有刺激性气味的有
2)、NO2的化学性质:
由于它能与某些有色物质 化合生成不稳定的无色物质。 无色物质容易分解而使有色物 质恢复原来的颜色--暂时性 选择性:不能使紫色石蕊试液 褪色(石蕊变红)---化合漂白
氯水
二氧化硫
SO2与有色物质 原理 氯水中HClO 直接结合生成 将有色物质氧 不稳定的无色 化成无色物质 物质
实质
氧化还原 反应
非氧化还原 反应
7.为了除去混入CO2中的SO2,最好将混合气体通入下 列哪种溶液中(B ) A.饱和烧碱溶液 B.饱和小苏打溶液 C.饱和纯碱溶液 D.浓硫酸 解析:饱和烧碱与饱和纯碱溶液既吸收SO2吸收 CO2;浓硫酸不能吸收SO2,故不可能。 8. 以下气体因与人体血液中血红蛋白作用引起中毒的 是( AB ) A.NO B.CO C.NO2 D.NH3 解析:NO与CO一样,都能与Fe2+结合,使血红蛋白 失去输氧能力。
高中化学 第十讲 非金属元素氯、硫、氮专题指导课件

(1)氯水中的Cl2与碘化钾、溴化钠等发生置换反应。 如 : Cl2 + 2Br - ===_2_C_l_-_+__B__r2_ ; Cl2 + 2I - ===_2_C_l_-_+__I_2。 (2)氯水中含有次氯酸能表现__漂__白____作用。 (3)久置氯水因次氯酸不稳定见光分解产生___氧__气___失效: 2HClO ==光===2HCl+O2↑。
(4)Cl - 检 验 : 氯 水 中 含 有 __C_l_-__ , 加 AgNO3 有 白 色 _A__g_C_l_沉淀产生,Cl-+Ag+===AgCl↓(白)。
4.氯气的实验室制法 (1)原理:MnO2+4HCl(浓) ==△=== M__n_C_l_2+__H__2_O_+__C_l_2_。 (2)收集方法:用向上排空气法或排饱和食盐水法(吸收 HCl杂质);检验Cl2收集满的方法是用湿润淀粉碘化钾试纸放 到集气瓶口(检验碘生成)观察试纸是否__变__蓝____。
►知识回顾 1.氯气的物理性质 (1) 氯 气 是 __黄__绿____ 色 , 有 __刺__激__性__ 气 味 , 微 溶 于 水 的 ___有__毒___气体,吸入过多氯气会使人窒息死亡。 (2) 闻氯气 的方法是 稍打开瓶 盖 ,用手 轻轻地在 瓶口 ___扇__动___,使极少量的氯气___飘_____进鼻孔。 2.氯气的化学性质:Cl2具有很强的氧化性,能氧化大 多数非金属元素和金属元素。
(1)氯气与金属反应。 ①Na在Cl2中燃烧:2Na+Cl2 =点==燃== __2_N_a_C_l__。 ②Fe在Cl2中燃烧:2Fe+3Cl2 ==△=== _2_F__eC__l3__。
③Cu在Cl2中燃烧:Cu+Cl2 ==△=== _C_u_C__l2___。 (2)氯气与氢气反应:Cl2+H2 =点==燃== _2_H_C_l____。 注意:①纯净的H2在Cl2中燃烧产生_苍__白__色___火焰。②H2 在Cl2混合气燃烧、光照反应极易爆炸。
硫及其化合物硫酸的性质和制备

1.可以使紫色石蕊试液变红
2.与碱反应: H2SO4+2NaOH=Na2SO4+H2O 3.与金属反应: H2SO4+Zn=ZnSO4+H2↑ 4.与金属氧化物:H2SO4+CuO=CuSO4+H2O 5.与某些盐反应:H2SO4+BaCl2=BaSO4↓+2HCl
专题4 硫氮和可持续发展
第
一 单 元
硫及硫的化合物
含 硫
二氧化硫及酸雨
化
合
物 的
硫酸的性质
性
质
和 应
硫酸的制备
用
自然界中的硫
火 山 口 的 硫
火 山 爆 发
火山喷口
天
游离态
然
地壳岩层
硫
硫
化合态
硫化物:硫铁矿(FeS2)等
硫酸盐:芒硝(Na2SO4·10H2O) 石膏(CaSO4·2H2O) 重晶石(BaSO4)
CO2
SO2
与水反应 CO2 + H2O
H2CO3
与碱反应 CO2 + 2NaOH = Na2CO3 + H2O
CO2 + Ca(OH)2 = CaCO3 + H2O
与碱性氧 化物反应 CO2 + CaO = CaCO3
2、从S元素化合价看: 既有氧化性又有还原性
3、特殊性质: ?
二、SO2的化学性质
煤和石油中 蛋白质中
一.硫单质
1、硫单质的性质 (1)物理性质: 淡黄色粉末,不溶于水、微溶于酒精、易溶 于CS2,熔、沸点较低。
同素异形体: 斜方硫、单斜硫等多种
(2)化学性质:----既有氧化性又有还原性
氮及其化合物中小学PPT教学课件

B.氨水中滴入酚酞变红,是因为氨气能电离出氢氧
根离子
C.因氨水中的氨主要以NH3·H2O的形式存在,故25% 的氨水是指每100 g氨水中含NH3·H2O 25 g
D.NH3·H2O的热不稳定性可以解释实验室中用加热氨 水的方法制取氨气
解析:氨气极易溶于水,常温下1体积的水溶解约700 体积的氨气,故A项中剩余气体中不含氨气,错误; 氨水显碱性的原因是氨气与水反应生成的一水合氨电 离出氢氧根离子,B项错误;虽然氨在其水溶液中主 要以一水合氨的形式存在,但习惯上认为氨水的溶质 是氨,C项错误;NH3·H2O不稳定,受热容易分解, 向浓氨水中加入氧化钙制取氨气的原因之一就是氧化 钙与水反应消耗水以及反应放热.
V(O2)=1.4 mL,V(NO2)=(4×1.4 mL)+3 mL=8.6 mL.
[答案] 7.2 mL NO2和2.8 mL O2或8.6 mL NO2和1.4 mL O2
1.如图所示,试管中盛装的是红棕色气 体(可能是混合物),当倒扣在盛有水 的水槽中时,试管内水面上升,但不 能充满试管,当向试管内鼓入氧气后, 可以观察到试管中水柱继续上升,经过多次重复后,试 管内完全被水充满,原来试管中盛装的可能是什么气体 ()
(2)若剩余的1 mL气体是NO,根据3NO2+H2O === 2HNO3+NO,则发生反应4NO2+O2+2H2O === 4HNO3 时过量的NO2体积为3 mL,设反应的O2的体积为y,则有 4NO2+O2+2H2O === 4HNO3
4y
y
则(4y+3)mL+y=10 mL,解得:y=1.4 mL,
答案:(1)C+4HNO3(浓)= =△= = = CO2↑+4NO2↑+2H2O
(2)
(3)加热
人教课标版 硫和氮的氧化物PPT15(说课)

三、学法指导
在教学过程中,以实验探究为主, 合作学习和自主学习为辅,充分发挥实 验探究的作用,通过创设情景,提出问 题,给学生提供了广阔的交流与讨论空 间以及展示自己的空间,力求让学生在 和谐、愉快的氛围中进行探究学习,体 验到学习的乐趣。
2.教学三维目标
(1)知识与技能:
了解二氧化硫的物理性质和用途,使学生掌握二 氧化硫的化学性质;通过学生动手实验,培养学生的实 验能力,观察能力和思维能力。
(2) 过程与方法:
通过探究活动过程,了解化学学习方法的科学 性, 使学生通过实验探究归纳出SO2的性质;培养学 生的实验探究能力、团队协作能力和思维的逻辑性。
和空气的平均相对分子质量 比空气密度大 对比
0C 容易液化 沸点为-10
易溶于水(1︰40)
二氧化硫溶于水 实验4-7:
二氧化硫溶于水
往二氧化硫水溶液中滴 加品红溶液
二、二氧化硫
1. 物理性质: 二氧化硫是一种无色有刺激性气味的 有毒的气体,密度比空气大,易溶于水, 在常温、常压下,1体积水大约能溶解40体 积的SO2 。
Ⅱ
Ⅱ Ⅰ Ⅱ Ⅲ1 Ⅱ Ⅲ1
良
良 优 良
轻微污染
良 轻微污染
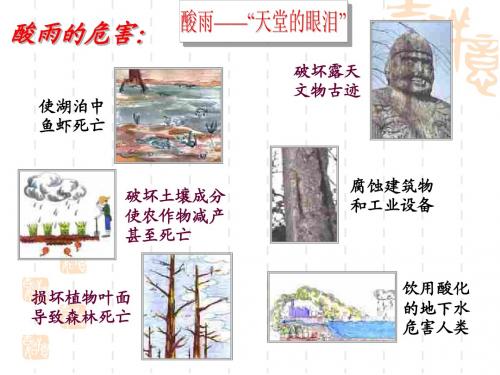
二氧化硫、二氧化氮会带来什么危害?
腐 蚀 前 的 大 佛
腐 蚀 前 的 森 林
腐 蚀 后 的 大 佛
腐 蚀 后 的 森 林
左侧图片摄于1908年
右侧图片摄于1968年
第一课时
