第五章__晶体化学
新人教版版高考化学总复习第五章晶体结构与性质教案
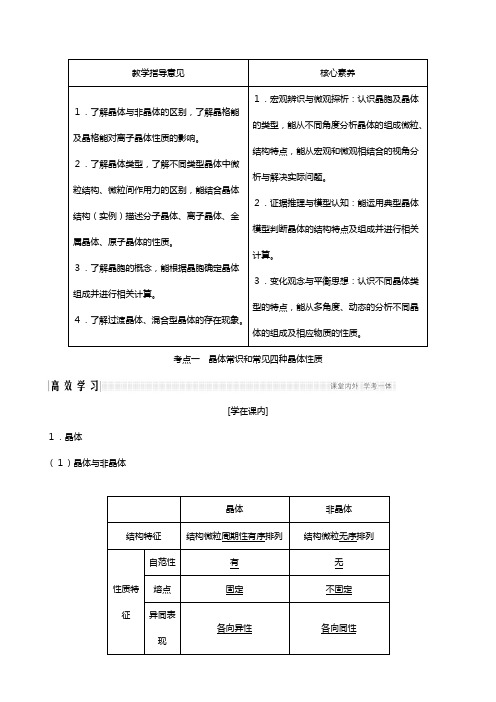
教学指导意见核心素养1.了解晶体与非晶体的区别,了解晶格能及晶格能对离子晶体性质的影响。
2.了解晶体类型,了解不同类型晶体中微粒结构、微粒间作用力的区别,能结合晶体结构(实例)描述分子晶体、离子晶体、金属晶体、原子晶体的性质。
3.了解晶胞的概念,能根据晶胞确定晶体组成并进行相关计算。
4.了解过渡晶体、混合型晶体的存在现象。
1.宏观辨识与微观探析:认识晶胞及晶体的类型,能从不同角度分析晶体的组成微粒、结构特点,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:能运用典型晶体模型判断晶体的结构特点及组成并进行相关计算。
3.变化观念与平衡思想:认识不同晶体类型的特点,能从多角度、动态的分析不同晶体的组成及相应物质的性质。
考点一晶体常识和常见四种晶体性质[学在课内]1.晶体(1)晶体与非晶体晶体非晶体结构特征结构微粒周期性有序排列结构微粒无序排列性质特征自范性有无熔点固定不固定异同表现各向异性各向同性对固体进行X射线衍射实验(2)得到晶体的途径1熔融态物质凝固。
2气态物质冷却不经液态直接凝固(凝华)。
3溶质从溶液中析出。
(3)晶胞1概念:描述晶体结构的基本单元。
2晶体中晶胞的排列——无隙并置A.无隙:相邻晶胞之间没有任何间隙。
B.并置:所有晶胞平行排列、取向相同。
(4)晶格能1定义:气态离子形成1摩尔离子晶体释放的能量,通常取正值,单位:kJ·mol—1。
2影响因素A.离子所带电荷数:离子所带电荷数越多,晶格能越大。
B.离子的半径:离子的半径越小,晶格能越大。
3与离子晶体性质的关系晶格能越大,形成的离子晶体越稳定,且熔点越高,硬度越大。
[名师点拨](1)具有规则几何外形的固体不一定是晶体,如玻璃。
(2)晶胞是从晶体中“截取”出来具有代表性的“平行六面体”,但不一定是最小的“平行六面体”。
2.四种晶体类型的比较[考在课外]教材延伸判断正误(1)晶体和非晶体的本质区别是晶体中粒子在微观空间里呈周期性的有序排列。
晶体结构、晶胞教案

晶体结构、晶胞教案第一章:晶体结构概述1.1 晶体与非晶体的区别定义晶体与非晶体晶体的有序排列与非晶体的无序排列1.2 晶体结构的类型离子晶体分子晶体金属晶体原子晶体1.3 晶体结构的基本特征晶体的周期性排列晶体的对称性晶体的空间点阵第二章:晶胞的概念与计算2.1 晶胞的定义晶胞的概念晶胞的构成2.2 晶胞的计算晶胞的体积计算晶胞中粒子的数量计算2.3 晶胞的类型简单晶胞体心立方晶胞六方最密堆积晶胞面心立方晶胞第三章:离子晶体结构3.1 离子晶体的定义与特点离子晶体的定义离子晶体的电荷平衡3.2 离子晶体的结构类型简单离子晶体复杂离子晶体3.3 离子晶体的空间结构晶体的晶胞参数晶体的晶胞中原子的位置第四章:分子晶体结构4.1 分子晶体的定义与特点分子晶体的定义分子晶体的分子间作用力4.2 分子晶体的结构类型线性分子晶体非线性分子晶体4.3 分子晶体的空间结构晶体的分子间作用力第五章:金属晶体结构5.1 金属晶体的定义与特点金属晶体的定义金属晶体的自由电子5.2 金属晶体的结构类型体心立方金属晶体面心立方金属晶体5.3 金属晶体的空间结构晶体的原子排列晶体的金属键第六章:原子晶体结构6.1 原子晶体的定义与特点原子晶体的定义原子晶体的共价键6.2 原子晶体的结构类型简单立方原子晶体面心立方原子晶体体心立方原子晶体6.3 原子晶体的空间结构晶体的原子排列第七章:六方最密堆积晶胞7.1 六方最密堆积晶胞的定义与特点六方最密堆积晶胞的定义六方最密堆积晶胞的空间利用率7.2 六方最密堆积晶胞的结构类型简单六方最密堆积晶胞体心六方最密堆积晶胞7.3 六方最密堆积晶胞的空间结构晶胞的原子排列晶胞的堆积方式第八章:晶体的生长与形态8.1 晶体生长的基本过程成核过程生长过程8.2 影响晶体生长的因素温度压力溶液的浓度8.3 晶体的形态晶体的表面形状晶体的内部结构第九章:晶体的物理性质9.1 晶体物理性质的定义与特点晶体物理性质的定义晶体物理性质的分类9.2 晶体物理性质的测量方法热分析光谱分析电学测量9.3 晶体物理性质的应用光学器件电子器件传感器第十章:晶体的化学性质10.1 晶体化学性质的定义与特点晶体化学性质的定义晶体化学性质的分类10.2 晶体化学性质的表征方法化学反应电化学测量光谱分析10.3 晶体化学性质的应用催化剂材料腐蚀与保护药物设计第十一章:晶体的应用领域11.1 晶体在电子学中的应用半导体晶体集成电路11.2 晶体在光学中的应用激光晶体光纤11.3 晶体在材料科学中的应用超导材料耐高温材料第十二章:晶体结构的研究方法12.1 X射线晶体学X射线衍射原理晶体学方程12.2 核磁共振(NMR)NMR原理晶体结构分析12.3 电子显微镜透射电子显微镜(TEM)扫描电子显微镜(SEM)第十三章:现代晶体学技术13.1 自动化晶体学自动化晶体生长自动化晶体测试13.2 计算晶体学分子动力学模拟量子化学计算13.3 纳米晶体技术纳米晶体合成纳米晶体应用第十四章:晶体生长的实验技术14.1 晶体生长的实验室设备炉子培养皿温度控制器14.2 实验操作步骤晶体生长的准备晶体生长的监控晶体的提取与清洗14.3 实验中常见问题与解决方法晶体生长速率控制晶体质量评估实验失败分析第十五章:晶体学的未来发展趋势15.1 新型晶体材料的探索高温超导体拓扑绝缘体15.2 晶体学与其他学科的交叉生物学与晶体学的结合化学与晶体学的结合15.3 晶体学技术的创新新型衍射技术高通量晶体生长技术重点和难点解析重点:理解晶体与非晶体的区别,掌握不同类型晶体结构的特点,了解晶胞的概念和计算方法,以及晶体结构对晶体性质的影响。
第5章固溶体
§5-3 间隙型固溶体
1.定义:杂质原子进入晶格的间隙位置而形成的固溶体。
2.影响因素 (1)溶质原子的大小和溶剂晶体空隙大小 溶质原子的半径小和溶剂晶体结构空隙大容易形成间隙型 固溶体。例:MgO只有四面体空隙可以填充,TiO2结构中还有 1/2 八面体空隙孔可以利用,CaF2中有1/2“立方体空隙”可以被 利用。沸石由硅、铝氧四面体组成的架状结构比长石开敞得多, 有很多大小均一的空洞和孔道为阳离子和水分子所占据,结合 很松,水可以可逆的脱附,阳离子也容易发生可逆的离子交换。 片沸石结构式为 Ca4[(AlO2)8(SiO2)28]•24H2O: 则晶体形成间隙固溶体的次序必然是: 片沸石>CaF2>TiO2&g. 按溶质原子在溶剂晶格中的位置划分: a. 置换型固溶体:晶体中一种离子被杂质原子置换。 Cr2O3→Al2O3 , MgO-CoO,PbZrO3-PbTiO3 ,在金
属氧化物中,主要发生在金属离子位置上的置换。
b. 填隙型固溶体:杂质原子进入晶格中的间隙位置。 金属和H、B、C、N等形成的固溶体都是间隙式固 溶体。
点为490℃,发生相变时,晶格常数剧烈变化,在常温下发生 开裂。PbZrO3 是一种反铁电体,居里点为230℃。两者结构 相同,Zr4+、Ti4+离子尺寸相差不多,能在常温生成连续固溶 体Pb(ZrxTi1-x)O3,x=0.1~0.3。在斜方铁电体和四方铁电体的 边界组成Pb(Zr0.54Ti0.46)O3处,压电性能、介电常数都达到最 大值,烧结性能也很好,被命名为PZT陶瓷。
1)高价置换低价产生阳离子空位: Al2O3―→2AlMg.. +VMg''+ 3Oo 2)低价置换高价产生阴离子空位:
结构化学第5章--晶体结构-5-04

结构 类型
点阵型 式
caesium chloride
CsCl
sodium chloride NaCl
立方P
立方 F
Zine blende structure
wurtzide structure
立方 ZnS
六方 ZnS
立方F 六方
calsium fluoride CaF2
rutile structቤተ መጻሕፍቲ ባይዱre TiO2
NaCl rNa+/rCl-=959pm/181pm=0.525 Na+填在Cl-堆积的八面体空隙中. CsCl rCs+/rCl-=169pm/181pm=0.934 Cs+填在Cl-堆积的正方体空隙中。
⑵正、负离子的配位数和离子晶体结构参数 对于简单的二元离子晶体来说,除正负离子半径比决定离 子晶体的结构类型外,离子晶体堆积的紧密程度(负离子 堆积产生的空隙是否被正离子填充满等)也影响着晶体的 结构型式。若Z+、Z-分别为正负离子的电荷数,n+、n-分 别为正负离子数,CN+、 CN-分别为正负离子的配位数, 有
电负性较大的非金属元素和电负性较小的金属元 素生成的化合物一般都是离子化合物。在离子化合物 中,金属元素将价电子转移给非金属,形成具有较稳 定电子结构的正、负离子。正、负离子由于静电力互 相吸引靠近,当它们充分靠近时又会因电子云重叠而 相互排斥。当吸引和排斥相平衡时,形成稳定的离子 化合物。由此可知,离子化合物中存在的结合力是以 正、负离子间静电力为基础的离子键。正、负离子具 有球对称的电子云(Unsöld定理),所以离子键也和金属 键一样没有饱和性和方向性。离子键向空间各个方向 发展,即形成了离子晶体。
立方F 四方P
中科大《结晶化学导论》第5章——唐凯斌2015

2、非单相
无明显取向晶粒 衍射峰相对强度的变化 与PDF卡数据基本一致。
(100)晶面的多级衍射增强。
六方ZnO hkl I 100 57 002 44 101 100 102 23 110 32 103 29 200 4 112 23 201 11
第三节 粉末衍射指标化
• 立方晶系指标化
• 粉末衍射图指标化示例
取立方晶系: a = 3.899Å 100 3.899 110 2.763 111 2.253 200 1.956 201 1.747 211 1.598 220 1.383
取四方晶系: at = 21/2 a = 5.514Å ct = 2a = 7.798Å
电子衍射 210
• 空间群判断示例
GdPS4的指标化结果:四方I格子,a = 1.072, c = 1.9096nm
考虑特殊衍射类型: 1、c方向:
hk0型衍射为200、 220、400、420、440、 620、640等,垂直c方 向可能存在a,b滑移 面。对于I格子,a、b 共存,垂直c方向的滑 移面为a。
00l型衍射只出现004、 008,对于四方晶系, 对应41螺旋轴,可初步 判断c方向对称元素为 41/a。
样品竖直测角仪
、连动
样品水平型测角仪
粉末衍射要求样品是十分细小的粉末颗粒,使试样在 受光照的区域中有足够多数目的晶粒,且试样受光照区域 中晶粒的取向是随机的,以得到强度相对准确的衍射峰。
粉末衍射要求样品表面是尽可能平整的平面,制样过程 中,样品应尽可能地与样品板参考面平齐,以得到位置相对 准确的衍射峰。如样品高于参考面,测得的值比真实值大, 衍射峰d值变小;反之d值变大。
CsCl Pm3m -Fe Im3m Cu Fm3m
晶体结构

第五章 晶体结构安徽师范大学化学与材料科学学院§51晶体的点阵理论晶体具有按一定几何规律排列的内部结构,即晶 体由原子(离子、原子团或离子团)近似无限地、在三 维空间周期性地呈重复排列而成。
这种结构上的长 程有序,是晶体与气体、液体以及非晶态固体的本 质区别。
晶体的内部结构称为晶体结构。
1. 晶体的结构特征(1)均匀性(2) 各向异性(3) 自发形成多面体外形(4) 具有确定的熔点(5) 对称性(6) X射线衍射2.周期性下面两个图形均表现出周期性:沿直线方向,每 隔相同的距离,就会出现相同的图案。
如果在图形 中划出一个最小的重复单位(阴影部分所示),通 过平移,将该单位沿直线向两端周期性重复排列, 就构成了上面的图形。
最小重复单位的选择不是唯一的,例如,在图(a) 中,下面任何一个图案都可以作为最小的重复单位。
点的位置可以任意指定,可以在单位中或边缘的任 何位置,但一旦指定后,每个单位中的点的位置必须 相同。
如,不论点的位置如何选取,最后得到的一组点在空间 的取向以及相邻点的间距不会发生变化。
3.结构基元在晶体中,原子(离子、原子团或离子团)周期性地重 复排列。
上面我们在图形找出了最小的重复单位,类似 的,可以在晶体中划出结构基元。
结构基元是指晶体中 能够通过平移在空间重复排列的基本结构单位。
【例1】一维实例:在直线上等间距排列的原子。
一个原子组成一个结构基元,它同时也是基本的化学组成单位。
结构基元必须满足如下四个条件:化学组成相同;空间结构相 同;排列取向相同;周围环境相同。
【例2】一维实例:在伸展的聚乙烯链中,CH2CH2组成一个 结构基元,而不是CH2。
【例3】二维实例:层状石墨分子,其结构基元由两个C原子组 成(相邻的2个C原子的周围环境不同)。
结构基元可以有不同的选法,但其中的原子种类和数目应保 持不变。
化工原理下第五章-结晶

搅拌,
溶液中杂质, 溶液的历史, 晶核的探测方法,等。
过饱和度的表示法
• 浓度差, ∆C
∆C=C-C*
• 过饱和度比, S
S=C/C*
• 相对过饱和度, σ
σ=S-1
式中,C 是过饱和溶液的浓度, C* 是在相同温度下溶质的溶解度。
过饱和度的产生
在化学工业、医药工业中,结晶操作的结晶过饱和度的产生方法有: 2. 冷却法 • 溶质的溶解度与温度有较大的变化关系,如KNO3 蒸发法
c β b γ
α a a c b
三维空间点阵
晶体常数
晶系 — 布拉维系
a a a a c a c b a
立方
(1S, 1Bd, 1F)
abc
四方
(1S, 1Bd)
abc
90 o
正交
(1S, 1Bd, 1Bs, 1F)
abc
90 o
90 o
c
c
a
a a a a
a
b
β
b
α
β γ
a
α
a
α α
120o
单斜
abc
90 o
三斜
abc
三方
abc
90 o
六方
abc
90 o
90 o 120o
(1S, 1Bs)
(1S)
(1S)
(1S)
素晶胞和复晶胞
又可分为: 溶解法 结晶法
溶液浓度的测定
1. 干燥残渣测定法(Dry residue,也叫称重法)
2. 分光光度法
3. 化学分析法 4. 密度法 5. 黏度法 6. 电导率测定法
晶体化学

Fe3+-O2-平均键价的计算
S = ( R/ R0) –N
式中— S 键价; R 键长= R++R-=0.67+1.32=1.99 nm; R0为S=1时的R值,也称为单价键长; N为大于1的数值,N越大,S随R的变化就越敏感; R0 、N是与原子种类、价态有关的经验常数,查表求得; R0 (Fe3+)=1.78;N (Fe3+) =5.7 故 S = 0.529 每个原子所连诸键的键价之和等于该原子的原子价。
O2-离子 Fe3+离子
第一层
第二层
第三层
12121212………
123123123123………
六方最紧密堆积单位晶胞
立方最紧密堆积单位晶胞
四面体空隙
八面体空隙
Fe3+-O2-阴阳离子间的静电引力计算
F (单位:库伦)
式中—F 阴离子与阳离子之间的静电引力,(C库伦); Z+Z-阴阳离子的电价,ZFe3+=3 ;ZO2-=2 ; e 电子的电量,1.6 ×10 – 19 (C); Rc 阳离子半径,RG(Fe3+)=0.067nm=6. 7×10-11m ; Ra 阴离子半径,RP(O2-)=0.132nm=1.32×10-10 m; K 常数,9×109Nm2/ C2; 求得 : FFe-O = 6.947×10-18 C
式中—σ阴阳离子的键合强度; K 键合强度系数, 大小取决于共价程度; Wk 正离子电价,+3; Wa 负离子电价,-2; CN 正离子配位数=6,R+/R-=0.67/1.32=0.507; d Fe3+-O2-离子间距,1.99nm; β键合弱化系数, β= 0.7~1.0 。 相对键合强度越大,键越牢固,矿物解理时键就越难断裂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
① 由于极化,正负离子的间距缩短,甚至 导致配位数下降,整个晶体的结构类型发生 变化。 例: ZnO:R+∕R-=0.63,CN=6(NaCl型) 实际CN=4(ZnS型) CaO:R+∕R-=0.80,CN=8(CsCl型)
实际 CN=6(NaCl型)
② 由于极化,正负离子的电子云重叠,离子 键的性质发生变化,向共价键过渡。 例: 硅离子 r=0.4;氧离子 r=1.40 计算 Si-O半径=1.80;O-O半径=2.80 实测: =1.60 =2.60
每个硅以自 旋相反的电 子对,分别 与四个最邻 近的硅原子 结合,形成 四个共价键 ——金刚石 形结构。
砷 的 晶 体 结 构
每个As原子与 另外三个As原 子配位,层结 构显出皱褶状, 层间距大于原 子间距(键 长)。图中虚 线表示一个晶 胞范围。
共价晶体的性质
共价键的结合力通常要比离子 键强,所以共价键具有强度高、硬 度高、脆性大、熔点高、沸点高和 挥发性低等特性,结构也比较稳定, 导电能力差。
4、晶体中化学键的类型
化学键: 离子键、共价键和金属键。
返回目录
非化学性: 范德华力
金属键
共价键
范德瓦尔键
大多数实际 材料的键合 可以用四面 体表面右内 部的一个点 表示。
离子键
键型四面体
离子晶体特点
陶瓷材料中的晶相大多属离子晶体。 离子晶体是由正负离子通过离子键, 按一定方式堆积起来而形成 的。由于离 子键的结合力很大,所以离子晶体在硬 度高、强度大、熔点和沸点较高,热膨 胀系数较小,但脆性大;良好绝缘体; 往往无色透明。
五、节省规则
一个晶体结构中,本质不同的结构 组元种类,倾向于为数最少。 如硅酸盐中,不会同时存在[SiO4]4和[SiO7]6-等不同的构造单元(个别例外).
6.
类质同像
返回目录
1.类质同像的概念
在晶体结构中某离子被其它类似的离子代替, 但不引起键性和晶体结构型式发生质变的现象。 例如镁橄榄石Mg2[SiO4]晶体,其晶格中Mg2+可 以被Fe2+所替代占据,由此形成的橄榄石 (Mg, Fe)2[SiO4]晶体。并且 Mg2+被Fe2+替代可以任意比例, 形成一个系列: Mg2[SiO4]----------------------------------- Fe2[SiO4] 镁橄榄石 橄榄石混晶或固溶体 铁橄榄石 这种情况称完全类质同像系列。
B—O之间有〔BO3〕和〔BO4〕两种。
3、离子的极化
返回目录
离子极化:就是指离子在外电场作用下,改变其形 状和大小的现象。
离子在其他离子所产生的外电场的作用下发 生极化,即被极化。 离子以其本身的电场作用于周围离子,使其 他离子极化,即主极化。
+ - + -
未极化
已极化
在离子晶体中:
阴离子半径较大,易于变形被极化,主 极化能力较低。 阳离子半径较小,电价较高,主极化作 用力大,被极化程度较低。
Rk∕Ra = 2 -1=0.414。此值是阳离子作为六次配位的下 限值。
Rk∕Ra <0.414时,表明阳离子过小,不能同时与周围的 六个阴离子都紧密接触,离子可在其中移动,结构是不稳 定的。
作为六次配位下限值的0.414也是 四次配位的上限值。
当Rk∕Ra的值等于或接近于0.414时, 阳离子有成为四次和六次两种配位的可 能。
Hexagonal closet packing,hcp
密堆
hcp的有:
Be、Mg、 Zn、Cd
fcc的有:
Al、γ-Fe、 Ni、Cu、Ag、 Au
堆积系数、致密度
等径圆球的各种最紧密堆积形式具有相同 的堆积密度,其堆积系数即球体积与整个堆积 体积比均为0.7405. 以立方面心为例计算:
V球 = 4(4/3πR3) = 16/3πR3 V晶胞=a3=(2 2 R)3=16 2 R3 堆积系数=V球/V晶胞=0.7405
共价晶体
共价晶体受共价键合轨道数和方向性的约 束,一个特定原子的最邻近原子数是有限制的, 达不到密堆积程度,堆积效率较低。如金刚石 晶体的堆积系数仅有0.34。 8-N(8减N,N表示这个原子最外层的电子 数)法则反映了某个元素在结合成共价晶体时, 所能获得的最大成键轨道数目。
硅 晶 体 结 构
最终出现:AB、AB、AB……的周期性重复 (两层重复)。等同点按六方格子排列,故称六 方最紧密堆积。密排层平行(0001)方向。
②第二种堆积是在由六个球围成的八面体空隙上进 行的,即第三层球堆在第一层与第二层球形成的八 面体空隙之上…...
发现第四层与第一层重复(中心投影位置重 合),第五层与第二层重复,第六层与第三层重复, 如此堆积下去,出现了:ABC、ABC、ABC…的周期 重复。
致密坚硬、富有韧性的金属或合金, 被广泛用作各种建筑的骨架材料,如高耸 的大厦。 金属有明亮悦目的光泽,用作装饰物。 良好的导电、导热性。稳定性以及抗腐 蚀性。
不等大球体的紧密堆积
当大小不等的球体进行堆积时, 其中较大的球将按六方和立方最紧密 堆积方式进行堆积,而较小的球则按 自身体积的大小填入其中的八面体空 隙中或四面体空隙中(离子化合物晶 体)。
——离子半径比
在离子不发生变形或者变形很小的情况 下,离子的配位数取决于正负离子的半径比。 以配位数为六的情况说明:
位于配位多面体中心的阳离子充填于被 分布在八面体顶角上的六个阴离子围成的八面 体空隙中,并且恰好与周围的六个阴离子均紧 密接触。取八面体中包含两个四次轴的平面。
图中直角三角形ABC可以算出:
另一种是由四个球围成的空隙,称为四面体空隙。
n个等大球体作最紧密堆积时,就必 定有n个八面体空隙和2n个四面体空隙
第三层球的排列 (C): ① 第一种堆积方式 是在四面体空隙上 进行的。即将第三 层球堆放在第一层 与第二层球体所形 成的四面体空隙的 位置上叠置结果, 会出现第三层球与 第一层球,球中心 投影位置重合……
在两种最基本 的最紧密堆积 方 式中,每个球体所 接触到的同径球体 个数为12(即配位 数等于12)。
CN=12
立方最紧密堆积: ABCABC…方式堆积(c图) Cubic closest packing,ccp或face center cubic,fcc. 六方最紧密堆积
密堆
ABAB…方式堆积(b图)
离 子 晶 体 的 结 构
NaCl晶体的结构
NaCl晶体结构
2、配位数和配位多面体
返回目录
配位数: 指每个原子或离子周围与之相接触
的原子个数或异号离子的个数。 配位多面体:各配位离子或原子的中心连线 所构成的多面体 影响配位的因素: 质点的相对大小 堆积的紧密程度 质点间化学键性质
重点:质点(正负离子)的相对大小
球体的紧密堆积
第一层球的排列 两层球的堆积
三角形空隙类型
尖 角 向 上
尖 角 向 下
第二层球排列(B):第二层球在堆积于第一层之上时,每球 只有与第一层的三个球同时接触才算是 最稳定的。即位于三角形空隙的位置。
八面体空隙
四面体空隙
两层球,作最紧密堆积,出现了两种不同的空隙: 一是由六个球围金属单质的结构与性质
◆ 由于金属采用密堆积结构以及离 域电子的金属键,在几何因素和电子 因素两方面的作用下,使金属容易形 成组成可变的合金,并具有许多宝贵 的特性和应用。 ◆ 如金属在锻压或锤打下,原子密 堆积层之间发生相对移动时,能保持 密堆积结构和金属键,而使金属具有 延展性。
返回目录
5、矿物晶体的结构规律
哥氏结晶化学规律 鲍林规则
哥希密特结晶化学定律
晶体的结构,取决于其组成质点 的数量、大小关系与极化性能。
不同的离子,形成的晶体结构是不同的。如 MgO与CsCl 同种离子,在不同的情况下,可形成不同的结 构。如Al、硼、铁、钛等。
化合物中,阴阳离子的比例不同所形成的结构 也是不同的。如:AX与A2X TiO2(金红石结构)和Ti2O3(刚玉结构) Fe2O3(刚玉结构)和Fe3O4(反尖晶石结构) 组成质点大小不同,配位数和晶体结构也不同。 极化性能对晶体结构的影响。
第一规则的核心
阳离子配位数取决于阳离子和阴离子半 径的比值,而非两者的半径。 表6-4可见,同一种元素有不同的配位数。
二、静电价规则
稳定的晶体结构中,从所有相邻接的阳离子 到达一个阴离子的静电键的总强度(S),等于 阴离子的电荷数。 S = Z+/n (n为配位数)
如MgO。Mg2+配位数为6, 其S=1/3,每个O2-为6个氧八 面体所共有。即每个O2-是6个 镁氧八面体[MgO6]的公共顶点。 MgO属NaCl型结构,一个 氧和六个Mg相联系,氧的电价 是-2,则镁的静电价强度之和 也应是2,一个镁的静电价强度 是1/3,那么共需要6个镁.
· ·
· ·
四、含有不同阳离子时的情况
一个晶体结构中,有多种阳离子存在,则 高价、低配位数的配位多面体趋于尽可能互不 相连,它们中间由其它阳离子配位多面体隔开, 至多也只能以共顶方式相连。 在镁橄榄石Mg 2[SiO4]中, 存在着[MgO6]八 面体和[SiO4]四面体, [SiO4]四面体彼此互不 相连,距离较远,而与[MgO6]八面体共棱相连。 在其它硅酸盐中, [SiO4]四面体也只能共角顶。
萤石结构:
Ca2+的配位数是8, 则Ca-F键的静电价强度 为S=2/8=1/4,如要保 持结构稳定,则根据本 原则,需要4个F才能稳 定。
[AlO4]结构: 铝的S=3/4,如果[AlO4]四面体 直接相连,则一个氧被两个铝共用, 或说一个氧和两个铝相连接,那么, 按照规则,稳定吗? 3/4 + 3/4 =6/4=1.5,但氧的 电价是2,两者并不相等,所以结构 不稳定.
