结构化学第9章晶体的结构习题解答
结构化学答案

连结其中任意两点可得一向量,将各点按此向量平移能复原的一组无限的点称为点阵。
点阵点:点阵中所有的点(抽象的)称点阵点,也称阵点。
结构基元:点阵中点的具体内容,或周期重复的最小单位。
2 晶体的基本性质a) 均匀性:化学组成等均匀,晶体任何一点在相同方向有相同的物理性质。
b) 各向异性:不同方向上物理性质不同。
c) 多面体外形:晶面数F+顶点数V=晶棱数E+2d) 确定的熔点e) 对称性f) 存在X-射线的衍射1. 前线轨道理论要点:①分子轨道中已填充电子的能级最高的轨道称最高占据轨道(HOMO)--Highest Occuppied Molecular Orbitals), 能级最低的空轨道称最低空轨道(LUMO--LowestUnoccuppied Molecular Orbitals), 统称前线轨道.②分子的前线轨道(类似与原子中的价轨道)在分子反应过程中起决定性的作用. 当两个分子相互接近时, 一个分子的HOMO与另一个分子的LUMO相互作用, 而且必须对称性匹配, 即正-正, 负-负进行叠加.同时2个分子的HOMO与LUMO能级应大致相近, 电子转移方向应与电负性一致, 这样有利于削弱旧键.注: 若1个电子/轨道, 称半占据轨道SOMO(Singly OccuppiedMO), 该轨道既是HOMO又是LUMO.(该轨道既可失去电子又可得到电子).2 分子轨道对称守恒原理将整个分子一起考虑, 在基元反应中, 若反应物和产物的分子轨道对称性一致, 反应容易进行. 即从反应物、过渡态到产物, 分子轨道始终保持某一点群的对称性, 反应容易进行.顺旋过程: 保持C2点群对称;对旋过程: 保持CS点群对称.要点:①反应物的分子轨道与产物的分子轨道一一对应;②相关轨道的对称性相同;③相关轨道的能级相近;④对称性相同的相关线不相交.如果产物的成键轨道与反应物的成键轨道相关联,活化能低,易于进行,加热能实现.如果成键轨道与反键轨道相关联,活化能高,难于反应,在光照条件下, 将基态电子激发到激发态才能反应.点群若一个分子所有对称操作构成一个群,这个群称为点群. 包括2个含义:(a) 都是点操作,至少有一个点不动; (b) 全部对称元素,至少通过一个公共点.成键条件(成键3原则):①能级相近:原子中最外层电子的能级高低相近. 能级低的分子轨道会含有较多的低能级的原子轨道的成分(组合系数表示);能级高的分子轨道会含有较多的高能级的原子轨道的成分.②轨道最大重叠使β积分最大,成键时体系能量降低较多. 因此,共价键具有方向性. 同时也会保证S积分最大.③对称性匹配(首要条件)轨道重叠时,必须有相同的符号(组成分子轨道的原子轨道必须有相同的对称性,即属于同一个不可约表示)1 分子轨道理论(Molecularorbitalstheory)将H2+成键理论推广到一般分子.A 分子轨道定义分子中每个电子在由各个原子核和其他电子组成的平均势场中运动, 第i个电子的运动状态可用波函数ψi描述, ψi为分子中的单电子波函数,又称分子轨道(MO).ψi*ψi为电子i在空间分布的几率密度,ψi*ψi dτ为体积元dτ中的几率. 若i电子的Hamilton算符为:则整个分子有ψ1, ψ2,…, ψn,对应E1,E2,…,En.那么, 整个分子(或体系)的波函数为:Ψ=Πψi(轨道近似或单电子近似); 体系能量为: E =ΣEi.B分子轨道形成分子轨道ψi可近似地用原子轨道线性组合(LCAO -Linear combination of atomic orbitals)得到. φj为AO,ψi为MO. n个AO可组成n个MO.成键轨道:分子轨道能级低于原子轨道能级的MO;反键轨道:分子轨道能级高于原子轨道能级的MO;非键轨道:分子轨道能级等于原子轨道能级的MO3分子中电子排布3原则:Pauli不相容原理; 能量最低原理; Hund规则.3) 合格波函数或品优波函数的条件:由于波函数描述的波是几率波,所以波函数ψ必须满足下列三个条件:a. 单值. 即在空间每一点ψ只能有一个值;b. 连续. 即ψ的值不会出现突跃, 而且ψ对x, y,z的一级微商也是连续函数;c. 归一化. 即波函数必须是平方可积的,而且ψ在整个空间的积分必须等于1, 有符合这三个条件的波函数称为合格波函数或品优波函数。
《结构化学》(7-10章)习题答案全解
《结晶学基础》习题答案目录第7章答案----------------------------------------------------------------------1第8章答案---------------------------------------------------------------------12第9章答案---------------------------------------------------------------------20第10章答案------------------------------------------------------------------251《结晶学基础》第七章习题答案7001 单晶:一个晶体能基本上被一个空间点阵的单位矢量所贯穿。
多晶:包含许多颗晶粒,这些晶粒可能为同一品种,也可能不同品种,由于各晶粒在空间取向可能不同,不能被同一点阵的单位矢量贯穿。
7002 (D) 7004 简单立方; Cs +和Cl -; 4C 37005 (1) 立方F (2) A 和 B (3) 4 个 (4) 4 组 (5) 3a (6) a /2 7007 4n 个 A, 8n 个 B, n 为自然数。
7010 d 111= 249 pm ; d 211= 176 pm ; d 100= 432 pm 7011 六方; D 3h 70127013 依次为立方,四方,四方,正交,六方。
7014 立方 P ,立方 I ,立方 F ; 四方 P ,四方 I 。
7015 旋转轴,镜面,对称中心,反轴; 旋转轴,镜面,对称中心,反轴,点阵,螺旋轴,滑移面;n =1,2,3,4,6; 32个; 七个晶系; 14种空间点阵型式; 230个空间群。
7016 (1) 四方晶系 (2) 四方 I (3) D 4 (4) a =b ≠c , α=β=γ=90° 7017 (1) 单斜晶系,单斜 P (2) C 2h (3) C 2, m , i 7018 (2a ,3b ,c ):(326); (a ,b ,c ):(111); (6a ,3b ,3c ):(122); (2a ,-3b ,-3c ):(322)。
结构化学课后答案第9章晶体的结构习题解答

第9章 晶体结构和性质习题解答【9.1】若平面周期性结构系按下列单位并置重复堆砌而成,试画出它们的点阵结构,并指出结构基元。
●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○解:用虚线画出点阵结构如下图,各结构基元中圈和黑点数如下表:1234567○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○●●●●●●●●●●●●●●●●●●●●图序号 1 2 3 4 5 6 7 结构基元数 1 1 1 1 1 1 1 黑点数 1 1 1 1 0 2 4 圈数1112313【评注】 从实际周期性结构中抽取出点阵的关键是理解点阵的含义,即抽取的点按连接其中任意两点的向量平移后必须能够复原。
如果不考虑格子单位的对称性,任何点阵均可划出素单位来,且素单位的形状并不是唯一的,但面积是确定不变的。
如果考虑到格子单位的对称形,必须选取正当单位,即在对称性尽量高的前提下,选取含点阵点数目尽量少的单位,也即保持格子形状不变的条件下,格子中点阵点数目要尽量少。
例如,对2号图像,如果原图是正方形,对应的正当格子单位应该与原图等价(并非现在的矩形素格子),此时结构基元包含两个黑点与两个圆圈。
【9.2】有一AB 型晶体,晶胞中A 和B 的坐标参数分别为(0,0,0)和(12,12,12)。
指明该晶体的空间点阵型式和结构基元。
解:晶胞中只有一个A 和一个B ,因此不论该晶体属于哪一个晶系,只能是简单点阵,结构基元为一个AB 。
【9.3】已知金刚石立方晶胞的晶胞参数a =356.7pm 。
请写出其中碳原子的分数坐标,并计算C —C 键的键长和晶胞密度。
解:金刚石立方晶胞中包含8个碳原子,其分数坐标为:(0,0,0),1(2,12,0),(12,0,1)2,(0,12,1)2,(14,14,1)4,3(4,34,1)4,(34,14,3)4,(14,34,3)4(0,0,0)与(14,14,14)两个原子间的距离即为C -C 键长,由两点间距离公式求得:C-C 356.7154.4pm r ====密度-13-10323-1812.0g mol 3.51 g cm (356.710cm)(6.022 10mol )A ZM D N V -⨯⋅==⋅⨯⨯⨯ 【9.4】立方晶系金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400。
结构化学题库与答案 (17)

《结晶学基础》第九章习题9001 某二元离子晶体AB具有立方硫化锌型结构,试填写:(1) 该离子晶体的点阵型式:________________________;(2) 正离子A2+的分数坐标:_________________________;(3) 负离子B2-的分数坐标:_________________________;(4) 晶胞中结构基元数目:__________________________;(5) 每个结构基元由多少个A2+和B2-组成:____________;(6) 负离子B2-的堆积方式:_________________________;(7) 正离子所占空隙类型:__________________________;(8) 正离子所占空隙分数:__________________________;(9) 正离子至负离子间的静电键强度为:_____________ ;(10) 和负离子直接邻接的正离子与该负离子间的静电键强度总和:_______。
9002 已知立方ZnS的立方晶胞参数a=541pm,Zn和S的相对原子质量分别为65.4 和32.0,试回答:(1) Zn和S原子在晶胞中的坐标参数;(2) Zn—S键长;(3) ZnS的晶体密度;(4) 计算330衍射面间距d330的值;(5) 估计衍射330的衍射强度。
9003 已知立方ZnS(闪锌矿)晶体晶胞参数a= 540.6?pm,求Zn—S键长。
9004 CaF2属立方晶系,正当晶胞中含有4个钙原子,其分数坐标为(0,0,0),(0,1/2,1/2),(1/2,0, 1/2),(1/2,1/2,0);八个氟原子,其分数坐标为(1/4,1/4,1/4),(1/4,3/4,1/4),(3/4,1/4,1/4),(1/4,1/4,3/4),(3/4,3/4,3/4),(3/4,3/4,1/4),(3/4,1/4,3/4),(1/4,3/4,3/4)。
结构化学结构练习题及答案

晶体练习题晶体练习题7002有一AB 晶胞,其中A 和B 原子的分数坐标为A(0,0,0),B(1/2,1/2,1/2),属于:------------------------------------ ( D )(A) 立方体心点阵立方体心点阵 (B) 立方面心点阵立方面心点阵 (C) 立方底心点阵立方底心点阵 (D) 立方简单点阵立方简单点阵 7004从CsCl 晶体中能抽出__简单立方______点阵,结构基元是___ Cs +和Cl -;_____,所属晶系的特征对称元素是____4C 3 ____。
7005某 AB 型晶体属立方型晶体属立方 ZnS 型,请回答下列问题:型,请回答下列问题: (1) 从该晶体中可抽取出什么空间点阵?从该晶体中可抽取出什么空间点阵? (2) 该晶体的结构基元为何?该晶体的结构基元为何?(3) 正当晶胞中含有几个结构基元?正当晶胞中含有几个结构基元? (4) 应写出几组应写出几组 B 原子的分数坐标?原子的分数坐标?(5) 晶胞棱长为晶胞棱长为a ,求在C 3轴方向上轴方向上 A —A 最短距离;最短距离; (6) 晶胞棱长为晶胞棱长为 a ,求在垂直4重轴的方向上重轴的方向上 B-B 最短距离。
最短距离。
(1) 立方F(2) A 和 B (3) 4 个 (4) 4 组(5) 3a(6) a/2 7015晶体宏观外形中的对称元素可有________,________,________,______四种类型;四种类型;晶体微观结构中的对称晶体微观结构中的对称元素可有________,________,________,________,________,________,______七种类型;晶体中对称轴的轴次(n )受晶体点阵结构的制约,受晶体点阵结构的制约,仅限于仅限于n =_________;晶体宏观外形中的对称元素进行一切可能的组合,晶体宏观外形中的对称元素进行一切可能的组合,可得可得________个晶体学点群;个晶体学点群;分属于分属于________个晶系,这些晶系总共有________种空间点阵型式,种空间点阵型式,晶体微观结构中的晶体微观结构中的对称元素组合可得________个空间群。
《无机化学》第九章分子结构课后习题参考答案

第九章分子结构课后习题参考答案2解:(1)Hg 原子的价电子构型是:5d 106s 2因中心原子Hg 采用sp 杂化,则分子为直线形。
(2)因中心原子Si 采用sp 3杂化,则分子构型为正四面体(3)因中心原子B 采用sp 2杂化,则分子构型为平面三角形(4)因中心原子N 采用sp 3杂化,有一对孤对占据杂化轨道,所以分子构型为三角锥形(5)因中心原子N 采用sp 2杂化,有一对孤对占据杂化轨道,所以分子构型为V 形(6)因中心原子Si 采用sp 3d 2杂化,所以分子构型为正八面体3解:(1)42414=⨯+=VP ,σ键数为4,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为正四面体。
用杂化轨道理论说明:因分子中共有四对成键,则需提供四条杂化轨道,所以Si 采用sp 3杂化形成四条sp 3杂化轨道供四对成键电子占据,分子构型为正四面体。
(2)224=+=VP ,σ键数为2,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为直线形。
杂化轨道理论:(3)32133⨯+=VP ,σ键数为3,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为平面三角形。
用杂化轨道理论说明:因分子中共有三对成键,则需提供三条杂化轨道,所以B 采用sp 2杂化形成三条sp 2杂化轨道供三对成键电子占据,分子构型为平面三角形。
(4)42135=⨯+=VP ,σ键数为3,有1对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为三角锥形。
杂化轨道理论:(5)42126=⨯+=VP ,σ键数为2,有2对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:(6)326=+=VP ,σ键数为2,有1对孤对电子对,则价电子对空间构型为平面三角形,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:4解:(1)521127=+⨯+=VP ,σ键数为2,有3对孤对电子存在,其价电子对空间构型为三角双锥,扣除孤电子对所占据的位置,其离子几何构型为直线形。
无机化学(上册):第9章 化学键与分子结构 习题答案
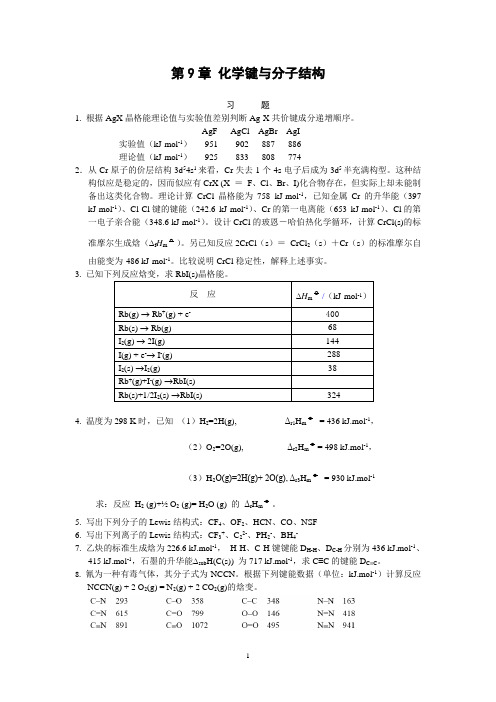
第9章化学键与分子结构习题1. 根据AgX晶格能理论值与实验值差别判断Ag-X共价键成分递增顺序。
AgF AgCl AgBr AgI实验值(kJ·mol-1)951 902 887 886理论值(kJ·mol-1)925 833 808 7742.从Cr原子的价层结构3d54s1来看,Cr失去1个4s电子后成为3d5半充满构型。
这种结构似应是稳定的,因而似应有CrX (X =F、Cl、Br、I)化合物存在,但实际上却未能制备出这类化合物。
理论计算CrCl晶格能为758 kJ·mol-1,已知金属Cr的升华能(397 kJ·mol-1)、Cl-Cl键的键能(242.6 kJ·mol-1)、Cr的第一电离能(653 kJ·mol-1)、Cl的第一电子亲合能(348.6 kJ·mol-1)。
设计CrCl的玻恩-哈伯热化学循环,计算CrCl(s)的标准摩尔生成焓(∆f H m o)。
另已知反应2CrCl(s)=CrCl2(s)+Cr(s)的标准摩尔自由能变为-486 kJ·mol-1。
比较说明CrCl稳定性,解释上述事实。
3.4. 温度为298 K时,已知(1)H2=2H(g), Δr1H m o= 436 kJ.mol-1,(2)O2=2O(g), Δr2H m o= 498 kJ.mol-1,(3)H2O(g)=2H(g)+ 2O(g), Δr3H m o= 930 kJ.mol-1 求:反应H2 (g)+½ O2 (g)= H2O (g) 的Δr H m o。
5. 写出下列分子的Lewis结构式:CF4、OF2、HCN、CO、NSF6. 写出下列离子的Lewis结构式:CF3+、C22-、PH2-、BH4-7. 乙炔的标准生成焓为226.6 kJ.mol-1,H-H、C-H键键能D H-H、D C-H分别为436 kJ.mol-1、415 kJ.mol-1,石墨的升华能∆sub H(C(s)) 为717 kJ.mol-1,求C≡C的键能D C≡C。
结构化学 09 离子晶体结构-4节课

B(负离子)
0
0
0
u
u
0
1/2
1/2
1/2
-u
-u
0
1/2+u 1/2-u
1/2
1/2-u 1/2+u 1/2
金红石型结构
金红石型结构
金红石型:离子堆积描述
结构型式
n+/n-
负离子堆积方式
正离子 CN+/CN- 所占空隙类型
正离子 所占空隙分数
金红石型 1:2 假六方密堆积
6:3
八面体
1/2
金红石型晶体中正离子所占空隙分数
2. n+/n-在晶体结构中的作用
(1) 化学组成比与电价比成反比
(2) 化学组成比与正、负离子配位数比成反比
(3) 正、负离子电价比与其配位数比成正比 (4) CN+主要由正、负离子半径比决定, 而CN-由此式决定
88..33..66 多多元元离离子子晶晶体体的的结结晶晶化化学学规规律律:: PPaauulliinngg规规则则
88..33 离离子子晶晶体体的的结结构构和和性性质质
离子键和晶格能
离子键的强弱可用晶格能大小表示。晶格能是0K时lmo1离 子化合物中的正、负离子(而不是正、负离子总共为lmo1),由相 互远离的气态结合成离子晶体时所释放出的能量, 也称点阵能。若 用化学反应式表示,晶格能U相当于下一反应的内能改变量:
CaF2(荧石)型晶体结构
萤石型:离子堆积描述
结构型式
n+/n-
负离子堆积方式
CN+/CN-
正离子 所占空隙类型
正离子 所占空隙分数
萤石型 1:2 简单立方堆积
8:4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第9章 晶体结构和性质习题解答【9.1】若平面周期性结构系按下列单位并置重复堆砌而成,试画出它们的点阵结构,并指出结构基元。
●●●●●●●●●●●●●●●●●●●●○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○解:用虚线画出点阵结构如下图,各结构基元中圈和黑点数如下表:1234567○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○○●●●●●●●●●●●●●●●●●●●●图序号 1 2 3 4 5 6 7 结构基元数 1 1 1 1 1 1 1 黑点数 1 1 1 1 0 2 4 圈数1112313【评注】 从实际周期性结构中抽取出点阵的关键是理解点阵的含义,即抽取的点按连接其中任意两点的向量平移后必须能够复原。
如果不考虑格子单位的对称性,任何点阵均可划出素单位来,且素单位的形状并不是唯一的,但面积是确定不变的。
如果考虑到格子单位的对称形,必须选取正当单位,即在对称性尽量高的前提下,选取含点阵点数目尽量少的单位,也即保持格子形状不变的条件下,格子中点阵点数目要尽量少。
例如,对2号图像,如果原图是正方形,对应的正当格子单位应该与原图等价(并非现在的矩形素格子),此时结构基元包含两个黑点与两个圆圈。
【9.2】有一AB 型晶体,晶胞中A 和B 的坐标参数分别为(0,0,0)和(12,12,12)。
指明该晶体的空间点阵型式和结构基元。
解:晶胞中只有一个A 和一个B ,因此不论该晶体属于哪一个晶系,只能是简单点阵,结构基元为一个AB 。
【9.3】已知金刚石立方晶胞的晶胞参数a =356.7pm 。
请写出其中碳原子的分数坐标,并计算C —C 键的键长和晶胞密度。
解:金刚石立方晶胞中包含8个碳原子,其分数坐标为:(0,0,0),1(2,12,0),(12,0,1)2,(0,12,1)2,(14,14,1)4,3(4,34,1)4,(34,14,3)4,(14,34,3)4(0,0,0)与(14,14,14)两个原子间的距离即为C -C 键长,由两点间距离公式求得:C-C 356.7154.4pm r a ====密度-13-10323-1812.0g mol 3.51 g cm (356.710cm)(6.022 10mol )A ZM D N V -⨯⋅==⋅⨯⨯⨯ 【9.4】立方晶系金属钨的粉末衍射线指标如下:110,200,211,220,310,222,321,400。
试问:(1) 钨晶体属于什么点阵型式?(2) X 射线波长为154.4pm ,220衍射角为43.62°,计算晶胞参数。
解:(1) 从衍射指标看出,衍射指标hkl 三个数的和均为偶数,即满足h+k+l =奇数时衍射线系统消失的条件,由此推断钨晶体属于体心立方点阵。
(2) 对立方晶系,衍射指标表示的面间距d hkl 与晶胞参数a 的关系为:hkl d =代入衍射指标表示的面间距d hkl 关联的Bragg 方程2sin hkl d θλ=得:316.5 pma ===【评注】 如果代入晶面指标表示的面间距()hkl d 关联的Bragg 方程()2sin hkl d n θλ=计算,则一定要注意衍射指标n 取值。
衍射指标为220的衍射实际是(110)晶面的2级衍射,即n =2。
()2223.802sin 2sin 43.62hkl hkl n d λλθ===()hkl d =(()316.5pmhkl hkl a d ===【9.5】(1) 银为立方晶系,用Cu K α射线(λ=154.18 pm )作粉末衍射,在hkl 类型衍射中,hkl 奇偶混合的系统消光。
衍射线经指标化后,选取333 衍射线,θ=78.64°,试计算晶胞参数。
(2) 已知Ag 的密度为10.507 g·cm -3,相对原子质量为107.87。
问晶胞中有几个Ag 原子,并写出Ag 原子的分数坐标。
解:(1) 对于立方晶系,衍射指标表示的面间距d hkl 与晶胞参数a的关系为:hkl d =408.57 pm a === (2) 1032310.507(408.5710) 6.02104107.87A DN V Z M -⨯⨯⨯⨯===由hkl 奇偶混杂衍射线系统消失的现象推知,此晶体为面心点阵。
因此4个Ag 原子的分数坐标为:(0,0,0),(12,12,0),(12,0,12),(0,12,12)。
【9.6】由于生成条件不同,C 60分子可堆积成不同的晶体结构,如立方最密堆积和六方最密堆积结构。
前者的晶胞参数a =1420pm ;后者的晶胞参数a= 1002pm ,c =1639pm 。
(1) 画出C 60的ccp 结构沿四重轴方向的投影图;并用分数坐标示出分子间多面体空隙中心的位置。
(2) 在C 60的ccp 和hcp 结构中,各种多面体空隙理论上所能容纳的“小球”的最大半径是多少?(3) C 60分子还可形成非最密堆积结构,使某些碱金属离子填入多面体空隙,从而制得超导材料。
在K 3C 60所形成的立方面心晶胞中,K +占据什么多面体空隙?占据空隙的百分数为多少?解:(1) C 60分子堆积成的ccp 结构沿4重轴方向的投影实际就是立方面心晶胞某个面的透视图。
实际晶胞(a)与沿4重轴方向的投影(b )如下图所示:(a) (b)题【9.6】图四面体空隙在顶点附近,其空隙中心的分数坐标为:(14,14,1)4,(14,14,3)4,(34,14,1)4,(34,14,3)4,(14,34,1)4,(14,34,3)4,(34,34,1)4,(34,34,3)4。
八面体空隙在体心与棱心处,其空隙中心的分数坐标为:(12,12,1)2,(12,0,0),(0,12,0),(0,0,1)2。
(2)欲求算多面体空隙理论上所能容纳的“小球”的最大半径,首先应求得大球(C 60)的半径R ,然后乘以相应的临界半径比即可。
在hcp 堆积结构中,由晶胞a 参数与C 60分子半径R 关系可求得:1002501pm 22a R === 在ccp 堆积结构中,由晶胞a 参数与C 60分子半径R 的关系可求得:1420502pm 44R === 由两种堆积的晶胞参数a 求得的R 稍有差异是可以理解的。
在ccp 和hcp 堆积结构中,球数:八面体空隙数:八四面体空隙数均为1:1:2,且同类空隙的大小相同。
因此,四面体空隙所能容纳的小球的最大半径为:r T =0.225R =0.225×501=112.7 pm八面体空隙所能容纳的小球的最大半径为:r O =0.414R =0.414×501=207.4 pm(3)由球数:八面体空隙数:八四面体空隙数=1:1:2特点可知,在K 3C 60晶体中,多面体空隙数与C 60分子数之比为3:1。
另外,从晶体的化学式知,K +数与C 60分子数之比亦为3:1。
因此,K +数与多面体空隙数之比为1:1,此即意味着K 3C 60晶体中所有的四面体空隙和八面体空隙均被K +占据,即占据的百分数为100%。
【评注】由a= 1002pm 和c =1639pm 可知,16391.6361002c a ==,非常接近等径圆球密堆积的轴率,这也间接说明C 60分子确为球形结构。
【9.7】金属钼为A2型结构,a =314.70pm ,试计算Mo 的原子半径及(100)和(110)面的面间距。
解:由于钼为A2型结构(立方体心点阵),原子在立方晶胞的体对角线上互相接触,因此可得:314.7=136.27pm r == (100)和(110)晶面的面间距分别为:(100)314.70pm d a ==(110)222.56pm d == 【评注】 对A2型结构的(100)晶面来说,体心位置的点穿插在(100)面之间,所以真实的面间距为a/2。
但对于(110)晶面来说,体心位置的点本来就在(100)面上,不引起面间距的改变,真实面间距不必进行校正。
【9.8】Pd 是A1型结构,a =389.0 pm ,它有很好的吸收H 2性能,常温下1体积的Pd 能吸收700体积的 H 2,试问:(1) 1体积(1 cm 3)的Pd 中含有多少个空隙(包括四面体空隙和八面体空隙)?(2) 700 体积的 H 2可解离为多少个 H 原子? 若全部H 原子占有空隙,则所占空隙的百分数是多少?解:(1) 在A1型堆积中,晶胞中有4个球。
由球数:八面体空隙数:八四面体空隙数=1:1:2的特点可知,一个晶胞中有4个八面体和8个四面体空隙,共12个空隙,因此1体积(1 cm 3)中共含有的空隙数为:3303233312(1cm)12110pm =2.010(389.0pm)a ⨯⨯⨯=⨯ (2)在标准状况条件下,700体积H 2可解离出的H 原子数为: 323122332700cm 6.0210mol =3.81022.410cm /mol -⨯⨯⨯⨯⨯H 原子占有空隙的百分数为:22233.810100%=18.5%2.010⨯⨯⨯ 【9.9】 试证明等径圆球的hcp 结构中,晶胞参数c 和a 的比值(称为轴率)为常数,即ca=1.633。
证明:下图 (a)示出A3型结构的一个简单六方晶胞。
该晶胞中有两个圆球、4个正四面体空隙和两个正八面体空隙。
由图可见,两个正四面体空隙共用一个顶点,正四面体高的两倍即晶胞参数c,而正四面体的棱长即为晶胞参数a或b( a=b=2r,r为堆积原子的半径)。
结合图(c),可知四面体的高AM为:11222222212222122221()()311()()23(2))1.63321.633AM AE EM AB BE DEAB AB AEr Rrcca⎡⎤=-=--⎢⎥⎣⎦⎡⎤=--⎢⎥⎣⎦⎡⎤=--⎢⎥⎣⎦=≈=⨯==(a) (b) (c)题【9.9】图【9.10】(填空题)在等径圆球的最密堆积中,一个四面体空隙由4 个圆球围成,因此一个球占有1/4个四面体空隙,而一个球参与8 个四面体空隙的形成,所以平均一个球占有 2 个四面体空隙。
在等径圆球的最密堆积中,一个八面体空隙由6个圆球围成,因此一个球占有1/6个空隙,而一个球参与 6 个八面体空隙的形成,所以平均一个球占有1个八面体空隙。
【评注】这是分析论证ccp和hcp堆积结构中,球数:八面体空隙数:八四面体空隙数=1:1:2的另一种表述。
当以A1型堆积为例时,以晶胞顶点球为坐标原点,在, ,a b c±±±方向的6条棱心处为八面体空隙,因此晶胞顶点球参与6个八面体空隙的形成;同样在顶点ABCDEMOθ附近的8个象限内各有一个四面体空隙,因此晶胞顶点球同时又参与8个四面体空隙的形成。
