总酸检验原始记录
容量法测定 酸价 原始记录表

1.配制:称取6g氢氧化钾,加入新煮沸过的冷水溶解,并稀释至1000mL,混匀进行标定。
2.标定:称取105℃-110℃电烘箱中干燥至恒重的工作基准试剂邻苯二甲酸氢钾,加无二氧化碳的水溶解,加2滴酚酞指示剂(10g/L),用配制的氢氧化钾溶液滴定至溶液呈粉红色,并保持30s,同时做空白实验临用时稀释。
稀释倍数
(A)
分取试液体积V1(mL)
消耗标液体积V(mL)
测定值(mg/g)
测定结果
(mg/g)
检测人: 校核人: 审核人:
容量法测定酸价原始记录(续表)
第 页 共 页
样品编号
取样量
m(g)
定容体积
()
稀释倍数
(A)
分取试液体积V1(mL)
消耗标液体积V(mL)
测定值(mg/g)
测定结果
(mg/g)
56.1-氢氧化钾的摩尔质量,单位为克每摩尔(g/mol);
m-油脂样品的称样量,单位为克(g)。
酸价≤1mg/g,计算结果保留2位小数;1mg/g<酸价≤100 mg/g,计算结果保留1位小数;酸价>100mg/g,计算结果保留至整数位。
检出限
/
空白消耗量
V0=mL
样品编号
取样量
m(g)
定容体积
()
样品处理情况
按GB 5009.229-2016对样品进行处理
标准滴定溶液浓度
CKOH=
计算公
XAV-酸价,单位为毫克每克(mg/g);
V-试样测定所消耗的标准滴定溶液的体积,单位为毫升(mL);
V0-相应的空白测定所消耗的标准滴定溶液的体积,单位为毫升(mL);
c-标准滴定溶液的摩尔浓度,单位为摩尔每升(mol/L);
调味料检验原始记录

调味料检验原始记录
产品名称批号生产日期检验日期产品规格生产数量
一、感官检验:
外观、
气味和口味:
二、净含量(g)检验方法:JJF1070-2005 主要仪器:天平
三、氨基酸态氮的测定检验依据:GB/T 2199-2008 主要仪器:酸度计
四、食盐含量的测定检验依据:GB/T 10782 主要仪器:电炉
五、总酸的测定检验依据:GB/T 10782 主要仪器:滴定装置
六、酸价检验依据:GB/T5009.37中的滴定法主要仪器:滴定装置
七、大肠菌群检测检验依据:GB/T 4789.3-2010 时间48 ±2h 培养温度:36±1℃
八、过氧化值检验依据:GB/T5009.37中的滴定法主要仪器:滴定装置
结论:检验员:。
酿造食醋原始检验记录
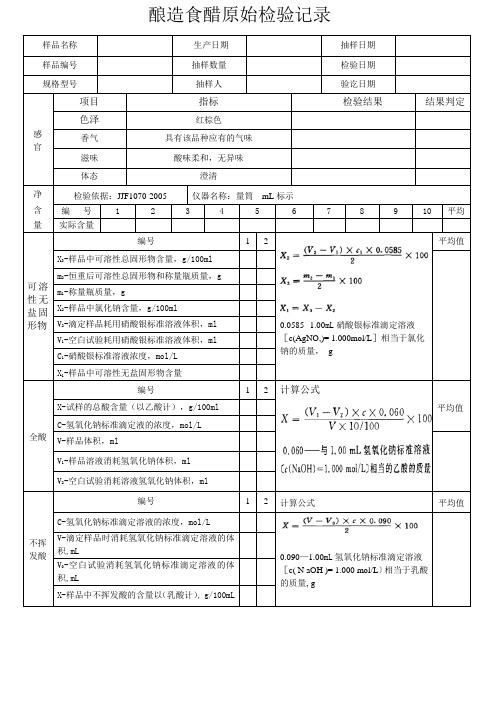
样品名称生产日期抽样日期样品编号抽样数量检验日期规格型号抽样人验讫日期感官项目指标检验结果结果判定色泽红棕色香气具有该品种应有的气味滋味酸味柔和,无异味体态澄清净含量检验依据:JJF1070-2005 仪器名称:量筒mL标示编号12345678910平均实际含量可溶性无盐固形物编号 1 20.0585--1.00mL硝酸银标准滴定溶液[c(AgNO,)= 1.000mol/L]相当于氯化钠的质量,g平均值X3-样品中可溶性总固形物含量,g/100mlm2-恒重后可溶性总固形物和称量瓶质量,gm1-称量瓶质量,gX2-样品中氯化钠含量,g/100mlV2-滴定样品耗用硝酸银标准溶液体积,mlV1-空白试验耗用硝酸银标准溶液体积,mlC1-硝酸银标准溶液浓度,mol/LX1-样品中可溶性无盐固形物含量全酸编号 1 2 计算公式平均值X-试样的总酸含量(以乙酸计),g/100mlC-氢氧化钠标准滴定液的浓度,mol/LV-样品体积,mlV1-样品溶液消耗氢氧化钠体积,mlV2-空白试验消耗溶液氢氧化钠体积,ml不挥发酸编号 1 2 计算公式平均值C-氢氧化钠标准滴定溶液的浓度,mol/L0.090—1.00mL氢氧化钠标准滴定溶液[c( N aOH )= 1.000 mol/L〕相当于乳酸的质量, gV-滴定样品时消耗氢氧化钠标准滴定溶液的体积,mLV0-空白试验消耗氢氧化钠标准滴定溶液的体积,mLX-样品中不挥发酸的含量以(乳酸计), g/100mL酿造食醋原始检验记录检验人:审核人:。
食盐、酸度检验原始记录
X=(V1-V2)*c*0.0585/m*(V3/100)*100
计算结果(g/100g)
平均值( g/100g)
最终结果
报告日期:检验人:复核人:复核日期:
总酸检验原始记录
产品名称:规格:数量:生产日期(批号):
主要检测用仪器设备:分析天平0.1mg、天平0.1g、酸度计、检验依据:
操作步骤
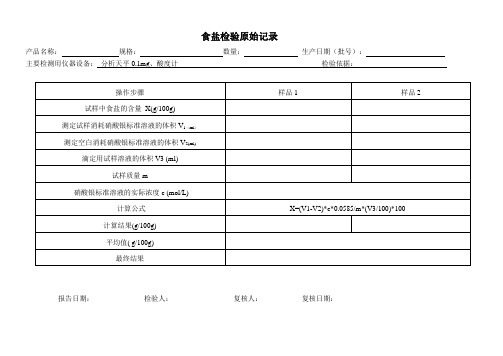
食盐检验原始记录
产品名称:规格:数量:生产日期(批号):
主要检测用仪器设备:分析天平0.1mg、酸度计检验依据:
操作步骤
样品1
样品2
试样中食盐的含量X(g/100g)
测定试样消耗硝酸银标准溶液的体积V1(ml)
测定空白消耗硝酸银标准溶液的体积V2(ml)
滴定用试样溶液的体积V3 (ml)
试样质量m
硝酸银标准溶液的实际浓度c (mol/L)
计算公式
X=(V1-V2)*c*0.09/m*(V3/100)*100
计算结果(g/100g)
平均值( g/100g)
最终结果
报告日期:检验人:复核人:复核日期:
样品1
样品2
X试样中的酸度(以乳酸计)(g/100g)
V1测定用试样消耗NaOH标准滴定溶液的体积(ml)
V2试剂空白消耗NaOH标准滴定溶液的体积(ml)
V3试样溶液体积(ml)
C NaOH标准溶液实际浓度(mol/L)
0.09与1.00 mlNa
露酒出厂检验原始记录

X=
V
检验员: 日期 :
检验原始记录
检验项目
试验数据记录
检验项目
总糖含量(以葡萄糖计)/(g/L)
费林溶液Ⅰ、Ⅱ各5ml相当于葡萄糖的克数(g)
吸取样品的体积v1(ml)
样品水解定容的体积v2(ml)
消耗样品溶液体积v3(ml)
F×1000
X1=
(v1/v2)×V3
总酯(以乙酸乙酯计)/(g/L)
检验原始记录
产品名称
规格
检验日期
检验数量
生产日期
报告日期
检验依据
检验项目
试验数据记录
实测结果
感官
净含量(g)
净含量
偏差
平均偏差:
单件超负偏差数:
总酸(以乙酸计)/(g/L)
样品体积V (ml)
氢氧化钠标准溶液浓度
c (mol/L)
滴定用样液消耗氢氧化钠体积
v1(ml)
空白溶液消耗氢氧化钠体积
v2(ml)
硫酸标准溶液浓度பைடு நூலகம்
c (mol/L)
滴定用样液消耗标准溶液体积
v1(ml)
空白溶液消耗标准溶液体积
v2(ml)
( v1-v2)×c×88
X=
50.0
酒精度(20℃)(%vol)
酒精度实测值a(%vol)
温度T(℃)
查表的酒精度值A(%vol)
干浸出物(g/L)
脱醇样品20℃时密度ρ
查表得总浸出物A
总糖含量B
干浸出物=A-B
总酸检测原始记录

总酸检测原始记录
批次:
1、检验依据:GB/T12456-2008
2、范围:适用于食品中总酸的测定
3、使用仪器:碱式滴定管 移液管 250ml容量瓶 ④250ml三角瓶
4、计算公式:
X (V 1V 2)c F K 1000 m
式中:X—总酸含量,以质量分数计。单位为克每千克(g/kg)
c—氢氧化钠标准滴定溶液浓度的准确数值。单位为摩尔每升(mol/L)
V1—滴定溶液时消耗氢氧化钠标准滴定溶液的体积的数值。单位为毫升(ml) V2—空白试验时消耗氢氧化钠标准滴定溶液的体积的数值。单位为毫升(ml) k—酸的换算系数:柠檬酸0.070(含一分子结晶水)
F—试液的稀释倍数
m—试样质量的数值,单位为克(g)
注:计算结果保留到小数点后两位,同一样品两次测量结果之差不得超过两次测定平均值 的2%
样品编号 m 1# 2# c
V1 V2 总酸结果
F
K
差值
检验员:
审核:
允差
平均值
报出结果 年月日
Hale Waihona Puke
检验原始记录(A4)

检验原始记录(A4)
检验报告制表审批单
气质联用分析表
注:此表由用户填写,,随原始记录发放。
检测人: 校核人: 审查人:
第页
检测人: 校核人: 审查人:
第页
原子吸收分析测试原始记录
检测人: 校核人: 审查人:
第页
氨基酸分析测试原始记录
检测人: 校核人: 审查人:
第页
酸度/离子分析测试原始记录
检测人: 校核人: 审查人:
第页液相色谱分析测试原始记录
检测人: 校核人: 审查人:
第页
荧光分光分析测试原始记录
检测人: 校核人: 审查人:
第页
凯氏定氮分析测试原始记录
检测人: 校核人: 审查人:
第页
薄层分析测试原始记录
检测人: 校核人: 审查人:
第页
紫外/可见分光光度测试原始记录
检测人: 校核人: 审查人: 第页油脂分析测试原始记录
检测人: 校核人: 审查人:
第页
重量分析测试( )原始记录
检测人: 校核人: 审查人:
第页
密度分析测试原始记录
检测人: 校核人: 审查人:
第页
( )检测原始记录
检测人: 校核人: 审查人:
第页盐分分析测试原始记录检测人: 校核人: 审查人:
第页分析测试( )原始记录
第页分析测试( )原始记录№:
第页( )感官检测原始记录。
试验原始记录数据

试验原始记录数据在进行试验时,需要记录一系列的原始数据,以便后续的数据分析和结果验证。
以下是一个关于一些试验的原始记录数据,共计1200字以上。
试验名称:酸碱中和实验试验目的:通过向酸性溶液中加入碱溶液,观察酸碱中和过程中溶液的pH值的变化。
试验材料:盛装有酸性溶液的玻璃烧杯、盛装有碱性溶液的滴液瓶、pH计、计时器、实验台。
试验步骤:1.使用pH计测量酸性溶液的初始pH值,并记录下来。
2.将酸性溶液倒入玻璃烧杯中,注意不要让溶液溅到皮肤或眼睛。
3.开始计时,每隔10秒钟向酸性溶液中滴加1滴碱性溶液,并用磁力搅拌子均匀搅拌。
4.每滴加一滴碱性溶液后,使用pH计测量溶液的pH值,并记录下来。
5.重复第4步,直到溶液的pH值达到中性(约为7)。
6.停止滴加碱性溶液,记录此时滴加的碱性溶液的总滴数,并计算出每滴碱溶液对应的pH值变化。
7.使用pH计测量中性溶液的pH值,并与初始pH值进行对比。
原始记录数据:试验时间:2024年1月1日9:00AM酸性溶液的初始pH值:3.5滴加碱溶液的时间(秒),碱溶液滴数,滴加后溶液的pH值10,1,3.720,2,4.130,3,4.440,4,4.850,5,5.260,6,5.670,7,6.080,8,6.490,9,6.7100,10,7.0滴加10滴碱溶液后,溶液的pH值达到中性,中性溶液的pH值为7.0。
试验结束后,需要对原始数据进行分析和总结。
根据实验记录,随着加入碱性溶液的滴数增加,酸性溶液的pH值逐渐增加,最终达到了中性状态。
从初始的酸性pH值3.5,到滴加10滴碱溶液后pH值为7.0,每滴碱溶液对应的pH值变化约为0.35、可见,滴加碱性溶液对酸性溶液的中和作用是明显的。
通过这个实验记录,我们可以观察到酸碱中和的过程,并了解到酸碱溶液在中和过程中pH值的变化。
这对于学习酸碱中和反应、了解物质性质具有重要意义,并且可以应用在很多实际生活和工业生产中。
