11化妆品原料检测报告
化妆品稳定性测试报告

化妆品稳定性测试报告概述本文档旨在提供一份化妆品稳定性测试的详细报告。
稳定性测试是确保化妆品产品的质量和安全性的重要步骤之一。
通过对化妆品产品在不同环境条件下的性能和稳定性进行评估,可以确保产品在使用寿命内保持其预期特性和效果。
测试目的稳定性测试的主要目的是评估化妆品产品在不同条件下的性能稳定性,并检查其是否满足预期的质量标准。
通过该测试,可以确定产品在不同环境条件下是否会发生质量变化或损坏,从而采取相应的措施确保产品质量。
方法与流程1.选择测试样本:从不同批次的化妆品产品中随机选择一定数量的样本作为测试样本。
2.设定测试条件:根据国家相关标准以及企业内部要求,设置不同的测试条件,包括温度、湿度、光照等。
3.进行测试:将样本放置在不同测试条件下进行测试,记录测试开始时间。
4.定期观察:定期观察样本的外观、气味、质地等特征,并记录测试期间出现的任何变化。
5.测试时间:测试时间根据产品类型和企业要求而定,通常为数天至数月不等。
6.结果分析:根据测试期间的观察记录,分析样本在不同条件下的稳定性表现,并进行结果统计。
7.结论与建议:根据测试结果,得出关于产品稳定性的结论,并提出相应的改进建议。
结果与讨论根据我们的测试结果,我们观察到以下情况:1.外观变化:部分样本在高温环境下出现了颜色变化或质地变化的情况,这可能是由于某些成分在高温下发生了化学反应导致的。
2.气味变化:部分样本在长时间暴露在高湿度环境下出现了气味变化的情况,这可能是由于某些成分的挥发性导致的。
3.pH值变化:部分样本在长时间暴露在光照环境下出现了pH值的变化,说明光照对化妆品产品的稳定性有一定的影响。
根据以上观察结果,我们可以得出以下结论:1.温度、湿度和光照等环境条件对于化妆品产品的稳定性有一定的影响。
在产品研发和生产过程中,应该充分考虑这些因素,并采取相应的措施来保证产品的稳定性。
2.需要对产品配方进行优化,选择稳定性更好的成分,以降低化学反应的风险。
成分检测报告

成分检测报告本报告旨在对所检测样品的成分进行详细分析和说明,以便客户了解样品的具体成分和特性。
本次检测样品为一种新型化妆品原料,经过严格的实验和分析,以下是本次成分检测的详细报告。
一、检测目的。
本次成分检测的目的是为了确认样品中各种成分的含量和性质,包括但不限于有机成分、无机成分、添加剂等。
通过对样品成分的分析,可以确保产品的质量和安全性,为产品的生产和销售提供科学依据。
二、检测方法。
本次成分检测采用了多种先进的分析方法,包括质谱分析、色谱分析、红外光谱分析等。
通过这些方法,可以准确地分析出样品中各种成分的含量和结构,为后续的产品开发和生产提供数据支持。
三、检测结果。
经过实验室的精密分析和测试,得出以下成分检测结果:1. 有机成分,样品中含有丰富的有机成分,主要包括天然植物提取物、活性成分等。
其中,天然植物提取物的含量高达30%,具有良好的保湿和滋养效果;活性成分的含量为15%,具有抗氧化和修复肌肤的作用。
2. 无机成分,样品中的无机成分主要包括矿物质、金属离子等。
其中,矿物质的含量占比较小,仅为5%,但对产品的稳定性和质感起着重要作用;金属离子的含量极低,不会对皮肤造成刺激或不良反应。
3. 添加剂,在样品中添加了少量的防腐剂和调理剂,以保证产品的保存期和使用感受。
经检测,防腐剂的含量在安全范围内,不会对人体健康造成影响;调理剂的含量适中,能够提升产品的使用感受。
四、结论。
根据以上的成分检测结果,可以得出以下结论:1. 样品中的有机成分丰富,具有良好的保湿和滋养效果,适合用于化妆品和护肤品的生产。
2. 样品中的无机成分含量适中,不会对产品的安全性和稳定性造成影响。
3. 样品中的添加剂使用合理,符合相关的安全标准和法规要求。
综上所述,本次成分检测结果表明样品的质量和安全性均符合相关标准和要求,可以放心用于产品的生产和销售。
五、建议。
基于本次成分检测的结果,建议在产品的配方设计和生产过程中,继续保持对成分含量和品质的严格把控,确保产品的质量和安全性。
化妆品中抗坏血酸磷酸酯镁等11种原料的检验方法2023年

附件7化妆品中抗坏血酸磷酸酯镁等11种原料的检验方法Determination of L-Ascorbic acid2-phosphate magnesium ester and other ten components incosmetics1范围本方法规定了高效液相色谱法测定化妆品中抗坏血酸磷酸酯镁、抗坏血酸葡糖苷、苯乙基间苯二酚、4-丁基间苯二酚、4-甲氧基水杨酸钾、阿魏酸、烟酰胺、曲酸、3-邻-乙基抗坏血酸、鞣花酸、凝血酸(氨甲环酸)11种成分的含量。
本方法第一部分适用于化妆品水剂类、乳液类、凝胶类、贴面面膜类、膏霜类和粉底类化妆品中抗坏血酸磷酸酯镁、抗坏血酸葡糖苷、苯乙基间苯二酚、4-丁基间苯二酚、4-甲氧基水杨酸钾、阿魏酸、烟酰胺、曲酸、3-邻-乙基抗坏血酸、鞣花酸含量的测定。
本方法第二部分适用于水剂类、乳液类、凝胶类、贴面面膜类、膏霜类化妆品中凝血酸(氨甲环酸)含量的测定。
第一部分化妆品中抗坏血酸磷酸酯镁等10种原料的检测2方法提要样品经甲醇水溶液(或添加少量二氯甲烷促溶解)超声提取后,采用高效液相色谱系统分离,二极管阵列检测器(DAD)检测,根据保留时间定性,峰面积定量,以标准曲线法计算含量。
本方法10种原料的检出限、定量下限及取样量为0.5g时检出浓度和最低定量浓度见表1。
表110种原料的检出限、定量下限、检出浓度和最低定量浓度序号成分检出限(ng)定量下限(ng)检出浓度(μg/g)最低定量浓度(μg/g)1抗坏血酸磷酸酯镁0.4 1.30.8 2.6 2抗坏血酸葡糖苷 1.0 3.1 2.0 6.2 3苯乙基间苯二酚 4.68.79.217.4 44-丁基间苯二酚 2.7 4.9 5.49.8 54-甲氧基水杨酸钾0.4 1.00.8 2.0 6阿魏酸0.5 1.2 1.0 2.4 7烟酰胺 1.0 3.3 2.0 6.6 8曲酸 1.1 2.1 2.2 4.2 93-邻-乙基抗坏血酸 1.4 2.7 2.8 5.4 10鞣花酸 2.7 6.1 5.412.23试剂和材料除另有规定外,本方法所用试剂均为分析纯,水为GB/T6682规定的一级水。
化妆品半成品成品检验规程

修改记录修改日期修改内容版本/版次修订人审批生效日期规范公司产品检验方法,确保产品质量得到有效控制。
2 范围适用于公司内所有半成品、成品(裸包装)的检验。
3 定义 无4 职责品检部:负责本规程的制定、修改,解释并监督实施。
检验员:负责对规定项目进行检测。
5 程序 抽样方案半成品抽样方案参照《原料和半成品取样管理规定》。
成品抽样方案外箱取样:若设总数为n ,则当n ≤3时,逐件取样;当3<n ≤100时,按n +1取样量随机取样;当n >100时,按2n+1取样量随机取样。
成品(裸包装)外观取样:成品(裸包装)的外观检验规则根据GB/T2828正常检验一次抽样方案,检查水平和抽样方案如下表所示:外观检查水平和抽样方案表批量范围 样本量Ac ReAc Re Ac Re 2-82↓↓↓9-15 3 ↓↓0 116-25 5 ↓↓↑26-50 8 ↓0 1 ↓51-90 13 ↓↑ 1 291-150 20 ↓↓ 2 3150-280 32 ↓ 1 2 3 4281-500 50 ↓ 2 3 5 6501-1200 80 0 1 3 4 7 81201-3200 125 ↑ 5 6 10 113201-10000 200 ↓7 8 14 15315 1 2 10 11 21 22 35001-150000 500 2 3 14 15 ↑800 3 4 21 22 ↑500001及其以上1250 5 6 ↑↑Ac-接收数,Re-拒收数:当样本数量大于或等于批量时,则执行100%检验。
↑-使用箭头上面的第一个抽样方案,↓-使用箭头下面的第一个抽样方案。
同类缺陷合计,当不合格数≤Ac时,则该批合格。
成品(裸包装)抽样频次按批次进行抽样检验。
型式检验:每年应不少于一次。
成品(裸包装)外观检验成品外观检查水平和具体检验标准参照下表:检验标准表一缺陷类别零缺陷A类(AQL=)B类(AQL=)C类(AQL=)缺陷内容1.料体异物(五金,虫子,碎玻璃类)2.喷码错误,无喷码3.产品错装,少装4.容器破裂5.料体用错1.料体异物(树脂,纤维类)2.喷码重码及模糊影响识别3.产品渗漏、封口开裂4.产品料体外观异常5.净含量低于表示值6. 标贴漏贴、错贴7.最小销售单元包装物错版,破损,内外表示不一致。
气相色谱_质谱法测定化妆品中的丙烯腈_刘茜

第30卷第1期2011年1月 分析测试学报FENX I CESH I XUEBAO(Journ al of Instrum entalAna l ysis) Vol 130No 1181~84收稿日期:2010-08-07;修回日期:2010-09-16通讯作者:马 强,T e:l 010-********-2191,E-m ai:l m aq iang1129@yah oo 1co m 1cn 气相色谱-质谱法测定化妆品中的丙烯腈刘 茜,马 强,席海为,王 烨,白 桦,王 超(中国检验检疫科学研究院,北京 100123)摘 要:建立了化妆品中丙烯腈的气相色谱-质谱分析方法。
不同类型的化妆品样品中加入甲醇超声提取,经高速离心处理浓缩后,采用O asis HLB 固相萃取柱净化,1mL 20%甲醇溶液淋洗,3mL 80%甲醇溶液洗脱,收集洗脱液,浓缩后经无水硫酸钠脱水,进行气相色谱-质谱定性及定量分析。
选用H P -I NNOW ax(60m @0125mm @0150L m )石英毛细管柱,流速112mL /m i n ,采用电子轰击电离源,选择监测离子m /z53、52、26(其中53为定量离子),外标法定量。
方法的平均回收率为84%~101%,相对标准偏差(RSD )为111%~412%,对丙烯腈的检出限为014mg /kg 。
该方法快速、准确、灵敏度高,可用于化妆品中丙烯腈的测定。
关键词:化妆品;丙烯腈;固相萃取;气相色谱-质谱法中图分类号:O657171;S4821294 文献标识码:A 文章编号:1004-4957(2011)01-0081-04do :i 1013969/j 1i ssn 11004-4957120111011017D eter m i nation of A cry l on itrile i n Cos m eti cs by GC-M S M ethodL I U X,i MA Q iang ,X IH a-i w e,i WANG Y e ,BA IH ua ,WANG Chao(Ch i nese A cade m y o f Inspecti on and Q uaranti ne ,Be iji ng 100123,Ch i na)Abstrac:t A gas chro m atography-m ass spectro m etric m ethod w as deve loped for the deter m i n ation o facrylon itrile i n cos m etic sa m ples .The cos m etics w ere ultrasonically ex tracted w ith m ethanol and thencentrifuged.The concentrated super natan tw as purified w ith an OasisH LB so li d phase extracti o n car -tr i d ge using 20%m ethano l solution as w ash i n g agen t and 80%m ethano l so l u ti o n as eluti n g agen.tThe e l u entw as f u rther dehydrated w ith anhydrous sodium sulpha te .The analysis w as carried outw itha capillary co l u m n(HP -I N NOW ax 60m @0125mm @0150L m )under electron ion izati o n cond iti o nsa t a fl o w rate o f 112m L /m in .The quantitati o n w as perfo r m ed by the externa l standar d m ethod underse lected ion m on ito ri n g (SI M )m ode using m on itering i o ns of m /z 53,52and 26.The recoveriesw ere i n the range of 84%-101%w ith re lative standard dev iations(RSDs)of 111%-412%.Thedetecti o n li m itw as 014mg /kg .This m ethod w as proved to be si m p le ,accurate ,and w as suitablefor the de ter m i n ation of acry lon itr ile i n cos m etics .Key w ords :cos m etics ;acrylon itrile ;solid phase ex traction;gas chr o m atography-m ass spectro m-etry 随着我国国民经济的蓬勃发展和人民生活水平的不断提高,化妆品已成为日常生活的重要消费品,其安全性也日益受到广泛关注。
化妆品生产表单汇总(1)

化妆品生产表单汇总汇总人:杜超衍日期:2016年5月1日- 1 - / 56表1 供应商评价表 (5)表2 合格供应商汇总表 (6)表3 到货通知单 (7)表4 物料入库单 (8)表5 采购物资检验/验证结果通知单 (9)表6 采购物资出入库台账 (10)表7 进货台账 (11)表8 批生产指令 (12)表9 领料单 (14)表10 称量记录 (16)表11 配料记录 (17)表12 投料记录 (18)表13 成品检验报告单 (19)表14 喷码、装盒记录 (20)表15 物料平衡计算表 (21)表16 成品同意放行审核记录 (22)表17 成品同意放行单 (23)表18 产品销售记录 (24)表19 不合格品处理审批表 (25)- 2 - / 56表20 不合格品销毁记录 (26)表21 不合格品台账 (27)表22 化妆品不良反应报告 (28)表23 投诉处理记录 (29)表24 运输车辆清洁记录 (30)表25 生产用具清洗、消毒记录 (31)表26 拆包、消毒记录 (32)表27 机器设备维修清洗保养记录 (33)表28 纯化水系统、贮罐及输送管道清洁消毒记录 (34)表29 虫害鼠害检查处理记录 (35)表30 化妆品安全风险分析记录表 (36)表31 温湿度记录 (37)表32 压差记录 (38)表33 人员进入车间审批表 (39)表34 内审自查报告 (40)表35 物料货位卡 (41)表36 成品货位卡 (42)表37 场所清洁消毒记录 (43)表38 清场记录 (44)- 3 - / 56表39 清场合格证 (45)表40 剧毒及易制毒性试剂保管使用台账 (46)表41 取样证 (47)表42 留样观察记录 (48)表43 质管员对外包岗位监督检查记录 (49)表44 员工培训计划 (50)表45 内部学习培训记录 (51)表46 外部学习情况登记表 (52)表47 从员人员健康检查档案 (53)表48 消毒剂配制使用记录 (54)表49 水池、地漏清洁消毒记录 (55)表50 车间臭氧消毒记录 (56)- 4 - / 56表1供应商评价表- 5 - / 56表2合格供应商汇总表- 6 - / 56到货通知单到货日期:年月日- 7 - / 56物料入库单第一联:仓库联第一联:仓库联白联第二联:财务联蓝联第三联:采购联红联第四联:品管联黄联- 8 - / 56采购物资检验/验证结果通知单编号:- 9 - / 56表6采购物资出入库台账产品名称/代号:包装规格:备注:本表用于单一采购物资的管理。
超高效液相色谱-串联质谱法测定化妆品中15种N-亚硝胺化合物

第42 卷第 11 期2023 年11 月Vol.42 No.111469~1478分析测试学报FENXI CESHI XUEBAO(Journal of Instrumental Analysis)超高效液相色谱-串联质谱法测定化妆品中15种N-亚硝胺化合物汪毅1,梁文耀1,何国山1,陈张好2,周智明2,吴谦1,席绍峰1,谭建华1*(1.广州质量监督检测研究院,国家化妆品质量检验检测中心(广州),广东广州511447;2.广东省药品检验所,广东广州510663)摘要:采用超高效液相色谱-串联质谱(UPLC-MS/MS)建立了化妆品中15种痕量N-亚硝胺化合物的分析方法。
水剂样品以水或乙腈分组超声提取,膏霜乳液样品采用亚铁氰化钾-乙酸锌溶液沉淀大分子或者饱和氯化钠-乙腈盐析分组处理后,以Agilent Poroshell 120 SB-Aq(100 mm×3.0 mm,2.7 μm)色谱柱分离,经大气压化学电离源(APCI)电离,多反应监测模式检测,以同位素内标法定量。
结果表明,15种N-亚硝胺化合物在相应质量浓度范围内线性关系良好(r2>0.995),检出限和定量下限分别为5~15 ng/g和15~45 ng/g。
水、乳、膏霜3种化妆品基质在25、50、100 ng/g加标水平下的平均回收率为88.0%~111%,相对标准偏差(RSD,n=6)为1.4%~9.8%。
该方法用于市售化妆品检测,发现13批次样品检出N-亚硝基二乙醇胺(NDELA),其中1批次超限量值。
方法的专属性强,灵敏度高,精密度好,解决了N-亚硝胺化合物稳定性差、易被干扰等问题,适用于化妆品中15种N-亚硝胺化合物的痕量测定。
关键词:N-亚硝胺化合物;化妆品;超高效液相色谱-串联质谱法(UPLC-MS/MS);大气压化学电离源中图分类号:O657.63;O623.732文献标识码:A 文章编号:1004-4957(2023)11-1469-10 Determination of Fifteen N-nitrosamine Compounds in Cosmetics by Ultra Performance Liquid Chromatography-TandemMass SpectrometryWANG Yi1,LIANG Wen-yao1,HE Guo-shan1,CHEN Zhang-hao2,ZHOU Zhi-ming2,WU Qian1,XI Shao-feng1,TAN Jian-hua1*(1.Guangzhou Quality Supervision and Testing Institute,National Quality Supervision and Testing Center for Cosmetics(Guangzhou),Guangzhou 511447,China;2.Guangdong Institute for Drug Control,Guangzhou 510663)Abstract:An ultra performance liquid chromatography-tandem mass spectrometric(UPLC-MS/MS)method was established for detecting 15 trace N-nitrosamine compounds in cosmetics. The final estab⁃lished method involved ultrasonic extraction of cosmetics using water or acetonitrile for different com⁃pounds. The samples were treated with potassium ferrocyanide-zinc acetate solution for precipitating macromolecules or saturated sodium chloride-acetonitrile for salting out.An Agilent Poroshell 120 SB-Aq(100 mm × 3.0 mm,2.7 μm) chromatography column was used for separation,followed by atmospheric pressure chemical ionization(APCI) source and multiple reaction monitoring mode detec⁃tion in the isotope internal standard method for quantification. The result showed good linearity(r2> 0.995) for the 15 N-nitrosamine compounds in their respective concentration ranges,with detection and quantitation limits of 5-15 ng/g and 15-45 ng/g,respectively.The average recoveries for the three cosmetic matrices(aqueous,emulsion,cream) at spiked levels of 25,50,100 ng/g were be⁃tween 88.0% and 111%,with relative standard deviations(RSD,n=6) of 1.4%-9.8%. The method was applied to the detection of commercial cosmetics and N-nitrosodiethanolamine(NDELA) was de⁃tected in 13 batches,with one batch exceeding the limit. The strong specificity,high sensitivity,and good precision made the method could solve the problems of poor stability and easy interference ofdoi:10.19969/j.fxcsxb.23051602收稿日期:2023-05-16;修回日期:2023-06-10基金项目:广东省药品监督管理局化妆品风险评估重点实验室专项(2021ZDZ03);广东省市场监督管理局科技项目(2022CZ06)∗通讯作者:谭建华,博士,正高级工程师,研究方向:色谱-质谱检测技术研究,E-mail:tanjianhua0734@第 42 卷分析测试学报N-nitrosamine compounds,and was suitable for the trace determination of 15 N-nitrosamine com⁃pounds in cosmetics.Key words:N-nitrosamine compounds;cosmetics;ultra performance liquid chromatography-tan⁃dem mass spectrometry(UPLC-MS/MS);atmospheric pressure chemical ionization(APCI) sourceN-亚硝胺化合物是一类具有N-亚硝基结构的化合物,因取代基的不同,形成了种类繁多的同系物,目前已发现超过300种[1]。
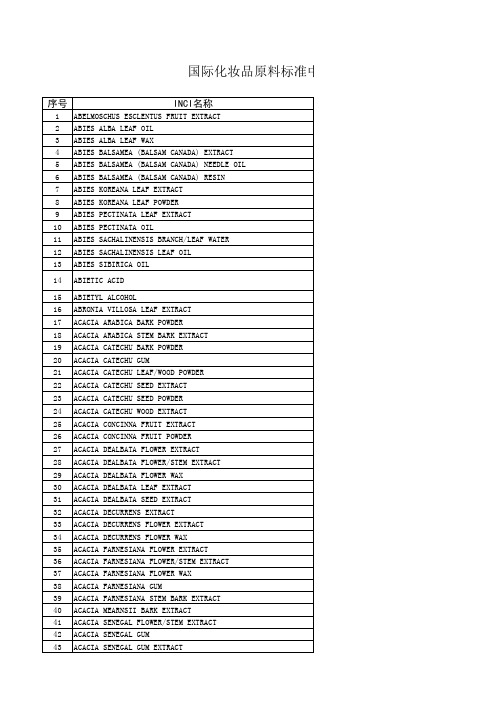
化妆品原料名称目录(含11号文件)+限禁用
108 ACETYL HEXAPEPTIDE-1 109 ACETYL HEXAPEPTIDE-7 110 ACETYL HEXAPEPTIDE-8 111 ACETYL HEXAPEPTIDE-20 112 ACETYL HISTIDINE 113 2-ACETYLHYDROQUINONE 114 ACETYL HYDROXYPROLINE 115 ACETYL LACTOSAMINE
5 ABIES BALSAMEA (BALSAM CANADA) NEEDLE OIL
6 ABIES BALSAMEA (BALSAM CANADA) RESIN
7 ABIES KOREANA LEAF EXTRACT
8 ABIES KOREANA LEAF POWDER
9 ABIES PECTINATA LEAF EXTRACT
92 ACETYL BENZOYLOXY PRASTERONE
93 ACETYL CARNITINE 94 ACETYL CARNITINE HCL 95 ACETYL CITRULL AMIDO ARGININE 96 ACETYL CYSTEINE 97 ACETYL DECAPEPTIDE-3 98 N-ACETYL DIHYDROSPHINGOSINE 99 ACETYL DIPEPTIDE-1 CETYL ESTER 100 ACETYLENEDIUREA/FORMALDEHYDE/TOSYLAMIDE CROSSPOLYMER
44 ACACIA SEYAL GUM
45 ACACIA SEYAL GUM EXTRACT
46 ACACIA VICTORIAE FRUIT EXTRACT
