PH1237 标准革兰氏染色液实验与操作方法
革兰氏染色法操作规程
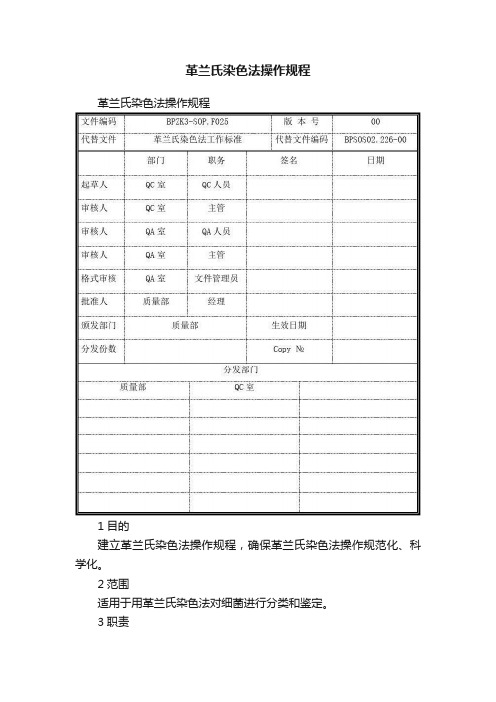
革兰氏染色法操作规程革兰氏染色法操作规程1目的建立革兰氏染色法操作规程,确保革兰氏染色法操作规范化、科学化。
2范围适用于用革兰氏染色法对细菌进行分类和鉴定。
3职责3.1检验员:负责按本规程进行革兰氏染色操作。
3.2 QC主管、质量部经理:负责监督。
4内容4.1仪器与用具酒精灯、洁净的盖玻片、接种环、滴管、生物显微镜。
4.2材料4.2.1试剂结晶紫、番红、碘化钾、碘、95%乙醇、草酸铵、香柏油。
4.2.2试液及配制方法4.2.2.1 结晶紫染色液:称取结晶紫2g,溶于20ml 95%乙醇中;称取草酸铵0.8g,溶于80ml水中;将两种溶液混合,静置48h后使用。
4.2.2.2碘染色液:称取碘化钾2g,加5~10ml水使充分溶解,加碘1g,待完全溶解后,加水至300ml。
4.2.2.3 番红复染液:称取番红0.25g溶于10ml 95%乙醇中,然后加水100ml。
4.3操作步骤4.3.1 样品固片取一干净的载玻片,用接种环挑取一环无菌水于载玻片中,挑取少量菌于生理盐水中涂片或直接滴一滴待检菌在盖玻片中央,自然干燥固定。
4.3.2 初染滴加结晶紫染液于已固定的涂片上,染1min,用水冲洗、甩干。
4.3.3 媒染滴加碘染色液,液作用1min,用水冲洗、甩干。
4.3.4 脱色滴加95%乙醇脱色,置白色背景下,侧动盖玻片,直至无紫色脱落为止(约为20-30秒),立即用水冲洗、甩干。
4.3.5 复染滴加番红复染液,染1-2 min,用水冲洗、甩干。
4.3.6 镜检置油镜下观察。
先用低倍镜找准目标,于涂有样品处滴加香柏油一滴,用油镜观察。
4.3.7 结果判定革兰氏阳性菌呈蓝紫色,革兰氏阴性菌呈红色。
以分散开的细菌的革兰氏染色反应为准,过于密集的细菌,常呈假阳性。
4.4 注意事项4.4.1 待检菌菌龄应为18~24h。
一般情况下,革兰氏阴性菌的染色反应较稳定,不易受菌龄长短影响;而革兰氏阳性菌,有的在幼龄时呈阳性,超过24h可变为阴性。
革兰氏染色说明

革兰氏染色【操作步骤】1、操作前准备:戴口罩、帽子、手套,穿工作服,准备并清点本试验所需器材。
2、制作涂片:细菌涂片的制作包括涂片、干燥、固定3个步骤。
(1)涂片:取洁净载玻片1张,用铅笔标记,并在玻片正中间位置滴加一滴生理盐水。
用灭菌环挑取菌落少许,均匀涂布于生理盐水中,并研磨成直径1~1.5cm的菌膜。
若取菌悬液标本涂片,则不需加生理盐水,直接用灭菌的接种环取菌液1~2环,直接均匀涂抹成菌膜。
(2)干燥:涂片最好置室温下自然干燥,也可将菌膜面向上,在酒精灯火焰上方约10cm处的热空气中微微加热烘干。
(3)固定:用手或玻片夹夹住载玻片一端,干燥的涂片面朝上,在酒精灯火焰的外焰上尽快对来回通过2~3次,以玻片反面接触皮肤热而不烫手为宜。
3.染色(1)初染:在制好的涂片上滴加结晶紫染液数滴(以刚好覆盖菌膜为宜),染色一分钟,倾斜载玻片,水洗。
甩去积水。
(2)媒染:滴加卢戈碘液数滴,染色1分钟,倾斜载玻片。
水洗,甩去积水。
(3)脱色:滴加95%乙醇数滴,轻轻摇动载玻片,使其脱色。
需10~30s 至无紫色脱出为准。
(4)复染:滴加稀释复红染液数滴,复染0.5min。
倾斜载玻片,水洗,甩去积水。
用滤纸吸干或者自然干燥。
4、油镜检查:待标本涂片自然干燥或用吸水纸吸干后,在菌膜上滴加香柏油,置油镜下检查。
表皮葡萄球菌染成紫色,为革兰阳性菌,呈葡萄球状排列;大肠埃希菌染成红色,为革兰阴性菌,呈散在的杆状。
5、其他:操作后正确处理医疗垃圾,实验器材归回原位。
【注意事项】1、整个操作过程须注意无菌操作。
2、因不同菌龄的细菌,革兰染色的结果也有差异,故一般以18~24h的培养物染色效果最好。
3、涂片若太厚或太薄,固定时菌体过分受热及脱色时间长短,都会影响染色结果,要严格按要求操作。
4、涂片最好在室温下自然干燥,若置酒精灯上微加热烘干时,切勿靠火焰太近,以免标本烤枯变形。
5、染色时,染液以覆盖标本为宜,不宜过多。
6、染色各环节均要严格掌握好时间,尤其是乙醇脱色环节,应根据菌膜厚度、室温等因素掌握适当时间,否则会影响染色结果。
革兰氏染色标准操作规程 sop文件

微生物室SOP文件-革兰氏染色标准操作规程原理本染色是最基本的染色法,染色结果将细菌分为革兰阳性(紫色)和革兰阴性(红色)两类,可用于标本涂片或菌落涂片。
标本采集与处理选择正确生理部位和采集合适的标本及其正确运送等环节至关重要。
而所有与标本质量有关的检验工作者必须要了解在整个实验过程中保证标本质量的重要性和必要性。
标本的选择与采集:采集送检标本前,标本选择的种类和采集部位必须反映有效病程。
一个没有有效病原体的标本是没有临床诊断价值的。
要避免常居菌群随时可能造成的污染,以确保取得反映感染过程的典型标本。
标本的送检:所有标本都必须立即送往实验室,最好在2小时内。
如不能及时送检,细菌病原体待检标本应按规定条件下存放,通常用于细菌学检验的标本的存放不要超过24小时。
临床标本或传染性材料从一个实验室到另一个实验室的送检,不论距离长短,都要求严格注意标本的包装和标签说明。
所要运送的材料必须贴上适当的标签,包装得当。
送检期间要予以安全防护。
试剂制备:结晶紫溶液:A液:结晶紫2.0g95%乙醇20mlB液:草酸铵0.8g蒸馏水80ml用前24h将A、B液混合,过滤后装入试剂瓶备用。
碘液碘1.0g碘化钾2.0g蒸馏水300ml将碘与碘化钾混合研磨,加少许水至完全溶解。
最后补足水量。
脱色液(丙酮酒精)95%酒精97ml丙酮3ml稀释复红石碳酸复红10ml蒸馏水90ml染色方法涂片经火焰固定,加结晶紫液染1分钟,清水冲洗。
加碘液染1分钟,清水冲洗。
加丙酮酒精脱色,不时摇动约15-25秒,至无紫色脱落为止,清水冲洗。
加稀释复红染15-25秒,清水冲洗。
干后镜检。
注意事项染液注意密封,以免凝结产生沉淀影响使用效果。
体液标本均应离心后取下层沉淀液与染液混合,以提高检出率。
提高责任心,做到全片检查。
临床意义将细菌分为革兰阳性菌和革兰阴性菌两大类,有助于进一步鉴定。
还可为临床选择用药提供参考,帮助临床制订有针对性的治疗方案。
革兰氏染色操作规程

革兰氏染色操作规程革兰氏染色法可将所有的细菌区分为革兰氏阳性菌(G+)和革兰氏阴性菌(G—)两大类,是细菌学上最常用的鉴别染色法。
1.原理该染色法所以能将细菌分为G+菌和G—菌,是由这两类菌的细胞壁结构和成分的不同所决定的。
G—菌的细胞壁中含有较多易被乙醇溶解的类脂质,而且肽聚糖层较薄、交联度低,故用乙醇或丙酮脱色时溶解了类脂质,增加了细胞壁的通透性,使初染的结晶紫和碘的复合物易于渗出,结果细菌就被脱色,再经蕃红复染后就成红色。
G+菌细胞壁中肽聚糖层厚且交联度高,类脂质含量少,经脱色剂处理后反而使肽聚糖层的孔径缩小,通透性降低,因此细菌仍保留初染时的颜色2.步骤(1)涂片:在一片干净的载玻片,滴上一滴蒸馏水。
用接种环挑取可疑菌落,均匀的涂在载玻片上。
(2)晾干:置通风处晾干。
(3)固定:将载玻片在酒精灯火焰上迅速的来回几次。
(4)结晶紫色染色:将玻片置于废液缸玻片搁架上,加适量(以盖满细菌涂面)的结晶紫染色液染色1分钟。
(5)水洗:倾去染色液,用水小心地冲洗。
(6)媒染:滴加卢哥氏碘液,媒染1min。
(7)水洗:用水洗去碘液。
(8)脱色:将玻片倾斜,连续滴加95%乙醇脱色20—25s至流出液无色,立即水洗。
(9)复染:滴加蕃红复染5min。
(10)水洗:用水洗去涂片上的蕃红染色液。
(11)晾干:将染好的涂片放空气中晾干或者用吸水纸吸干。
(12)镜检:镜检时先用低倍,再用高倍,最后用油镜观察,并判断菌体的革兰氏染色反应性。
3.实验完毕后的处理:①将浸过油的镜头按下述方法擦拭干净,a.先用擦镜纸将油镜头上的油擦去。
b.用擦镜纸沾少许二甲苯将镜头擦2—3次。
c.再用干净的擦镜纸将镜头擦2—3次。
注意擦镜头时向一个方向擦拭。
②看后的染色玻片用废纸将香柏油擦干。
革兰氏染色实验步骤

.;. 革兰氏染色一.实验流程:1、取载玻片用纱布擦干,载玻片的一面用marker笔画一个小圈(用来大致确定菌液滴的位置)。
涂菌的部位在火焰上烤一下,除去油脂。
2、涂片:液体培养基:左手持菌液试管,在酒精灯火焰附近5cm左右打开管盖;右手持接种环在火焰中烧灼灭菌,等冷却后从试管中沾取菌液一环,在洁净无脂的载玻片上涂直径2mm左右的涂膜,最后将接种环在火焰上烧灼灭菌。
固体培养基:先在载玻片上滴一滴无菌水,再用接种环取少量菌体,涂在载玻片上,使其薄而均匀。
3、晾干:让涂片在空气中自然干燥。
4、固定:让菌膜朝上,通过火焰2-3次固定(以不烫手为宜)。
5、染色:将固定过的涂片放报纸上,滴加草酸铵结晶紫液,染1min。
6、水洗:用水缓慢冲洗涂片上的染色液,用吸水纸吸干。
简单染色结束可观察细胞形态。
7、媒染:滴加1滴碘液,染1min,水洗。
8、脱色:吸去残留水,连续滴加95%乙醇脱色20-30s至流出液无紫色,立即水洗。
9、复染:滴加蕃红复染3-5min,水洗。
至此,革兰氏染色结束。
二.染色结果:革兰氏阳性菌都呈紫色,革兰氏阴性菌都呈红色。
备注:1.革兰氏阳性菌:葡萄球菌属(主要是金黄色葡萄球菌、表皮葡萄球菌等)、链球菌属(肺炎链球菌、草绿色链球菌、肠球菌等)、白喉杆菌、炭疽杆菌、破伤风杆菌、蜡样芽孢杆菌等,其中,金黄色葡萄球菌、肠球菌等为临床重要等病原菌。
2.革兰氏阴性菌:埃希氏菌属、枸橼酸菌属、假单胞菌属(绿脓杆菌等)、莫拉菌属(卡他莫拉菌等)、奈瑟菌属(淋球菌、脑膜炎双球菌等)、不动杆菌属(鲍曼不动杆菌、罗菲不动杆菌等)、克雷伯菌属(主要是肺炎克雷伯杆菌)、沙门氏菌属、志贺氏菌属(痢疾杆菌等)、黄杆菌属、变形杆菌属、军团菌属、耶尔森菌属、嗜血杆菌属(杜克雷嗜血杆菌、流感嗜血杆菌等)、产气杆菌属、霍乱弧菌、阴沟肠杆菌等。
革兰氏染色实验步骤

革兰氏染色实验步骤革兰氏染色实验是一种常用的细菌染色技术,用于区分细菌的结构特征和形态特点。
本实验主要通过染色剂的作用,将细菌分为革兰氏阳性菌和革兰氏阴性菌两类,以便于细菌的鉴定和分类。
革兰氏染色实验步骤如下:1. 准备工作:a. 准备好所需的试剂和设备,包括革兰染色试剂(碘液、乙醇、靛紫溶液等)、玻璃片、显微镜、高压锅等。
b. 清洗玻璃片和显微镜,确保无尘无油。
c. 培养细菌,选择适宜的培养基和条件培养出细菌。
2. 取一根无菌的铂丝或吸管,在培养基上横划取一些细菌。
3. 将铂丝或吸管上的细菌悬浮于一滴蒸馏水中,均匀涂抹在玻璃片上。
4. 玻璃片上的细菌涂片晾干。
5. 将涂片固定在高压锅中,用碘液浸泡1分钟,使细菌固定。
6. 用纯净水冲洗玻璃片,将多余的碘液冲洗掉。
7. 加入靛紫溶液,浸泡2分钟,使细菌染色。
8. 用纯净水冲洗玻璃片,将多余的靛紫溶液冲洗掉。
9. 加入乙醇或酒精醋酸液,浸泡20-30秒,使细菌去染。
10. 用纯净水冲洗玻璃片,将多余的乙醇或酒精醋酸液冲洗掉。
11. 将玻璃片晾干或用吸纸吸干。
12. 在显微镜下观察染色后的细菌涂片。
通过革兰氏染色实验,我们可以根据细菌的染色情况判断其是革兰氏阳性菌还是革兰氏阴性菌。
革兰氏阳性菌在染色后呈紫色或蓝色,而革兰氏阴性菌在染色后呈红色或粉红色。
这是因为革兰氏阳性菌具有较厚的胞壁,可以保留靛紫染料,而革兰氏阴性菌具有较薄的胞壁,无法保留靛紫染料。
革兰氏染色实验是微生物学中常用的一种技术,在细菌学研究和临床诊断中有着广泛的应用。
通过这个实验,我们可以快速地鉴定和分类细菌,为后续的研究和治疗提供便利。
同时,在临床诊断中,革兰氏染色实验也可以帮助医生判断感染性疾病的病原体类型,从而指导合理的治疗方案。
总结起来,革兰氏染色实验是一项简单而重要的实验技术,在微生物学和临床诊断中有着广泛的应用。
通过这个实验,我们可以快速地区分细菌类型,为后续的研究和治疗提供便利。
革兰氏染色操作方法过程

革兰氏染色操作方法过程革兰氏染色是一种常用的细菌染色方法,用于区分革兰氏阳性菌和革兰氏阴性菌。
操作步骤如下:1. 取一支细菌培养液,用无菌棉签蘸取适量的细菌样品。
2. 在显微镜片上滴加一滴细菌样品。
3. 用锡夹夹住显微镜片,将显微镜片通过火焰杀菌,以消毒细菌样品。
4. 将显微镜片上的细菌样品放置于乙醇中,浸泡1-2分钟,进行固定。
5. 取出显微镜片,倾倒掉乙醇,用水冲洗显微镜片,以去除残留的乙醇。
6. 滴加革兰氏染色液(由紫色的结晶紫和碘酒混合制成),使其完全覆盖细菌样品。
7. 静置1分钟,将显微镜片冲洗至水清。
8. 将显微镜片放入去结晶紫酒的洗涤液中,浸泡20-30秒,进行除色。
9. 冲洗干净后,加入洗净的碱性碘液,浸泡20-30秒,进行碘固定。
10. 将显微镜片放入无菌水中,冲洗干净。
11. 用酒精洗液将显微镜片沥干。
12. 将显微镜片放入苏木精洗涤液中,浸泡20-30秒,进行染色。
13. 冲洗干净后,用水洗涤。
14. 用酒精洗液将显微镜片沥干。
15. 将显微镜片放入氯仿中,浸泡1-2分钟,清洗细胞。
16. 用酒精洗液将显微镜片沥干。
17. 将显微镜片放入醋酸乙酯中,浸泡1-2分钟,清洗细胞。
18. 用酒精洗液将显微镜片沥干。
19. 将显微镜片倒置在玻璃片上晾干。
20. 最后,在显微镜下观察染色结果。
革兰氏阳性菌为紫色,革兰氏阴性菌为粉红色。
注意事项:- 操作中要使用无菌试剂和器皿,以防止细菌污染。
- 染色液的配制和保存要按照说明书进行。
- 操作过程中要注意不要受伤,避免染色液和化学物品溅到皮肤或眼睛上。
- 染色后,显微镜片要彻底干燥,以便观察。
革兰氏染色法实验报告内容

革兰氏染色法实验报告内容实验目的本实验的目的是学习和掌握革兰氏染色法的原理和操作方法,了解革兰氏阴性和阳性菌的特点,并通过染色观察和区分不同类型的细菌。
实验原理革兰氏染色法是一种常用的细菌染色方法,它是根据细菌细胞壁的结构差异,通过染色反应将细菌分为革兰氏阴性和阳性两类。
革兰氏氏阴性菌是指细胞壁较厚,染色后呈现粉红色的菌群,如大肠杆菌等。
而革兰氏阳性菌细胞壁较薄,染色后呈现紫色的菌群,如金黄色葡萄球菌等。
革兰氏染色法主要分为以下几个步骤:1. 取少量液体培养基,通过接种线将细菌接种于培养基上。
2. 将已接种的培养基涂布在玻璃片上,形成薄膜。
3. 用火焰消毒的钳子夹住已冷却的玻璃片,将细菌薄膜向上,放置在炉子上加热1-2分钟,使细菌固定在玻璃片上。
4. 取革兰染色剂,倒入上述玻璃片上,静置1分钟。
5. 用水冲洗玻璃片,直到水清。
6. 涂上碘试剂,静置1分钟。
7. 用酒精洗去碘试剂,直到水清。
8. 加入对应革兰氏颜色染色剂,静置30秒。
9. 用水冲洗玻璃片,直到水清。
10. 将玻璃片倒立在滤纸上晾干。
11. 使用显微镜观察染色后的细菌。
实验步骤1. 准备工作:- 消毒实验室台面和显微镜镜头,确保实验环境无菌。
- 准备好所需实验器材和试剂。
2. 在实验室台面上铺上无菌纸,将待染色的细菌培养基涂布在玻璃片上。
3. 将已接种的培养基涂布在玻璃片上,形成薄膜。
4. 用巴氏钳夹住已冷却的玻璃片,将细菌薄膜向上,放置在炉子上加热1-2分钟,使细菌固定在玻璃片上。
5. 取革兰染色剂,倒入上述玻璃片上,静置1分钟。
6. 用水冲洗玻璃片,直到水清。
7. 涂上碘试剂,静置1分钟。
8. 用酒精洗去碘试剂,直到水清。
9. 加入对应革兰氏颜色染色剂,静置30秒。
10. 用水冲洗玻璃片,直到水清。
11. 将玻璃片倒立在无菌纸上晾干。
12. 使用显微镜观察染色后的细菌。
实验结果通过观察染色后的细菌样本,我们可以得出以下结论:- 粉色细菌样本为革兰氏阴性菌。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PH1237|标准革兰氏染色液
Standard Gramˊs Stain
Catalog No:PH1237Size:☐4×100mL|☐4×250mL Store at RT
简介
革兰氏染色法是丹麦医生Christain Gram于1884年所发明,是细菌学中广泛使用的一种鉴别染色法,亦是一种复染法。
未经染色的细菌,由于其与周围环境折光率差别甚小,故在显微镜下极难观察。
染色后细菌与环境形成鲜明对比,可以清楚地观察到细菌的形态、排列及某些结构特征,用以分类鉴定。
通过此法染色可将细菌鉴别为革兰阳性菌(G+)和革兰阴性菌(G-)两大类。
细菌的不同显色反应是由于细胞壁对乙醇的通透性和抗脱色能力的差异,主要是肽聚糖层厚度和结构决定的。
经结晶紫染色的细胞用碘液处理后形成不溶性复合物,乙醇能使它脱色。
在革兰阴性细胞染色中,乙醇或丙酮破坏了胞壁外膜、损伤肽聚糖层和细胞质膜,结晶紫和碘复合物从细胞中渗漏出来,当再用其他染色液复染时,显现红色。
红色染料虽然也能进入已染成紫色的G+细胞,但被紫色盖没,所以红色显示不出来。
在革兰阳性细胞染色中,乙醇还能使厚的肽聚糖层脱水,导致孔隙变小,由于结晶紫和碘复合物分子太大,不能通过细胞壁,不易脱色,所以保持着紫色。
Standard Gramˊs Stain采用最经典的革兰染色配方,临床标本直接涂片,背景干净,胞核胞质对比强烈,胞内吞噬体清晰易辨认,细菌染色特征典型。
组份
名称4×100ml4×250ml Storage
试剂(A):结晶紫染色液100ml250ml RT避光
试剂(B):Gram碘液100ml250ml RT避光
试剂(C):脱色液100ml250ml RT
试剂(D):沙黄染色液100ml250ml RT避光
自备材料
1、接种环或挑取细菌的其他工具
2、酒精灯
3、载玻片
4、光学显微镜
操作步骤
(仅供参考):
1、涂片:取待检细菌,于载玻片中央涂成薄层或者或在载玻片上滴加少许无菌水,混合均匀,涂成一薄层。
2、干燥:涂片后在室温下自然干燥,也可在酒精灯上略加温,使之迅速干燥。
3、固定:手持载玻片一端,标本面朝上,在酒精灯的火焰外侧快速来回移动3~5次,每次1s,温度不宜过高,防止菌体蛋白变性,放置待凉后染色。
也可以用甲醇或乙醇固定。
4、初染:滴加结晶紫染色液染色1~2min,清水冲洗去染色液。
5、媒染:滴加Gram碘液,并覆盖载玻片,室温放置1~2min,水洗。
6、脱色:滴加脱色液,摇动10~30s,直至流下的脱色液不出现紫色时为止,立即用水冲去脱色液,终止反应。
7、复染:滴加沙黄染色液染色30~60s,水洗。
8、干燥。
镜检:置油镜观察。
染色结果
革兰氏阳性菌>>>>蓝色至紫色
革兰氏阴性菌>>>>红色
注意事项
1、涂片之前,应事先在背面做好圆圈标记,以便判断后续试验的位置。
2、取细菌时,应注意自我防护,拔或塞试管塞时,应将试管口通过火焰略加烧灼,最后将接种环在火焰上烧灼灭菌。
3、加热固定涂片时,应注意玻片勿太靠近火焰,一般要求玻片温度不超过60℃,以玻片背面触及手背皮肤不觉过烫为宜。
4、革兰氏染色的关键在于严格掌握脱色程度,脱色时间应根据经验判断。
脱色过度,阳性菌可被误染为阴性菌;脱色不够,阴性菌可被误染为阳性菌。
5、待检细菌培养时间会影响染色,阳性菌培养时间过长或已死亡或细菌溶解,常呈阴性。
6、为了您的安全和健康,请穿实验服并戴一次性手套操作。
