6号溶剂残留检测整体解决方案书
溶剂残留检测程序

溶剂残留检测程序一.打开气相色谱仪1.用于测溶残的样品要求用新样品瓶装,并且没有在有溶剂的地方打开过口。
2.将待测样品摇匀,准确称量25.00g到一个溶残瓶(105度120分钟烘后)中,塞好胶塞,50度水浴40±5min,用100μL微量进样器抽取溶残瓶内样品上方气体,置换三次以上,最后抽取100μL,迅速打入气相色谱进样器内,同时按下N2010色谱工作站上的开始图标开始检测。
3.检测完成,若发现自动积分基线不平,或者没有自动积分,需要进行手动积分。
4.手动积分方法:根据峰的形状修改起始点和结束点,根据基线的波动情况增减峰,比如由于基线本身波动形成的小碎峰,峰面积一般不大于200,而且出现频繁,需要删去; 5.出峰位置:正己烷溶剂在1分钟处出现,乙丙醚溶剂峰紧跟在正己烷溶剂峰后面出现,乙酸乙酯溶剂在1.7min处出峰,95%乙醇溶剂在2.6min左右出峰,甲醇溶剂出峰时间比较长,一般从3min开始到8min左右结束;根据这些出峰位置,如果样品中没有甲醇溶剂,一般4min以后没有峰出现,若有尖峰出现,属于仪器的突然波动应该删去,如果调整峰时出现手动积分无效,可以重新操作,或者把需要修改的峰删去,再根据需要添加峰。
二、附件:气相色谱使用规定1.计算办法计算时,样品中含有那些溶剂就以那些溶剂为标准样.即出、入库辣椒红、辣椒精采用95%乙醇溶剂分离的用乙丙醚和95%乙醇溶剂为标准样,用甲醇溶剂分离的用乙丙醚和甲醇溶剂为标准样;红辣素用乙丙醚溶剂为标准样;进厂色拉油用正己烷溶剂为标准样2. 进样器管理及使用2.1所有进样器购买后进行编号,使用时按编号顺序使用并记录在质检气相检测登记相应的表中;2.2正常情况下使用一根进样器,另外备用一根进样器,其余进样器放集中保管;2.3不允许把进样器的拉杆拔出;2.4进样器每用一天,清洗一次,每天早晨清洗前一天用的,用甲醇清洗后,再用纯净水冲洗,之后105度烘120分钟,不要打开烘箱门,自然降到室温,取出备第二天使用;2.5检测有异常时,如怀疑进样器有问题,需使用备用进样器进行比较;2.6当使用的进样器损坏或报废时,再从一楼办公室领用一根新进样器,使用前先用新进样器校准原来进样器;3 .进样的基本要求3.1缓慢匀速:是指取样时缓慢匀速,保证进样器中没有别的物质;3.2快速:是指取样后送进仪器要快,工作站起动要快,尽量做到进样与起动工作站同时进行,样品应进入汽化室中载气流速的区域;3.3重复:是指取样要重复、送入仪器的操作也要重复,即每次进样时尽量做到一致,以保证保留时间一样;3.4进样器温度要正确设置;进样汽化温度要设置正确,要高于试样的平均沸点,温度太低会造成高沸点组份汽化不完全,温度太高,可能会引起某些组份的分解。
残留溶剂测定的要求和测定方法

初筛结果:7个企业的盐酸头孢他美酯中均
可能含有异丙醇。
(2)证明:以初筛结果作为检测对象(本例
为异丙醇),参考知识库选择等温色谱系 统和色谱条件(本例选择SPB-1色谱柱, 在40℃条件下测定);将供试品中测得的 色谱峰的保留时间与相应对照品(本例为 异丙醇)的保留时间比较;并通过标准加 入法进一步证明初筛结果的正确性。
测定法 CHP05版之四
• 第一法(溶液直接进样法) 取标准溶液和供试品溶液,分别连续 进样3次,每次2μl,测得相应的峰面积,以 内标法测定时,计算待测物峰面积与内标 物峰面积之比,供试品溶液所得的峰面积 比的平均值不得大于由标准溶液所得的峰 面积比的平均值。以外标法测定时,供试 品溶液所得的待测物峰的平均面积不得大 于由标准溶液所得的待测物峰的平均面积。
顶空毛细管气相色谱法
• 建立了测定药品中残留溶剂的知识库;
• 实现了计算机辅助计算,优化残留溶剂测
定的色谱条件;
• 对药品中残留溶剂测定中的影响因素进行
了考察。
•
(1) 内标物的选择 二氧六环与吡啶可以互为内标,苯与甲苯可以互为内 标,氯仿的内标物为1,2-二氯乙烷。 (2) 温度选择 测定二氧六环、吡啶、苯、甲苯时柱温为170℃,测定 氯仿、二氯甲烷时柱温为140℃,测定环氧乙烷时柱温为 80℃。进样口及检测器温度应高出柱温30℃。 (3) 测定方法 从方法的精密度考虑,二氧六环、吡啶宜用第一法; 苯、甲苯、氯仿、二氯甲烷可以用第一法或第二法;环氧 乙烷直接用第二法;其中在用第二法测定苯、甲苯时,在 水浴中加热时间为30分钟,测定环氧乙烷时在水浴中加热 时间为5分钟。 如果用第一法时,样品本身会给色谱系统带来干扰或 严重污染,则宜采用第二法。 (4) 供试品取用量决定于其溶解度,如供试品在水中 难溶,可以改用酸、碱溶液溶解。标准贮备液的取用量取 决于供试品取用量及残留有机溶剂的限度。
残留溶剂测定法2015版药典

残留溶剂测定法药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。
药品中常见的残留溶剂及限度见附表1,除另有规定外,第一,第二,第三类溶剂的残留限度应符合附表1中的规定;对其他溶剂,应根据生产工艺的特点,制定相应的限度,使其符合产品规范,药品生产质量管理规范(GMP)或其他基本的质量要求。
本法照气相色谱法(通则0521)测定。
色谱柱1,毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互换使用。
(1)非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。
(2)极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。
(3)中极性色谱柱固定液为(35%)二苯基-(65%)甲基聚硅氧烷、(50%)二苯基-(50%)二甲基聚硅氧烷、(35%)二苯基-(65%)二甲基聚硅氧烷、(14%)氰丙基苯基-(86%)二甲基聚硅氧烷、(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱等。
(4)弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷、(5%)二苯基-(95%)二甲基聚硅氧烷共聚物的毛细管柱等。
2,填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。
系统适用性试验(1)用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于5000,;填充柱的理论板数一般不低于1000。
(2)色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1.5。
(3)以内标法测定时,对作品溶液连续进样5次,所得待测物与内标物峰面积之比的相对标准偏差(RSD)应不大于5%;若以外标法测定,所得待测物峰面积的RSD应不大于10%。
供试品溶液的制备1,顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺,二甲基亚砜或其他适宜溶剂;根据供试品和待测溶剂的溶解度,选择适宜的溶剂且应不干扰待测溶剂的测定。
残留溶剂GC检查方法的设计验证

02
溶剂
03
温度
04
不分流进样
05
顶空瓶体积
八、提高灵敏度
利用盐析作用,即在水溶液中加入无机盐(硫酸钠)来改变挥发性组分的分配系数。常用高浓度,甚至用饱和浓度。盐析作用对极性组分的影响远大于对非极性组分的影响。
例如在水溶液样品溶剂中加入0.01mol/L氯化钠溶液可使甲醇、乙醇灵敏度提高5倍(这种方法不常用)。
不可研磨样品,必须原态取样
01
不可超声、不能加热溶解样品
02
样品置顶空瓶中压盖后可以超声、加热
03
样品与对照品配制方法一致,避免基质效应
04
前述三类溶剂取样量尽可能大,至少0.1g/ml
05
四、供试品制备
01
进样方式首选顶空,基线干净
02
卤代烃直接进样容易灭火
五、进样方式
ICH限度并不是最高要求
不主张使用污染性大、毒性大的溶媒!
前述三类溶剂如果顶空进样应选择K小的溶媒!
其次溶媒是否能溶解待测溶剂?
水、DMF、DMSO、不挥发酸碱溶液,不可使用盐酸液和氨水,顶空进样可选择在80~90°C加热能溶解样品的试剂。
苯、甲苯、三氯甲烷等水溶性不好的溶剂,可先用少量乙醇或甲醇溶解待查溶剂再用水稀释。
三、溶媒
直接进样:
水、合适的有机溶媒或混合液。对于非极性色谱柱,水对柱有影响,会缩短柱的使用寿命。
A
B
顶空小平加盖后可超声加热助溶
有报道加5%SDS助溶。
助溶方式:
不可超声或加热助溶* ,以免残留溶剂挥发;如果顶空进样,样品置顶空瓶封盖之后可以超声或加热溶解。
大颗粒样品不可以研磨取样,只能取原态样品(或冷冻粉碎)。
气相色谱法测定奥氮平原料药中6种残留溶剂含量

到 要求 。
2 溶 液配 制 . 2 定 位溶 液 :准确 称取 乙醇 、二 氯 甲烷 、二 甲基 甲酰胺 、丙酮 、 甲苯 、乙酸 乙酯 各适 量 ,分别 用二 甲亚 砜稀 释 。 混 合对 照品 溶液 :精 密称 取 0 5 0 g乙醇 ,0 3 0 g 氯 甲 . 0 2 . 0 二 0
Ab t a t sr e :0b e tv :T sa fs t o o h e emi a in o i r a i ov n e i u n Oln p n , eh d :Ga h o t g a h s a p id ic ie o e tb ih a meh d f r te d tr n t f sx o g n c s l e tr sd e i a z i e M t o s o sc r ma o r p y wa p l e
Hale Waihona Puke 奥氮 平( l z p e是一 种新 型非 典型 抗精 神病 药物 ,系 噻吩 Oa ai ) n n 苯 二氮卓 类五 羟色 胺P 多巴胺(. T D ) 5H P A 拮抗 剂 , 改善 脑 内多种 能 神经 通路 功 能 ,尤其 是选择 性 作用 于 中脑边 缘 多 巴胺 通路 。该药 在 合成过 程 中 ,使用 了 乙醇、 二氯 甲烷 、二 甲基 甲酰 胺 、丙酮 、 甲苯 、 乙酸 乙酯等 有机 溶剂 ,根 据 《 中国药 典 》规定 ,为保证 安 全用 药 ,必须 对成 品 中的残 留有 机溶 剂进 行检 测 。现 采用 毛细 管 气相 色谱 法 同时测 定上 述有 机溶 剂 ,操 作简便 ,重复 性好 ,结 果 准确 可靠 ,可 用于 本 品的质量 控 制 。
De e m i to fS x O r ni l n s d si a a neby G C t r na i n o i ga c So ve tRe i ue n Ol nz pi
0861残留溶剂测定法

0861残留溶剂测定法药品中的残留溶剂系指在原料药或辅料的生产中,以及在制剂制备过程中使用的,但在工艺过程中未能完全去除的有机溶剂。
药品中常见的残留溶剂及限度见附表1,除另有规定外,第一、第二、第三类溶剂的残留限度应符合附表1中的规定;对其他溶剂,应根据生产工艺的特点,制定相应的限度,使其符合产品规范、药品生产质量管理规范(GMP)或其他基本的质量要求。
本法一般采用色谱法,如照气相色谱法(通则0521)测定。
色谱柱1. 毛细管柱除另有规定外,极性相近的同类色谱柱之间可以互换使用。
(1)非极性色谱柱固定液为100%的二甲基聚硅氧烷的毛细管柱。
(2)极性色谱柱固定液为聚乙二醇(PEG-20M)的毛细管柱。
(3)中极性色谱柱固定液为(35%)二苯基-(65%)甲基聚硅氧烷、(50%)二苯基-(50%)二甲基聚硅氧烷、(35%)二苯基-(65%)二甲基聚硅氧烷、(14%)氰丙基苯基-(86%)二甲基聚硅氧烷、(6%)氰丙基苯基-(94%)二甲基聚硅氧烷的毛细管柱等。
(4)弱极性色谱柱固定液为(5%)苯基-(95%)甲基聚硅氧烷、(5%)二苯基-(95%)二甲基硅氧烷共聚物的毛细管柱等。
2. 填充柱以直径为0.18~0.25mm的二乙烯苯-乙基乙烯苯型高分子多孔小球或其他适宜的填料作为固定相。
系统适用性试验(1)用待测物的色谱峰计算,毛细管色谱柱的理论板数一般不低于5000;填充柱的理论板数一般不低于1000。
(2)色谱图中,待测物色谱峰与其相邻色谱峰的分离度应大于1.5。
(3)以内标法测定时,对照品溶液连续进样5次,所得待测物与内标物峰面积之比的相对标准偏差(RSD)应不大于5%;若以外标法测定,所得待测物峰面积的RSD 应不大于10%。
供试品溶液的制备1. 顶空进样除另有规定外,精密称取供试品0.1~1g;通常以水为溶剂;对于非水溶性药物,可采用N,N-二甲基甲酰胺、二甲基亚砜或其他适宜溶剂;根据供试品和待测溶剂的溶解度,选择适宜的溶剂且应不干扰待测溶剂的测定。
溶剂残留测量不确定度评定作业指导书

溶剂残留测量不确定度评定作业指导书1.目的规定了溶剂残留测量不确定度的评定方法,保证实验室对测量结果进行不确定度评定和报告出具。
2.适用范围适用于检测中心溶剂残留项目的不确定度评定与表示。
3.依据的技术文件JJF1059.1-2012 《测量不确定度的评定与表示》、GB/T27418-2017《测量不确定度的评定与表示》、CNAS-CL01-G003:2019《测量不确定度评定要求》、YC/T207-2014《烟用纸张中溶剂残留的测定顶空-气相色谱/质谱联用法》、L FJC-CX-17《测量不确定度控制程序》。
4.测量不确定度评定的步骤4.1一般评定不确定度的流程如下图1 评定测量不确定度的流程图4.2建立测量的数学模型溶剂残留数学模型:称溶剂残留测量不确定度评定作业指导书发布日期2019-11-15 实施日期2019-11-20()()22001111011110========⎛⎫⎛⎫--⎪ ⎪⎪ ⎪-⎝⎭⎝⎭===⎛⎫⎛⎫⎪ ⎪⎪ ⎪⎝⎭⎝⎭∑∑∑∑∑∑∑∑n k n ki ij i iji j i jij i ijn k n ki ij ij i ij iji j i jij i ijMs Vs W PVy VsX X X XS V Vd SX XCK Ms Vs x W PVy Vs xS V Vd S式中:C——VOC含量(单位:mg∙m-2);K——工作曲线斜率(单位:U(m2∙mg-1);X——定量离子峰面积(单位:U);X0——空白试验定量离子峰面积(单位:U);k——标准工作溶液平行测定次数;n——工作曲线数据点个数(标准工作溶液级数);x ij——第i级标准工作溶液第j次测定,定量离子峰面积(单位:U);Vs ij——第i级标准工作溶液第j次测定,标准工作溶液加入体积(1mL);S ij——第i级标准工作溶液第j次测定,原纸加入面积(单位:m2);W——标样质量(单位:mg);P——标样纯度;V0——标准储备液的定容体积(100mL);Vy i——第i级标准工作溶液中标准储备液移取体积(单位:mL);Vd i——第i级标准工作溶液的定容体积(100mL);Ms i——第i级标准工作溶液中VOC浓度(单位:mg∙mL-1)。
Q3C(R6)-20191004-S-Step 4杂质:残留溶剂指导原则
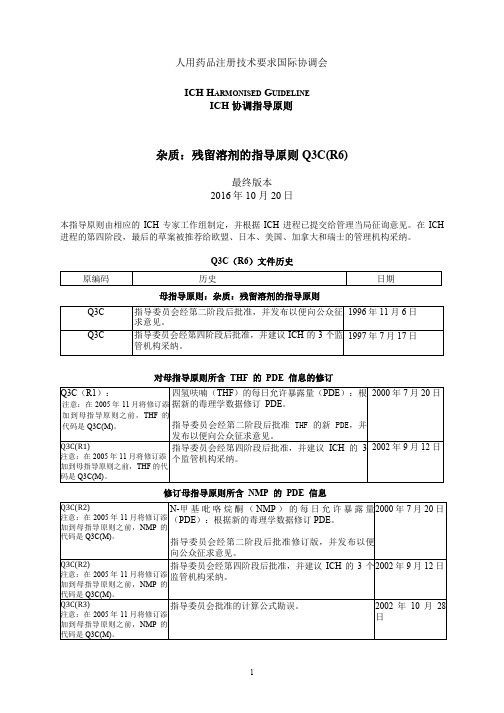
人用药品注册技术要求国际协调会ICH H ARMONISED G UIDELINEICH 协调指导原则杂质:残留溶剂的指导原则 Q3C(R6)最终版本2016年 10 月 20日本指导原则由相应的ICH 专家工作组制定,并根据ICH 进程已提交给管理当局征询意见。
在ICH 进程的第四阶段,最后的草案被推荐给欧盟、日本、美国、加拿大和瑞士的管理机构采纳。
Q3C(R6)文件历史母指导原则:杂质:残留溶剂的指导原则对母指导原则所含THF的PDE信息的修订修订母指导原则所含NMP的PDE信息母指导原则:杂质:残留溶剂的指导原则对母指导原则所含异丙基苯的PDE信息的修订修订母指导原则所含甲基异丁基酮的PDE信息,并纳入三乙胺的PDE乙二醇PDE修正I MPURITIES: G UIDELINE FOR R ESIDUAL S OLVENTS杂质:残留溶剂的指导原则TABLE OF CONTENTS目录PART I:IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS (4)第一部分:杂质:残留溶剂的指导原则 (4)1.INTRODUCTION引言 (4)2.SCOPE OF THE GUIDELINE 指导原则的适用范围 (5)3.GENERAL PRINCIPLES通则 (6)3.1Classification of Residual Solvents by Risk Assessment基于风险评估的残留溶剂的分类 (6)3.2 Methods for Establishing Exposure Limits 建立暴露限度的方法 (6)3.3 Options for Describing Limits of Class 2 Solvents 2 类溶剂限度的表示方法 (7)3.4 Analytical Procedures分析方法 (9)3.5 Reporting levels of residual solvents残留溶剂的报告水平 (9)4.LIMITS OF RESIDUAL SOLVENTS 残留溶剂的限度 (10)4.1 Solvents to Be Avoided应避免的溶剂 (10)4.2 Solvents to Be Limited应限制的溶剂 (10)4.3 Solvents with Low Toxic Potential低潜在毒性的溶剂 (12)4.4 Solvents for which No Adequate Toxicological Data was Found 没有足够毒理学数据的溶剂 (13)GLOSSARY术语 (14)APPENDIX 1. LIST OF SOLVENTS INCLUDED IN THE GUIDELINE附录 1:指导原则中包括的溶剂列表 (15)APPENDIX 2. ADDITIONAL BACKGROUND附录 2:其他背景 (18)APPENDIX 3. METHODS FOR ESTABLISHING EXPOSURE LIMITS附录 3:建立暴露限度的方法 (19)PART II:IMPURITIES: RESIDUAL SOLVENTS (MAINTENANCE)PDE FOR TETRAHYDROFURAN第二部分:杂质:残留溶剂(修订)四氢呋喃的 PDE (23)PART III:IMPURITIES : RESIDUAL SOLVENTS (MAINTENANCE) PDE FOR N-METHYLPYRROLIDONE (NMP) 第三部分:杂质:残留溶剂(修订)N-甲基吡咯烷酮(NMP)的 PDE25 PART IV:IMPURITIES : RESIDUAL SOLVENTS (MAINTENANCE) PDE FOR CUMENEICH Harmonised Tripartite Guideline第四部分:杂质:残留溶剂(修订)异丙基苯的 PDE (27)PART V:IMPURITIES : RESIDUAL SOLVENTS (MAINTENANCE)PDE FOR TRIETHYLAMINE AND PDE OF METHYLISOBUTYLKETONE第五部分:杂质:残留溶剂(修订)三乙胺的 PDE 和甲基异丁基酮的 PDE (31)PART I:IMPURITIES: GUIDELINE FOR RESIDUAL SOLVENTS第一部分:杂质:残留溶剂的指导原则Having reached Step 4 of the ICH Process at the ICH Steering Committee meeting on 17 July 1997, this Guideline is recommended for adoption to the three regulatory parties to ICH在 1997 年 7 月 17 日的 ICH 指导委员会会议上进入 ICH 进程第四阶段,并建议 ICH 的三方监管机构采纳该指导原则1.INTRODUCTION引言The objective of this guideline is to recommend acceptable amounts for residual solvents in pharmaceuticals for the safety of the patient. The guideline recommends use of less toxic solvents and describes levels considered to be toxicologically acceptable for some residual solvents.本指导原则旨在建议为保证患者安全而应规定的药物中残留溶剂的可接受量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6号溶剂残留检测整体解决方案书
1.引言:
6号溶剂油又称6号溶剂,6号抽提溶剂油,外观为无色透明液体,是各种低级烷烃的混合物。产品
馏份范围较工业己烷宽,具有工业己烷类似的性质。能与除蓖麻油以外的多数液态油脂混溶,可溶解低
级脂肪酸。6号溶剂其主要成分是正已烷和庚烷,此外还含有少量苯、甲苯等有害物质,是一种麻醉呼
吸中枢具有一定毒性的溶剂。由于6号抽提溶剂中含有对人体有害的苯、芳烃、硫等物质,对人体神经
系统、脏器会有一定的伤害,使神经细胞内类脂平衡失调,导致各种人体机能紊乱,食用油中溶剂残留
量过高,长期食用会导致人精神麻痹甚至瘫痪。根据GB/T 5009.37-2003食用植物油卫生标准,武汉恒
信仪器有限公司针对客户需求提供分析食用油中6号溶剂残留的解决方案。
2.实验设备:
1. 恒信GC2020气相色谱仪(带程序升温) 1套
2. 氢气发生器 1台
3. 空气发生器 1台
4. 色谱工作站 1台
5. 6号溶剂油残留检测专用色谱柱 1支
6. 电子天平(0.1mg) 1台
顶空进样瓶及注射器 若干
空进样器 1台
3.实验条件:
1 色谱柱: 6号溶剂油残留检测专用色谱柱
2 检测器:氢火焰离子化检测器
3 柱温:60℃
4 汽化室温度:140℃
5 载气(N3):30 mL/min
6 氢气:50 mL/min
7 空气:500 mL/min
步骤:1. 取预先在气相色谱仪上测试管六号溶剂量较低的油为曲线制备的体底油(或经70℃开放式赶
掉大部分残留溶剂的食用油或压榨油),分别称取25g放人6支顶空瓶中,密塞。通过塞子注入六号溶
剂标准液配置6个不同浓度的标准样。放人50℃顶空进样器,平衡30min,分别抽取液上气体注入色谱,
各响应值扣除空白值后,绘制标准曲线(多个色谱峰用归一化法计算)。
2. 称取25g的食用油样,密塞后于50℃恒温箱中加热30min,取出后立即用微量注射器或注射器吸取
0.10 mL~ 0.15mL液上气体(与标准曲线进样体积一致)注入气相色谱,记录单组分或多组分(用归一化
法)测量峰高或峰面积,与标准曲线比较,求出液上气体六号溶剂的含量。
