紫外吸收和荧光光谱的计算
紫外吸收光谱和荧光发射光谱的区别

《紫外吸收光谱和荧光发射光谱的区别》紫外吸收光谱呀,那可是挺有意思的一个事儿呢。
它主要说的就是物质对紫外光的吸收情况啦。
想象一下,紫外光就像一群小精灵,往物质那儿跑,有些物质可就不客气啦,会把这些紫外光的一部分给“吃”进去,也就是吸收掉呀。
然后咱们通过仪器去检测,就能看到在不同波长的紫外光下,物质吸收的程度不一样,最后画出的那个光谱图,就反映了这个物质对紫外光吸收的特点呢。
比如说,有的地方吸收得多,光谱上就出现个高高的峰,有的地方吸收少,那就是个矮矮的小坡啦。
荧光发射光谱就不一样咯。
它得先有个激发的过程呀,就好比给物质打一针“兴奋剂”,用特定波长的光去照射这个物质,物质里的那些小粒子呀,就像被叫醒了一样,变得活跃起来啦。
然后呢,这些活跃起来的粒子过一会儿又会把吸收来的能量以光的形式再发射出去,咱们检测这个发射出来的光,画出的光谱就是荧光发射光谱啦。
它的样子和紫外吸收光谱可大不一样哦,荧光发射光谱的峰呀、谷呀,对应的情况都和紫外吸收光谱有着自己的差别呢。
从产生的原理上看呀,紫外吸收光谱就是物质单纯地吸收紫外光,就像肚子饿了吃东西一样简单直接。
可荧光发射光谱呢,先是吸收了能量被激发,再把能量转化成光发出去,就像先充电再放电的感觉呀,多了这么个曲折的过程呢。
再说说它们在实际用处上的区别呗。
紫外吸收光谱常常用来判断物质里有没有某些特定的结构呀,就像侦探一样,靠它能发现物质的一些小秘密呢。
荧光发射光谱呢,在检测一些微量的物质上可有一手啦,哪怕只有一点点物质,它发射出来的荧光有时候也能被检测到,可厉害了。
还有哦,在观察它们的条件上也有不同呀。
紫外吸收光谱一般就是在紫外光照射下看看吸收情况就行啦。
荧光发射光谱呢,除了要选好激发光的波长,还得注意周围环境呀,有时候环境稍微变一变,那荧光发射的强度啥的都会跟着变呢,得小心翼翼地去检测哦。
紫外吸收光谱和荧光发射光谱,各有各的特点,各有各的本事,就像两个不同的小伙伴,在分析物质的这个大舞台上各自发挥着独特的作用,咱们了解它们的区别,就能更好地利用它们去探索物质世界的奥秘啦。
紫外分光光度法和荧光分析法

1 Beer-Lambort 定律A=log T =Ecl *A为吸收度;
*T为透光率; *E为吸收系数(以 E *c为溶液浓度; *l为样品总厚度。
1% 1cm
表示,溶液浓度为1%(g/ml),厚度为1cm时的吸光度值)
适用条件:入射光为单色光 溶液是稀溶液 固体、 液体和气体样品在同一波长 下,各组分吸光度具有加和性
吸收光谱
10-4-10-7g/ml
选择性
高
一般
应用
硫色素荧光法测定维生素B1
维生素B1 在碱性溶液中被铁氰化钾氧化成硫色素,在紫(365nm)
照射下呈蓝色荧光(435nm)通过与对照品荧光强度比较。即可测得供试 品含量(课本260页)
荧光分光光度法测定维生素E
采用同步荧光扫描法测定血清中维生素E,有效的消除溶剂拉曼 光谱的干扰,提高灵敏度和准确性。(课本277页)
双波长分光光度法
不需空白溶液作参比;但需要两个单色器获得两
束单色光(λ1和λ2);以参比波长λ1处的吸光度Aλ1 作为参比,来消除干扰。在分析浑浊或背景吸收 较大的复杂试样时显示出很大的优越性。灵敏度、 选择性、测量精密度等方面都比单波长法有所提 高。 ΔA=A λ2 -A λ1 =(ελ2 -ελ1 ) b c 两波长处测得的吸光度差值ΔA与待测组分浓度 成正比 (例子:课本366页)
其他
卡尔曼滤波法
偏最小二乘法 小波变换
三波长分光光度法
系数倍率法
……
原理 与紫外-可见法异同点
应用
原理
荧光 — 分子吸收电磁波后,从其最低激发 态重新发射紫外线或可见光的现象 利用某些物质被一定波长的光照射后所产 生的,能够反映该物质特性的荧光来进行 定性定量的分析方法——荧光分析法。
物质的吸收光谱与荧光光谱测定方法

物质的吸收光谱与荧光光谱测定方法为了了解物质的性质和结构,科学家们需要使用不同的方法进行分析和检测。
在生物化学研究中,吸收光谱和荧光光谱是两种常用的测定方法。
本文将介绍这两种方法及其在研究中的应用。
一、吸收光谱吸收光谱是指物质对入射光吸收的强度变化规律的记录。
物质吸收光谱与其分子中的某些基团有关,可以用来判断分子的化学结构。
吸收光谱通常在紫外或可见光范围内测量。
对于有色的溶液或溶液中含有吸收剂的物质,可通过吸光度法进行测定。
吸光度(A)是指单位厚度、单位物质的样品溶液对波长为λ的光线的吸收能力。
一般情况下,吸光度与浓度成正比,可以用于定量测定样品中物质的含量。
例如,在生命科学研究中,DNA和蛋白质等生物分子可以通过吸收光谱测定其浓度,同时还可以了解它们的结构和性质。
二、荧光光谱荧光是指物质在受到激发后,发出能量较低的光的现象。
荧光光谱是指荧光强度随受激波长变化的记录。
与吸收光谱相比,荧光光谱可以提供更多的关于分子的信息,例如其分子结构、化学成分、分子量、分子大小和分子内部的环境等。
荧光常常用于分析分子之间的相互作用。
通过测量荧光强度和发射波长的变化,可以研究分子之间的相互作用、结构变化和分子的运动。
例如,荧光蛋白是生物学中重要的工具,通过荧光光谱可以了解蛋白质结构和分子动力学信息。
三、应用举例1. 脂质分析脂质是生物体内重要的分子之一,涉及生物能量代谢和信号传递等多个领域。
吸收光谱和荧光光谱被广泛应用于脂质分析。
以近年来广受欢迎的脂质体为例,吸收光谱和荧光光谱可以用于研究其内部结构和性质。
通过测量荧光强度和发射波长的变化,可以了解脂质体内脂质分子的疏水性和结构变化;通过吸收光谱测量,可以了解脂质体中膜蛋白的含量和结构。
2. 蛋白质研究蛋白质是生命活动中不可或缺的分子,其结构和功能对人类健康具有重要意义。
吸收光谱和荧光光谱在蛋白质研究中也有广泛应用。
以光谱法测定蛋白质的稳定性为例,通过检测溶液中的吸收光谱和荧光光谱,可以判断蛋白质的结构变化和稳定性降解程度。
荧光光谱分析法PPT课件

第12页/共39页
荧光发射光谱 荧光激发光谱
磷光光谱
200 260 320 380 440 500 560 620 室温下菲的乙醇溶液荧(磷)光光谱
第13页/共39页
激发光谱与发射光谱的关系
a. Stokes位移 荧光光谱总是位于物质激发光谱的长波一侧,即荧光波长大于激发光波长的
4
第4页/共39页
小结:分子能级与跃迁 基态(S0)→激发态:吸收特定频率的辐射;量子化;跃迁 一次到位; 激发态→基态:多种途径和方式(见能级图);速度最快、激发态寿命最短的途 径占优势,发生的几率大; 第一、第二、…电子激发单重态 S1 、S2… ; 第一、第二、…电子激发三重态 T1 、 T2 … ;
17
第17页/共39页
2.有机化合物的分子结构与荧光的 关系
(1)跃迁类型:* → 的荧光效率高,系间跨越过程的速率常数小,有利于荧 光的产生; (2)共轭效应:提高共轭度有利于增加荧光效率并产生红移
(3)刚性平面结构:可降低分子振动 ,减少与溶剂的相互作用,故具有很强 的荧光。如荧光素和酚酞有相似结构, 荧光素有很强的荧光,酚酞却没有。
21
第21页/共39页
3. 溶液pH 对酸碱化合物,溶液pH的影响较大,需要严格控制;
当荧光物质本身是弱酸或弱碱时,溶液的pH值对该荧光物质的荧光强度有较大影响, 这主要是因为在不同酸度中分子和离子间的平衡改变,离子结构发生变化,因此荧光强度 也有差异。每一种荧光物质都有它最适宜的发射荧光的存在形式,也就是有它最适宜的 pH值范围。例如苯胺在不同pH值下有下列平衡关系:
磷光发射:电子由第一激发三重态的最低振动能级→基态(T1 →S0跃迁);发光速度很 慢: 10-4~100s、磷光的能量比荧光小
第9章 紫外吸收光谱分析

讨论:
(1) 转动能级间的能量差Δ Ε r:0.005~0.050eV,跃迁 产生吸收光谱位于远红外区。远红外光谱或分子转动光谱; (2) 振动能级的能量差Δ Ε v约为:0.05~1eV,跃迁产 生的吸收光谱位于红外区,红外光谱或分子振动光谱; (3) 电子能级的能量差Δ Ε e较大1~20eV,电子跃迁产生 的吸收光谱在紫外—可见光区,紫外—可见光谱或分子的电 子光谱;
p → p*跃迁:红移; ;e
pp np
max(正己烷)
230 329
max(氯仿)
238 315
max(甲醇)
237 309
max(水)
243 305
溶剂的影响
苯
1
1:乙醚
酰
丙
2:水
酮
2
极性溶剂使精细结构 消失;
250 300
非极性 → 极性 n → p*跃迁:兰移; ;e p → p*跃迁:红移; ;e
(2)共轭烯烃中的 p → p*
p*
p*₃
p*
p p*
165nm 217nm p₂
(HOMO LVMO) p
p₁
p
max
共轭烯烃(不多于四个双键)p p*跃迁吸收峰位置可由伍德
沃德——菲泽 规则估算。 max= 基+nii
基-----是由非环或六环共轭二烯母体决定的基准值; 无环、非稠环二烯母体: max=217 nm
红移与蓝移
有机化合物的吸收谱带 常常因引入取代基或改变溶 剂使最大吸收波长λmax和吸 收强度发生变化:
λmax向长波方向移动称为 红移,向短波方向移动称为 蓝移 (或紫移)。吸收强度即 摩尔吸光系数ε增大或减小的 现象分别称为增色效应或减 色效应,如图所示。
第九章 紫外吸收光谱分析
3.在下列化合物中,哪些适宜作为紫外 光谱测定中的溶剂? 甲醇、乙醚、苯、碘乙烷、乙醇、 正丁醚、环己烷 4. 下列化合物中哪一个的max最长? CH4; CH3I; CH2I2
在下列化合物中同时含有*、 n*、 *跃迁的化合物是 三氯甲烷、丙酮、丁二烯、二甲苯
在下列化合物中,那一个化合物能吸 收波长较长的辐射( ) 苯、二甲苯、对氯代甲苯、萘
1, 3-丁二烯:max=210nm, =20000L· mol-1· cm-1
1, 5己二烯:两个不共轭的双键,1-己烯:一个双键。 1, 5-己二烯与1, 3-丁二烯比较:两者都有两个双键, 摩尔吸光系数相近;区别: 1, 3-丁二烯中两个双键共
轭,吸收波长红移,最大吸收波长= 210nm 。因此,
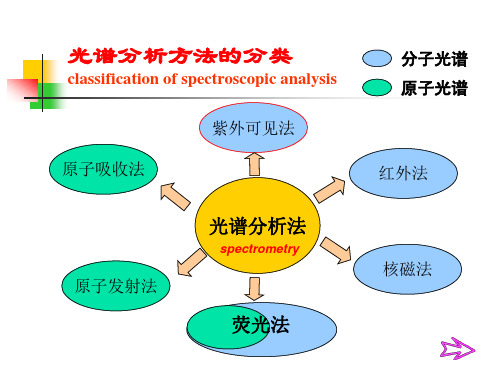
光谱分析方法的分类
classification of spectroscopic analysis 紫外可见法
分子光谱 原子光谱
原子吸收法
红外法
光谱分析法
spectrometry
原子发射法
核磁法
荧光法
光学分析法概要(P201)
依据:物质吸收、发射电磁辐射(电磁波;光) 光学分析法:利用物质与电磁辐射的相互作用来进行 分析的方法。
⑶ * 跃迁(NV跃迁)
吸收波长处于远紫外区的近紫外端或近 紫外区,max一般在104以上, 强吸收。有机化 合物中含有 电子的化合物均可发生该类跃 迁。如不饱和烃 * 跃迁 ( 乙烯 * 跃 迁的max=165nm, max=104;乙炔*跃迁的 max=173nm 。 乙 醛 * 跃 迁 的 max 为 190nm,max:104。( <200nm ;生色团)
某化合物分子式为,
紫外吸收光谱
R带与K带
R带: R带相当于n →π* 跃迁所吸收的能量产生的吸收带。 含有杂原子的不饱和基团,如-C=O、-N=N- 、-NO、-NO2 等发色团的特征。 特点:(1)吸收较弱; (2)波长较长270-300nm K带: 由于共轭双键中π → π* 跃迁所产生的吸收带称为K带。 特点:(1)吸收强度大,摩尔吸光系数大(104-105之间) (2)波长在217-280nm之间。 (3)利用紫外吸收光谱是否有K吸收带,作为判断共 轭体系的重要依据。
讨论:
(4)吸收光谱波长分布由产生谱带跃迁能级间的能量差决定, 反映分子内部能级分布状况,是物质定性依据; (5)吸收谱带强度与分子偶极矩变化、跃迁几率有关,提供分 子结构信息。通常将在最大吸收波长处测得的摩尔吸光系数 ε max作定性依据。不同物质λ max可能相同,但ε max不一定
相同;
(6)吸收谱带强度与该物质分子吸收光子数成正比,定量分析
紫外吸收光谱
电子跃迁与分子吸收光谱
物质分子内部三种运动形式: (1)电子相对于原子核的运动; (2)原子核在其平衡位置附近的相对振动;
(3)分子本身绕其重心的转动。
分子具有三种不同能级:电子能级、振动能级和转动能级 三种能级都是量子化的,且各自具有相应的能量。 分子的内能:电子能量Ee 、振动能量Ev 、转动能量Er 即: E=Ee+Ev+Er
生色团 烯 炔 羧基 酰胺基 羰基 偶氮基 硝基 亚硝基 硝酸酯
溶剂 正庚烷 正庚烷 乙醇 水 正己烷 乙醇 异辛酯 乙醚
二氧杂环己烷
/nm 177 178 204 214 186 339,665 280 300,665 270
emax
(整理)紫外吸收光谱法
(整理)紫外吸收光谱法第8章紫外吸收光谱法紫外-可见分⼦吸收光谱法(ultraviolet-visible molecular absorption spectrometry,UV-VIS ),⼜称紫外-可见分光光度法(ultraviolet-visible spectrophotometry )。
它是研究分⼦吸收190~750nm 波长范围内的吸收光谱。
紫外-可见吸收光谱主要产⽣与分⼦价电⼦在电⼦能级间的跃迁,是研究物质电⼦光谱的分析⽅法。
通过测定分⼦对紫外-可见光的吸收,可以⽤于鉴定和定量测定⼤量的⽆机化合物和有机化合物。
在化学和临床实验室所采⽤的定量分析技术中,紫外-可见分⼦吸收光谱法是应⽤最⼴泛的⽅法之⼀。
§9-1 光吸收定律⼀、朗伯-⽐尔定律分⼦吸收光谱法是基于测定在光程长度为b (cm )的透明池中,溶液的透射⽐T 或吸光度A 进⾏定量分析。
通常被分析物质的浓度c 与吸光度A 呈线性关系,可⽤下式表⽰:0lg tI A abc I == (9-1)式中各参数的定义如表9-1所⽰。
该式是朗伯-⽐尔定律的数学表达式,它指出:当⼀束单⾊光穿过透明介质时,光强度的降低同⼊射光的强度、吸收介质的厚度以及光路中吸光微粒的数⽬呈正⽐。
由于被分析物质的溶液是放在透明的吸收池中测量,在空⽓/吸收池壁以及吸收池壁/溶液的界⾯间会发⽣反射,因⽽导致⼊射光和透射光的损失。
如当黄光垂直通过空⽓/玻璃或玻璃/空⽓界⾯时,约有8.5%的光因反射⽽被损失。
此外,光束的衰减也来源于⼤分⼦的散射和吸收池的吸收。
故通常不能按表9-1所⽰的定义直接测定透射⽐和吸光度。
为了补偿这些影响,在实际测量中,采⽤在另⼀等同的吸收池中放⼊溶剂与被分析溶液的透射强度进⾏⽐较。
⼆、吸光度的加和性当溶液中含有多种对光产⽣吸收的物质,且各组分间不存在相互作⽤时,则该溶液对波长λ光的总吸收光度A 等于溶液中每⼀成分的吸光度之和,即吸光度具有加和性。
荧光光谱基础知识
荧 光 光 谱(Fluorescence Spectroscopy )韩荣成(10303023)北京大学,03级生物医学工程一、背景知识:1.荧光,是指物质在吸收紫外光后发出的波长较长的紫外荧光或可见荧光,以及吸收波长较短的可见光后发出波长较长的可见荧光。
除了紫外荧光和可见荧光,还有红外荧光、X 射线荧光等。
在很多情况下,分子从激发态回到基态过程中,能量通过热量等形式散失到周围。
但 是在某些情况下,能量能以光子发射的形式释放出来。
分子的能量状态在光学分析中涉及的分子能量有:E 0=Ee+Ev+Er ,其中Ee:价电子运动能(electron ); Ev :原子在平衡位置的振动能(vibration );Er :分子绕其重心的转动能(rotation )。
Ee 大约为1eV 数量级;Ev 大约为10-1~10-2 eV ;Er 大约为10-4~10-5eV 数量级,可见⊿Ee>⊿Ev>⊿Er分子吸收能量后,处于激发态的分子通过非辐射过程丢失能量,首先到达S1的最低振动能级,这一过程称为内转换(internal conversion),发生在10-11s内。
从S1的最低振动能级以光子形式放出能量而回到基态的不同振动能级,这一过程称为荧光(fluorescence),发生在10-9s内;如果以非辐射的形式丢失能量则称为淬灭(quenching)。
如果某种物质在被某种波长的光照射以后能在较长的时间内发出比荧光波长更长的波长的光,则称这种光为磷光。
磷光产生的机制与荧光是不同的,虽然它们都属于发射光谱,但磷光不是处于第一电子激发态的最低振动能级的分子直接释放出光子回到基态的结果,而是从某种能量低于第一电子激发态的最低振动能级的另一种亚稳能级⎯三重态向基态的各振动能级以辐射方式产生跃迁时发出的光。
所谓三重态或三线态,是指分子中电子自旋量子数S=1,即原来两个配对的自旋方向相反的电子之一自旋方向改变,以至电子自旋之和不为0的情况。
紫外吸收光谱
化合物
1,3-丁二烯 1,3,5-己二烯
溶剂
己烷 异辛烷
max/nm
217 268 304 334 364
emax
21,000 43,000 — 121,000 138,000
1,3,5,7-辛四烯 环己烷
1,3,5,7,9-癸四烯 1,3,5,7,9,11- 十 二 烷基六烯
用不同波长的单色光照射, 测吸光度;
吸收曲线的讨论:
①同一种物质对不同波长光的 吸光度不同。吸光度最大处对应 的波长称为最大吸收波长λ max ②不同浓度的同一种物质,其吸收曲线形状相似λmax不变。 而对于不同物质,它们的吸收曲线形状和λmax则不同。 ③吸收曲线可以提供物质的结构信息,并作为物质定性分析的 依据之一。
,但ε max不一定相同;
(6)吸收谱带强度与该物质分子吸收的光子数成正比,定量分
析的依据。
一、紫外吸收光谱的产生
formation of UV
1.概述
紫外吸收光谱:分子中价电子能级跃迁。 波长范围:100-800 nm. (1) 远紫外光区: 100-200nm
(2) 近紫外光区: 200-400nm
讨论:
④不同浓度的同一种物质,在某一定波长下吸光度 A 有差异,在λ max处吸光度A 的差异最大。此特性可作作
为物质定量分析的依据。
⑤在λ max处吸光度随浓度变化的幅度最大,所以测定
最灵敏。
基本术语
生色团: 分子中可吸收光子产生电子跃迁的基团 最有用的紫外—可见光谱是由π→π*和n→π*跃迁 产生的。这两种跃迁均要求有机物分子中含有不饱 和基团。简单的生色团由双键或叁键体系组成,如 乙烯基、羰基、亚硝基、偶氮基—N=N—、乙炔基 、腈基—C≡N等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验报告
化学测量与计算实验Ⅱ
实验名称:紫外吸收和荧光光谱的计算
学生姓名:学号:
院(系):年级:级指导教师:
实验日期:2017.03.27 交报告日期:2017.04.10
一、实验目的
1.掌握紫外吸收的基本原理;
2.熟悉溶液中的计算方法;
3.学会如何看MO 。
二、实验原理
1. 溶剂效应的理论方法
我们对溶剂效应的静态模拟,关心的是溶剂效应的两个方面:一是溶剂分子反应中心有键的作用,包括配位键和氢键等,这种作用属于短程作用,另一个是 极性溶剂的偶极距和溶质分子偶极距之间的静电相互作用,这个属于远程作用,当然溶剂和溶质之间的色散力作用也是重要的远程作用,特别是对于非极性溶剂而言,但是色散力的描述是量子化学模拟的一个难题。
高斯计算时,考虑溶剂效应,可以采用三种策略: ① 超分子方法
对于短程作用十分重要的体系,直接考虑溶剂分子和反应中心的作用。
② 连续介质模型
对于没有短程作用的体系,把溶剂效应看成是溶质分子分布在具有均一性质 的连续介质当中,也称为反应场。
③ 超分子-连续介质方法
短程作用的超分子方法和远程作用的连续介质模型结合起来的方法渐渐 为人们所青睐。
这种方法得到的结果更为可靠,因为它综合考虑的溶剂的短程作用和远程作用。
短程作用的模拟,很直观的直接采用 QM 的方法研究溶剂分子作用了的活性 中心,考虑这种成键对反应区域和反应过渡态结构和能量的影响。
远程作用 需要做一些物理上的近似处理(也就是一定的物理模型)。
连续介质模型有 很多,作为常用的是 PCM (极化连续介质模型)。
在连续的介质中腾出空穴以容纳溶 质,会导致体系能量升高,这部分的能量称为 cavity formation energy 。
空穴中的溶质和溶剂的作用,主要是范德华力的作用 (不包括静电作用)。
这部分能量称为分散-排斥能,一般为负值 (能量降低)。
溶质分子的电荷分布会通过静电作用使连续介质(溶剂)产生极 化,而溶剂的极化作用反过来又会影响到溶质分子的电荷分布。
这就是静电 的相互作用,使体系能量降低。
三项能量的加和得到了溶剂化自由能前两项的能量与空穴表面积接近成正比关系,在 PCM 模型中,这两项能量由表面积结合一些与原子 特性相关的半经验参数计算而得。
2.溶剂化能
溶剂化能是溶剂分子与溶解于其中的离子,在相互作用形成络合物的溶剂化作用过程中放出的能量。
该能量用于破坏电解质分子的晶格,使之在溶剂中能够自动溶解而成为自由离子。
定义:∆F sol =G sol −U gas
其中,∆F sol = ∆F el + ∆F HB + ∆F cav + ∆F dis−rep (静电能) (氢键能) (孔穴能) (色散-排斥能)
a
Q V F 2)1(d 21 :2s s el εερϕ-==∆⎰溶剂化能)11)(21(Cl H s s a a +-=εε
3.紫外吸收光谱
许多有机分子中的价电子跃迁,须吸收波长在
200~1000 nm 范围内的光,恰好落在紫外-可见光
区域。
因此,紫外吸收光谱是由于分子中价电子的
跃迁而产生的,也可以称它为电子光谱。
4.荧光光谱
荧光激发光谱:让不同波长的激发光激发荧光物质使之发生荧光,而让荧光以固定的发射波长照射到检测器上,然后以激发光波长为横坐标,以荧光强度为纵坐标所绘制的图,即为荧光激发光谱。
荧光发射光谱的形状与激发光的波长无关。
荧光发射光谱:使激发光的波长和强度保持不变,而让荧光物质所发出的荧光通过发射单色器照射于检测器上,亦即进行扫描,以荧光波长为横坐标,以荧光强度为纵坐标作图,即为荧光光谱,又称荧光发射光谱。
三、实验步骤
1.打开电脑当中的G09W 软件,新建任务。
2.建设任务,进行计算方法(route section)、标题、分子所带电荷及自旋多重度、分子坐标的输入,然后保存为输入文件。
3.使用CHEMCRAFT软件将几何构型画出,使用此软件获得该分子的坐标。
4.选择RUN 并保存输出文件的位置。
5.等待计算完成后,打开输出文件,分析所得到的数据。
6.可以使用CHEMCRAFT软件读取OUT文件,获得相关数据。
四、实验内容
1.优化几何构型
#p b3lyp/6-31G(d,p) opt freq
scrf=(pcm,solvent=chloroform)
2.用优化好的几何构型计算紫外光谱和输出MO
#p b3lyp/6-31G(d,p) td(nstate=6) pop=full gfinput scrf=(pcm,solvent=chloroform)
3.荧光光谱计算
#p b3lyp/6-31G(d,p) td(nstate=3) opt scrf=(pcm,solvent=chloroform)
五、实验结果
1.乙烯分子
振动频率/cm -1
振子强度 153.13 0.4146 148.61 0 132.55 0.0004 128.37 0 126.94 0 118.09 0
紫外吸收光谱图:
FMO 图:
TD spectrum
Wavelength, nm
175
170
165
160
155
150
145
140
135
130
125
120
115
110
f
0.5 0.48 0.46 0.44 0.42 0.4 0.38 0.36 0.34 0.32 0.3 0.28 0.26 0.24 0.22 0.2 0.18 0.16 0.14 0.12 0.1 0.08 0.06 0.04 0.02 0
6 -> 14 -0.10133
8 -> 9 0.70642
8 <- 9 -0.12230 2.反式1-3丁二烯分子
振动频率/cm-1振子强度213.720.7501
172.590
170.570.0004
149.610
148.290
148.060.0003紫外吸收光谱:
FMO图:
TD spectrum
Wavelength, nm
240
230
220
210
200
190
180
170
160
150
140
130
120
f 0.9
0.85 0.8 0.75 0.7 0.65 0.6 0.55 0.5 0.45 0.4 0.35 0.3 0.25 0.2 0.15 0.1 0.05
15 -> 16 0.71188 15 <- 16 -0.12003
3.反式1,3,5-己三烯分子 振动频率/cm -1
振子强度 268.96 1.161 211.85 0 180.82 0 174.03 0 173.87 0.0001 169.3 0.0003
紫外吸收光谱:
FMO 图:
荧光光谱:
Excited State 1: Singlet-BU 3.8038 eV 325.95 nm f=1.2501 <S**2>=0.000 22 -> 23 0.71430 TD spectrum
Wavelength, nm
300
290
280
270
260
250
240
230
220
210
200
190
180
170
160
150
140
130
f
1
4. 顺式-戊-3-烯-2-酮分子
振动频率/cm -1
振子强度 340.01
0.0002 220.27 0.3638 177.85 0.0002 172.27 0 167.6 0.0018 160.47
0.0454
紫外吸收光谱:
Excited State 2: Singlet-A 5.6287 eV 220.27 nm f=0.3638 <S**2>=0.000 22 -> 24 0.69864
Excited State 6: Singlet-A 7.7265 eV 160.47 nm f=0.0454 <S**2>=0.000 21 -> 24 0.64887
FMO 图:
TD spectrum
Wavelength, nm
340
320
300
280
260
240
220
200
180
160
f
0.44 0.42 0.4 0.38 0.36 0.34 0.32 0.3 0.28 0.26 0.24
0.22 0.2 0.18 0.16 0.14 0.12 0.1 0.08 0.06 0.04 0.02 0
六、实验反思与总结
1. 本次实验最后一个分子不需要进行荧光光谱的计算,因为G09W 软件计算运行得很慢,需要运行很长的时间,甚至有可能运算不出来结果。
2.本次实验的%mem值应至少大于600mb。
