第一章物质及其变化知识讲解
1.1.1 物质的分类 第一章 物质及其变化

1.1.1物质的分类学习目标:1.了解物质分类的方法和依据。
2.认识元素可以组成不同种类的物质,根据物质的组成和性质可以对物质进行分类。
3.知道分散系的概念,能说出分散系的分类。
4.认识胶体是一种常见的分散系。
5.能根据胶体的性质解释生活中与之有关的现象。
知识点一同素异形体含义:由同一种元素形成的几种性质不同的单质,叫做这种元素的同素异形体。
举例①金刚石、石墨和C60是碳元素的同素异形体。
②氧气和臭氧(O3)是氧元素的同素异形体。
(1)产生同素异形体的原因①组成分子的原子数目和成键方式不同,如氧气(O2)和臭氧(O3)。
②原子的排列方式不同,如金刚石和石墨。
(2)研究对象①同素异形体是指单质,不是指化合物。
②互为同素异形体的不同单质是由同一种元素组成的,构成它们的原子的核电荷数相同。
(3)同素异形体的“同”“异”的含义①“同”——指元素相同;②“异”——指形成单质不同,结构不同,性质有差异。
(4)同素异形体的“结构决定性质”①同素异形体的结构不同,性质存在差异。
②物理性质不同,化学性质有的相似,有的相差较大。
【典例1】清晨,松树林中的空气特别清新,是因为有极少量的氧气变成了臭氧,反应的方程式为3O2⇋2O3。
下列说法中正确的是( )A.这是一个化合反应B.由氧元素构成的物质是纯净物C.产生的臭氧与氧气是氧元素的同素异形体D.这个反应属于物理变化[思路启迪] 解答该题时一定要注意以下关键点:(1)同素异形体的物理性质不同,化学性质有的相似,有的相差较大,同素异形体间的转化是化学变化。
(2)由同种元素组成的物质可能是纯净物中的单质,也可能是同素异形体组成的混合物。
对同素异形体概念的理解(1)组成元素:只含有一种元素。
(2)物质类别:互为同素异形体的只能是单质。
(3)性质关系:同素异形体之间的物理性质有差异,但化学性质相似。
(4)相互转化:同素异形体之间的转化属于化学变化。
(5)同素异形体之间的转化既有单质参加,又有单质生成,但没有涉及化合价的变化。
九年级科学上册 第1章 物质及其变化复习知识点归纳

第1章物质及其变化第1节物质的变化知识点1 物质是在不断变化着的1.物理变化和化学变化:产生新物质的变化属于化学变化,不产生新物质的变化属于物理变化。
2.化学变化的基本特征是生成新物质.化学变化一定伴随发生物理变化,但物理变化中不一定发化学变化。
知识点2 探索物质变化的方法1.化学变化中常伴随发光、放热、放出气体、产生沉等现象,但有这些现象的变化不一定是化学变化.判断化学变化的依据是生成了新物质。
2.探索物质的变化和变化规律时,可以通过观察、实验等方法,从物质的状态、颜色、温度(吸热或放热)、有无沉淀或气体生成等方面寻找证据.第2节物质的酸碱性知识点1 酸性物质和碱性物质1.电离:物质溶解于水或受热熔化而形成自由移动离子的过程,叫做电离。
2.酸是由氢离子和酸根离子组成的化合物,碱是由金属离子和氢氧根离子组成的化合物.3.酸在水中电离时,生成的阳离子都是氢离子;碱在水中电离时,生成的阴离子都是氢氧根离子。
知识点2 酸碱指示剂1.在酸性或碱性溶液里能显示不同颜色的物质,叫做酸碱指示剂,通常简称指示剂。
2.紫色的石蕊试液在酸性溶液中显示红色,在碱性溶液中显示蓝色;无色的酚酞试液在酸性溶液中不变色,在碱性溶液中显示红色;蓝色石蕊试纸在酸性溶液中显示红色,在碱性溶液中显示蓝色;红色石蕊试纸在酸性溶液中显示红色,在碱性溶液中显示蓝色.3.酸性溶液或碱性溶液使指示剂变色,不能说成指示剂使酸性溶液或碱性溶液变色。
因为变色的物质是指示剂,不是酸性或碱性溶液.4.花瓣中含有一些植物色素,这些色素在酸性或碱性溶液中呈现不同的颜色,用花的汁液可以制成酸碱指示剂。
知识点3 溶液酸碱性的强弱程度1.溶液的酸碱性强弱程度简称酸碱度。
2.化学上通常用pH表示溶液的酸碱度。
pH的范围通常在0~14之间。
3.pH=7,溶液呈中性;pH<7,溶液呈酸性,pH越小,物质酸性越强;pH〉7,溶液呈碱性,pH越大,物质碱性越强。
4.pH=0的溶液是酸性溶液,但不是酸性最强的。
物质及其变化知识归纳

礼源中学九年级科学《物质及其变化》知识归纳班级_________姓名________学号____一、概念:1. 酸的组成:氢离子+酸根离子2. 碱的组成:金属离子(或铵根离子)+氢氧根离子3. 盐的组成:金属离子(或铵根离子)+酸根离子4. 复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB5. 稀释浓硫酸的方法:把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6. 中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
中和反应应用:⑴改变土壤的酸碱性⑵处理工厂的废水⑶用于医药7. 潮解物质暴露在空气中因吸收空气中的水分,表面潮解并逐渐溶解的现象。
(如NaOH)8. 风化——结晶水合物在常温下,放在干燥的空气里逐渐失去结晶水的现象。
二、熟记常见元素和原子团的化合价口诀:钾钠银氢+1;钙镁钡锌+2;氟氯溴碘-1;一二铜、二三铁;三铝四硅五价磷;二四六硫、二四碳;单质化合价为零(原子团的化合价负一价:氢氧根(OHˉ),硝酸根(NO3ˉ),氯酸根(ClO3ˉ),高锰酸根(MnO4ˉ);负二价:硫酸根(SO42ˉ),碳酸根(CO32ˉ),亚硫酸根(SO32ˉ),锰酸根(MnO42ˉ);负三价:磷酸根(PO43ˉ);正一价:铵根(NH4+)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色。
(2)酸+活泼金属=盐+氢气。
(3)酸+某些金属氧化物=盐+水。
(4)酸+碱=盐+水。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应: Zn + 2HCl = ZnCl2 + H2 ↑有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应: Zn + H2SO4 = ZnSO4 + H2↑3、铁跟稀盐酸反应: Fe + 2HCl = FeCl2 + H2 ↑有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应: Fe + H2SO4 =FeSO4 + H2↑溶液变成浅绿色。
人教版2019新教材高中化学必修一第一章第一节物质的分类及转化知识点梳理
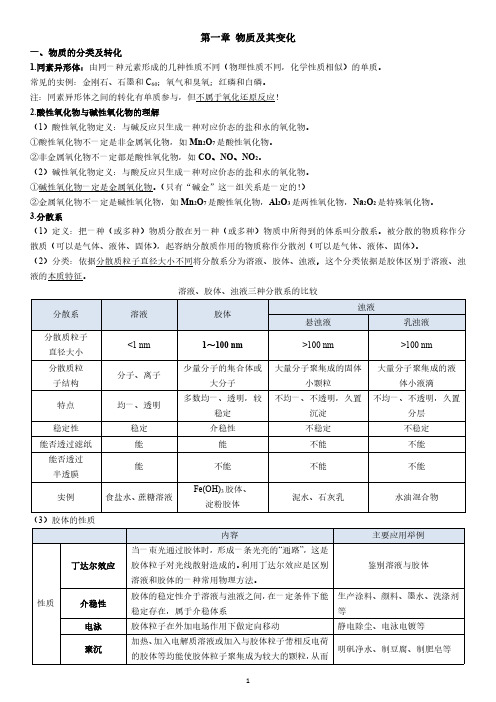
第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。
第一章 物质及其变化

气体常数可由实验测定。如测得1.000mol气体在273.15K、 101.325kPa的条件下所占的体积为22.414×10–3m3,则得:
新返回液体的过程。
湖南石油化工职业技术学院
当蒸发和凝聚达到动态平衡时: 液体
蒸发 凝聚
蒸气
此时,在液体上部的蒸气量不再改变,蒸气具有恒定的压力。
(3) 饱和蒸气压(蒸气压):在恒定温度下,与液体平衡的蒸气压力。
a. 蒸气压是物质的一种特性,与液体的质量和容器的体积无关。 b. 蒸气压大的物质为易挥发物质,蒸气压小的物质为难挥发物质。 c. 液体的蒸气压随温度的升高而增大。 例4 用锌与盐酸反应制备氢气,如果在25℃时用排水法收集氢气, 总压为98.6kPa(已知25时水的饱和蒸气压为3.17kPa),体积为 2.50×10-3m3。 求:(1) 试样中氢的分压是多少?(2) 收集到的氢气的质量是多少?
Ө ─ 标准符号,指反应各物质处于标准状态; △rHmӨ(298K):读作温度在298K时的标准摩尔反应焓变。 2.热化学方程式的注意事项 (1)需要注明反应的温度和压力条件。
(2)△H与化学计量数有关,应与具体的反应联系,否则无意义。
2H2(g) + O2(g) → 2H2O(g);△rHmӨ(298K) = -483.6kJ〃mol-1 (3)需在反应式中注明物质的聚集状态。“g”为气态,“l”为 液态,“s”为固态。 2H2(g) + O2(g) → 2H2O(l);△rHmӨ(298K) = -572.0kJ〃mol-1 (4)逆反应的热效应与正反应的热效应数值相等而符合相反。 2H2O(l) → 2H2(g) + O2(g) ;△rHmӨ(298K) = 572.0kJ〃mol-1
第一章 物质及其变化 第一节 物质的分类及转化(解析版)

第一节物质的分类及转化【学习目标】1.能从元素组成的角度分析认识物质,根据物质的组成和性质对物质进行分类。
2.熟知溶液、浊液、胶体三种分散系的本质区别。
3.了解胶体的性质及其应用,会鉴别胶体和溶液。
4.熟知酸、碱、盐的性质,会写相关反应的化学方程式,并判断其反应类型。
5.认识同类物质具有相似性,学会分析研究物质性质与相互转化的方法,促进“证据推理与模型认知”化学核心素养的发展。
【基础知识】一、物质的分类1、元素:元素是具有相同核电荷数(即质子数)的一类原子的总称。
2、分子:能够独立存在并保持物质化学性质的最小微粒,由原子构成,呈电中性,具有一定的物理化学性3、同素异形体:同种元素形成的不同单质叫同素异形体。
形成方式:①原子个数不同,如O2和O3;②原子排列方式不同,如金刚石和石墨。
4、纯净物:由同种单质或化合物组成的物质。
5、混合物:由几种不同的单质或化合物组成的物质。
6、单质:由同种元素组成的纯净物称为单质,包括金属单质和非金属单质。
7、化合物:由两种或两种以上元素组成的纯净物称为化合物,包括酸、碱、盐、氧化物等。
注意:常见的混合物举例:①气体混合物水煤气爆鸣气天然气焦炉气高炉煤气石油气主要成分CO、H2H2、O2CH4H2、CH4等CO、CO2、N2等丙烷、H2等②液体混合物氨水王水硬水水玻璃福尔马林汽油主要成分NH3·H2ONH3、H2O 盐酸、硝酸含Ca2+、Mg2+较多的水Na2SiO3、H2O甲醛、H2OC5~C11的烃③固体混合物8、分类的方法(1)树状分类法:根据对象的共同点和差异,将对象分为不同的种类,而且形成具有一定从属关系的不同等级系统的一种分类方法。
应用树状分类法可以对同类事物进行再分类。
(2)交叉分类法:根据不同的分类标准对同一物质进行分类的一种方法。
在对物质进行分类时,采用交叉分类法能从不同角度对物质进行较全面的分析。
9、分散系:一种(或多种)物质分散到另一种(或多种)物质中所得到的体系,叫做分散系。
新人教高中化学必修1讲义02 第一章第一节第2讲 物质的转化

第一章 物质及其变化 第一节物质的分类及转化 第2讲 物质的转化【讲】知识点1酸碱盐的性质 (1)酸的性质 ①酸:H ++酸根离子 按强弱分:常见的强酸:盐酸、硫酸、硝酸等常见的弱酸:碳酸、亚硫酸、磷酸、醋酸、亚硝酸、硫化氢等按有无氧分: 常见的含氧酸: 常见的无氧酸:按有无挥发性(沸点高低)分: 常见的挥发性酸: 常见的非挥发性酸:②酸具有相似化学性质的原因:从微观角度来看,不同的酸溶液中都含有H +。
③酸的通性酸⎩⎪⎨⎪⎧+酸碱指示剂,如使紫色石蕊溶液变红色+活泼金属―→盐+氢气(置换反应)⎭⎬⎫+碱性氧化物―→盐+水+碱―→盐+水+盐―→新酸+新盐复分解反应例如:(2)碱的性质①碱:金属阳离子+OH -及一水合氨 按强弱分类常见的强碱: 氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡等 常见的弱碱:一水合氨、氢氧化铁、氢氧化铜等按溶解性分类 常见的可溶性碱: 常见的不可溶性碱:②碱具有相似化学性质的原因:从微观角度来看,不同的碱溶液中都含有OH -。
③碱的通性碱⎩⎪⎨⎪⎧+酸碱指示剂,如使酚酞溶液变红色⎭⎬⎫+酸性氧化物―→盐+水+酸―→盐+水+盐―→新碱+新盐复分解反应(3)盐的性质①盐:金属阳离子(铵根离子)+酸根离子 可溶性盐:氯化钠、硝酸钾等 不可溶性盐:硫酸钡、氯化银等②同一类盐具有相似化学性质的原因:从微观角度来看,组成上含有相同阴离子或阳离子。
③盐的通性盐⎩⎨⎧⎭⎬⎫+酸→新盐+新酸+碱→新盐+新碱+盐→新盐+新盐复分解反应 特别提醒 盐与盐、盐与碱能反应的条件一般要求二者都可溶。
【练】1.将下列各组物质按酸、碱、盐的分类依次排列,正确的是( )A .硫酸、纯碱、石膏B .硫酸、烧碱、胆矾C .硫酸氢钠、生石灰、醋酸钠D .磷酸、熟石灰、苛性钠 答案 B解析 硫酸属于酸,纯碱是Na 2CO 3,属于盐,石膏属于盐,A 错误;硫酸属于酸,烧碱是NaOH ,属于碱,胆矾是五水硫酸铜,属于盐,B 正确;硫酸氢钠属于盐,生石灰属于氧化物,醋酸钠属于盐,C 错误;磷酸属于酸,熟石灰属于碱,苛性钠是NaOH ,属于碱,D 错误。
浙教版2023-2024学年第一学期九年级科学第一章《物质及其变化》知识梳理

浙教版2023-2024学年第一学期九年级科学第一章《物质及其变化》知识梳理第一章《物质及其变化》知识梳理第1节物质的变化1.常见的变化(1)物质的变化包括物理变化和化学变化,二者根本区别:①宏观上变化中是否生成新物质;②微观上变化中是否生成新分子。
(2)化学变化的实质是构成物质分子的原子重新进行组合,形成了新的分子;在化学变化中同时伴随有物理变化;而物理变化中不一定有化学变化。
2.物质的性质(1)物质的性质包括:物理性质和化学性质;(2)物理性质是指物质不需发生化学变化就表现出来的性质,它可通过人体感官直接感知或用仪器测量出来,如颜色、状态、气味、味道、密度、溶解性、熔点、沸点、硬度、吸附性、挥发性、导热性、导电性、延展性、铁磁性等;(3)化学性质是物质在化学变化中表现出来的性质,如可燃性、助燃性、稳定性、还原性、氧化性、毒性、酸碱性等。
第2节物质的酸碱性1.一些物质溶解于水或受热熔化而离解成自由移动离子的过程。
(1)在溶液里,所有的阳离子带的正电荷总数和所有阴离子带的负电荷总数相等,整个溶液不显电性;(2)书写时要注意配平,使方程式两边各元素的原子个数相等;(3)阴、阳离子所带的电荷数一般可以根据它们在化合物中的化合价来判断。
2.表示方法:电离方程式。
3.酸性物质:具有酸性的物质。
常见的酸性物质有盐酸、碳酸、醋酸(食醋)、草酸、柠檬酸、苹果酸等。
4.酸:酸在水中电离时,产生的阳离子全部都是H+。
5.酸的溶液一定是酸性溶液;酸性溶液不一定是酸的溶液。
6.碱性物质:具有碱性的物质。
常见的碱性物质有氢氧化钠、苏打、熟石灰、氨水、肥皂水等。
7.碱:碱在水中电离时,产生的阴离子全部都是OH-。
8.碱的溶液一定是碱性溶液;碱性溶液不一定是碱的溶液。
9.在酸性或碱性溶液里能显示出不同颜色的物质,叫做酸碱指示剂,通常简称指示剂。
常见的酸碱指示剂有紫色石蕊试液和无色酚酞试液。
(1)某一酸性溶液,能使紫色石蕊试液变红色,无色酚酞试液不变色;(2)某一碱性溶液,能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
PA
nART V
PB
nBRT V
P总
n总RT V
(nA
nB )RT V
PA nA nA P总 nA nB n总
或
PA
P总
nA n总
同理
PB
P总
nB n总
例1 (P3):在0.0100 m3容器中含有2.50×10-3 mol H2, 1.00×10-3 mol He 和 3.00×10-4 mol Ne,在35℃时总
第一章 物质及其变化
第一节 物质的聚集状态 1-1 气体 1-2 液体 1-3 固体 1-4 等离子体 第二节 化学反应中的质量关系和能量关系
1-1 质量守恒定律 1-2 反应热效应 焓变 1-3 热化学方程式 1-4 热化学定律
1-5 生成热(生成焓)
1-1 气体 1. 理想气体状态方程式 2. 混合气体分压定律 3. 混合气体分体积定律
分析,各气体的体积分数为:CO 60.0%,H2 10.0%, 其他气体为30.0%.求混合气中:(1) CO和H2的分 压;(2) CO和H2的物质的量.
解题思路:(1)PA
nART V
PA
P总
nA n总
PA P总nn总 A P总VV总 A √
(2) PAV总 = nA R T
P总 VA = nA R T
(2) P(H2)V= n(H2)RT =
m(H 2 )RT M (H2)
m(H2)
=
P(H2)VM(H2) RT
9 .5 4 13P 0 a 0 .00m 2 3 2 5 .0g 0 2 m 1 ol 8 .3J 1m 4 1 o K l1 2K 98
=0.194g
3. 混合气体分体积定律
分体积的概念:
解:(1)
P(CO)=
P(总)×
V (CO V总
)
=101.3
kPa×0.600=60.8
kPa
P(H2)=P(总)×
V (H 2) V总
=101.3
kPa×0.100=10.1
kPa
(2)n(H2)=P(HR2 )TV(总)
1.0 113 0P a1.00 1 03m3 8.31J4 m o1lK130K 0
R =n p T V =1 0 1 .3 2 1 5 .0 × 0 1 0 0 m 3 P o a l× × 2 2 7 2 3 ..4 1 1 5 4 K × 1 0 -3 m 3
注:
= 8.314 Pa ·m3 ·mol-1 ·K-1
8.314 8.314
Pa ·m3 ·mol-1 ·K-1 kPa ·L ·mol-1 ·K-1
8314 Pa ·L·mol-1 ·K-1
(3) 理想气体状态方程式的其它运用
① 求分子量(摩尔质量)Mr PV =nRT =(m/M) RT M=mRT/PV
② 求密度(ρ)
ρ= m/V
P(m/ρ) = nRT
ρ= P(m/n)/(RT) M= m/n
ρ= (PM)/(RT)
2. 混合气体分压定律
组分气体:混合气体中的每一种气体就称为组分气体。
分压力:混合气体中每一组分气体在相同温度下占有与
混合气体相同体积时所产生的压力,叫做组分气体的分
压力。
T、V相同
nnAAnnBB P总
nA
nB
PA
PB
混合气体分压定律:混合气体的总压等于混合气体中各组 分气体分压之和。
P总 = PA + PB + … (T,V恒定)
1-1 气体
1. 理想气体状态方程式
理想气体的假设: 分子没有质量、没有体积、没有作用力
理想气体状态方程式
PV = n R T
压体 力积
物摩温 质尔度 的气 量体
常 数
(T为热力学温度)
在标准状态下(SI):P=101.3256×103Pa, Vm=22.414×10-3m3, n=1.000mol, T=273.15K
压为多少?
解题思路一:
PA
nART V
P总=PA+PB+PC
解题思路二:
P总
n总RT V
(nA
nB +nc ) V
RT
解: p(H2) =
n(H2 )RT V
2 .5 1 0 3 m 0 8 o .30 .J l 0 1 m m 1 4 3 1 o K 0 1 l(2 7 3)K 3 5 = 640 Pa
T
P
某气体的分体积是指和混合气体具有
相同温度(T)和相同压力(P总)时该气
体所占的体积。
VA
混合气体分体积定律:
VB
V总VAVB (T,P恒定)
nA
VA
nB
VB
V总 P总= P
VA
n ART P总
V总
n总 RT P总
VB
nB RT P总
PA P总nn总 A P总VV总 A
例3:在27℃,101.3 kPa下,取1.00L混合气体进行
=4.00×10-3 mol
n(CO)= P(CO)V(总) 6.0 813 0P a1.0 01 0 3m 3
RT
8.31J4m o 1K l 130K0
=2.40×10-2 mol
或n(H2)=
P(总) V(H2) RT
10 .3 1 130 P a0.10 1 0 0 3m 3 8.31 J4 m o 1K l 130 K0
n( He ) RT
p(He) =
V
1 .0 1 0 3 m 0 8 o .3J l1 m 4 1 o K 1 l( 2 7 3 ) K 3 5 0 .0m 1 3 0
= 256 Pa
n( Ne) R T
p(Ne) =
V
3 .0 1 0 4 m 0 8 o .3L J 1 m 4 1 o K 1 l(2 7 3)K 3 5 0 .0m 1 3 0
解题思路:P总 = PA + PB PAV =nART =(m/M) RT
解: (1) 用排水法在水面上收集的气体为被水蒸气饱和了的 氢气, 试样中水蒸气的分压为3.17 kPa, 根据分压定律:
P总 = P(H2) + P(H2O)
P(H2) = P总 - P(H2O) = (98.6-3.17) kPa = 95.4 kPa
= 76.8 Pa
P总 = P(H2)+P(H2O) +P(H2O)= (640+256+76.8) Pa = 973 Pa
解法二:
P总 =
n(总)RT V
=
{n(H2)
+
n(He)
V
+
n(Ne)}RT
例2 :(P3)用锌与盐酸反应制备氢气: Zn(s) + 2H+ Zn2+ + H2(g), 如果在25℃时用排水法 收集氢气, 总压为98.6 kPa (已知25℃时水的饱和蒸 气压为3.17kPa), 体积为2.50×10-3 m3. 求: (1)试样中氢的分压是多少? (2)收集到的氢的质量是多少?
