杂环化合物
杂环化合物

含一个杂原子的六元杂环(一)吡啶吡啶是从煤焦油中分离出来的具有特殊臭味的无色液体,沸点为115.3℃,比重为0.982,是性能良好的溶剂和脱酸剂。
其衍生物广泛存在于自然界中,是许多天然药物、染料和生物碱的基本组成部分。
1.电子结构及芳香性吡啶的结构与苯非常相似,近代物理方法测得,吡啶分子中的碳碳键长为139pm ,介于C-N 单键(147pm )和C=N 双键(128pm )之间,而且其碳碳键与碳氮键的键长数值也相近,键角约为120°,这说明吡啶环上键的平均化程度较高,但没有苯完全。
吡啶环上的碳原子和氮原子均以sp 2杂化轨道相互重叠形成ζ键,构成一个平面六元环。
每个原子上有一个p 轨道垂直于环平面,每个p 轨道中有一个电子,这些p 轨道侧面重叠形成一个封闭的大π键,π电子数目为6,符合4n+2规则,与苯环类似。
因此,吡啶具有一定的芳香性。
氮原子上还有一个sp 2杂化轨道没有参与成键,被一对未共用电子对所占据,是吡啶具有碱性。
吡啶环上的氮原子的电负性较大,对环上电子云密度分布有很大影响,使π电子云向氮原子上偏移,在氮原子周围电子云密度高,而环的其他部分电子云密度降低,尤其是邻、对位上降低显著。
所以吡啶的芳香性比苯差。
见图14-1。
N 1. 001. 010. 841. 430. 87(a )吡啶的分子轨道示意图 (b )吡啶中氮原子的杂化轨道 (c) 吡啶的电子云密度图14-1 吡啶的结构在吡啶分子中,氮原子的作用类似于硝基苯的硝基,使其邻、对位上的电子云密度比苯环降低,间位则与苯环相近,这样,环上碳原子的电子云密度远远少于苯,因此象吡啶这类芳杂环又被称为“缺π”杂环。
这类杂环表现在化学性质上是亲电取代反应变难,亲核取代反应变易,氧化反应变难,还原反应变易。
2.物理性质(1)偶极矩 吡啶为极性分子,其分子极性比其饱和的化合物——哌啶大。
这是因为在哌啶环中,氮原子只有吸电子的诱导效应(-I ),而在吡啶环中,氮原子既有吸电子的诱导效应,又有吸电子的共轭效应(-C )。
杂环化合物

3. 化学性质
1.亲电取代反应 五元杂环为富电子共轭体系,电荷密度比苯大, 富电子共轭体系 五元杂环为富电子共轭体系,电荷密度比苯大,比苯 反应,亲电取代反应的活性为: 容易进行亲电取代 反应,亲电取代反应的活性为: 主要进入α 吡咯 > 呋喃 > 噻吩 > 苯,主要进入α- 位。 正是由于反应活性太高,而环稳定性差,反应一般需在 正是由于反应活性太高,而环稳定性差, 温和条件下进行,对试剂及反应条件必须有所选择和控 温和条件下进行,对试剂及反应条件必须有所选择和控 制。P.206 不需要催化剂,要在较低温度和进行。 不需要催化剂,要在较低温度和进行。 ★ 硝化反应: 不能用混酸硝化,一般是用乙酰基硝酸酯 硝化反应: 不能用混酸硝化, (CH3COONO2)作硝化试剂,在低温下进行。 作硝化试剂,在低温下进行。 作硝化试剂 ★ 磺化反应 : 呋喃、吡咯不能用浓硫酸磺化,要用吡啶三氧 呋喃、吡咯不能用浓硫酸磺化, 12 化硫的络合物,噻吩可直接用浓硫酸磺化。 化硫的络合物,噻吩可直接用浓硫酸磺化。
OH N H K a = 1.3 × 10 -10 1 × 10 -15 CH 3CH 2OH 1 × 10 -18
+ KOH N H
N- K+
16
N- K+
CH3I
N CH3
N CH3 H
N- K+ + CH3COCl
N COCH3
N COCH3 H
N-乙酰基吡咯
+ R MgX N H + RH N MgX RX
2-乙酰基吡咯
吡咯卤化镁
N R
N R H
17
三、重要的五元杂环衍生物
(一)糠醛(α- 呋喃甲醛):无色透明的液体,易氧化. 糠醛( 呋喃甲醛) 无色透明的液体,易氧化. 1.制备 由农副产品如甘蔗杂渣、花生壳、高粱杆、棉子壳…… 由农副产品如甘蔗杂渣、花生壳、高粱杆、棉子壳 用稀酸加热蒸煮制取。 用稀酸加热蒸煮制取。
第十六章杂环化合物
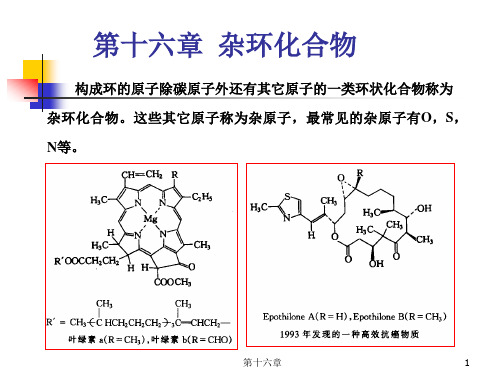
第十六章
20
呋喃在镍催化下,加氢可得四氢呋喃。四氢呋喃沸点65.5℃,
是良好的溶剂,也是有机合成的原料。从四氢呋喃可得到己二酸和
己二胺,它们是制造尼龙—66的原料。
第十六章
21
尽管呋喃在温和条件下容易发生亲电取代反应,但由于它的芳
香性较弱,呋喃及其衍生物可以容易地进行Diels—Alder反应和一般
合物。最常见的和最稳定的杂环化合物可分为五元杂环和六元杂环 两大类,在每一类中又根据杂原子种类、数目、单环或稠环等再分 类。
第十六章
4
第十六章
5
第十六章
6
杂环化合物的命名采用英文名称的音译,一般在同音汉字的左
边加一“口”旁。对于含一个杂原子的杂环也可把靠近杂原子的位
置叫做α位,其次为β位和γ位。
沸点162℃。糠醛在醋酸存在下遇苯胺呈亮红色,可用来定性检验 糠醛。糠醛可由农副产品如燕麦壳、玉米芯、棉子壳等原料来制取。 这些原料中含有戊醛糖的高聚物 (戊聚糖)。戊聚糖用盐酸处理后, 先解聚变为戊醛糖,然后再失水而成糠醛。
第十六章
19
糠醛是一个很好的溶剂,也是有机合成的原料。糠醛的化学性
质同苯甲醛类似,例如糠醛与约50%氢氧化钠水溶液作用可生成糠
第十六章
7
16.1.2 结构和芳香性
呋喃、噻吩和吡咯是含一个杂原子的五元杂环化合物,组成环
的五个原子位于同一平面上,彼此以 σ键相连接,每个碳原子还有
一个电子在p轨道上,杂原子的未共用电子对也在p轨道上,这五个 p轨道都垂直于环所在的平面。
第十六章
8
呋喃、吡咯和噻吩的离域能分别为67 kJ· mol-1、88 kJ· mol-1和
杂环化合物

+ H2SO4 S
2)H2 )
25℃
S
SO3H
S
4. 用途:合成药物 用途:
H2 MoS2
S
(四)吡咯
N H
含氮化合物的碱性取决于氮原子上未共用 电子对与H 结合能力。 电子对与 +结合能力。 1.物理性质:无色油状液体, 131℃,难溶于 1.物理性质:无色油状液体,b.p 131℃,难溶于 物理性质 易溶于醚或醇中。 水,易溶于醚或醇中。 鉴别:盐酸松片反应呈红色。 鉴别:盐酸松片反应呈红色。
N H
O
S
2. 吡啶
sp2杂化 共平面 大π键 π电子数为6,符合休克尔规则(4n+2)。 电子数为 ,符合休克尔规则( )。 具有芳香性(比苯小) 具有芳香性(比苯小) 电负性: 电负性:N>C,环上碳原子的电子云密度降 , 亲电取代比苯困难,且主要为β 位 比苯困难 低,亲电取代比苯困难,且主要为β-位。 比较容易发生亲核取代,且主要在α 位 比较容易发生亲核取代,且主要在α-位。 容易发生亲核取代 碱性。 N上有未共用电子对,容易接受质子,具有碱性。 上有未共用电子对,容易接受质子,具有碱性
CHO
α-呋喃甲醛 呋喃甲醛
HO CH CH OH H CH C H CHO OH OH
戊糖
稀HCl
O
CHO + 3H2O
2. 物理性质 无色液体,b.p 161.7℃,在光、热空气 无色液体, ℃ 在光、 中,很快产生树脂状聚合物 黄→褐→黑 鉴别方法: 鉴别方法: 遇苯铵醋酸盐溶液呈深红色, 遇苯铵醋酸盐溶液呈深红色,也能鉴别戊糖
7
N N N N H
2 4 8 3 9
5
O
苯并吡喃(氧杂萘) 苯并吡喃(氧杂萘)
有机化学 第二十章杂环化合物
2.加成反应 呋喃、吡咯催化氢化,失去芳香性,得到饱和 的杂环化合物:
四氢吡咯为有机碱,广泛存在于自然界中的某 些生物碱中。
四氢呋喃是重要的有机溶剂。
噻吩中含硫,会使一般的催化剂中毒,氢化时必 须采用特殊催化剂。
工业上通常用开链化合物合成四氢噻吩。四氢噻 吩氧化成四亚甲基砜(或环丁砜),它是一个重要的 溶剂。
(6 )取代呋喃、噻吩、吡咯的定位效应
一取代呋喃、噻吩及吡咯进一步取代,定位效 应应由环上杂原子的α定位效应及取代基共同决定。 例如,3位上有取代基,第二个基团进入环的1位或5 位(即α位),是1位还是5位又由环上原有取代基 的性质决定◦例如,噻吩-3-甲酸溴代,生成5-溴噻 吩-3-甲酸。羧基是间位定位基,因此第二个基团进 入5位即羧基的间位。
一、五元杂环
五元环中含两个或两个(至少有一个氮原子) 以上的杂原子的体系称唑(azole)。如果杂原子不 同,则按氧、硫、氮的顺序编号。
二、六元杂环 三、稠杂环
20.2 五元单杂环化合物
一、呋喃、噻吩、吡咯的物理性质和结构
呋喃、噻吩、吡咯是最重要的含一个杂原子的 五元杂环化合物。它们的重要性不在于它们的单体, 而是它们的衍生物。它们的衍生物不但种类繁多, 而且有些是重要的工业原料,有些具有重要的生理 作用。
叶绿素与蛋白质结合,存在于植物的叶和绿色 的茎中,叶绿素利用卟啉环的多共辗体系易吸收紫 外光,成为激发态,促进光合作用,使光能转变为 化学能。
血红素存在于哺乳动物的红血球中,它与蛋白 质结合成血红蛋白,血红素中的Fe2+具有空的d轨道, 可以可逆地络合氧,在动物体内起到输送氧气的作 用。一氧化碳会使人中毒,其原因之一是因为它与 血红蛋白结合的能力强于氧,从而阻止了血红蛋白 与氧的结合。
杂环化合物的命名

环的编号规则
环的编号规则是 按照环的大小和 位置进行编号的。
环的编号规则是 按照环的大小和 位置进行编号的。
环的编号规则是 按照环的大小和 位置进行编号的。
环的编号规则是 按照环的大小和 位置进行编号的。
取代基的命名规则
取代基的命名应 遵循IUPC命名规
则
取代基的命名应 从取代基的母体
开始
取代基的命名应 遵循取代基的优
THNKS
汇报人:
杂环化合物的命名
,
汇报人:
目录
01 杂 环 化 合 物 的 定 义 和分类
03 常 见 杂 环 化 合 物 的
命名示例
05 杂 环 化 合 物 的 命 名
练习
02 杂 环 化 合 物 的 命 名 规则
04 命 名 杂 环 化 合 物 时 的注意事项
Prt One
杂环化合物的定义 和分类
杂环化合物的定义
喹啉衍生物:含有 一个或多个取代基 的喹啉化合物
异喹啉衍生物:含 有一个或多个取代 基的异喹啉化合物
嘌呤类化合物
嘌呤类化合物包括:腺嘌呤、鸟嘌呤、黄嘌呤、次黄嘌呤等
命名规则:根据杂环化合物的结构和性质进行命名
示例:腺嘌呤(denine)、鸟嘌呤(Gunine)、黄嘌呤(Xnthine)、次黄嘌呤 (Hypoxnthine)
嘧啶类化合物
嘧啶类化合物:含有两个氮原子的六元杂环化合物 命名规则:根据氮原子的位置和取代基的不同进行命名 示例:2-甲基嘧啶、3-乙基嘧啶、4-氯嘧啶等 注意事项:命名时需注意氮原子的位置和取代基的顺序
喹啉类化合物
喹啉:含有一个氮 原子的六元杂环化 合物
异喹啉:含有两个 氮原子的六元杂环 化合物
十二 杂环化合物
(二) 喹啉
N
重要的衍生物
OH CH3O N CH3 CH(CH2)3N(C2H5)2 N N HO O O O
扑疟喹啉
10-羟基喜树碱
1 喹啉的碱性
.
. . . . . . . . . .N
.
.
PKb
N 9.1
N 8.8
喹啉的碱性与吡啶相当
2 亲电取代
6
5 8
4
N
活化环 7
3 2
1
钝化环
有利于亲核取代生, 且主要发生在2位
CH2CHCOOH N H 色氨酸 OH HO O NH2 N H 色胺 O O CH OH OH S O 硫靛蓝 S CH2CH2NH2
(一) 吲哚
[试分析] 亲电取代发生在苯环还是杂环上?
3
..
并指出具体位置。
亲电取代主要发生在杂环3位
N H
N N C6H5 N H + C6H5N
+
N ClN H
综上所述:亲电取代主要发生在吡啶环的β位,、位 不发生反应。
Br2
300℃ HNO3, H 2SO4 300℃ H2SO4, HgSO4 220℃
Br N NO2 N S O3H N
N
吡啶环也象硝基苯一样,不能发生傅克烷基化和酰基化反应
3、 亲核取代反应
吡啶环容易发生亲核取代反应。 、位,以位为主。
C6H5Li
+ LiH N C6H5
N
CH3ONa
N
Cl
Cl CH3OH
N
OCH3
NH2
+ NH3 N N
+ HCl
4、 氧化
CH3
杂环化合物定义
杂环化合物定义杂环化合物是一类含有至少一个杂原子(指不是碳原子的原子)的碳氢化合物。
它们的分子结构通常包括一个或多个环,并含有不同的杂原子,如氮、氧、硫等,这赋予了它们独特的化学性质和功能。
一、杂原子1.1 氮杂环化合物其中最常见的是咪唑和嘧啶。
在咪唑中,氮原子是在环上的。
它使它在一些细胞信号转导、 RNA 与 DNA 的生物合成中扮演重要角色。
而嘧啶含有两个氮原子,一个位于环中,另一个则连接着杂环。
1.2 氧杂环化合物这类化合物通常包括呋喃、吡咯烷酮、吡喃等。
多用于制药、农药、染料等领域。
1.3 硫杂环化合物例如噻吩和二恶硫。
其中噻吩可以作为一些染料、润滑油和药物的原料,因为它具有防腐和抗氧化的作用。
二、杂环的特点2.1 可通过不同的杂原子以及相对排列方式制造出种类繁多的化合物。
2.2 杂环化合物具有多种多样的化学和生物活性,因此成为了广泛应用的重要原料。
2.3 杂环亦能改变化合物的分子形状和分子间的各种不同相互作用,从而加强添加物的分子间相互作用力,其作用值得深入挖掘。
三、杂环的应用3.1 杂环化合物广泛应用于医药领域,如抗生素、抗肿瘤药物、心血管药物等的制造。
3.2 在新型材料的研究中,杂环化合物作为一种功能性的化合物,拥有广泛的应用前景。
3.3 杂环化合物也被用于新型铀和镎的萃取分离和控制核材料的制备。
结语杂环化合物是一类特别的有机化合物,以其多样的结构和广阔的应用领域而被广泛使用。
期望在未来,随着人们对其的进一步研究,可以开发出更为优异的化合物及其应用。
杂环化合物整理
2,5-二氢噻吩
硫
2,3-二氢噻吩
砷
砷杂茂(Arsole)
磷
磷杂茂(Phosphole)
硫
环丁砜
环己烷
氮
六氢吡啶、氮杂环己烷、哌啶
氧
四氢吡喃、氧杂环己烷
硫
四氢噻喃、硫杂环己烷
氮
吡啶、氮杂苯
氮
二氢吡啶
四氢吡啶
氮
1,2,3,4-四氢吡啶
氮
1,2,3,6-四氢吡啶
氮
2,3,4,5-四氢吡啶
环数
杂原子
名称 环丙烷
氮
氮丙环、氮丙啶、吖丙啶、环氮乙烷
氧
氧丙环、恶丙环、氧化乙烯、环氧乙烷
三元环
硫
硫丙环、噻丙环、硫化乙烯、环硫乙烷
氮
1-氮丙烯、1-氮丙因、1-吖丙因
氮
2-吖丙因(2-氮丙烯)
氧
氧丙烯、恶丙烯
硫
硫丙烯、噻丙烯
环丁烷
氮
吖丁啶
氮
吖丁氮1-吖丁(1- Nhomakorabea环丁烯)
四元环
氮
四元环
氧
氧
氧 硫 硫
吡喃
氧
α-吡喃(1,2-吡喃)
氧 六元环
γ-吡喃(1,4-吡喃)
氧
3,4-二氢-2H-吡喃(2,3-二氢吡喃)
噻喃
硫
α-噻喃(1,2-噻喃)
硫
γ-噻喃(1,4-噻喃)
硼
硼杂苯(Borabenzene)
硅
硅杂苯(Silabenzene)
锗
锗杂苯(Germanabenzene)
锡
锡杂苯(Stannabenzene)
含五元环的 稠环
杂环化合物总结
NO2
N
SO3H Br
Br2 H2SO4
+
N
N
Br
KNH2 NH3a, EtOH
N
H
S
S
Na, EtOH
+
S
S
Zn, HAc
N
H2, Ni
H
4. 吡咯的酸碱性
+
N
N
H2, Ni 200oC
N
H
H
H
RMgX
CH3I
N
RH
N
MgXI
N
H
MgX
CH3
KOH,
(1)CO2
(2)H2O
N COOH
N
CO2
K
H O
N H
C OK H3O
N COOH H
C6H5COCl
N O C C6H5
5. 鉴别 呋喃蒸汽遇到被盐酸浸湿过的松木片时,即呈现绿色
噻吩在浓硫酸的存在下,与靛红一同加热显示蓝色
吡咯的蒸汽或其醇溶液,能使进过浓盐酸的松木片变成红色
1. 碱性 (CH3)3N>吡啶>苯胺>吡咯
CH3
+ CH3I
N
280 290oC
+
NI CH3
N CH3 HI
N HI
2. 对氧化作用稳定,氧化侧链
CH2CH3 O
COOH
六
N
N
元 杂
3. 亲电取代,在位,不发生酰基化,烷基化反应
环
Br
化
Br2
合 物
N
N SO3H
H2SO4
N
N
NO2
H2SO4 HNO3 N
