等效平衡练习题
等效平衡练习题

等效平衡练习题1.一定温度下,把2.0体积的N2和6.0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2⇌2NH3.已知平衡时NH3的浓度是c mol•L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol•L-1的是()A. 1.0体积的N2和3.0体积的H2B. 2.0体积的N2、6.0体积的H2和4.0体积的NH3C. 4.0体积的NH3和1.0体积的H2D. 2.0体积的NH32.某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g)⇌2HI(g).反应体系中各物质浓度的有关数据如表.下列判断正确的是()A. HI的平衡浓度:a=b>0.004B. 平衡时,H2的转化率:丁>甲C. 平衡时,乙中H2的转化帛等于20% D. 丙中条件下,该反应的平衡常数K=43.在1L的密闭容器中通入2molNH3,在一定温度下发生下列反应:2NH3⇌N2+3H2,达到平衡时,容器内N2的百分含量为a%.若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内N2的百分含量也为a%的是()A. 3molH2+2molN2B. 2molNH3+1molN2C. 3molN2+1molH2D. 0.1molNH3+0.95molN2+2.85molH24.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2⇌2SO3,并达到平衡.在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率()A. 等于p%B. 大于p%C. 小于p%D. 无法判断5.某温度下在容积不变的密闭容器中发生如下反应:2SO2+O2⇌2SO3(g),若开始时只充入2molSO3(g),达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入了2mol SO2和1molO2的混合气体,达到平衡时SO2的转化率为()A. 20%B. 40%C. 60%D. 80%6.在固定容积的容器中盛有1molPCl5,200℃时发生如下反应:PCl5(g)⇌PCl3+Cl2(g)达到平衡时,PCl5体积分数为M%.若恒温下向容器中再通入1molPCl5,再次达平衡时,PCl5所占体积分数为N%,则M和N的关系是()A. M>NB. M<NC. M=ND. 无法判断7.恒温下,在容积为1升的甲、乙两个恒容密闭容器中分别充入H2和I2发生可逆H2(g)+I2(g)⇌2HI(g)△H=-14.9kJ/mol,实验时有关数据如表:容器编号起始浓度mol/L平衡时的浓度mol/L平衡时放出的热量/KJI2H2HI甲0.01 0.01 0.004 Q1乙0.02 0.02 a Q2下列判断正确的()A. 平衡时,乙中颜色更深,a>0.008B. 平衡时,放出的热量:Q1=Q2=0.149kJC. 该温度下,该反应的平衡常数K=4D. 平衡后,向甲中再充入0.004mol HI气体,再次达到平衡时HI的百分含量不变8.在容积相同的A、B两个密闭容器中,分别充入amolN2和bmolH2,使它们在同温度下反应,并达到平衡,若A容器保持体积不变,B容器保持压强不变,当A中NH3的体积分数为25%时,则B中NH3的体积分数为()A. 12.5%B. 25%C. <25%D. >25%9.在t℃时,向2L密闭容器中放入1molA和1molB,发生下列反应:A(g)+B(g)⇌C(g)+2D(g),平衡时C的含量为m%,保持其他条件不变,若按下列配比将物质放入容器中达到平衡时,C的含量仍为m%的是()A. 2molA和1molBB. 2molD和A、B、C各1molC. 1molC和2molDD. 1molC和1molD10. 在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) ⇌ xC(气),达到平衡后,C的体积分数为W%。
高中化学等效平衡专题练习

高中化学等效平衡专题练习1.在恒定压力下,一个可变容积的密闭中发生如下反应:2NH3(g) + CO2(g) → CO(NH2)2(g) + H2O(g)。
开始时放入2mol NH3和1mol CO2,达到平衡后生成a mol H2O。
若开始时放入x mol NH3、2mol CO2和1mol H2O(g),达到平衡后H2O的物质的量是3a mol,则x为多少?答案:3mol。
2.在一个密闭中,加入3mol A和1mol B,在一定条件下发生反应3A(g) + B(g) → 2C(g) + D(g),达到平衡时,测得C的浓度为XXX。
若保持中压强和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是哪个?答案:3mol A+1mol B+2mol C+1mol D。
3.在一定条件下,向一个带活塞的密闭中充入2mol SO2和1mol O2,发生下列反应:2SO2(g) + O2(g) → 2SO3(g)。
达到平衡后改变下述条件,SO3气体平衡浓度不改变的是哪个?答案:保持温度和内压强不变,充入1mol SO2(g)。
4.在一个固定容积的密闭中,加入mmol A和nmol B,发生下列反应:mA + nB → pC。
平衡时C的浓度是XXX。
若体积和温度不变,起始时放入amol A、bmol B、cmol C,若要平衡后C的浓度仍为w mol/L,则a、b、c应满足的关系是什么?答案:a:b:c=m:n:p,且(ap/m)+c=p。
5.在一个VL密闭中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2 + O2 → 2SO3.平衡时SO3为a mol。
在相同温度下按下列配比在VL密闭中放入起始物质,平衡时关于SO3的正确叙述是什么?(未提供答案)1.A放入0.2mol SO2、0.1mol O2、0.1mol SO3,达到平衡时SO3必小于a mol。
等效平衡专项练习汇总

化学平衡1.可逆反应①X(g)+2Y(g)2Z(g) ②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密闭隔板。
反应开始和达到平衡状态时有关物理量的变化如图所示(隔板两侧反应室温度相同)。
下列判断正确的是( ) 1 2 3 4 51molX 2molY 2molM 反应开始X Y Z M N P 平衡(II )2.6X Y Z 平衡(I )2.8恒温降温M N P 隔板隔板隔板1 2 3 4 51 2 3 4 5 A .反应①的正反应是吸热反应B .达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15C .达平衡(I)时X 的转化率为5/11D .在平衡(I)和平衡(II)中M 的体积分数相同2.相同温度下,容积均恒为 2 L 的甲、乙、丙3个密闭容器中发生反应:2SO 2(g)+O 2(g)2SO 3(g) △H=-197kJ·mol -l 。
实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )A .Q 1>Q 3>Q 2 =78.8 kJB .三个容器中反应的平衡常数均为K=2C .甲中反应达到平衡时,若升高温度,则SO 2的转化率将大于50%D .若乙容器中的反应经t min 达到平衡,则0~tmin 内,v(O 2)=15tmol/(L·min)3.一定温度下,有可逆反应:2A(g)+2B(g)C(g)+3D(g) ΔH<0。
现将2molA和2molB 充入体积为V的甲容器,将2molC和6molD充入乙容器并使乙容器在反应开始前的体积为2V(如图1)。
关于两容器中反应的说法正确的是()A.甲容器中的反应先达到化学平衡状态B.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示C.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成相同,混合气体的平均相对分子质量也相同D.在甲容器中再充入2molA和2molB,平衡后甲中物质C的浓度与乙中物质C的浓度相等4.一定温度下可逆反应:A(s)+2B(g)2C(g)+D(g) △H<0。
等效平衡专项练习(有答案)

等效平衡1、在一个1L得密闭容器中,加入2molA与1molB,发生下述反应: 2A(g) + B(g) 3C(g) + D(s),达到平衡时,C得浓度为1、2mol/L,维持容器得体积与温度不变,按下列配比作为起始物质,达到平衡后,C得浓度还就是1、2mol/L得就是A.1mol A+0、5mol B+1、5mol C+0、1mol DB.3mol C+ 0、7mol DC.2mol A+1mol B+1molDD.0、5mol A+0、25mol B+2、25mol C2、在一恒定得容器中充入2 mol A与1 mol B发生反应:2A(g)+B(g) x C(g),达到平衡后,C 得体积分数为W%;若维持容器得容积与温度不变,按起始物质得量A:0、6 mol、B:0、3 mol、C:1、4 mol充入容器,达到平衡后,C得体积分数仍为W%,则x值为A、只能为2B、只能为3C、可能就是2,也可能就是3D、无法确定3、在一容积可变得密闭容器中,通入1mol X与3 mol Y,在一定条件下发生如下反应X (g) + 3 Y (g) 2 Z (g),到达平衡后,Y得转化率为a %,然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新得平衡时,Y得转化率为b %。
则a与b得关系就是A、a=bB、a>bC、a<bD、不能确定4、某温度下,在一容积固定得容器中,反应aA(g)+bB(g) hH(g)达到平衡后,A、B、H得物质得量分别为amol、bmol与hmol。
已知a+b=2h,,若保持温度不变,将三者得物质得量增大一倍,则下列判断正确得就是A. 平衡不移动B. 混合气体得密度不变C. B得体积分数减少D. amol/L<c(A)<2amol/L5、某温度下,在一容积可变得容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B与C得物质得量分别为4mol、2mol与4mol。
保持温度与压强不变,对平行混合物中三者得物质得量做如下调整,可使平衡右移得就是A 均减半B 均加倍C 均增加1molD 均减少1mol6、两个体积相同得密闭容器A、B,在A中充入SO2与O2各1mol,在B中充入SO2与O2各2 mol,加热到相同温度,有如下反应2SO2(g)+ O2(g) 2SO3(g),对此反应,下述不正确得就是A.反应速率B>AB.SO2得转化率B>AC.平衡时各组分含量B = AD.平衡时容器得压强B>A7、一个真空密闭容器中盛有1molPCl5,加热到200℃时发生如下反应:PCl5(气)PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%、若在同一温度与同一容器中,最初投入就是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%、则M 与N得关系A、大于B、小于C、等于D、不能肯定8、在密容器中,aA(g) bB(g)达平衡后,保持温度不变,将容器体积扩大1倍,当达到新平衡时,B得浓度就是原来得60%,下列说法正确得就是A、平衡向正反应方向移动了 B.物质A得转化率减少了C、物质B得质量分数增加了 D.a>b9、在一定体积与一定条件下有反应N2+3H2 2NH3,现分别从两条途径建立平衡:I.起始浓度N2 l mol·L-1, H2 3 mol·L-1II、起始浓度N2 2 mol·L-1, H2 6 mol·L-1下列叙述正确得就是A、 I与II两途径达到平衡时,体系内各成分得体积分数相同B.达到平衡时,I途径得反应速率v(H2)等于II途径得反应速率v(H2)C.达到平衡时,I途径体系内混合气体得密度为途径II体系内混合气体得密度得1/2D.达到平衡时,II途径体系内混合气体得压强就是I途径内混合气体压强得2倍10、在密闭容器中,对于反应:2SO2(g)+O2(g) 2SO3(g),SO2与O2起始时分别为20 mol与10 mol;达平衡时,SO2得转化率为80%。
《等效平衡》练习题

《等效平衡》练习题1.在密闭容器中进行下列反应:M(g)+N(g)确的是()A.正反应吸热,L是气体 B.正反应吸热,L是固体C.正反应放热,L是气体 D.正反应放热,L是固体或液体2.某可逆反应L(s)+G(g) 3R(g); △H>0,下图表示外界条件温度、压强的变化对上述反应的影R(g)+2L(?)此反应符合下面图象,下列叙述正响。
试判断图中y轴可以表示()A.平衡混合气中R的质量分数 B.达到平衡时G的转化率C.平衡混合气中G的质量分数 D.达到平衡时L的转化率3.(2011重庆理综)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )A.CO2(g)+2NH3(g)B.CO2(g)+H2(g)C.CH3CH2OH(g) CO(NH2)2(s)+H2O(g); ΔH<0 CO(g)+H2O(g);ΔH>0 CH2==CH2(g)+H2O(g);ΔH>02C6H5CH===CH2(g)+2H2O(g);ΔH<02NO2(g) ΔH=+57 kJ/mol,在温度为T1、 T2D.2C6H5CH2CH3(g)+O2(g) 4.(2012江苏双选)在密闭容器中发生反应N2O4(g)时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
下列说法正确的是()A.A、C两点的反应速率:A>CB.A、C两点气体的颜色:A点浅,C点深C.由状态B到状态A,可以用升温的方法D.A、C两点气体的平均相对分子质量:A>C5.在密闭的容器中,对于反应2SO2(g)+ Q2(g)2SO3(g),SO2和O2起开始时分别为20mol 和10mol;达平衡时SO2的转化率为80%。
若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为()A.10mol和10%2SO2(g)+O2(g) B.20mol和20% C.20mol和40% D.20mol和80% 6.一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应: 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是()...A.保持温度和容器体积不变,充入1mol SO2(g) B.保持温度和容器内压强不变,充入1mol SO3(g)C.保持温度和容器内压强不变,充入1mol O2(g) D.保持温度和容器内压强不变,充入1mol Ar(g)7.某温度下,在一容积可变的容器中,反应2A(g)+B(g) 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2 mol和4 mol。
等效平衡经典习题
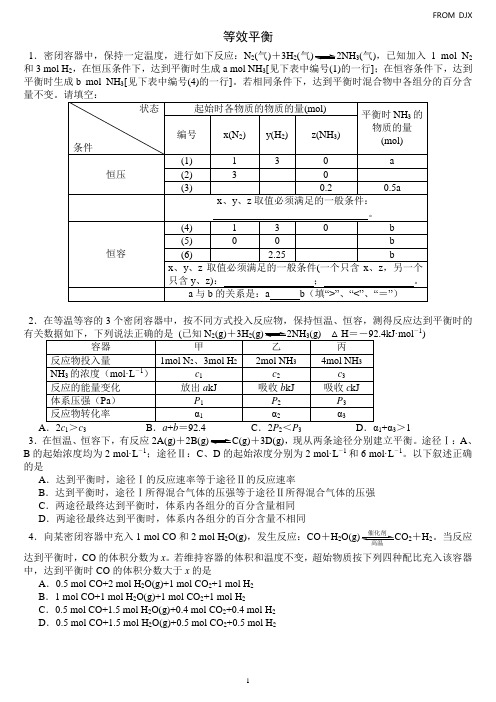
等效平衡1.密闭容器中,保持一定温度,进行如下反应:N 2(气)+3H 2(气3(气),已知加入1 mol N 2和3 mol H 2,在恒压条件下,达到平衡时生成a mol NH 3[见下表中编号(1)的一行];在恒容条件下,达到平衡时生成b mol NH 3[见下表中编号(4)的一行]。
若相同条件下,达到平衡时混合物中各组分的百分含2.在等温等容的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的mol -1)13231+α3>13.在恒温、恒容下,有反应2A(g)++3D(g),现从两条途径分别建立平衡。
途径Ⅰ:A 、B 的起始浓度均为2 mol·L -1;途径Ⅱ:C 、D 的起始浓度分别为2 mol·L -1和6 mol·L -1。
以下叙述正确的是A .达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ的反应速率B .达到平衡时,途径Ⅰ所得混合气体的压强等于途径Ⅱ所得混合气体的压强C .两途径最终达到平衡时,体系内各组分的百分含量相同D .两途径最终达到平衡时,体系内各组分的百分含量不相同4.向某密闭容器中充入1 mol CO 和2 mol H 2O(g),发生反应:CO +H 2催化剂2+H 2。
当反应达到平衡时,CO 的体积分数为x 。
若维持容器的体积和温度不变,超始物质按下列四种配比充入该容器中,达到平衡时CO 的体积分数大于x 的是A .0.5 mol CO+2 mol H 2O(g)+1 mol CO 2+1 mol H 2B .1 mol CO+1 mol H 2O(g)+1 mol CO 2+1 mol H 2C .0.5 mol CO+1.5 mol H 2O(g)+0.4 mol CO 2+0.4 mol H 2D .0.5 mol CO+1.5 mol H 2O(g)+0.5 mol CO 2+0.5 mol H 25.一定条件下,向一带活塞的密闭容器中充入 2 mol SO2和 1 mol O2,发生反应2SO2(g)+O23(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是A.保持温度和容器体积不变,充入1 mol SO3 B.保持温度和容器压强不变,充入1 mol SO3 C.保持温度和容器压强不变,充入1 mol O2 D.保持温度和容器压强不变,充入1 mol Ar 6.一个真空密闭容器中盛有1mol PCl5,加热到200℃时发生如下反应:PCl5(气3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%。
化学平衡之等效平衡练习题含解析答案
化学平衡练习题例1将3 mol A和1 mol B混合于一体积可变的密闭容器P中;以此时的温度、压强和体积作为起始条件;发生了如下反应:达到平衡时C的浓度为w mol·L-1..回答⑴~⑸小题:1保持温度和压强不变;按下列四种配比充入容器P中;平衡后C的浓度仍为w mol·L-1的是A6 mol A+2 mol B B3 mol A+1 mol B十2 mol C;C2 mol C+1 mol B+1 mol D D1 mol C+2mol D2保持原起始温度和体积不变;要使平衡后C的浓度仍为w mol·L-1;应按下列哪种配比向容器Q中充入有关物质A3 mol A+1 mol B B4 mol C十2 mol D C1.5 mol A+0.5mol B+1 mol C +0.5 mol D D以上均不能满足条件;3保持原起始温度和体积不变;若仍按3 mol A和1 mol B配比在容器Q 中发生反应;则平衡时C的浓度和w rml·L-1的关系是A>w B< w C= w D不能确定4将2 mol C和2 mol D按起始温度和压强充入容器Q中;保持温度和体积不变;平衡时C 的浓度为V mol ·L -1;V 与w 和叫的关系是 A V >w B V <w C V=w D 无法比较5维持原起始温度和体积不变;按下列哪种配比充入容器Q 可使平衡时C 的浓度为V mol ·L -1A1 mol C+0.5 m01 D . B3 mol A+2 mol B C3 mol A+1 mol B+1 mol D D 以上均不能满足条件 解析⑴A ⑵ D .⑶ B .⑷ B .⑸ C .例2某温度下向1L 密闭容器中充入1mol N2和3 mol H 2;使反应N 2+3H 3达到平衡;平衡混合气中N 2、H 2、NH 3的浓度分别为M 、N 、Gmol /L .如果温度不变;只改变初始物质的加入量;要求M 、N 、G 保持不变;则N 2、H 2、NH 3的加入量用x 、y 、z 表示时应满足的条件是: ①若x=0;y=0;则z= ;②若x=0.75 mol;则y= ;z= ;③x 、y 、z 取值必须满足的一般条件是用含x 、y 、z 方程表示;其中一个含x 、z;另一个含y 、z .. 若将上述条件改为恒温、恒压;其它均不变;则 a .若x=0;y=0;则z= ;b .若x=0.75 mol;则y= ;z= ;c .x 、y 、z 取值必须满足的一般条件是 ..答案 ①z=2 mol . ②y=2.25 mol;z=0.5 mol.. ③ 12=+zx 323=+z y a . z 为任意值. b . y=2.25mol;z 为任意值.. c .x ︰y=1︰3;即y=3x 时z 为任意值.例34如右图所示;将4 mol SO 2和2 mol O 2置于体积可变的等压容器中;在一定温度下发生反应2SO 2g+O 23g;△H <0.该反应达到平衡状态A 时;测知气体的物质的量为4.2 mol;SO 2、O 2、SO 3的起始物质的量分别以现a 、b 、c 表示.1向达到平衡状态A 的容器中通入少量O 2;体系中SO 2的体积分数 填“增大”或“减小”或“不变".要使SO 2的体积分数再变到与平衡状态A 相同;可采取的措施是或 ..2若起始时a=1.2 mol;B=0.6 mol;且达到平衡后各气体的体积分数与平衡状态A 相同;则起始时c 的取值为 ..3要使反应开始时向逆反应方向进行;且达到平衡后各气体的物质的量与平衡状态A 相同;则起始时c 的取值范围为 .. 答案 1通入适量的SO 2 给体系升温 2任意值33.6<C ≤4〖巩固与应用〗基础题1、在一个固定体积的密闭容器中;加入2molA 和1molB;发生反应:达到平衡时C 的浓度为Wmol/L;若维持容器体积和温度不变;按下列四种配比作为起始物质;达到平衡后;C 的浓度仍为Wmol/L 的是 A 、4molA+2molB B 、3molC+1molD+1molB C 、3molC+1molD D 、1molA+0.5molB+1.5molC+0.5molD2、在450℃、5.05×107Pa 时;如果把1体积N 2和3体积H 2的混合物通入一个装有催化剂的密闭容器中反应达到平衡时;得到含NH 352%体积分数的混合气体..在同温同压下向密闭容器中通入2体积N 2和6体积H 2;达到平衡时NH 3的体积分数为A 、大于52%B 、等于52%C 、小于52%D 、不能确定 3、在固定体积的密闭容器中;一定温度下;加入2molBr 2;1molH 2;发生反应:Br2g + H 2到达平衡时;HBr 质量分数为W%;在相同条件下;按下列情况充入物质到达平衡时;HBr 的质量分数仍为W%的是A、2molHBrB、3molHBrC、4molBr2+2molH2D1molBr2+2molHBr4、在一定温度下的容积固定的密闭容器里充入1molC和1mol水蒸气;发生反应:Cs+H22g..当反应达到平衡时;测得水蒸气的浓度为Wmol/L;如果起始按下列配比填料;平衡时水蒸气的浓度不为Wmol/L的是A、2molC+1molCO+1molH2 B、1molCO+1molH2C、 2.5molC+2molH2Og D、0.5molH2Og+0.5molH2+0.5molCO+0.5molC5、可逆反应Ag+Bg2Cg在固定容积的容器中进行;如果向容器中充入1molA和1mol B;在某温度下达到平衡时;C的体积分数为m%;若向容器中充入1molC;在同样的温度下达到平衡时;C的体积分数为n%;则m和n的关系正确的是A.m>n B.m<n C.m=n D.无法比较6、在一密闭的容器中充入2mol A和1mol B发生反应:2Ag+Bg xCg;达到平衡后;C的体积分数为w%;若维持容器的容积和温度不变;按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器;达到平衡后;C的体积分数仍为w%;则x的值为A.只能为2 B.只能为3 C.可能为2;也可能为3 D.无法确定7、体积相同的甲、乙两个容器中;分别充有等物质的量的SO2和O2;在相同温度下发生反应:2SO2+O22SO3并达到平衡..在这过程中;甲容器保持体积不变;乙容器保持压强不变;若甲容器中SO2的转化率为p%;则乙容器中SO2的转化率为A.等于p% B.大于p% C.小于p% D.无法判断8、在相同温度下;有相同体积的甲、乙两容器;甲容器中充入1g N2和1g H2;乙容器中充入2g N2和2g H2..下列叙述中;错误的是A.化学反应速率:乙>甲B.平衡后N2的浓度:乙>甲C.H2的转化率:乙>甲D.平衡混合气中H2的体积分数:乙>甲9、某恒温恒压下;向可变容积的密闭容器中充入3 L A和2 L B;发生如下反应:3Ag+2Bg xCg+yDg达到平衡时;C的体积分数为m%;若维持温度、压强不变;将0.6 L A、0.4 L B;4 L C、0.8 L D作为起始物质充入密闭容器中;达到平衡时C的体积分数仍为w%;则x;y的值分别为A.x=3;y=1B.x=4;y=1C.x=5;y=1D.x=2;y=310、在一定温度下;把2molSO2和1molO2通过一个一定容积的密闭容器里;发生如下反应:2SO2g + O2g 2SO3g..当此反应进行到一定程度时;反应混合物就处于化学平衡状态..现在该容器中维持温度不变;令a、b、c分别代表初始时SO2、O2和SO3的物质的量mol;若a、b、c取不同的数值;它们必须满足一定的关系才能保证达到平衡;反应混合物中三种气体的百分含量仍跟上述平衡时完全相同;填写下列空白:1若a=0;b=0;则c= ..2若a=0.5;则b= ;c= ..3若a、b、c取值必须满足的一般条件是请用两个方程式表示;其中一个只含a和c;另一个只含b和c ;能力题11、甲、乙两容器;甲的容积固定;乙的容积可变..在一定温度下;3mol N2和4mol H2;反应达到平衡时;生成NH3的物质的量为amol..1相同温度下;向乙中通入2molNH3;且保持容积与甲相同;当反应达到平衡时;各物质的浓度与甲平衡中相同..起始时乙中还通入了____mol N2和____molH2..2相同温度下;若向乙中通入6mol N2和8mol H2;且保持压强与甲相等;当反应达到平衡时;生成氨的物质的量为b mol;则a∶b______1∶2;若乙与甲的容积始终相等;达到平衡时;生成氨的物质的量为 c mol;则a∶c_____1∶2填“>”、“<”或“=”..12、在一个盛有催化剂容积可变的密闭容器中;保持一定温度和压强;进行以下反应:N2+3H22NH3..已知加入1mol N2和4mol H2时;达到平衡后生成a molNH3见下表已知项..在相同温度、压强下;保持平衡时各组分的体积分数不变..对下列编号①~③的状态;填写表中空白..已知编号起始状态物质的量 n/mol平衡时NH3的物质的量n/molN2H2NH3140a① 1.560②10.5a③m gg≥4m13 I.恒温、恒压下;在一个可变容积的容器中发生如下发应:A气+B气C气1若开始时放入1molA和1molB;到达平衡后;生成a molC;这时A的物质的量为 mol..2若开始时放入3molA和3molB;到达平衡后;生成C的物质的量为mol..3若开始时放入x molA;2molB和1molC;到达平衡后;A和C的物质的量分别是ymol和3a mol;则x= mol;y= mol..平衡时;B的物质的量选填一个编号甲大于2 mol 乙等于2 mol 丙小于2 mol 丁可能大于、等于或小于2mol 作出此判断的理由是 ..4若在3的平衡混合物中再加入3molC;待再次到达平衡后;C的物质的量分数是 ..II.若维持温度不变;在一个与1反应前起始体积相同、且容积固定的容器中发生上述反应..5开始时放入1molA和1molB到达平衡后生成b molC..将b与1小题中的a进行比较选填一个编号..甲a<b 乙a>b 丙a=b 丁不能比较a和b的大小作出此判断的理由是 ..易错题14、在固定体积的容器中加入1molN2O4发生如下反应 N2O42NO2当达到平衡时保持温度不变再充入1 molN2O4气体;则平衡向移动 N2O4转化率如何变化15、一定温度下;向一固定体积为V的容器中加入4molNO2.发生如下反应:2NO2N 2O4当达到平衡时;保持温度不变再充入1 molNO2气体;则平衡向移动 NO2的转化率如何变化16、在一固定体积为V的容器中;加入1molA和1molB发生如下反应:Ag+Bg2Cg达到平衡后:1如果再加入1molA则平衡向移动平衡时B的转化率如何变化 A的的转化率如何变化2在反应1的基础上再加入1molB则平衡向移动平衡时A的转化率如何变化 B的的转化率如何变化与反应1相比较32的平衡状态与原平衡状态相比;A、B的转化率如何变化17、在T K、pkPa时;向体积为V L的密闭容器内充入1 mol A和1 mol B.保持恒温恒压;反应Ag+Bg芦兰Cg达到平衡时C的体积分数为40%.使温度和压强在上述条件下恒定不变;若向密闭容器中充入2 mol A和2 tool B;则反应达到平衡时容器的体积为;C的体积分数为 ..参考答案1C 2B 3CD 4C 5C 6C 7B 8D 9C10、答案:12 20.25 1.5 3a+c=2 2b+c=211、1当乙的容积与甲保持相同时;要达到等效平衡;则应满足乙中的投料量与甲中相等;将2mol NH3全部归到平衡的左边相当于1mol N2与3mol H2;因此还差2mol N2和1mol H2..2当乙的压强与甲保持相同时;只要乙的投料方式中N2和H2的物质的量之比与甲中相等即可达到等效平衡..因此向乙中通入6mol N2和8mol H2;达到平衡时;生成氨的物质的量浓度与甲中相等;而氨的物质的量物质的量b=2a;所以a∶b=1∶2;若乙的容积与甲保持相等;则相当于在原平衡的基础上使压强增大2倍;则平衡要向右移动;所以平衡时氨的物质的量物质的量c>2a;即a∶c <1∶2..12、对于一般的可逆反应;在恒温恒压条件下;只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同;则达平衡后;与原平衡等效..①因为从题干可知nN 2∶nH 2∶nNH 3平衡=1∶4∶a;所以①状态下nN 2∶nH 2∶nNH 3平衡=1.5∶6∶1.5a..②起始状态时;有1mol NH 3;则相当于起始时有N 2和H 2分别为0.5mol 和1.5mol;按nN 2∶nH 2∶nNH 3平衡=1∶4∶a;可得②状态时nN 2∶nH 2∶nNH 3平衡=0.5∶2∶0.5a;所以原有N 2和H 2分别为0和0.5mol..③设起始时nNH 3为x mol;则相当于N 2和H 2总量分别为m +2xmol 和g +23x mol;则m +2x ∶g +23x=1∶4;即可得x =2g -4m设为nNH 3平衡y mol;可得: 4∶a =g +23x∶y;即:y =g -3m ·a.. 13、11-a 23a 32 3-3a 丁若3a >1;B 的物质的量小于2mol ;若13=a ;B 的物质的量等于2mol ; 若3a <1;B 的物质的量大于2mol 4aa -2 5乙 因为5小题中容器容积不变;而1小题中容器的容积缩小;所以5小题的容器中的压力小于1小题容器中的压力;有利于逆向反应;故反应达到平衡后a >b..14、平衡向正反应方向移动 、N 2O 4转化率减小 15、平衡向右移动、NO 2转化率增大16、1加入A 则增大反应物浓度;平衡正反应方向移动;B 的转化率增大;A 的转化率减小..2再加入B 则平衡向正反应方向移动;A 的转化率增大;B 的转化率减小..3若与原平衡相比;则A 、B 的转化率不变.. 17、原文解析略 答案:710V40%。
等效平衡练习题(含解析答案)
等效平衡练习题【例1】将3 mol A与1 mol B混合于一体积可变得密闭容器P中,以此时得温度、压强与体积作为起始条件,发生了如下反应: 3A(g)+B(g) 2 C(g)+D(g)达到平衡时C得浓度为w mol·L-1。
回答⑴~⑸小题:(1)保持温度与压强不变,按下列四种配比充入容器P中,平衡后C得浓度仍为w mol·L-1得就是( )(A)6 mol A+2 mol B (B)3 mol A+1 mol B十2 mol C,(C)2 mol C+1 mol B+1 mol D (D)1 mol C+2mol D(2)保持原起始温度与体积不变,要使平衡后C得浓度仍为w mol·L-1,应按下列哪种配比向容器Q中充入有关物质( )(A)3 mol A+1 mol B (B)4 mol C十2 mol D(C)1、5 mol A+0、5mol B+1 mol C +0、5 mol D (D)以上均不能满足条件,(3)保持原起始温度与体积不变,若仍按3 mol A与1 mol B配比在容器Q中发生反应,则平衡时C得浓度与w rml·L-1得关系就是( )(A)>w(B)<w(C)= w(D)不能确定(4)将2 mol C与2 mol D按起始温度与压强充入容器Q中,保持温度与体积不变,平衡时C得浓度为V mol·L-1,V与w得关系就是( )(A) V>w(B) V<w(C) V=w(D)无法比较(5)维持原起始温度与体积不变,按下列哪种配比充入容器Q可使平衡时C得浓度为V mol·L-1 ( )(A)1 mol C+0、5 m01 D . (B)3 mol A+2 mol B(C)3 mol A+1 mol B+1 mol D (D)以上均不能满足条件解析⑴(A)⑵(D).⑶(B).⑷(B).⑸(C).【例2】某温度下向1L密闭容器中充入1mol N2与3 mol H2,使反应N2+3H22NH3达到平衡,平衡混合气中N2、H2、NH3得浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质得加入量,要求M、N、G保持不变,则N2、H2、NH3得加入量用x、y、z表示时应满足得条件就是:①若x=0,y=0,则z= ;②若x=0、75 mol,则y= ,z= ;③x、y、z取值必须满足得一般条件就是(用含x、y、z方程表示,其中一个含x、z,另一个含y、z) 。
等效平衡专题习题含答案
等效平衡专题练习一、等效平衡概念等效平衡是指在一定条件(恒温恒容或恒温恒压)下,只是起始加入情况不同的同一可逆反应达平衡后,任何相同组分的体积分数或物质的量分数均相等的平衡。
在等效平衡中,有一类特殊的平衡,不仅任何相同组分X的含量(体积分数、物质的量分数)均相同,而且相同组分的物质的量均相同,这类等效平衡又称为同一平衡。
同一平衡是等效平衡的特例。
如,常温常压下,可逆反应:2SO2 + O22SO2①2mol 1mol 0mol②0mol 0mol 2mol③0.5mol 0.25mol 1.5mol①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡二、等效平衡规律判断是否建立等效平衡,根据不同的特点和外部条件,有以下几种情况:①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,若保持其数值相等,则两平衡等效。
此时,各组分的浓度、反应速率等分别与原平衡相同,亦称为同一平衡。
②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,只要物质的量的比值与原平衡相同则两平衡等效。
此时,各配料量不同,只导致其各组分的浓度反应速率等分别不同于原平衡,而各组分的百分含量相同。
③在恒温、恒压下,不论反应前后气体分子数是否发生改变,改变起始时加入物质的物质的量,根据化学方程式的化学计量数换算成同一则物质的物质的量只要物质的量之比与原平衡相同,则两平衡等效。
此时的情形与(2)相似。
例题、【2003年江苏高考试题】恒温、恒压下,在一个可变容积的容器中发生如下反应:A(g)+B(g) C(g)(1)若开始时放入1 mol A和1 mol B,到达平衡后,生成a mol C,这时A的物质的量为 mol。
等效平衡练习题
等效平衡练习题练习1、在一固定容积的密闭容器中充入2moA和1moB,发生反应:2A气B气C气,达到平衡后,C的体积分数为W%。
若维持容器体积和温度不变,、为起始物质,达到平衡后,C的体积分数仍为W%,则值为()A、1B、2C、3D、4练习2、恒温、恒压下,在一个可变容积的容器中发生如下发应:A(气)+B(气)C (气)I.恒温、恒压下,在一个可变容积的容器中发生如下发应: A(气)+B(气)C(1)若开始时放入1moA和1moB,到达平衡后,生成a moC,这时A的物质的量为 mo。
(2)若开始时放入3moA和3moB,到达平衡后,生成C的物质的量为 _____mo。
(3)若开始时放入 moA,2moB和1moC,到达平衡后,A和C的物质的量分别是mo和3a mo,则=mo,= mo。
平衡时,B的物质的量(选填一个编号)(甲)大于2 mo (乙)等于 2 mo(丙)小于 2 mo (丁)可能大于、等于或小于2mo作出此判断的理由是。
(4)若在(3)的平衡混合物中再加入3moC,待再次到达平衡后,C的物质的量分数是。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放入1moA和1moB到达平衡后生成b moC。
将b与(1)小题中的a进行比较(选填一个编号)。
(甲)a<b (乙)a>b (丙)a=b (丁)不能比较a和b的大小练习3、某温度下,向某密闭容器中加入1moN2和3moH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。
若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:1)恒定T、V:[1]若X=0,Y=0,则Z=-----------。
[2]若X=075,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是---------------。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO 0.01mol
1L
A
H2O 0.01mol
等效平1L衡T0
CO2 0.01mol
B
H2 0.01mol
1L T0
CO 0.006mol
H2O0.006mol
H2 0.004mol CO2 0.004mol
1L T0
等效平衡
一、定义 : 在一定条件下,对同一可逆反应, 以不同的投料方式进行反应,只要起始时加入 物质的物质的量“相当”,达到化学平衡时, 同种物质在各混合物中的百分含量相同,这样 的平衡互称为等效平衡。
强调:
二、等效平衡的解法——极值转换法
方法: 无论平衡从那个方向建立,在判 断时都可根据给定条件和反应计量数把生成 物全部推算为反应物或把反应物全部推算为 生成物再与原平衡加入的物质的量相比较, 若物质的量“相当”,则为等效平衡。
T、V不变 2SO2+O2
2 SO3
SO2 2mol O2 1mol SO3 0mol
模型构建:恒温恒容
1L
1mol I2 1mol H2
等效
1L
2mol I2 2mol H2
增大压强 2L 平衡不移动
2mol I2 2mol H2
ks5u精品课件
T、P不变 2SO2+O2
2 SO3
SO2 2mol O2 1mol SO3 0mol
转化为同种物
平衡状态
质时物质的量
之比相同
A、B两容器中SO2 (O2 、 SO3 )百分比 组成是相等的。
即CO的体积分数仍为x;B选项相当于2molCO、2molH2O(g),
可以认为是在原平衡的基础上又加入了1molCO,平衡向
右移动,但是CO的体积分数增大,即大于x;C选项相当
于0.9molCO、1.9molH2O(g),此投料相当于在0.9molCO 和1.8molH2O(g)的平衡体系(与原平衡等效)中再加入 0.1mol H2O(g),平衡向右移动,CO的体积分数减小,即
A.4 molA+2 molB B.2 molA+1 molB+2 molC C.2 molC+1 molB D.2 molC E.1 molA+0.5 molB+1 molC 达到平衡后,C的物质的量浓度仍是K mol/L的
是( DE )
例2:在恒温、恒容下,有反应:2A(g)+2B(g)
C(g)+3D(g),现从两条途径分别建立平衡。途径 Ⅰ:A、B的起始浓度均为2mol·L-1;途径Ⅱ:C、 D的起始浓度分别为2mol·L-1和6mol·L-1。以下
SO2 0mol O2 0mol SO3 2mol
SO2 1mol O2 0.5mol SO3 1mol
转化为同种物质 时物质的量相同
平衡状态
SO2 1.2mol O2 0.6mol SO3 0.8mol
SO2 0.5mol O2 0.25mol SO3 1.5mol
T、V不变 H2(g)+I2 (g)
H2O(g),发生反应:CO+H2O(g)
催化剂 高温
CO2+H2。
达到平衡时,CO的体积分数为x。若维持容器的体
积和温度不变,起始物质按下列四种配比充入该容
器中,达到平衡时CO的体积分数大于x的是(B )
A.0.5mol CO+2mol H2O(g)+1mol CO2+1mH2 B.1mol CO+1mol H2O(g)+1mol CO2+1mol H2 C.0.5mol CO+1.5mol H2O(g)+0.4mol CO2+0.4mol
1L
1molA 1molB
<1L amol C
1L bmol C
P↑ ,平衡正 移,nc↑
ks5u精品课件
的量成比例 按比例变化)
记忆口诀 • 等压比相等,等容量相等 • 但若体不变,可为比相等
例1:在一定温度下,把2molSO2和1molO2通入一个一定
容积的密闭的容器里,发生如下反应2SO2+O2 2SO3 当此反应进行到一定程度时,反应混和物就处于化 学平衡状态。现在该容器中,维持温度不变,令a、b、 c分别代表初始加入的SO2、O2和SO3的物质的量(摩)。 如果a、b、c取不同的数值,它们必须满足一定的相互 关系,才能保证达到平衡时,反应混合物中三种气体的 百分含量仍跟上述平衡时的完全相同。请填写下列空白:
H2 D.0.5mol CO+1.5mol H2O(g)+0.5mol CO2+0.5mol
H2
ks5u精品课件
本题考查了等效平衡的问题。该反应∆V=0,因此在恒 温恒容条件下等效平衡的条件是CO和H2O(g)的物质的量 之比与起始加入的物质的量之比相等即可。因此只要将
各选项中的投料转化为CO和H2O(g)的物质的量,并与原 平衡进行对比即可。A选项相当于1.5molCO、3molH2O(g), 即二者之比为1∶2,所以此情况下的平衡与原平衡等效,
c 叙述正确的是( ) A. 达到平衡时,途径Ⅰ的反应速率等于途径Ⅱ 的反应速率
B. 达到平衡时,途径Ⅰ所得混合气体的压强等 于途径Ⅱ所得混合气体的压强
C. 两途径最终达到平衡时,体系内各组分的百 分含量相同
D. 两途径最终达到平衡时,体系内各组分的百 分含量不相同 ks5u精品课件
练习2:向某密闭容器中充入1mol CO和2mol
(1)若a=0,b=0,则c=______2_______
(2)若a=0.5,则 b= 0.25 c= 1.5
(3)a、b、c取值必须满足的一般条件是(请用两个方程式 表示,其中一个只含a和c,另一个只含b和c):
a+c=2,2b+c=2
练习1: 在一个固定体积的密闭容器中,加入
2molA和1molB,发生反应2A(g)+B(g) 2C(g), 达到平衡时,C的物质的量浓度为K mol/L,若维持 容器体积和温度不变,按下列配比作为起始物质:
条件 等效条件
结果
恒温恒容 (△n(g)≠0)
投料换算成相
同物质表示时
物质的量相同
两平衡各组分百分含 量均相同(n、c相同)
恒温恒容 投料换算成相同 两平衡各组分百分
物质表示时物质
(△n(g)=0) 的量成比例
含量相同,(n、c 按比例变化 )
投料换算成相同 两平衡各组分百分含 恒温恒压 物质表示时物质 量相同,(c相同, 2、学会熟练应用等效平衡模式及极限思
想进行相关计算。 3、通过对不同条件下的等效平衡分析拓
展思路,开拓视野。
判断方法:
虚拟一个中间过程,如一个容器、一 个隔板等,然后进行比较
ks5u精品课件
化学平衡状态的建立
催化剂
CO+H2O(气)1200℃ CO2+H2
2HI(g)
I2 1mol H2 1mol HI 0mol
I2 2mol H2 2mol HI 0mol
I2 0mol H2 0mol HI 2mol
I2 0mol H2 0mol HI 4mol
转化为同种物 质时物质的量 之比相同
平衡状态
四种情况中
达到平衡后, I2、H2、HI的 组成百分比是 相同的。
SO2 4mol O2 2mol SO3 0mol 或
SO2 0mol O2 0mol SO3 4mol
模型构建:恒温恒压
2molSO2 1molO2
等效
4molSO2 2molO2
抽去隔板 2molSO2 平衡不移动
1molO2
2molSO2 1molO2
ks5u精品课件
三、等效平衡分类、建成条件及结果
小于x;D选项相当于1molCO、2molH2O(g),此平衡与原 平衡相同,所以CO的体积分数也为x。因此达到平衡时CO
的体积分数大于x的只有Bks选5u精项品课。件
作业: 完成第二章练习题第7~10题
ks5u精品课件
三、等效平衡的三大类型
1、恒温恒容(定T、V)的等效平衡 (1).在定T、V条件下,对于反应前后气体体积改 变的反应:若改变起始加入情况,只要通过可逆反应的 化学计量数比换算成平衡时左右两边同一边物质的物质 的量与原平衡相同,则二平衡等效。 (2).在定T、V条件下,对于反应前后气体体积不 变的反应:只要反应物(或生成物)的物质的量的比例与 原平衡相同,则二平衡等效。 2、恒温恒压(定T、P)的等效平衡 在定T、P条件下:若改变起始加入情况,只要通过可 逆反应的化学计量数比换算成平衡时左右两边同一边物 质的物质的量之比相同。
