第六章 有机反应活性中间 习题答案
有机化学各章习题与及答案

有机化学各章习题与及答案有机化学各章习题与及答案第一章绪论1. 在下列化合物中,偶极矩最大的是( )A.CH3CH2ClB. H2C=CHClC. HC≡CCl2. 根据当代的观点,有机物应该是( )A.来自动植物的化合物B. 来自于自然界的化合物C. 人工合成的化合物D. 含碳的化合物3. 1828年维勒(F. Wohler)合成尿素时,他用的是( )A.碳酸铵B. 醋酸铵C. 氰酸铵D. 草酸铵4. 有机物的结构特点之一就是多数有机物都以( )A.配价键结合B. 共价键结合C. 离子键结合D. 氢键结合5. 根椐元素化合价,下列分子式正确的是( )A.C6H13B. C5H9Cl2C. C8H16OD. C7H15O6. 下列共价键中极性最强的是( )A.H-CC. H-OD. C-N7. 下列溶剂中极性最强的是( )A.C2H5OC2H5B. CCl4C. C6H6D. CH3CH2OH8. 下列溶剂中最难溶解离子型化合物的是( )A. H2OB. CH3OHC. CHCl3D. C8H189. 下列溶剂中最易溶解离子型化合物的是( )A.庚烷 B. 石油醚 C. 水 D. 苯10. 通常有机物分子中发生化学反应的主要结构部位是( )A.键B. 氢键C. 所有碳原子D. 官能团(功能基)第二章烷烃1. 在烷烃的自由基取代反应中,不同类型的氢被取代活性最大的是( )A.一级B. 二级C. 三级D. 那个都不是2. 氟、氯、溴三种不同的卤素在同种条件下,与某种烷烃发生自由基取代时,对不同氢选择性最高的是( )A.氟C. 溴D.3. 在自由基反应中化学键发生( )A. 异裂B. 均裂C. 不断裂D. 既不是异裂也不是均裂4. 下列烷烃沸点最低的是( )A. 正己烷B. 2,3-二甲基戊烷C. 3-甲基戊烷D. 2,3-二甲基丁烷5. 在具有同碳原子数的烷烃构造异构体中,最稳定的是( )的异构体( )A. 支链较多B. 支链较少C. 无支链6. 引起烷烃构象异构的原因是( )A. 分子中的双键旋转受阻B. 分子中的单双键共轭C. 分子中有双键D. 分子中的两个碳原子围绕C-C单键作相对旋转7. 将下列化合物绕C-C键旋转时哪一个化合物需要克服的能垒最大( )A. CH2ClCH2BrB. CH2ClCH2IC. CH2ClCH2ClD. CH2ICH2I8. ClCH2CH2Br中最稳定的构象是( )A. 顺交叉式B. 部分重叠式C. 全重叠式D. 反交叉式9. 假定甲基自由基为平面构型时,其未成对电子处在什么轨道( )A. 1sB. 2sC. sp2D. 2p10. 下列游离基中相对最不稳定的是( )A. (CH3)3C.B. CH2=CHCH2.C. CH3.D. CH3CH2.11. 构象异构是属于( )A. 结构异构B. 碳链异构C. 互变异构D. 立体异构12. 下列烃的命名哪个是正确的?( )A、乙基丙烷 B. 2-甲基-3-乙基丁烷C. 2,2-二甲基-4-异丙基庚烷D. 3-甲基-2-丁烯13. 下列烃的命名哪个不符合系统命名法?( )A.2-甲基-3-乙基辛烷 B. 2,4-二甲基-3-乙基己烷C. 2,3-二甲基-5-异丙基庚烷D. 2, 3, 5-三甲基-4-丙基庚烷14. 按沸点由高到低的次序排列以下四种烷烃①庚烷②2,2-二甲基丁烷③己烷④戊烷( )A. ③>②>①>④B. ①>③>②>④C. ①>②>③>④D. ①>②>③>④15. 异己烷进行氯化,其一氯代物有几种?( )A. 2种B. 3种C. 4种D. 5种16. 化合物的分子式为C5H12一元氯代产物只有一种,结构式是( )A.C(CH3)4 B. CH3CH2CH2CH2CH3C. (CH3)2CHCH2CH317. 下列分子中,表示烷烃的是( )A. C2H2B. C2H4C. C2H6D. C6H618. 下列各组化合物中,属同系物的是( )A. C2H6和C4H8B. C3H8和C6H14C. C8H18和C4H10D. C5H12和C7H1419. 甲烷分子不是以碳原子为中心的平面结构,而是以碳原子为中心的正四面体结构,其原因之一是甲烷的平面结构式解释不了下列事实( )A. CH3Cl不存在同分异构体B. CH2Cl2不存在同分异构体C.CHCl3不存在同分异构体 D. CH4是非极性分子20. 甲基丁烷和氯气发生取代反应时,能生成一氯化物异构体的数目是( )A. 1种B. 2种C. 3种D. 4种21. 实验室制取甲烷的正确方法是( )A. 醇与浓硫酸在170℃条件下反应B. 电石直接与水反应C. 无水醋酸钠与碱石灰混和物加热至高温D. 醋酸钠与氢氧化钠混和物加热至高温第三章烯烃1. 在烯烃与HX的亲电加成反应中,主要生成卤素连在含氢较( )的碳上( )A. 好B. 差C. 不能确定2. 烯烃双键碳上的烃基越多,其稳定性越( )A. 好B. 差C. 不能确定3. 反应过程中出现碳正离子活性中间体,而且相互竟争的反应是( )A. SN2与E2B. SN1与SN2C. SN1与E14. 碳正离子a.R 2C=CH-C +R 2 、b. R 3C +、c. RCH=CHC +HR 、d. RC +=CH 2稳定性次序为( )A. a >b >c >dB. b >a >c >dC. a >b ≈c >dD. c >b >a >d 5. 下列烯烃发生亲电加成反应最活泼的是( )A. (CH 3)2C=CHCH 3B. CH 3CH=CHCH 3C. CH 2=CHCF 3D. CH 2=CHCl 3 6. 下列反应中间体的相对稳定性顺序由大到小为( )CH 2CH 3CH 3CHCH 3CH 3C CH 33+++A. B. C.A. A >B >CB. A >C >BC. C >B >AD. B >C >A 7. 1-己烯、顺-3-己烯和反-3-己烯三者相对稳定性的次序是( )A. 反-3-己烯>顺-3-己烯>1-己烯B. 1-己烯>顺-3-己烯>反-3-己烯C. 顺-3-己烯>1-己烯>反-3-己烯8. 在烯烃与HX 的加成反应中,反应经两步而完成,生成( )的一步是速度较慢的步骤( )A. 碳正离子B. 碳负离子C. 自由基9. 分子式为C 5H 10的烯烃化合物,其异构体数为( )A. 3个B. 4个D. 6个10. 在下列化合物中,最容易进行亲电加成反应的是( )A.CH 2=CHCH=CH 2B.CH 3CH=CHCH 3C.CH 3CH=CHCHOD.CH 2=CHCl 11. 马尔科夫经验规律应用于( )A. 游离基的稳定性B. 离子型反应C. 不对称烯烃的亲电加成反应D. 游离基的取代反应12. 下列加成反应不遵循马尔科夫经验规律的是( )A. 丙烯与溴化氢反应B. 2-甲基丙烯与浓硫酸反应C. 2-甲基丙烯与次氯酸反应D. 2-甲基丙烯在有过氧化物存在下与溴化氢反应13. 若正己烷中有杂质1-己烯,用洗涤方法能除去该杂质的试剂是( )A. 水B. 汽油C. 溴水D. 浓硫酸14. 有一碳氢化合物I ,其分子式为C 6H 12 ,能使溴水褪色,并溶于浓硫酸,I 加氢生成正己烷,I 用过量KMnO 4氧化生成两种不同的羧酸,试推测I 的结构( ) A. CH 2=CHCH 2CH 2CH 2CH 2 B. CH 3CH=CHCH 2CH 2CH 3 C. CH 3CH 2CH=CHCH 2CH 3 D. CH 3CH 2CH=CHCH=CH 215. 下列正碳离子中,最稳定的是( )CH 3CH 3CH 3CH 2CH 3++A. B.C.D.CH 3CH 3++16. 具有顺反异构体的物质是( )CH 3CH C CO 2HCH 3CH 3CH C CH 3CH 3CH 3C CH 3CHCH 2CH 3H 2C CH 2A. B.C. D.17. 分子式为C 4H 8的烯烃与稀、冷KMnO 4溶液反应得到内消旋体的是( )CH 2CHCH 2CH 3CH 2C(CH 3)2C CHHCH 3CH 3C CHCH 3HCH 3A. B.C. D.18. 下列反应进行较快的是( )A.B.CH 3CH 3Cl KOH/C H OH3CH 3CH 3CH 3ClKOH/C H OH3CH 319. 下列化合物稳定性最大的是( )A. B.C. D.H 3C CH 2H 3CCH 3H 3CCH 3H 3CCH 3CH 3第四章炔烃和二烯烃1. 在含水丙酮中,p-CH 3OC 6H 4CH 2Cl 的水解速度是C 6H 5CH 2Cl 的一万倍,原因是( )A.甲氧基的-I 效应B. 甲氧基的+E 效应C. 甲氧基的+E 效应大于-I 效应D. 甲氧基的空间效应2. 下列化合物中氢原子最易离解的为( )A. 乙烯B. 乙烷C. 乙炔D. 都不是3. 二烯体1,3-丁二烯与下列亲二烯体化合物发生Diels-Alder 反应时活性较大的是( )A. 乙烯B. 丙烯醛C. 丁烯醛D. 丙烯4. 下列化合物中酸性较强的为( )A. 乙烯B. 乙醇C. 乙炔D. H 25. 在CH 3CH=CHCH 2CH 3化合物的自由基取代反应中,( )氢被溴取代的活性最大A. 1-位B. 2-位及3-位C. 4-位D. 5-位6. 下列物质能与Ag(NH 3)2+反应生成白色沉淀的是( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔7. 下列物质能与Cu2Cl2的氨水溶液反应生成红色沉淀的是( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔8. 以下反应过程中,不生成碳正离子中间体的反应是( )A. SN1B. E1C. 烯烃的亲电加成D. Diels-Alder反应9. 在sp3, sp2, sp杂化轨道中p轨道成分最多的是()杂化轨道( )A. sp3B. sp2C. sp10. 鉴别环丙烷,丙烯与丙块需要的试剂是( )A. AgNO3的氨溶液;KMnO4溶液B. HgSO4/H2SO4; KMnO4溶液C. Br2的CCl4溶液;KMnO4溶液D. AgNO3的氨溶液11. 结构式为CH3CHCICH=CHCH3的化合物其立体异构体数目是( )A. 1B. 2C. 3D. 412. 1-戊烯-4-炔与1摩尔Br2反应时,预期的主要产物是( )A. 3,3-二溴-1-戊-4-炔B. 1,2-二溴-1,4-戊二烯C. 4,5-二溴-2-戊炔D. 1,5-二溴-1,3-戊二烯13. 某二烯烃和一分子溴加成结果生成2,5-二溴-3-己烯,该二烯烃经高锰酸钾氧化得到两分子乙酸和一分子草酸,该二烯烃的结构式是( )A. CH2=CHCH=CHCH2CH3B. CH3CH=CHCH=CHCH3C. CH3CH=CHCH2CH=CH2D. CH2 =CHCH2CH2CH=CH214. 下列化合物无对映体的是( )H 3C H 3CH 3C CH C CH CH 3H 5C 6CH C CHC 6H 5H 5C 6N CH 32H 5C 3H 7I -+A.B.C. D.15. 下列炔烃中,在HgSO 4-H 2SO 4的存在下发生水合反应,能得到醛的是( )A. B.C. D.CH 3C C CH3CH 3C CHHC CHCH 3CH 2CH 2C CH16. 一化合物分子式为C 5H 8,该化合物可吸收两分子溴,不能与硝酸银的氨溶液作用,用过量的酸性高锰酸钾溶液作用,生成两分子二氧化碳和一分子丙酮酸推测该化合物的结构式( )A. B.C. D.CH 3C CCH 2CH 3HC C CHCH 33CH 2CHCH CHCH 3H 2C C CH CH 2CH 317. 下面三种化合物与一分子HBr 加成反应活性最大的是( )A. B. C.PhCH CH 2p O 2NC 6H 4CH CH 2p CH 3C 6H 4CH CH 2第五章环烷烃1. 环已烷的所有构象中最稳定的构象是( )A. 船式C. 椅式2. A. 环丙烷、B. 环丁烷、C. 环己烷、D. 环戊烷的稳定性顺序( )A. C>D>B>AB. A>B>C>DC. D>C>B>AD. D>A>B>C 3. 下列四种环己烷衍生物其分子内非键张力(Enb )从大到小顺序应该( ) A. B.C.D.(CH 3)3CCH 3(CH 3)3CCH 3C(CH 3)3CH 3C(CH 3)3CH 3A. A >B >C >DB. A >C >D >BC. D >C >B >AD. D >A >B >C 4. 1,3-二甲基环己烷不可能具有( )A. 构象异构B. 构型异构C. 几何异构D. 旋光异构5. 环烷烃的环上碳原子是以哪种轨道成键的?( )A. sp 2杂化轨道B. s 轨道C. p 轨道D. sp 3杂化轨道6. 碳原子以sp 2杂化轨道相连成环状,不能使高锰酸钾溶液褪色,也不与溴加成的一类化合物是( )A. 环烯烃B. 环炔烃C. 芳香烃D. 脂环烃7. 环烷烃的稳定性可以从它们的角张力来推断,下列环烷烃哪个稳定性最差?( )A. 环丙烷B. 环丁烷C. 环己烷D. 环庚烷8. 单环烷烃的通式是下列哪一个?( )A. C n H 2nB. C n H 2n+2C. C n H 2n-2D. C n H 2n-69. 下列物质的化学活泼性顺序是①丙烯②环丙烷③环丁烷④丁烷( )A. ①>②>③>④B. ②>①>③>④C. ①>②>④>③D. ①>②>③=④ 10. 下列物质中,与异丁烯不属同分异构体的是( )A. 2-丁烯B. 甲基环丙烷C. 2-甲基-1-丁烯D. 环丁烷11.CH 2CH 3CH 3HH的正确名称是( )A. 1-甲基-3-乙基环戊烷B. 顺-1-甲基-4-乙基环戊烷C. 反-1-甲基-3-乙基戊烷D. 顺-1-甲基-3-乙基环戊烷12. 环己烷的椅式构象中,12个C-H 键可区分为两组,每组分别用符号( )表示( )A. α与βB. σ与πC. a 与eD. R 与S 13. 下列反应不能进行的是( )A. B.C.D.CH3+KMnO 4/H+H 2高温+Br 2hv+KMnO 4/H 3O+14. 下列化合物燃烧热最大的是( )A.B. C.D.15. 下列物质与环丙烷为同系物的是( )A.B. C. D.CH 3CHCH 316. 1,2-二甲基环己烷最稳定的构象是( )A.B.C.D.H CH 3CH 3HCH 3CH 3CH 33317. 下列1,2,3-三氯环己烷的三个异构体中,最稳定的异构体是( )A. B.C.ClClCl ClClClCl ClCl第六章对映异构1. 下列物质中具有手性的为()。
有机化学课后题答案chapter06
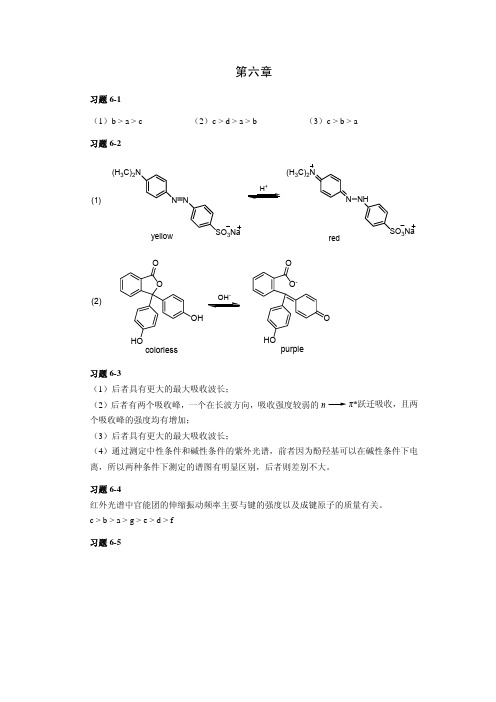
第六章习题6-1(1)b > a > c (2)c > d > a > b (3)c > b > a 习题6-2(H 3C)2NN NSO 3Na(H 3C)2NN NHSO 3Na+(1)yellowredOHOO -O -OHOO colorlesspurple(2)习题6-3(1)后者具有更大的最大吸收波长;(2)后者有两个吸收峰,一个在长波方向,吸收强度较弱的n π*跃迁吸收,且两个吸收峰的强度均有增加;(3)后者具有更大的最大吸收波长;(4)通过测定中性条件和碱性条件的紫外光谱,前者因为酚羟基可以在碱性条件下电离,所以两种条件下测定的谱图有明显区别,后者则差别不大。
习题6-4红外光谱中官能团的伸缩振动频率主要与键的强度以及成键原子的质量有关。
c > b > a > g > e > d > f 习题6-5· 244 · 第十一章 氧化还原反应 a 、前者没有1050~1250 cm -1的C -O 伸缩振动吸收; b 、后者没有—COOH 的C=O 伸缩振动在1700~1750 cm -1; c 、前者没有—COOH 的O -H 伸缩振动吸收,在2500~3200 cm -1。
习题6-6前者为三取代烯烃,后者为四取代烯烃,在IR 指纹区的650~1000 cm -1范围有明显差异,且后者在1385~1365cm -1处有一个异丙基的特征吸收。
CH 3C 3CHCH 2CH 3在840-790cm -1处存在一个=C-H 弯曲振动吸收;而且在1385-1365cm -1处有-CH 3 的 C -H 弯曲振动吸收;在1450-1420cm -1处有-CH 2 ,-CH 的 C -H 弯曲振动吸收CH 3CCH 3CCHCH 3CH3CH 3在~1385cm -1和~1368cm -1处存在两个强度相等的吸收峰;为-CH (CH 3)2 的特征吸收。
《有机化学》章节习题答案.docx
第一章习题1.何为共价键的饱和性和方向性?2.下列分子中哪些具有极性键?哪些是极性分子?(1)CH4 (2) CH2C12 (3) CH3Br (4) CH3OH (5) CH30CH3 (6) HC=CH3.按碳架形状分类,下列化合物各属哪一类化合物?第二章习题1.用系统命名法命名下列化合物:(1) (CH3CH2)2CHCH3C2H5 (2) CH3CCH2CH3CH2CH2CH3CH3CH2 CH2CH3(3)\ c // \(CH3)3C CH(CH3)2(4) (C2H5)2CHCH(C2H5)CH2CH(CH3)2CH(CH3)2(5)CH3—CH—CH2—CH—CH—CH3CH2CH3 CH3CH2CH34.指出下列每个分子中存在的官能团类型:⑺ H3C ----- < C(CH3)3 (8)2. 写出下列化合物的构造式:(1) 由一个叔丁基和异丙基组成的烷炷; (2) 含一侧链甲基,分子量为98的环烷炫(3) 分子量为114,同时含有1°、2°、3。
、4。
碳的烷炷。
3.写出下列化合物的结构式,如其名称与系统命名原则不符,请予以改正。
(1)3, 3-二甲基丁烷 (2)2, 3-二甲基-2-乙基丁烷 (3) 4 -异丙基庚烷(4) 3> 4-二甲基-3 -乙基戊烷(5)3, 4, 5-三甲基-4-正丙基庚烷 ⑹2 -叔丁基-4, 5 -二甲基己烷4. 相对分子质量为72的烷任进行高温氯化反应,根据氯化产物的不同,推测各种烷炷的结构式。
(1)只生成一种一氯代产物(2)可生成三种不同的一氯代产物(3) 生成四种不同的一氯代产物 (4)只生成二种二氯代产物 5.不查表将下列烷炷的沸点由高至低排列成序: (1)2, 3-二甲基戊烷 (2) 2-甲基己烷 (3)正庚烷 (4) 正戊烷(5)环戊烷6. 写出下列化合物的优势构象—( 「CH2CH3 (1) BrCH 2CH 2Cl (2) CH 3CH 2CH 2CH 2CH 3 (3) '、'、—/(4)反-1-甲基-4-叔丁基环己烷7. 写出1, 3-二甲基环已烷和1-甲基-4-异丙基环已烷的顺、反异构体优势构象,并比较每组中哪个稳定。
第六章 有机反应活性中间 习 题

第六章有机反应活性中间习题6-1指出下列反应的反应类型。
反应历程中如果有活性中间体,请写出活性中间体的结构。
(ⅰ)
(ⅱ)
(ⅲ)
(ⅳ)
(ⅴ)
6-2比较下列碳正离子的稳定性,由大到小的顺序排列。
(ⅰ)
a b c
(ⅱ)
a b c
d e
6-3写出下面反应的反应历程,指出历程中生成的活性中间体。
6-4试比较下列化合物或离子酸性的大小。
(ⅰ)2-甲基吡啶和3-甲基吡啶
(ⅱ)和
6-5完成下述反应,写出反应历程。
6-6将下列两组自由基按稳定性由大到小的顺序排列。
(ⅰ) a. b. c. d.
(ⅱ) a. b. c.
6-7完成下面的反应式,并写出反应的可能历程。
6-8 下列两个反应均发生环的扩大反应,根据所给的反应物和试剂,写出反应中间产物和环扩大的产物。
(ⅰ)(ⅱ)
6-9苯炔的结构是(1)而不是(2),为什么?
(1)(2)
6-10 完成下列反应。
(ⅰ)(ⅱ)
(ⅲ)。
有机化学课后习题参考答案完整版

有机化学课后习题参考答案完整版⽬录第⼀章绪论 0第⼆章饱和烃 (1)第三章不饱和烃 (5)第四章环烃 (13)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应⽤ (33)第⼋章醇酚醚 (43)第九章醛、酮、醌 (52)第⼗章羧酸及其衍⽣物 (63)第⼗⼀章取代酸 (71)第⼗⼆章含氮化合物 (78)第⼗三章含硫和含磷有机化合物 (86)第⼗四章碳⽔化合物 (89)第⼗五章氨基酸、多肽与蛋⽩质 (100)第⼗六章类脂化合物 (105)第⼗七章杂环化合物 (114)Fulin 湛师第⼀章绪论1.1扼要归纳典型的以离⼦键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于⽔中所得的溶液与NaBr 及KCl 各1mol 溶于⽔中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在⼀起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于⽔中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离⼦各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在⽔中是以分⼦状态存在,所以是两组不同的混合物。
1.3碳原⼦核外及氢原⼦核外各有⼏个电⼦?它们是怎样分布的?画出它们的轨道形状。
当四个氢原⼦与⼀个碳原⼦结合成甲烷(CH 4)时,碳原⼦核外有⼏个电⼦是⽤来与氢成键的?画出它们的轨道形状及甲烷分⼦的形状。
答案:C+624H CCH 4中C 中有4个电⼦与氢成键为SP 3杂化轨道,正四⾯体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电⼦式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H H HCC HH HH 或b.H C H c.H N Hd.H S H e.H O NOf.OC H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OS H H或1.5下列各化合物哪个有偶极矩?画出其⽅向。
有机化学第六章习题答案

H OH
CHO
(R)
H OH
(S)
HO H
CH2OH
I
CH2OH
II
CH2OH
III
CH2OH
IV
(1)(II) 和(III)是否是对映体?
不
(2)(I)和(IV)是否是对映体?
不
(3) (II)和(IV)是否是对映体?
不
(4) (I)和(II)的沸点是否相同?
相同
(5) (I)和(III)的沸点是否相同?
α = +1.15 o α = 11+0001.150o.5= +23 o
第二次观察说明第一次观察的到的α是+23°,而不是α±n180°。
十二、根据给出的四个立体异构体的Fisher投影式,回答
下列问题: CHO (R) H OH (R) H OH
CHO
(S)
HO H
(S)
HO H
CHO
(S)
HO H
不同
(6) 把这四种立体异构体等量混合,混合物有无旋光性? 无旋光
十八、某化合物(A)的分子式为C6H10,具有光学活性。可 与碱性硝酸银的氨溶液生成白色沉淀。若以Pt为催化剂催 化氢化,则(A)转别为C6H14(B),(B)无光学活性。试推测 (A)和(B)的结构式。
(A) C2H5CH(CH3)C CH (B) C2H5CH(CH3)CH2CH3
H
H
(1)(3)(4) Ch3
七、Fischer投影式 H Br 是R型还是S型? 下列各结
CH2CH3
构式,那些同上面这个投影式是同一化合物?
(1) C2H5 H Br
(2) H
(3)
机理习题及答案
第六章 有机反应机理和测定方法6-1 利用稳定态近似原理指导下列反应生成C 的速度公式:解:k 2× k 1k 2+k -16-2 从观察到的实验现象提出符合这些现象的反应历程。
1)下列两个反应有相等的反应速度并遵循相同的动力学方程:-O H2)hOHH-反应在重水中进行时若在反应完成前回收原料有氘代原料产生。
CH 2C H 2N H 2CH 2C H 2O H CH 2C H 2OH H 2SO 4***CD 2CH 2O HH O CDCH 2CD 2CH 2BrCDCH2CH 3O Na CH 3O H+5) HOCl 和CH 2=CHCH 2*Cl 得到三种产物1 ,2 , 3 ,若用CH 2=C (CH 3)CH 2*Cl 反应,则标记*Cl 重排的产物比例要小得多。
ClClCl O HClCl O HClCl O H *+***+H OCl6)铬酸氧化(CH 3)2CD(OH)的速度为(CH 3)2CH (O D)的六分之一。
7)化合物1进行S N 1反应比2快,3进行S N 2反应比4慢。
8)顺 1,2-环己二醇与HIO 4反应比反式异构体快。
9) 2R ,3S -3-氯-2-丁醇在NaOH/C 2H 5OH 溶液中反应得光活性的环氧化物,再用KOH/H 2O 处理得内消旋2,3-丁二醇。
10)CH 3O1 进行酸性水解生成无18O 的乙酸,CH 3O2在同样条件下生成带18O 的乙酸。
解: 1)两个反应决速步骤都是O HH-2)P hHP h-CH2CH2N H2CH2CH2O HCH2CH2O HCH2CH2N2CH2CH2****+*+CD2CH2O HCD CH2CD2CH2O H2CD2CH2++决速步骤为生成碳正离子,未牵涉C-D键断裂。
CD2CH2Br CDCH2CH3OCH3OD本反应是E1cb反应, 决速步骤为生成碳负离子,牵涉C-D键断裂。
5)次氯酸HOCl和同位素标记了的烯丙基氯H2C=CHCH2*Cl反应生成三种产物:ClCH2CH(OH)CH2*Cl、HOCH2CHClCH2*Cl和HOCH2CH*ClCH2Cl 。
普通化学第六章课后习题解答
第六章酸碱反应参考答案P 142综合性思考题:1、解:①稀释后)(10.0100050020.01-⋅=⨯=L mol c BOH ∵500/>θb B O H K c ∴可用最简式求算)(-OH c 即: θb K c OH c ⋅=-)( 35101010.0)(---=⨯=OH c)10lg (140.143---=-=pOH pH=14.0-3=11.0②加入NaOH 后:c[NaOH]=c[BOH]=0.20×500/1000=0.10(mol.L -1)此时可以只考虑NaOH 的解离:∴c(OH -)=c[NaOH]=0.10(mol.L -1)pH=14.0-pOH=14-(-lg0.1)=14.0-1=13.0③加入0.10mol/L500mL 弱酸后形成BOH~BA 缓冲体系:BOH+HA=BA+H 2O)(05.010005001.05002.0)(1-⋅=⨯-⨯=L mol BOH c )(05.010005001.0)(1-⋅=⨯=L mol BA c sb bc c pK pOH lg -=θ )()(l g )100.1lg(5BA c BOH c -⨯-=- 0.505.005.0lg 5=-= pH=14-pOH=14-5.0=9.0④加入0.20mol/L500mL 弱酸后形成弱酸弱碱盐体系:BOH+HA=BA+H 2O 根据θθ21)(a a K K H c ⋅=+有:87514210100.1100.1100.1)(----+=⨯⨯⨯⨯=⋅=θθθa b W K K K H c pH=-lg[H +]=-lg10-8=8⑤加入0.40mol/L500mL 弱酸后形成HA~BA 缓冲体系:反应式为:BOH+HA=BA+H 2O)(10.010005002.05004.0)(1-⋅=⨯-⨯=L mol HA c )(10.010005002.0)()(1-⋅=⨯==L mol BOH c BA c sa a c c pK pH lg -=θ )()(lg )100.1lg(7BA c HA c -⨯-=- 0.71.01.0lg 0.7=-= ⑥加入0.20mol.L -1500mLHCl 后,BOH+HCl=BCl+H 2O)(10.0100050020.0)()(1-+⋅=⨯==L mol HCl c B c 此时形成强酸弱碱盐体系:9514101010---===θθθb W a K K K ∵500/>+θa B K c ∴591010.010)()(--++=⨯=⋅=B c K H c a θpH=-lg(10-5)=5.0⑦加入0.40mol.L -1500mLHCl 后,BOH+HCl=BCl+H 2O)(10.010005002.050040.0)(1-⋅=⨯-⨯=L mol HCl c )(10.0100050020.0)()(1-+⋅=⨯==L mol BOH c B c 此时以HCl 解离为主:c (H +)=c (HCl )=0.10pH=-lg(0.1)=1.0⑧当加入大量水稀释至BOH 浓度为 1.0×10-10mol.L -1时,可以仅仅考虑水的解离,此时c(H)≈c(OH)=1.0×10-7(mol ·L -1)pH=-lg(H +)=-lg(10-7)=7.02、解:①OH HPO224+---+OH PO H 42 O H2-++OH HOH H P O224+-+-+O H PO 334 质点量的大小为--->>344224PO PO H HPO ②A 、在体系中加入等体积0.10mol/L 的NaOH ,此时可组成Na 2HPO 4~Na 3PO 4缓冲溶液B 、在体系中加入等体积德0.10 mol/L 的HCl ,此时可组成Na 2HPO 4~NaH 2PO 4缓冲溶液 ③可用酸式盐体系求算:θθ32)(a a K K H c ⋅=+111381016.31010)(---+⨯=⨯=H cpH=-lg(3.16×10-11)=10.5④等体积0.10mol/L 的NaOH ,此时可组成Na 2HPO 4~Na 3PO 4缓冲溶液A 、决定溶液pH 的关键平衡过程为:OH HPO224+-+-+O H PO 334 B 、抗酸成分:-34PO ;抗碱成分:-24HPOC 、)/(05.0210.020.0)(24L mol VV V HPO c =⨯-⨯=-)/(05.0210.0)(34L mol V V PO c =⨯=- 根据盐酸c lg c pK pH a -=θ有:13)10(lg 0.0505.0lg 133=-=-=-θa pK pH ⑤等体积加入0.10mol.L -1HCl 后,---+=+Cl PO H HCl HPO 4224此时:)/(05.0210.020.0)(24L mol VV V HPO c =⨯-⨯=-)/(05.0210.0)()(42L mol V V HCl c PO H c =⨯==- 组成H 2PO 4-~HPO 42-缓冲溶液根据盐酸c lgc pK pH a -=θ有: 8)10(lg 0.0505.0lg 82=-=-=-θa pK pH ⑥等体积加入0.10mol.L -1HCl 后,---+=+Cl PO H HCl HPO 4224完全反应生成H 2PO 42,此时可用酸式盐计算:θθ21)(a a K K H c ⋅=+6831016.31010---⨯=⨯=pH=-lg(3.16×10-6)=5.5⑦等体积加入0.20mol/LNaOH 后,反应为:O H PO OH HPO 2344+=+---此时体系为多元弱酸盐体系Na 3PO 4O H PO234+---+OH HPO 24)(10.0220.0)()(134--⋅===L mol VV NaOH c PO c 1131431101010---===θθθa Wb K K K ∵500/)(134<-θb K POc ,所以可用求根公式计算:2)(4)()(34121--⋅++-=PO c K K K OH c b b b θθθ21.0104)10(101211⨯⨯++-=--- =0.0618(mol.L -1)pH=14-pOH=14-(-lg0.0618)=14-1.21=12.79P 1232、解:方法1: ∵1mol 的任何理想气体在标准状况下所占的体积都为22.4L , ∴11.2L 气体的)(5.04.222.113mol n NH == 配成1L 溶液,浓度为:)(5.01/5.01-⋅==L mol L mol c b∵500/>θb b K c ,可用近似公式计算:即:35)(1097.25.01077.1--⨯=⨯⨯=⋅=-b b OH c K c θ ∴ 47.111097.2lg 14143=⨯-=-=-pOH pH方法2: 标态下:10011.20.458.314298PVnRT n mol ⨯=⇒==⨯ 10.45/10.45b c mol L -∴==⋅∵500/>θb bK c ,可用近似公式计算: 即:35)(1082.245.01077.1--⨯=⨯⨯=⋅=-b b OH c K cθ ∴45.111082.2lg 14143=⨯-=-=-pOH pH3、解:①未加NH 4Ac 前,HAc 浓度为0.1mol/L ∵c(HAc)/K a θ>500,可用最简式计算: 溶液的HAca c K H ⋅=+θ][ =1.33×10-3 (mol/L)pH 1=2.87 电离度%1001.01033.1%100][][31⨯⨯=⨯=-+HAc H α = 1.33%②加入NH 4Ac , NH 4Ac 溶解后).(1.0177/7.7/][1444-===L mol VM W Ac NH AcNH Ac NH 此时组成HAc~NH 4Ac 混合溶液 溶液中[HAc]=0.1mol/L ,[A c -]=[NH 4Ac]=0.1mol/L依题意有: HAc H + + Ac -平衡时: 0.1-x x 0.1+x ]1.0[]1.0[][][][x x x HAc Ac H K a -+⋅=⋅=-+θ∵c(HAc)/K a θ>500且有大量的Ac -,产生同离子效应,故离解的x 很小,∴0.1-x ≈0.1+x ≈0.1 ∴[H +]=x= K a θ.0.1/0.1=1.78×10-5(mol/L)pH 2=4.75电离度%1001.01078.1%100][][52⨯⨯=⨯=-+HAc H α =0.0178%由计算结果可看出,加入NH 4Ac 后,因为产生同离子效应,使得HAc 的解离度降低,pH 值增大。
化工反应工程答案 第六章
6.多相系统中的化学反应与传递现象6.1、在半径为R 的球形催化剂上,等温进行气相反应⇔A B 。
试以产物B 的浓度C B 为纵座标,径向距离r 为横座标,针对下列三种情况分别绘出产物B 的浓度分布示意图。
(1) (1) 化学动力学控制 (2) (2) 外扩散控制(3) (3) 内、外扩散的影响均不能忽略图中要示出C BG ,C BS 及C Be 的相对位置,它们分别为气相主体、催化剂外表面、催化剂颗粒中心处B 的浓度,C Be 是B 的平衡浓度。
如以产物A 的浓度CA 为纵座标,情况又是如何?解(1)以产物B 的浓度为纵座标(2)以产物A 的浓度为纵座标6.2 已知催化剂颗粒外表面的气膜传热系数为117w/m 2K,气体的密度和热容分别为0.8kg/m 3和2.4J/kgK,试估算气膜的传质系数. 解:-=====⨯⨯=⨯=2/3321/(/)(/P r),/P r 1/117/0.8 2.410 6.09410/219.4/D H G p s c c G s p J J k C h S S k h C m s m hρρ又6.3 某催化剂,其真密度为3.60g/cm3,颗粒密度为1.65g/cm3,比表面积为100m2/g.试求该催化剂的孔容,孔隙率和平均孔半径. 解:=-=<>=<>====3(1),0.5422/,65.6/0.542/1.650.328/ p t p p a p r p a g p p r S r AV cm g ρρεεερερ由得由得由催化剂6.4 已知铁催化剂的堆密度为 2.7g/cm 3, 颗粒密度为 3.8 g/cm 3,比表面积为16m 2/g,试求每毫升颗粒和每毫升床层的催化剂表面积. 解:==2260.8/43.2/p g g S m m lS m m lρρb 每毫升颗粒的表面积=每毫升床层的表面积=6.5 试推导二级反应和半级反应的扩散有效因子表达式(6.23)和(6.24). 解:(1)二级反应,()()(()=-=-==-±=⎡⎤=-±⎣⎦=-2222222,,/2/1/21,/A w A S G m A G A S w A SG m ww A S w A G G m w A G w A G G m R k C k a C C k C k a k k C k C k a k C k C k a αηA Sx 由上解得:C按定义此即(6.23)式式中D a=(2)半级反应()(=-=-==-±==-+⎛=-+=+- ⎝⎭1/21/21/21/21/21/21/221/2,(),/2/(/2122A w A S G m A G A S w A SA S w G mw A S w A G w G m A GR k C k a C C k C C k k a k C k C k k a C D a D a D αηx 由上解得:按定义:-⎡+⎢=-⎢⎢⎣⎦⎡⎤⎛+⎢⎥ =-⎢⎥ ⎢⎥⎝⎣⎦=1/221/221/222212(6.24),:/w A G G mD a D a D a k C k a 此即式式中6.6 在充填ZnO-Fe2O3催化剂的固床反应器中,进行乙炔水合反应:+→++2223322232C H H O C H C O C H C O H已知床层某处的压力和温度分别为0.10Mpa,400℃,气相中C 2H 2含量为3%(mol),该反应速率方程为r=kC A ,式中C A 为C 2H 2的浓度,速率常数k=7.06×107exp(-61570/RT),h -1,试求该处的外扩散有效因子.数据:催化剂颗粒直径0.5cm,颗粒密度1.6g/cm 3,C 2H 2扩散系数7.3×10-5m 2/s,气体粘度2.35×10-5Pa ﹒s,床层中气体的质量流速0.2kg/m 2s. 解:由已知条件可得()()---=⋅=⨯⨯=⨯+⨯=+===⨯⨯⨯===-=⨯⨯2530.359552/370.24/R e 0.0050.24/2.351051.06260.03180.972730.3303/22.44002730.357/(R e )0.24852.3510/(0.33037.310)0.97460.1837/()615707.0610exp 8.314673D b c G Dc G kg m skg mj S Gk j m sS k ρερ()-⎡⎤= = ⎢⎥⎣⎦==⨯ ⋅⎡⎤=⨯=⎢⎥⎣⎦332221174.6/0.3263//0.203910/10.005/(0.005)16000.756w p m l h l s k k m kg s a m ρππ====+/0.0014810.99851w G m D a k k a D aπη6.7实验室管式反应器的内径2.1cm,长80cm ,内装直径6.35mm 的银催化剂进行乙烯氧化反应,原料气为含乙烯 2.25%(mol)的空气,在反应器内某处测得P=1.06×105Pa,T G =470K,乙烯转化率35.7%,环氧乙烷收率23.2%,已知+→ =-⨯ +→+ =-⨯ 42422412462422222419.6110/232 1.2510/C H O C H O H J m olC H C H O C O H O H J m olC H ∆∆颗粒外表面对气相主体的传热系数为58.3w/m 2K,颗粒密度为 1.89g/cm 3.设乙烯氧化的反应速率为 1.02×10-2kmol/kg ﹒h,试求该处催化剂外表面与气流主体间的温度差. 解:()-= ⋅⎛⎫-=-+--=⨯ ⎪⎝⎭= ⋅=⨯⋅⋅=== -=--= 512252223()10.2/23.223.2()()1 5.00110/35.735.758.3/ 2.09910/0.50/16()()/48.59A r s p pm p pp pg G A r s m R m ol kg h H H H J m ol h w m k J m K h S d a m kgV d T T R H h a Kπρπρ∆∆∆∆6.8 一级连串反应:−−→−−→12A B C在0.1Mpa 及360℃下进行,已知k 1=4.368 s -1,k 2=0.417 s -1,催化剂颗粒密度为1.3g/cm 3,(k G a m )A 和(k G a m )B 均为20cm 3/g ﹒s.试求当C BG /C AG =0.4时目的产物B 的瞬时选择性和外扩散不发生影响时的瞬时选择性.解:外扩散无影响时,由(6.35)式得:⨯'=-=0.41730.410.96184.368S外扩散有影响时,由(6.34)式得:⨯=-=+10.41730.4(1.168)0.940310.01605 4.368(1.01605)S上式中所用的 ====1122/0.168/0.01605a G m a G mk D k a k D k a ρρ6.9 在Pt/Al 2O 3催化剂上于200℃用空气进行微量一氧化碳反应,已知催化剂的孔容为0.3cm 3/g,比表面积为200m 2/g,颗粒密度为1.2g/cm 3,曲节因子为3.7.CO-空气二元系统中CO 的正常扩散系数为0.192cm 2/s.试求CO 在该催化剂颗粒中的有效扩散系数.(----=== ===≥=⨯⨯=⨯ ==⨯ 53822322/30,10,0.36/216.610,,:9.7103010 1.19610// 1.16410/ g g p g pa k k p V S A cm V r D cm sD e D cm sλερλετa 解:r 为努森扩散故有6.10 试推导球形催化剂的内扩散有效因子表达式(6.60). 解:==-=-+2222223,:1122A A AC u dC du u dr r drrd C d uduudr r dr r dr r 令可得用以上各式对教材中(6.55)式进行变量置换得:= =2222p d u b udrb k D e式中 (A)(A) (A) 式为二阶常系数齐次微分方程,边界条件:r=0 du/dr=0; r=R p u=C AS R p (B) 结合边界条件(B)式解(A)得:= sinh()()sinh()p A AS p R br C C C r bR有内扩散影响时的反应速率为:()=-= 24()pA A pr R dC R D e R D drπ()=⎛⎫-=- ⎪⎝⎭(),():114tanh pA r R A p s A S s s dC C D drR R C D e πφφφ由式求出代入式得 按内扩散有效因子的定义:⎛⎫⎛⎫=-=- ⎪ ⎪⎝⎭⎝⎭3411311()3tanh tanh 4p s A S s s s s s p p A S R C D e E R k C πφηφφφφφπ==s p pbR R φ式中==⎛⎫=- ⎪⎝⎭/3():111()tanh(3)3s E F φφηφφφ若令则式可改写为(F)即为教材(6.60)式,(E)式是(6.60)的又一形式.6.11 在球形催化剂上进行气体A 的分解反应,该反应为一级不可逆放热反应.已知颗粒直径为0.3cm,气体在颗粒 中有效扩散系数为 4.5×10-5m 2/h,颗粒外表面气膜传热系数为44.72w/m 2﹒K,气膜传质系数为310m/h,反应热效应为-162kJ/mol,气相主体A 的浓度为0.20mol/l,实验测得A 的表观反应速率为1.67mol/minl, 试估算:(1) (1) 外扩散阻力对反应速率的影响; (2) (2) 内扩散阻力对反应速率的影响; (3) (3) 外表面与气相主体间的温度差. 解:--=⋅=⨯⋅⨯⨯==⨯<*53331.67/m in 1.00210/(1)31.671060.8081100.150.2(310/60),.A A G GR m ol l m ol m h LC k *A判别外扩散阻力的影响用(6.79)式:R故仅从传质考虑外扩散影响可不计==*2(2)(6.82),:2.783s A s A GR LD eC φφ判别内扩散阻力的影响用式先求出====2,2.783,(6.60)3.1,0.288,s s φηφφφη因有从可借助式估算出由此可知内扩散阻力影响严重.(3)计算外表面与气相主体间温度差⊿Tm :=-=⋅⋅⋅*)/m G s A s T T T R h ∆∆r 颗粒体积(H 颗粒外表面积=50.4K6.12 在固体催化剂上进行一级不可逆反应→ ()A B A已知反应速率常数k,催化剂外表面积对气相的传质系数为k G a m ,内扩散有效因子η.C AG 为气相主体中组分A 的浓度. (1)试推导:()()-= +11A G A G mCR B k k a η(2)若反应式(A)改为一级可逆反应则相应的(B)式如何?解:(1)一级不可逆反应A B:()()()()-=-==+==+/1A G A GA S m G m A G G mA G G mR k C C a k k a C k k a C k k a kηηηηA SA SAA SC由上可解得:C 解得:-RC(2)一级可逆反应:A B()()()()()()()()-=-=+-+=+--=+-=++:11 A G m A G A S A SA e G m A G A eG m A G A S A A S A e G m R k a C C k kCC k a C kC k a k C C R k kC C k a k kηηηηηA S由解得:C则有6.13 在150℃,用半径100μm 的镍催化剂进行气相苯加氢反应,由于原料中氢大量过剩,可将该反应按一级(对苯)反应处理,在内,外扩散影响已消除的情况下,测得反应速率常数k p =5min -1, 苯在催化剂颗粒中有效扩散系数为0.2cm 2/s,试问:(1) (1) 在0.1Mpa 下,要使η=0.8,催化剂颗粒的最大直径是多少?(2) (2) 改在 2.02Mpa 下操作,并假定苯的有效扩散系数与压力成反比,重复上问的计算.(3) (3) 改为液相苯加氢反应,液态苯在催化剂颗粒中的有效扩散系数10-5cm 2/s.而反应速率常数保持不变,要使η=0.8,求催化剂颗粒的最大直径. 解:()==⎛⎫- ⎪ ⎪⎝⎭(1)0.107611tanh 33pd φηφφφ1由(6.60)式=用试差法从上二式可解得当η=0.8时,需d p <6.36cm(2)2.02Mpa 时,De ≈0.2×0.101/2.02=0.01 cm 2/s,与此相对应:==0.418pd φ同上法可求得当η=0.8时,需d p <1.42cm(3)液相反应时,De=1×10-6cm 2/s,与此相应的φ为21.51dp,同上法可求得当η=0.8时,需d p <0.0142cm.6.14 一级不可逆反应A B,在装有球形催化剂的微分固定床反应器中进行温度为400℃等温,测得反应物浓度为0.05kmol/m 3时的反应速率为 2.5 kmol/m 3床层﹒min ,该温度下以单位体积床层计的本征速率常数为k v =50s -1 ,床层孔隙率为0.3,A 的有效扩散系数为0.03cm 2/s,假定外扩散阻力可不计,试求:(1) (1) 反应条件下催化剂的内扩散有效因子 (2) (2) 反应器中所装催化剂颗粒的半径()===== --==-==⨯⨯ ⋅3171.43/18.13500.05/p v B B B vvvpB pA v A SV k V V V k k k l sV V V d R k C km ol s m εεφηηp p 解:k k 床层实验测得(-R A )=0.0417 kmol/s ﹒m 3床层, 解上二式得η=0.0167,可见内扩散影响严重.由η=1/φ=1/8.13dp=0.0167,可解出dp=7.38cm,即反应器所装催化剂的颗粒 半径为3.69cm.6.15 在0.10Mpa,530℃进行丁烷脱氢反应,采用直径5mm 的球形铬铝催化剂,此催化剂的物理性质为:比表面积120m 2/g,孔容0.35cm 3/g,颗粒密度1.2g/cm 3,曲节因子 3.4.在上述反应条件下该反应可按一级不可逆反应处理,本征反应速率常数为0.94cm 3/gs,外扩散阻力可忽略,试求内扩散有效因子.解:丁烷分子量为58,λ=10-5cm,<ra>=2Vg/Sg=58.3×10-8cm, λ/2<ra>=8.576,此值与10接近,故可近似扩散是以奴森扩散为主:--=⨯⨯=⨯22970058.3102.10410/k D cm s-==⨯==32/ 2.610/1.736k p m D e D cm sετφ由(6.60)式算得η=0.465.6.16 在固定床反应器中等温进行一级不可逆反应,床内填充直径为6mm 的球形催化剂,反应组分在其中的扩散系数为0.02cm 2/s,在操作温度下,反应式速率常数等于0.01min -1,有人建议改有3mm 的球形催化剂以提高产量,你认为采用此建议能否增产?增产幅度有多大?假定催化剂的物理性质及化学性质均不随颗粒大小而改变,并且改换粒度后仍保持同一温度操作.解:=======0.6,0.02887,0.9995,0.3,0.01444,0.9998p p d cm d cm φηφη故采用此建议产量的增加是很有限的.6.17 在V 2O 5/SiO 2催化剂上进行萘氧化制苯酐的反应,反应在 1.013×105Pa 和350℃下进行,萘-空气混合气体中萘的含量为0.10%(mol),反应速率式为:⎛⎫=⨯-⋅ ⎪⎝⎭50.381353603.82110exp ,/A Ar p km ol kg hR T式中PA 为萘的分压,Pa.已知催化剂颗粒密度为1.3g/cm 3,颗粒直径为0.5cm,试计算萘氧化率为80%时萘的转化速率(假定外扩散阻力可忽略),有效扩散系数等于3×10-3cm 2/s.解:因外扩散阻力可不计,故C AS ≈C AG ,()-= ⋅0.38/A p AGR k C km ol kg h η式中η由教材(6.66)式计算,为此先计算以下数据:--==⨯⎛⎫=⨯-⋅ ⎪⎝⎭⎛⎫ =⨯-⋅ ⎪⎝⎭13250.3850.383/12,310/,1353603.8210exp /1353603.8210exp /p p p A G p A Ga V cmD e cm s k p km ol kg hR T p km ol m h R T ρA 的值由:r 颗粒 将此P AG =C AG RT,ρp =1300kg/m 3颗粒,T=(350+273)K 代入上式,并将小时换为秒计则得:-=⨯⋅40.3832.19610/A AG r C km ol m s 颗粒 由上式得 k p =2.196×10-4又:C AS =C AG =P AG /RT=105×0.1%(1-0.8)/(8314×623)=3.861×10-6 kmol/m 3 将有关数值代入(6.66)式得:()()()()--=====⨯==⨯⎰⎰⎰1/20.3831/20.381/24]1.12:8.76910[][]1.566310A S A CA S A CA S C A A C C A S A G A GA A C C A A a f C dC f C f C C f C dC C dC η式中最后得萘氧化率为80%时的萘的转化速率为:()--==⨯⋅0.38632.15710/A p AGR k C km ol m sη颗粒6.18 乙苯脱氢反应在直径为0.4cm 的球形催化剂上进行,反应条件是0.10Mpa,600℃,原料气为乙苯和水蒸汽的混合物,二者摩尔比为1:9,假定该反应可按拟一级反应处理.⎛⎫''= =-⋅⋅ ⎪⎝⎭913000.1244exp ,/wE B w r k p k km ol kg h Pa R T 苯乙烯(1)当催化剂的孔径足够大,孔内扩散属于正常扩散,扩散系数D’=1.5×10-5m 2/s, 试计算内扩散有效因子.(2)当催化剂的平均孔径为100Å时,重新计算内扩散有效因子. 已知:催化剂颗粒密度为1.45g/cm 3,孔率为0.35,曲节因子为3.0. 解:为计算内扩散有效因子,先求取K p := ⋅= ⋅3//EB p EB r kp km ol kg h k p km ol m hρ由颗粒将 P E B =RTC E B ,T=(600+273)代入上式得:=⨯ ⋅= ⋅3334.50810/ 1.252/BE EB r C km ol m h C km ol m s 颗粒颗粒 由此得K p =1.252 s -1(1) (1) 孔径足够大,属正常扩散时,-==⨯ 62/ 1.7510/p m De D m sετ由此求得Φ=0.564,由(6.60)式算得η=0.85(2) (2) 孔半径为100Å时:λ/2<ra>=10-5/200×10-8=5,属于过渡区扩散,由教材(6.36)式可算得乙苯的Dk=2.784×10-2cm 2/s.--==⨯+⨯2221 2.34810/112.784100.15D cm s--==⨯=⨯32722.73910/ 2.73910/pmD D e cm s m sετ由上数据可算得φ=1.425,由教材(6.60)式算得η=0.5286.19 苯(B)在钒催化剂上部分氧化成顺酐(MA),反应为:这三个反应均为一级反应.实验测得反应器内某处气相中苯和顺酐的浓度分别为 1.27%和0.55%(均为mol%),催化剂外表面温度为623K,此温度下,k1=0.0196 s -1,k2=0.0158 s -1,k3=1.98×10-3 s -1,苯与顺酐的k G a m 均为 1.0×10-4m 3/skg.催化剂的颗粒密度为1500kg/m 3,试计算反应的瞬间选择性并与外扩散无影响时的瞬时选择性相比较.解:()()---==⨯=⨯=⨯⋅====-=+ 55512332312/ 1.30710, 1.05310,0.13210/./0.1307,0.1053,0.0132),w p w w w w G m a a m B G B S w w B S k k k k k m kg s D a k k a D D A a C C k k C ρa12G 由可算出单位均为由可算得D为简化起见以表示顺酐,C 表示(C O +C O 由教材(6.18)式可写出:k ()()(A )-= - (B )-= - (1223)m A S A G w B S w A S m C S C G w A S w B S a C C k C k C a C C k C k C C G G k k=++=+++++1221121(1)/(1)(2)/(1)/[(1)(1)]B S B G a a A s A G a a B G a a a C C D D C C D D C D D D 由得由得 有外扩散影响时的瞬时选择性:()()()()()=-+⎡⎤⎡⎤++=-+⎢⎥⎢⎥++++++⎣⎦⎣⎦⎡⎤++=-+⎢⎥++++⎣⎦=1213121131313213212131131322/1111(1)110.4742w B S w A S w w B Sw w A G a B G a a w w w w a a a a B G w w a a A G a w w w w a B G a S k C k C k k C k k C D C D D k k k k D D D D C k k D D C D k k k k D C D 无外扩散影响时的瞬时选择性:'=-=++1213130.5726w w C G w w w w B G k k C S k k k k C6.20 原题见教材,今补充如下:实验测得A 的气相浓度为1.68×10-5mol/cm 3时的反应速率为1.04×10-5(mol/cm 3床层﹒s).解:已知 ()---=⨯-=⨯ ⋅*5531.0410/(10.4) 1.73310/AR m ol cm s 颗粒若不计外扩散阻力,则C AS =C AG =1.68×10-5mol/cm 3 由教材312页: ()=-*2/s A AG R L DeC φL=dp/6=0.04cm,可算得s φ=0.1375,由(6.82)式=2sφφη,将此式与(6.60)式用试差法联立求解可得:φ=0.387 η=0.92。
(完整版)有机化学练习题以及答案-全选择(最新整理)
有机化学各章习题及答案第一章绪论1.在下列化合物中,偶极矩最大的是( )A.CH3CH2ClB. H2C=CHClC. HC≡CCl2.根据当代的观点,有机物应该是( )A.来自动植物的化合物B. 来自于自然界的化合物C. 人工合成的化合物D. 含碳的化合物3.1828 年维勒(F. Wohler)合成尿素时,他用的是( )A.碳酸铵B. 醋酸铵C. 氰酸铵D. 草酸铵4.有机物的结构特点之一就是多数有机物都以( )A.配价键结合B. 共价键结合C. 离子键结合D. 氢键结合5.根椐元素化合价,下列分子式正确的是( )A.C6H13B. C5H9Cl2C. C8H16OD. C7H15O6.下列共价键中极性最强的是( )A.H-CB. C-OC. H-OD. C-N7.下列溶剂中极性最强的是( )A.C2H5OC2H5B. CCl4C. C6H6D. CH3CH2OH8.下列溶剂中最难溶解离子型化合物的是( )A.H2OB. CH3OHC. CHCl3D. C8H189.下列溶剂中最易溶解离子型化合物的是( )A.庚烷 B. 石油醚 C. 水 D. 苯10.通常有机物分子中发生化学反应的主要结构部位是( )A.键B. 氢键C. 所有碳原子D. 官能团(功能基)第二章烷烃1.在烷烃的自由基取代反应中,不同类型的氢被取代活性最大的是( )A.一级B. 二级C. 三级D. 那个都不是2.氟、氯、溴三种不同的卤素在同种条件下,与某种烷烃发生自由基取代时,对不同氢选择性最高的是( )A.氟B. 氯C. 溴D.3.在自由基反应中化学键发生( )A.异裂B. 均裂C. 不断裂D. 既不是异裂也不是均裂4.下列烷烃沸点最低的是( )A.正己烷B. 2,3-二甲基戊烷C. 3-甲基戊烷D. 2,3-二甲基丁烷5.在具有同碳原子数的烷烃构造异构体中,最稳定的是( )的异构体( )A.支链较多B. 支链较少C. 无支链6.引起烷烃构象异构的原因是( )A.分子中的双键旋转受阻B. 分子中的单双键共轭C. 分子中有双键D. 分子中的两个碳原子围绕C-C 单键作相对旋转7.将下列化合物绕C-C 键旋转时哪一个化合物需要克服的能垒最大( )A.CH2ClCH2BrB. CH2ClCH2IC. CH2ClCH2ClD. CH2ICH2I8.ClCH2CH2Br 中最稳定的构象是( )A.顺交叉式B. 部分重叠式C. 全重叠式D. 反交叉式9.假定甲基自由基为平面构型时,其未成对电子处在什么轨道( )A.1sB. 2sC. sp2D. 2p10.下列游离基中相对最不稳定的是( )A.(CH3)3C.B. CH2=CHCH2.C. CH3.D. CH3CH2.11.构象异构是属于( )A.结构异构B. 碳链异构C. 互变异构D. 立体异构12.下列烃的命名哪个是正确的?( )A、乙基丙烷 B. 2-甲基-3-乙基丁烷C. 2,2-二甲基-4-异丙基庚烷D. 3-甲基-2-丁烯13.下列烃的命名哪个不符合系统命名法?( )A.2-甲基-3-乙基辛烷 B. 2,4-二甲基-3-乙基己烷C. 2,3-二甲基-5-异丙基庚烷D. 2, 3, 5-三甲基-4-丙基庚烷14.按沸点由高到低的次序排列以下四种烷烃① 庚烷②2,2-二甲基丁烷③己烷④ 戊烷( )A. ③>②>①>④B. ①>③>②>④C. ①>②>③>④D. ①>②>③>④15.异己烷进行氯化,其一氯代物有几种?( )A.2 种B. 3 种C. 4 种D. 5 种16.化合物的分子式为C5H12一元氯代产物只有一种,结构式是( )A.C(CH3)4 B. CH3CH2CH2CH2CH3C. (CH3)2CHCH2CH317.下列分子中,表示烷烃的是( )A.C2H2B. C2H4C. C2H6D. C6H618.下列各组化合物中,属同系物的是( )A.C2H6和C4H8B. C3H8和C6H14C. C8H18和C4H10D. C5H12和C7H1419.甲烷分子不是以碳原子为中心的平面结构,而是以碳原子为中心的正四面体结构,其原因之一是甲烷的平面结构式解释不了下列事实( )A.CH3Cl 不存在同分异构体B. CH2Cl2不存在同分异构体C.CHCl3不存在同分异构体D. CH4是非极性分子20.甲基丁烷和氯气发生取代反应时,能生成一氯化物异构体的数目是( )A.1 种B. 2 种C. 3 种D. 4 种21.实验室制取甲烷的正确方法是( )A.醇与浓硫酸在170℃条件下反应B. 电石直接与水反应C. 无水醋酸钠与碱石灰混和物加热至高温D. 醋酸钠与氢氧化钠混和物加热至高温第三章烯烃1.在烯烃与HX 的亲电加成反应中,主要生成卤素连在含氢较( )的碳上( )A.好B. 差C. 不能确定2.烯烃双键碳上的烃基越多,其稳定性越( )A.好B. 差C. 不能确定3.反应过程中出现碳正离子活性中间体,而且相互竟争的反应是( )A.SN2 与E2B. SN1 与SN2C. SN1 与E14.碳正离子a.R2C=CH-C+R2、b. R3C+、c. RCH=CHC+HR 、d. RC+=CH2稳定性次序为( )A.a>b>c>dB. b>a>c>dC. a>b≈c>dD. c>b>a>d5.下列烯烃发生亲电加成反应最活泼的是( )A.(CH3)2C=CHCH3 B. CH3CH=CHCH3 C. CH2=CHCF3 D. CH2=CHCl36.下列反应中间体的相对稳定性顺序由大到小为( )A. +CH +B.CH CH3C.CHCH233CH 3 + C CH3CH3A. A>B>CB. A>C>BC. C>B>AD. B>C>A7.1-己烯、顺-3-己烯和反-3-己烯三者相对稳定性的次序是( )+A. 反-3-己烯>顺-3-己烯>1-己烯B. 1-己烯>顺-3-己烯>反-3-己烯C. 顺-3-己烯>1-己烯>反-3-己烯8. 在烯烃与 HX 的加成反应中,反应经两步而完成,生成( )的一步是速度较慢的步骤( )A. 碳正离子B. 碳负离子C. 自由基9. 分子式为 C 5H 10 的烯烃化合物,其异构体数为 ( )A. 3 个B. 4 个C. 5 个D. 6 个10. 在下列化合物中,最容易进行亲电加成反应的是 ( )A.CH 2=CHCH=CH 2B.CH 3CH=CHCH 3C.CH 3CH=CHCHOD.CH 2=CHCl11. 马尔科夫经验规律应用于 ( )A. 游离基的稳定性B. 离子型反应C. 不对称烯烃的亲电加成反应D. 游离基的取代反应12. 下列加成反应不遵循马尔科夫经验规律的是 ( )A. 丙烯与溴化氢反应B. 2-甲基丙烯与浓硫酸反应C. 2-甲基丙烯与次氯酸反应D. 2-甲基丙烯在有过氧化物存在下与溴化氢反应13. 若正己烷中有杂质 1-己烯,用洗涤方法能除去该杂质的试剂是 ( )A. 水B. 汽油C. 溴水D. 浓硫酸14. 有一碳氢化合物 I ,其分子式为 C 6H 12 ,能使溴水褪色,并溶于浓硫酸,I 加氢生成正己烷,I 用过量 KMnO 4 氧化生成两种不同的羧酸,试推测 I 的结构 ( ) A. CH 2=CHCH 2CH 2CH 2CH 2 B. CH 3CH=CHCH 2CH 2CH 3C. CH 3CH 2CH=CHCH 2CH 3D. CH 3CH 2CH=CHCH=CH 215. 下列正碳离子中,最稳定的是 ( )A. +CH 3 B.CH 3+CH 3 C.CH 3CH 3CH 3+D.CH 2 CH 316. 具有顺反异构体的物质是 ( )A.CH3CH C CO2HCH3B.CH3CH C CH3CH3C.CH3C CHCH2CH3 D.H2C CH2CH317.分子式为C4H8的烯烃与稀、冷KMnO4溶液反应得到内消旋体的是( )A.CH2 CHCH2CH3B. CH2C(CH3)2C. CH3C CHCH3HD. CH3HHC CCH318.下列反应进行较快的是( )CH3Cl KOH/C2H3OHCH3CH3B.CH KOH/C2H3OHCH3A.CH3 3ClCH3CH3 19.下列化合物稳定性最大的是( )A.H3C CH2H3CCH3CH3C. H3C CH3D. H3C CH3第四章炔烃和二烯烃1.在含水丙酮中,p-CH3OC6H4CH2Cl 的水解速度是C6H5CH2Cl 的一万倍,原因是( )A.甲氧基的-I 效应B. 甲氧基的+E 效应C. 甲氧基的+E 效应大于-I 效应D. 甲氧基的空间效应2.下列化合物中氢原子最易离解的为( )A.乙烯B. 乙烷C. 乙炔D. 都不是3.二烯体1,3-丁二烯与下列亲二烯体化合物发生Diels-Alder 反应时活性较大的是( )A.乙烯B. 丙烯醛C. 丁烯醛D. 丙烯4.下列化合物中酸性较强的为( )B.3 2 A. 乙烯 B. 乙醇 C. 乙炔 D. H 25. 在 CH 3CH=CHCH 2CH 3 化合物的自由基取代反应中, ( )氢被溴取代的活性最大A. 1-位B. 2-位及 3-位C. 4-位D. 5-位6. 下列物质能与 Ag(NH ) +反应生成白色沉淀的是 ( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔7. 下列物质能与 Cu 2Cl 2 的氨水溶液反应生成红色沉淀的是 ( )A. 乙醇B. 乙烯C. 2-丁炔D. 1-丁炔8. 以下反应过程中,不生成碳正离子中间体的反应是 ( )A. SN1B. E1C. 烯烃的亲电加成D. Diels-Alder 反应9. 在 sp 3, sp 2, sp 杂化轨道中 p 轨道成分最多的是( )杂化轨道( )A. sp 3B. sp 2C. sp10. 鉴别环丙烷,丙烯与丙块需要的试剂是 ( )A. AgNO 3 的氨溶液;KMnO 4 溶液B. HgSO 4/H 2SO 4; KMnO 4 溶液C. Br 2 的 CCl 4 溶液;KMnO 4 溶液D. AgNO 3 的氨溶液11. 结构式为 CH 3CHCICH=CHCH 3 的化合物其立体异构体数目是 ( )A. 1B. 2C. 3D. 412. 1-戊烯-4-炔与 1 摩尔 Br 2 反应时,预期的主要产物是 ( )A. 3,3-二溴-1-戊-4-炔B. 1,2-二溴-1,4-戊二烯C. 4,5-二溴-2-戊炔D. 1,5-二溴-1,3-戊二烯13. 某二烯烃和一分子溴加成结果生成 2,5-二溴-3-己烯,该二烯烃经高锰酸钾氧化得到两分子乙酸和一分子草酸,该二烯烃的结构式是 ( ) A. CH 2=CHCH=CHCH 2CH 3 B. CH 3CH=CHCH=CHCH 3C. CH 3CH=CHCH 2CH=CH 2D. CH 2 =CHCH 2CH 2CH=CH 214. 下列化合物无对映体的是 ( )H 3H A.B. H 3C CH C CH CH 3 H 3CH 33H 7C. H 5C 6CH C CHC HD. H 5C 6 N 3 I -6 5C 2H 515. 下列炔烃中,在 HgSO 4-H 2SO 4 的存在下发生水合反应,能得到醛的是( )A. CH 3 C C CH 3B. CH 3CH 2CH 2 C CHC. CH 3 C CHD. HC CH16. 一化合物分子式为 C 5H 8,该化合物可吸收两分子溴,不能与硝酸银的氨溶液作用,用过量的酸性高锰酸钾溶液作用,生成两分子二氧化碳和一分子丙酮酸推测该化合物的结构式( )A. CH 3C CCH 2CH 3C. CH 2 CHCH CHCH 3B. HC C CHCH 3CH 3D. H 2C C CH CH 2CH 317. 下面三种化合物与一分子 HBr 加成反应活性最大的是( )A. PhCH CH 2B. p O 2NC 6H 4CH CH 2C. p CH 3C 6H 4CH CH 2第五章 环烷烃1. 环已烷的所有构象中最稳定的构象是 ( )A. 船式B. 扭船式C. 椅式2. A. 环丙烷、B. 环丁烷、C. 环己烷、D. 环戊烷的稳定性顺序 ( )A. C>D>B>AB. A>B>C>DC. D>C>B>AD. D>A>B>C3. 下列四种环己烷衍生物其分子内非键张力(Enb )从大到小顺序应该( )3 3A. (CH 3)3CC.C(CH 3)3CH 33B. (CH ) C CH 3CH 3D.C(CH 3)3A. A >B >C >DB. A >C >D >BC. D >C >B >AD. D >A >B >C4. 1,3-二甲基环己烷不可能具有 ( )A. 构象异构B. 构型异构C. 几何异构D. 旋光异构5. 环烷烃的环上碳原子是以哪种轨道成键的?( )A. sp 2 杂化轨道B. s 轨 道C. p 轨道D. sp 3 杂化轨道6. 碳原子以 sp 2 杂化轨道相连成环状,不能使高锰酸钾溶液褪色,也不与溴加成的一类化合物是( )A. 环烯烃B. 环炔烃C. 芳香烃D. 脂环烃7. 环烷烃的稳定性可以从它们的角张力来推断,下列环烷烃哪个稳定性最差? ( )A. 环丙烷B. 环丁烷C. 环己烷D. 环庚烷8. 单环烷烃的通式是下列哪一个? ( )A. C n H 2nB. C n H 2n+2C. C n H 2n-2D. C n H 2n-6 9. 下列物质的化学活泼性顺序是①丙烯②环丙烷③环丁烷④丁烷 ( )A. ①>②>③>④B. ②>①>③>④C. ①>②>④>③D. ①>②>③=④10. 下列物质中,与异丁烯不属同分异构体的是 ( )A. 2-丁烯B. 甲基环丙烷C. 2-甲基-1-丁烯D. 环丁烷CH 3 11.CH 2CH 3的正确名称是 ( )HHA. 1-甲基-3-乙基环戊烷B. 顺-1-甲基-4-乙基环戊烷C CH 3 C. 反-1-甲基-3-乙基戊烷D. 顺-1-甲基-3-乙基环戊烷12. 环己烷的椅式构象中,12 个 C-H 键可区分为两组,每组分别用符号( )表示 ( )A. α与βB. σ与πC. a 与 eD. R 与 S13. 下列反应不能进行的是( )CH 3 A.+ KMnO 4/H +B. + H 2Ni¸ß ÎÂC.+ Br 2D.+ KMnO 4/H 3O +14. 下列化合物燃烧热最大的是 ( )A.B.C.D.15. 下列物质与环丙烷为同系物的是 ( )CH 3 A. CH 3CHB.C. D.16. 1,2-二甲基环己烷最稳定的构象是 ( )HH 3CCH 3A.CH 3CH 3 B.C.D. H 3CHH3CH 317. 下列 1,2,3-三氯环己烷的三个异构体中,最稳定的异构体是 ( )ClA. B. C. Cl ClClCl ClCl ClCl第六章 对映异构1. 下列物质中具有手性的为( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章有机反应活性中间习题答案
6-1 解(ⅰ)芳烃的亲电取代反应,活性中间体为σ络合物,即离域的碳正离子(ⅱ)S N1反应,有重排产物。
有两种碳正离子,
(ⅲ) E1cb反应,活性中间体为碳负离子。
(ⅳ)芳环的亲核取代反应,消除-加成历程,活性中间体为为苯炔。
(ⅴ)霍夫曼重排反应,活性中间体为酰基氮烯即乃春。
6-2解(ⅰ)c>b>a
(ⅱ)a>c>d>b>e
6-3 解根据反应条件和反应物与产物对比,该反应是醇在酸的作用下的脱水反应。
反应是E1反应,有活性中间体碳正离子。
反应有碳骼的变化,说明反应过程中发生了碳正离子的重排。
历程如下:
6-4解(ⅰ)考察2-甲基吡啶和3-甲基吡啶的共轭碱,共轭碱稳定的,则碱性弱,其共轭酸的酸性则强。
2-甲基吡啶的α-H在强碱的作用下生成的碳负离子具有如下共振结构:
N的电负性比C大,负电荷在N上,共振式较稳定。
3-甲基吡啶的α-H在强碱的作用下生成的碳负离子具有如下共振结构:
所有共振式的负电荷都在C上。
上述分析说明2-甲基吡啶的α位的负离子比3-甲基吡啶的α位的负离子稳定,碱性弱,共轭酸的酸性则强。
(ⅱ)用杂化效应解释。
中氧SP2杂化,是SP3杂化。
SP2杂化S的成分较多,氧上的未共用电子对在SP2杂化轨道中,离核较近,氧对未共用电子对
的吸引力较大,未共用电子对质子的吸引力较小,酸性比
强。
6-5解
反应产物为:
反应历程:
3-甲基吡啶不能发生上面的反应。
6-6解(ⅰ)c>b>a>d
(ⅱ) b>c>a 它们的离解能分别是163.2kJ/mol 、200.8 kJ/mol、330.5 kJ/mol。
6-7 解反应产物:
反应的可能历程:
6-8 解
(ⅰ)
(ⅱ)
6-9 解苯炔中的叁键碳原子仍为杂化状态,叁键的形成基本上不影响苯环中离域的π体系,苯环的稳定性保持不变,而新的“π键”是由两个杂化轨道,在环平面内,侧面交盖而形成很弱的键,如(1)所示。
这样的结构是与苯炔高度的化学活性一致的,也是经物理方法所证实的。
在(2)中,两个叁键碳原子处于SP杂化状态,各以一个SP杂化轨道交盖形成一个σ键,又各以两个P轨道交盖形成两个π键,一个π键垂直于苯环平面,另一个π键平行于苯环平面。
这样的碳-碳叁键是线型结构,键角180O。
叁键碳原子的SP
杂化轨道与环中其它碳原子的杂化轨道交盖成键时张力太大,而且也破坏了苯环的结构。
显然这种结构是不大可能的。
6-10
解(ⅰ)苯炔的亲核加成,产物为
(ⅱ),苯炔的亲电加成,产物为
(ⅲ)苯炔的环加成,产物为。
