14化学热力学基础
化学热力学基础

Qp = ΔU +Δ (pV) = (U2 - U1) +p(V2 -V1) = (U2 + p2V2) - (U1 + p1V1)
ΔH 称为焓变。ΔH > 0,表明体系从环境吸热; ΔH < 0, 表明体系向环境放热。
4பைடு நூலகம்
1、“焓”不是系统所含的热量。QP与ΔH只是数值上相等, QP不是状态函数,而ΔH是状态函数 。 特别提醒
恒压过程、恒容过程,绝热过程和循环过程。
2
途径
完成这一过程的具体步骤。
4、热与功
体系与环境之间因为温度差而进行的能量交换形式。 热(Q) 体系从环境吸热:Q > 0 ;体系向环境放热:Q < 0 特点:不是状态函数 体系与环境之间除热以外的其它能量交换形式。
功(W)
环境对体系做功:W > 0 ;体系对环境做功:W < 0
7
对于任意的化学反应:aA + bB = gG + dD 标准摩尔反应焓变 rHm = H = g fHm(G)+ d fHm(D)- a fHm(A)- b fHm(B)
标准摩尔燃烧焓变 C H m
Θ
1mol纯物质在标准状态和指定温度下完全燃烧时的标准焓变。 完全燃烧是指C、H、N、S等分别被氧化为CO2(g)、H2O(l)、N2(g)、SO2(g) 。 规定:完全燃烧产物的 CHm= 0 。即: CHm(CO2,g) = CHm(H2O,l) = CHm(N2,g)= CHm(SO2,g) = CHm(O2,g) = 0 对于任意的化学反应:aA + bB = gG + dD rHm = H = a CHm(A)+ b CHm(B)- g CHm(G)- d CHm(D)
化学热力学基础

W = pΔV
第2章 化学热力学基础
§2.1 热力学第一定律
例:圆筒内装有理想气体,其截面积为 A,圆桶 上有活塞,外压为 p,有一热源使气体膨胀,把活塞 推出ΔL,问系统对外作功多少?
解: -WFΔL
因为 p F ,所以 F = pA A
代入上式 -W = pAL= pV= p(V2-V1) W = -pV (求体积功的公式)
第2章 化学热力学基础
§2.1 热力学第一定律
难点:
1、盖斯定律的运用,标准摩尔生成热的含义以及 化学反应热效应的计算;
2、熵的含义、熵值大小的一般规律、标准摩尔熵 的含义及化学反应熵变的计算,熵判断化学反 应进行方向的判断原则及适用条件;
3、吉布斯自由能的含义、标准摩尔吉布斯自由能 的含义以及化学反应吉布斯自由能变的计算, 吉布斯自由能判断化学反应进行方向的判断原 则及适用条件。
§2.2 热化学
反应热的测量: 弹式量热计:
弹式量热计适用于气体以及有机化合物的燃烧 反应。测得的反应热是恒容反应热QV。
杯式量热计: 适用于测量恒压热效应Qp ,如液相反应的反应
热,溶解热,中和热等。
第2章 化学热力学基础
§2.2 热化学
3、反应进度概念
(1) 定义
n B n B 0 ν B ξ
第2章 化学热力学基础
§2.2 热化学
正、逆反应的 H值大小相等,符号相反
H2(g)
+
1 2
O2(g) → H2O(l)
ΔrHm285.m 8 k o 1 Jl
H2O(l)
→
H2(g)
+
1 2
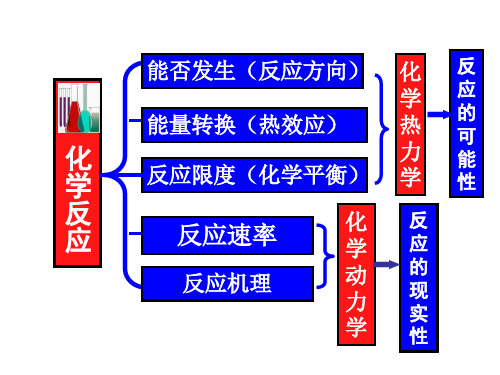
热力学基础、动力学基础、化学平衡知识要点

热力学基础、动力学基础、化学平衡知识要点—大众化学补充一、热力学基础(研究化学反映方向、程度(进行的可能性),反映涉及的能量) 对于化学反映:其中B ν为物质B 的化学计量数。
反映物的化学计量数为负,产物的化学计量数位正。
反映进度: 单位为mol.反映进度必需对应的化学计量方程式。
热和功1.2.1热---系统与环境之间由于存在温差而传递的能量。
系统吸热:Q >0; 系统放热:Q <0。
功---系统与环境之间除热之外以其它形式传递的能量;系统对环境做功,W <0(失功);环境对系统做功,W >0(得功)。
功的分类:体积功(膨胀功)、非体积功(如表面功、电功)。
1.2.2热力学第必然律: 焓: 1.3.1反映的标准摩尔焓变:r △,一个反映的焓变必需对应的化学计量方程式。
标准状态:气体:T ,p =100kPa ;液、固体:T ,1个大气压下,纯物质;溶液:溶质B ,b B =1mol·kg -1,,C B =1mol·L -1,1.3.2 f H △(B,相态,T ),单位是kJ·mol -1:在温度T 下,由参考状态单质生成物质B(νB =+1)的标准摩尔焓变,称为物质B 的标准摩尔生成焓。
参考态单质的标准摩尔生成焓为零。
1.3.3 c △相态,T ),单位是kJ·mol -1:在温度T 下, 物质B (νB = -1)完全氧化成指定产物时的标准摩尔焓变,称为物质B 的标准摩尔燃烧焓。
燃烧产物和O2的标准摩尔燃烧焓均为零。
1.3.4 Hess 盖斯定律:化学反映无论是一步完成仍是分几步完成,其反映焓变老是相同的对于化学反映:a A + b B → y Y + z Zr △T ) = ∑νBf H △:焓变=生成物的生成焓之和—反映物的生成焓之和;r △T ) =- ∑νB焓变=反映物的燃烧焓之和—生成物的燃烧焓之和; 自发转变:在没有外界(即没有非体积功)作用下,系统自身发生转变的进程。
化学热力概论20140208

A
(状态 函数) Ⅱ (过程量)
B
(状态 函数)
Ⅰ和Ⅱ的过程量一般不同:QⅠ≠ QⅡ, WⅠ≠ WⅡ Ⅰ和Ⅱ的状态函数变化相同:YⅠ= YⅡ
课堂练习
1. 均是强度性质的一组是:(
B)
A. P﹑U﹑T﹑
C. P﹑T﹑m﹑ A. m﹑V﹑H﹑U C. H﹑m﹑﹑C
B. P﹑T﹑﹑
液相
§1-1 热力学概论
二、热力学状态函数
(一)状态函数的概念
2.状态函数: 用来描述系统状态的物理量。 如:m、T、P、V、U、H、S、G (T、P、V可直接测量) 3.状态函数的分类:
容量性质(广延性质):与n成正比,有加和性。 例如m,V,U,H; 强度性质:与n无关,无加和性。 例如T,p,Vm,
ቤተ መጻሕፍቲ ባይዱ
函数的方法,建立物质体系平衡的热力学函数及函数间
的定量关系,不涉及物质的微观结构。 化学热力学研究以下问题,如: N2 (g) + 3H2(g) = 2 NH3 (g) 1.反应的方向(△rGm ø ﹤0 ) 2.反应过程的能量转换——放热?吸热?( △rHm﹤0,放 热; △rHm﹥0,吸热)
第一章 化学热力学基础
§1-1 热力学概论
一、热力学系统
1. 定义:系统——研究对象(也称体系)
环境——与系统有相互影响的外界
例如,研究结晶硫酸铜 的溶解过程时,可将结 晶硫酸铜和水溶液作为 系统,环境就是三角瓶 及瓶外的周围物质
敞开系统 封闭系统 孤立系统
开放系统 有物质和 能量交换
封闭系统 只有能量 交换
孤立系统 无物质和 能量交换
D. V﹑T﹑﹑H B. m﹑V﹑﹑C D. U﹑T﹑P﹑V
化学热力学的基本定律

化学热力学的基本定律化学热力学是研究化学反应中热现象的科学,它揭示了物质在化学反应中的热变化规律。
在化学热力学的研究中,有一些基本定律被广泛应用,帮助我们理解和预测化学反应中的热现象。
本文将介绍化学热力学中的基本定律,包括热力学第一定律、热力学第二定律和熵增定律。
热力学第一定律是热力学的基本定律之一,也称为能量守恒定律。
它表明在一个系统中,能量的总量是守恒的,能量既不能被创造也不能被毁灭,只能从一种形式转化为另一种形式。
热力学第一定律的数学表达式为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做功。
根据热力学第一定律,系统吸收的热量等于系统内能的增加与对外界所做的功之和。
热力学第一定律的一个重要应用是热力学循环的分析。
在热力学循环中,系统经历一系列的热力学过程,最终回到初始状态。
根据热力学第一定律,整个热力学循环中系统的内能变化为零,即ΔU = 0。
这意味着系统在一个完整的热力学循环中,吸收的热量等于对外界所做的功,系统的总能量保持不变。
热力学第二定律是热力学中另一个重要的定律,也称为熵增定律。
热力学第二定律表明在一个孤立系统中,熵永远不会减少,只会增加或保持不变。
熵是描述系统无序程度的物理量,熵增定律可以解释为自然趋向于混乱的方向。
热力学第二定律还提出了热力学不可逆过程的概念,即在不可逆过程中系统的总熵必定增加。
熵增定律对于化学反应的方向和速率有着重要的影响。
在化学反应中,如果系统的总熵增加,那么这个反应是自发进行的;反之,如果系统的总熵减少,那么这个反应是不自发进行的。
通过熵增定律,我们可以预测化学反应的进行方向,以及了解反应的自发性和不可逆性。
除了热力学第一定律和热力学第二定律外,熵增定律也是化学热力学中的重要定律之一。
熵增定律指出在一个孤立系统中,熵的总变化永远大于等于零,即ΔS ≥ 0。
这意味着孤立系统中的熵永远不会减少,只会增加或保持不变。
熵增定律也可以解释为自然趋向于混乱的方向,系统总是倾向于朝着熵增加的方向发展。
化学热力学基础
Q 和W 都不是状态函数
体积功
体积功是体系在反抗外压发生体积变 化时而引起的体系与环境间能量的传递。 W体= p外ΔV
p内 P内 ΔV
P外 p外
第二节 热力学第一定律和热化学
热力学第一定律
能量只能从一种形式转化为另一种形式,从一个 物体传递给另一个物体,但在转化和传递过程中,能 量的总数量不变。 它的另一种表达形式就是:不供给能量而连续不 断的对外做功的第一类永动机是不可能造成的。
CaCO3 (方解石)
CaO(s)+ CO2(g)
△ rH m
CaO(s)+ CO2(g)
Ca(s)+ C (石墨)+ O2
标准生成焓
温度T下,由标准态的各元素的稳定单质生成 标准态下1mol某纯物质的热效应称为该物质的标 准摩尔生成焓(standard molar enthalpy of formation)简称标准生成焓。
example
例:2H2(g)+O2(g)=2H2O(g)
△rHm(298.15K)=-483.6 kJ· -1 mol H2(g)+1/2O2(g)=H2O(g)
△rHm(298.15K)=-241.8 kJ· -1 mol
标准摩尔生成焓和标准摩尔燃烧焓
CaCO3 (方解石) Qp =△rH=H2 - H1 =∑H(生成物) - ∑H(反应物)
练习题 求H2O(l)→H2O(g) ΔrHm
ΔfHm
1 查表: H2(g) + O2(g) = H2O(l) 2
H2O(l) = -285.8 kJ· -1 mol
1 H2(g) + O2(g) = H2O(g) 2
ΔfHm H2O(g) = -241.8 kJ· -1 mol ΔrHm = ΔfHm H2O(g)-ΔfHm H2O(l) ΔrHm = -241.8+285.8 = 44.0 kJ· -1 mol
化学热力学基础概念

化学热力学基础概念化学热力学是研究化学反应中能量变化的学科,它是化学的一个重要分支。
在化学反应中,物质的能量会发生变化,热力学正是研究这种能量变化的规律和原理。
本文将介绍化学热力学的基础概念,包括能量、焓、熵和自由能等。
一、能量能量是物质存在的基本属性,是物质运动和相互作用的结果。
在化学反应中,能量的变化可以分为两类:热能和化学能。
热能是指物质的温度和热量的能量,而化学能是指物质分子之间的化学键能量。
二、焓焓是热力学中常用的一个物理量,表示系统的热能。
在化学反应中,焓的变化可以用来描述反应的放热或吸热过程。
焓的变化可以通过测量反应物和生成物的温度变化来确定。
三、熵熵是热力学中描述系统无序程度的物理量,也可以理解为系统的混乱程度。
在化学反应中,熵的变化可以用来描述反应的自发性和方向性。
熵的变化越大,反应越倾向于自发进行。
四、自由能自由能是热力学中描述系统能量状态的物理量,也是判断反应是否进行的重要指标。
自由能的变化可以用来判断反应的可逆性和方向性。
当自由能变化为负时,反应是可逆的;当自由能变化为正时,反应是不可逆的。
五、热力学第一定律热力学第一定律是热力学的基本定律之一,也被称为能量守恒定律。
它表明能量在物质转化过程中不会凭空消失或产生,只会从一种形式转化为另一种形式。
热力学第一定律可以用数学公式表示为ΔU = Q - W,其中ΔU表示系统内能的变化,Q表示系统吸收的热量,W表示系统对外界做的功。
六、热力学第二定律热力学第二定律是热力学的另一个基本定律,也被称为熵增定律。
它表明在孤立系统中,熵总是增加的,即系统的无序程度总是增加的。
热力学第二定律还提出了熵增定律的两个等价表述:卡诺定理和熵不减原理。
七、热力学第三定律热力学第三定律是热力学的最后一个基本定律,也被称为绝对零度定律。
它表明在绝对零度下,系统的熵为零。
热力学第三定律还提出了绝对零度的概念,即绝对零度是温度的最低限度,为0K或-273.15℃。
化学热力学基础

4. Thermodynamics does not apply to systems that contain only a few molecules; a system must contain a great many molecules for it to be treated thermodynamically.
In thermodynamics, the total store of energy in a system is called its internal energy, U.
当体系的状态发生变化时,体系与环境之间必然伴随着能 量的交换, “热”和“功” 。
热:由于温度差引起的能量从环境到体系的流动或者热 交换过程中,体系发生化学变化或相变(变化过程中,温 度不变)。热用符号Q 表示, SI单位为J。
Energy is the capacity of a system to do work (and ultimately, to lift a weight). If a system can do a lot of work, we say that it possesses a lot of energy.
变;如果其性质发生改变,则称为“稳态”(steady state)。
“稳态”举例:两端温度不同的金属棒,一端40C,另 一端50C,给予足够条件,其温度不随时间而改变,但 是,在环境中移动时,其温度就会发生改变 。
三、状态和状态函数
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
δQ Байду номын сангаасδQ = T0 T
定温-定压反应, 定温-定压反应,T=T0, p=p0,Tds=d(Ts), W = pdV = d( pV) δ 由上式可得 由上式可得
δWu ≤ d(U + pV TS) = d(H TS)
定义:吉布斯自由能(函数) 为状态参数。 定义:吉布斯自由能(函数) G=H-TS,为状态参数。则有 δWu ≤ dG 对于可逆的定温-定压反应,系统可作出最大的有用功。 对于可逆的定温-定压反应,系统可作出最大的有用功。即 可逆的定温
Qp = HP HR = Hm, CO2 (Hm, C + Hm, O2 )
燃烧在标准状态下进行, 燃烧在标准状态下进行,实验测得1mol碳燃烧时放出热量393520J。 按规定,标准状态下Hm,C=0、Hm,O2=0,故由上式可得CO2在标准 按规定, 状态下焓的数值, 状态下焓的数值,即标准生成焓的值为
由于理想气体的焓值仅与温度有关, 由于理想气体的焓值仅与温度有关,并利用热容与焓的关系有
T 0 0 Hm(T ) = Hm,f + Hm(298K T ) = Hm,f + ∫298KCp0,mdT →
可见,只要已知反应物及生成物的标准生成焓, 可见,只要已知反应物及生成物的标准生成焓,就可求得反应 物及生成物的焓或热力学能,从而可按能量方程式分析化学反应过 物及生成物的焓或热力学能, 程中的能量转换关系。 程中的能量转换关系。
dS0 =
代入孤立系统熵增原理的表达式, 代入孤立系统熵增原理的表达式,有 TdS δQ ≥0 δQ = dU + δWtot = dU + δW + δWu 按第一定律 可得化学反应过程有用功表达式: 可得化学反应过程有用功表达式: δWu ≤ (dU TdS) δW
2010年9月24日 第十四章 化学热力学基础 11
2010年9月24日 第十四章 化学热力学基础 10
14-4 热力学第二定律在化学反应中的应用 第二定律用于化学反应, 第二定律用于化学反应,即要判断反应的方向及确定达到化学 平衡的条件。对于燃烧过程,是确定温度、 平衡的条件。对于燃烧过程,是确定温度、压力和过量空气量对燃 烧完全程度的影响,以及计算燃烧不完全的程度。 烧完全程度的影响,以及计算燃烧不完全的程度。 对由系统及周围物质组成的孤立系统,有 对由系统及周围物质组成的孤立系统, dS+dS0≥0 对于大多数可以按定温-定压或定温-定容分析的化学反应, 对于大多数可以按定温-定压或定温-定容分析的化学反应,系 统的温度一定且与周围环境温度相同, 统的温度一定且与周围环境温度相同,因而有
2010年9月24日 第十四章 化学热力学基础 9
14-3 理论燃烧温度 给定条件下的理论燃烧温度 定压或定容条件下, 给定条件下的 理论燃烧温度 —定压或定容条件下 , 燃料在给 定的过量空气中绝热完全燃烧时,生成物所达到的温度。 定的过量空气中绝热完全燃烧时,生成物所达到的温度。 对定压绝热燃烧过程,按定压燃烧能量转换关系,有 定压绝热燃烧过程,按定压燃烧能量转换关系, 燃烧过程 HP = HR 即绝热条件下进行定压燃烧时, 即绝热条件下进行定压燃烧时 , 反应物的焓全部转变成生成物的 根据焓和温度的关系,可按照生成物的焓值, 焓 。 根据焓和温度的关系, 可按照生成物的焓值 , 确定定压燃烧 系统的理论燃烧温度。 系统的理论燃烧温度。 定容绝热燃烧过程,按定容燃烧的能量转换关系, 燃烧过程 对定容绝热燃烧过程,按定容燃烧的能量转换关系,有 UP =UR 即在绝热条件下进行定容燃烧时, 即在绝热条件下进行定容燃烧时 , 反应物的热力学能全部转变成 生成物的热力学能。根据热力学能和温度的关系, 生成物的热力学能 。 根据热力学能和温度的关系 , 可按照生成物 的热力学能的数值,确定定容燃烧的理论燃烧温度。 的热力学能的数值,确定定容燃烧的理论燃烧温度。
2010年9月24日 第十四章 化学热力学基础 7
实际燃烧反应均在定压或定容条件下进行。 实际燃烧反应均在定压或定容条件下进行。 定温-定压条件下, 定温-定压条件下,燃料完全燃烧所释放的热量称为该燃料的 定压燃烧热, 定压燃烧热,显然 Qp= HP-HR 定温-定容条件下,燃料完全燃烧所释放的热量称为该燃料的定容 定温-定容条件下,燃料完全燃烧所释放的热量称为该燃料的定容 燃烧热, 燃烧热,显然 QV=UP-UR 发热量或 燃烧热的绝对值也称为燃料的发热量 热值。 燃烧热的绝对值也称为燃料的发热量或热值。 燃烧产物中有水蒸气时,热值可分为高热值 低热值。 高热值和 燃烧产物中有水蒸气时,热值可分为高热值和低热值。 燃烧生成物中水为气态时所得的热值。 低热值—燃烧生成物中水为气态时所得的热值。 燃烧生成物中水分凝结时所得热值。 高热值—燃烧生成物中水分凝结时所得热值。 一般热值测定装置测得的为高热值, 一般热值测定装置测得的为高热值,但动力设备中燃烧产物温 度较高,其中的水分以气态形式存在,所利用的为低热值。 度较高,其中的水分以气态形式存在,所利用的为低热值。
第十四章 化学热力学基础
14-1 化学反应的质量守恒分析 14-2 热力学第一定律在化学反应中的应用 14-3 理论燃烧温度 14-4 热力学第二定律在化学反应中的应用 14-5 化学平衡和平衡常数 14-6 化学平衡和温度、压力及组成的关系 化学平衡和温度、 14-7 离解和离解度 14-8 绝对熵和热力学第三定律
及
Q′′ = HCO2 (HO2 + HCO ) = Hm, CO2 (Hm, CO + 0.5Hm, C ) p
Q 显然有, 即无论是一步实施还是两步实施, 显然有, p = Q′ + Q′′,即无论是一步实施还是两步实施,碳燃烧生 p p 成二氧化碳的定压反应过程, 反应热相同。 成二氧化碳的定压反应过程,其反应热相同。
Qp = HCO2 (HO2 + HC ) = Hm, CO2 (Hm, O2 + Hm, C )
式中, 物质的焓(摩尔焓 式中,Hm为1mol物质的焓 摩尔焓 。分两步实施该过程时有 物质的焓 摩尔焓)。
Q′ = HCO (HO2 + HC ) = Hm, CO (Hm, C + 0.5Hm, O2 ) p
0 Hm,f,CO2 = 393520J/m ol
常用物质的标准状态焓可由热工手册查得。 常用物质的标准状态焓可由热工手册查得。
2010年9月24日 第十四章 化学热力学基础 6
任意状态下的焓 ,可按下式求得: 可按下式求得:
0 Hm(T, p) = Hm,f + Hm(298K T,0.101325 →p) MPa →
2010年9月24日 第十四章 化学热力学基础 2
过量空气量少时,出现不完全燃烧。 过量空气量少时,出现不完全燃烧。如过量空气量为10%,5% 不完全燃烧 的碳生成一氧化碳, 的碳生成一氧化碳,则甲烷燃烧化学反应方程式为
CH4 +1.1× 2O2 +1.1× 2× 3.76N2 = 0.95CO2 + 0.05CO + 2H2O + 0.225O2 + 8.27N2
ol ol 摩尔空气燃料比: 摩尔空气燃料比: Z = na = 2 m + 7.52 m = 9.52 0
质量空气燃料比: 质量空气燃料比:
'
nf 0
1m ol
ma 2m ×32 kg/m + 7.52m ×28 kg/m ol ol ol ol Z0 = = =17.2 m 1m ×16 kg/m ol ol f 0
2010年9月24日 第十四章 化学热力学基础 8
如果反应物和生成物中气态物质都可作为理想气体处理, 如果反应物和生成物中气态物质都可作为理想气体处理,则对 于同一种燃烧反应, 于同一种燃烧反应,在相同温度下其定压燃烧热和定容燃烧热之间 存在一个简单的关系。 存在一个简单的关系。定压燃烧热的关系式可以表示为 Qp= HP-HR =(UP-UR)+p(VP-VR) 对于理想气体上式可以写成 Qp=QV+ p(VP-VR) 按理想气体状态方程, 按理想气体状态方程,有 p(VP-VR) =(nP-nR)RT 则 Qp=QV+ (nP-nR)RT 根据此式,可依 的实验数据求取另一个的数值。 根据此式,可依QV或Qp的实验数据求取另一个的数值。一般情况 可近似取定压燃烧热和定容燃烧热相等。 下,可近似取定压燃烧热和定容燃烧热相等。工程手册中可查得 标准状态下定压热值。 标准状态下定压热值。
2010年9月24日 第十四章 化学热力学基础 1
14-1 化学反应的质量守恒分析 化学反应方程式 反应物质的质量守恒关系式。 化学反应方程式—反应物质的质量守恒关系式。如甲烷在氧中 燃烧, 燃烧,其化学反应方程式为
CH4 + 2O2 = CO2 + 2H2O
工程上,燃烧总是在空气中进行,空气: 工程上,燃烧总是在空气中进行,空气: yO2 = 21%, yN2 = 79%。 甲烷在空气中完全燃烧,有 甲烷在空气中完全燃烧,
CH4 + 2O2 + 2 × 3.76N2 = CO2 + 2H2O + 7.52N2
过量空气量:空气量大于其理论值的百分率。 过量空气量:空气量大于其理论值的百分率。 当过量空气量为50%时,甲烷燃烧的化学反应方程式为
CH4 + 1.5 × 2O2 + 1.5 × 2 × 3.76N2 = CO2 + 2H2O + O2 + 11.28N2
2010年9月24日 第十四章 化学热力学基础 5
分析化学反应的能量转换时,需确定反应前后系统热力学能变 析化学反应的能量转换时, 化或焓变,因此需确定不同物质的焓及热力学能数值间的关系。 化或焓变,因此需确定不同物质的焓及热力学能数值间的关系。 规定:标准状态( ℃ 规定:标准状态(25℃、0.101325 MPa)下各种稳定元素的焓的 下各种稳定元素的焓的 数值为零。 数值为零。 标准生成焓—通过典型化学反应确定的各种物质在标准状态下 标准生成焓 通过典型化学反应确定的各种物质在标准状态下 0 的焓的数值。 表示。 的焓的数值。每1mol物质标准生成焓用符号 Hm, f 表示。 物质标准生成焓用符号 例如,根据碳定压燃烧过程 例如,根据碳定压燃烧过程C+O2=CO2,按其能量转换关系有
