1-2有机化合物结构特点
有机化合物的结构特点

有机化合物的结构特点1.碳骨架:有机化合物的一个显著特征是它们都含有碳骨架。
碳原子有四个价电子,并具有形成共价键的能力,因此在有机化合物中,碳原子可以与其他碳原子或其他元素形成单键、双键或三键,构建出各种不同的碳骨架。
碳骨架的形状对化合物的性质具有重要影响,常见的碳骨架包括直链烷烃、支链烷烃、环烷烃、芳香烃和多环化合物等。
2.键的特性:有机化合物中的化学键主要为共价键,共价键的形成使相邻原子共享电子对。
共价键的强度较高,使得有机化合物在常温下大多数是液体或固体。
另外,由于碳原子具有四个价电子,因此它可以形成单键、双键或三键。
不同类型的键对有机化合物的性质和反应活性都有影响。
3.官能团:官能团是有机化合物中具有特定功能的基团,通过官能团的存在,有机化合物具有了不同的性质和反应。
常见的官能团包括羟基(—OH)、羰基(C=O)、醇基(—OH)、酸基(—COOH)、醛基(—CHO)和羧基(—COOH)等。
官能团可以通过化学反应进行转化,从而赋予有机化合物不同的性质和用途,例如醇可以进行酯化反应制备酯类化合物,酮可以进行取代反应制备醇类化合物等。
4.杂原子:有机化合物中除了碳和氢之外,还可以含有其他杂原子,如氮、氧、硫、氯等。
这些杂原子的引入使有机化合物拥有更多的化学性质和反应路径。
例如,含有氮的有机化合物可以显示碱性或受到质子化的酸性等性质。
氧原子可以通过氧化反应进行氧化还原等。
5.空间结构:有机化合物的空间结构对其性质和反应具有重要影响。
空间结构的变化可以影响分子间的相互作用、分子的极性以及分子的空间取向。
空间结构常通过立体化学来描述,包括立体异构体(光学异构体和构造异构体)以及分子的空间取向(单体的原、伏和反原位等)。
总之,有机化合物的结构特点主要体现在碳骨架的构建、键的特性、官能团的存在、杂原子的引入以及空间结构的变化。
这些结构特点直接影响了有机物的性质、反应活性以及应用领域。
有机化合物的结构特点

H..
H
CH4
H:C.. :H
H—C—H
H
H
甲烷分子的立体结构:
以碳原子为中心, 四个氢原子 为顶点的正四面体。键角:109°28′
甲烷是非极性分子,是高度对称的
正四面体结构。碳原子位于中心,四个 氢原子位于顶点,C原子与四个H原子形 成共价键,四个C-H键完全 H︰‥C︰‥C︰H
HH
HH (4)结构式: H—C—C—H
HH
(4)结构简式: CH3CH3
CH3CHCH2CHCH=CH2 CH3 CH3
(5)键线式:把有机物分子中的碳、氢元素符号 省略,只表示分子中键的连接情况, 每个拐点或终点均表示有一个碳原 子,称为键线式。
C7H9Cl
(1)判断某种烃的一氯代物种类 方法:找出有多少种不同的氢原子 关键:对称氢原子的确定
①同一碳原子上的氢原子是等效的。 ②同一碳原子上所连接甲基上的氢原子是等效的。 ③处于同一面对称位置上的氢原子是等效的。
CnH2n CnH2n-2 CnH2n+2O CnH2nO CnH2nO2
单烯烃、环烷烃 二烯烃、炔烃 饱和一元醇、烷基醚 饱和一元醛、酮 饱和一元羧酸、酯
书写有机物的同分异构体的步骤
首先考虑官能团异构 其次考虑碳链异构 最后考虑位置异构
(1)判断某种烃的一氯代物种类(等效氢法) 方法:找出有多少种不同的氢原子 关键:对称氢原子的确定
第一章 认识有机化合物
2 有机化合物的结构特点
有机化合物特性
1、组成元素少,多种异构现象,数量庞大; 2、易燃; 3、熔沸点低; 4、不导电; 5、难溶于水; 6、反应速度慢且反应复杂。
思考:
有机化合物的结构特点

有机化合物的结构特点有机化合物是由碳和氢以及其他一些元素(如氧、氮、硫等)组成的化合物。
它们具有以下几个结构特点。
1.碳的四价性:碳原子有四个价电子,可以与其他原子形成共价键。
这使得碳原子能够以多种方式和其他原子形成化合物,从而构建出非常多样化的有机分子。
2.分支链和环结构:由于碳原子可以与其他碳原子形成共价键,有机化合物可以形成分支链和环结构。
分支链是由一个主链上的碳原子之外的碳原子构成的侧链。
环结构是由若干个碳原子构成的平面环状结构,称为环状碳骨架。
3.含氧官能团:许多有机化合物中含有氧元素,形成了各种各样的含氧官能团,如羟基(-OH)、羰基(C=O)、醇基(-R-OH)等。
这些官能团赋予了有机化合物特定的化学和物理性质。
4.含氮官能团:有机化合物中也常常含有氮元素,形成了各种各样的含氮官能团,如胺基(-NH2)、腈基(C≡N)等。
这些官能团赋予了有机化合物特定的结构和性质。
5.立体化学:有机化合物中的碳原子可以形成手性中心,这意味着它们可以存在两个非对称的立体异构体。
这种分子的手性性质对于它们的活性和生物活性非常关键。
6.官能团的位置和取代:有机化合物中,官能团的位置和取代方式对其性质和化学反应起着重要的影响。
不同位置和取代方式的官能团可以导致化合物具有不同的性质和反应。
7.范德华力:有机化合物中的分子间作用力主要是范德华力,它是由于分子间的短暂的电荷不均引起的吸引力。
范德华力的强弱决定了有机化合物的物理性质,如沸点、溶解度等。
以上是有机化合物的一些主要结构特点。
有机化合物的结构特点丰富多样,这使得它们具有广泛的应用领域,包括药物、合成材料、农药等。
1-1-2有机化合物中的共价键和同分异构现象(教学课件)-高中化学人教版(2019)选择性必修3

C4H10
正丁烷
CH3—CH—CH3 CH3
异丁烷
异构类型
实例
1
2
3
4
C4H8 CH2=CH—CH2—CH3
1-丁烯
1
2
3
4
CH3—CH=CH—CH3
2-丁烯
位置异构
C6H4Cl2
邻二氯苯 间二氯苯 对二氯苯
异构类型
实例
官能团异构 C2H6O
乙醇
二甲醚
4.键线式
在表示有机化合物的组成和结构时,将碳、氢元素符号省略,只表示分子
第一节 有机化合物的结构特点
第2课时
有机化合物中的共价键 和同分异构现象
课堂引入
甲烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共 价键的类型有什么不同呢?
甲烷
乙烯
目标一 有机化合物中的共价键
1.有机化合物中共价键的类型 原子轨道的重叠方式 (1) σ键——“头碰头”重叠
σ键和π键
√C.1个HClO分子中含有2个σ键 H—O—Cl
D.1个乙醇分子中含有6个σ键,1个π键
自我测试
12
2.光气(COCl2),又称碳酰氯,常温下为无色气体,有剧毒。光气化学性质不 稳定,反应活性较高,常用作合成农药、药物、染料及其他化工产品的中间
体。氯仿(CHCl3)被氧化可产生光气:2CHCl3+O2―→2HCl+2COCl2。下列说
下同)。 (2)其中属于碳架异构的是
___①_________。
(3)其中属于位置异构的是
___②_________。
导练
①CH3—CH2—CH2—CH3和
②CH2==CH—CH2—CH3和CH3—CH==CH—CH3 ③CH3—CH2—OH和CH3—O—CH3
1-2有机化合物的结构特点

4.结构式 结构式 有机物分子中原子间的一对共用电子用 H H 一根短线表示,称为结构式。 一根短线表示,称为结构式。 5.结构简式: 结构简式: 结构简式 H—C—C—H H H
将结构式中的单键省略,连在同碳上的氢合并, 将结构式中的单键省略,连在同碳上的氢合并, 双键和三键不能省略 不能省略,但是 称为结构简式。双键和三键不能省略 但是 醛基、羧基的碳氧双键可以简写为 的碳氧双键可以简写为—CHO,— 醛基、羧基的碳氧双键可以简写为 COOH
√
【练习】写出分子式为C5H10的同分异构体。 练习】写出分子式为 的同分异构体。 ①按碳链异构书写 ②按位置异构书写 ③按官能团异构书写
序号 1 2 3 4 5
类别 烯烃 环烷烃 炔烃 二烯烃 饱和一元链状醇 饱和醚 饱和一元链状醛 酮 饱和羧酸 酯
通式
常 见 的 类 别 异 构 现 象
CnH2n CnH2n-2 CnH2n+2O CnH2nO CnH2nO2
官能团异构:官能团不同引起的异构, 官能团异构:官能团不同引起的异构, 如: 烯烃和环烷烃
3、同分异构体的书写规律
书写步骤: 碳链异构→位置异构→官能团异构 书写步骤: 碳链异构→位置异构→
例题】书写C 【例题】书写 7H16的同分异构体 1.一直链C 1.一直链C7 : 一直链
C—C—C—C—C—C—C
(2)支链为两个甲基: 支链为两个甲基:
(2)支链为两个甲基: 支链为两个甲基:
C ∣ C -C - C - C - C- C- C ∣ C
A、两甲基在同一个碳原子上 、
C ∣ C -C - C - C - C ∣ C C ∣ C -C - C - C - C ∣ C
A、两甲基在同一个碳原子上 、
1.2有机化合物的结构特点
同分异构体的书写思路:
方法:官能团异构 碳链异构
位置异构
①不饱和度计算:根据分子式计算不饱和度 ②官能团异构:分析可能的官能团或结构 ③碳链异构:画出碳骨架 成直链,一线串;
以烷烃为例:从头摘,挂中间; 往边排,不到端; 碳数多,整到散; 多支链,对邻间。
④位置异构:移动官能团的位置 选择取代法或插空法
常见的官能团(类别)异构现象
1.判断C4H10O 可能有哪些官 能团?
2.判断C5H10O 可能有哪些官 能团?
序号 1 2 3 4 5
类别
通式
烯烃 环烷烃 炔烃 二烯烃 饱和一元醇 饱和一元醚 饱和一元醛 饱和一元酮 饱和一元羧酸 饱和一元酯
CnH2n
CnH2n-2 CnH2n+2O CnH2nO
CH3—CH—CH—CH3
CH3 CH3
CH3
类型2. 烃的一元取代物的同分异构体
【变式】己烷(C6H14) 的一个H原子被Cl原子(或—OH) 取代后有多少种结构?
方法:碳链异构→位置异构
等效氢规律
①同一碳原子上的氢原子是等效的。 ②同一碳原子上所连接甲基上的氢原子是等效的。
③处于同一对称位置的碳原子上的氢原子是等效的。
二、有机物中的同分异构现象 物质名称 结构式 相同点 不同点 沸 点
分子式、相对分子质量相同
正戊烷
异戊烷
新戊烷
结构不同,性质不同 36.07℃ 9.5℃ 27.9℃
1.同分异构现象的类别
碳链异构:由于碳链骨架不同而产生的异构
CH3 CH3 C H CH3 CH3CH2CH2CH3
H3C CH CH CH3
— —
CH3
确定同分异构体的种类 ——基元法
有机物的结构特点

有机物的结构特点1.碳骨架:有机物的基本结构是由碳原子构成的骨架,通常是以碳原子为中心,周围连接着其他原子或基团。
碳原子可以形成单、双、三键,因此有机物的结构非常多样。
并且,由于碳原子具有四个价电子,因此碳原子可以与其他原子或基团形成非常稳定的共价键。
2.官能团:官能团是有机物分子中带有化学活性的基团,决定了有机物的性质和化学反应。
常见的官能团包括羟基(-OH)、羧基(-COOH)、胺基(-NH2)、酮基(-C=O)、醇基(-OR)等等。
官能团的存在使得有机物可以发生各种反应,从而具有广泛的化学性质。
3.立体化学:有机化合物中的碳原子可以形成手性中心,即孤立的碳原子围绕四个不同的基团构成一个手性碳中心。
手性碳中心的存在会导致有机化合物的立体异构体产生,其中非对映异构体的存在使得有机物的化学性质和生物活性发生巨大的差异。
4.键的类型:有机化合物中的键可以是单键、双键或三键。
单键是由两个原子共享一个电子对所形成的,是最具活性和易于断裂的键。
双键和三键则具有更强的化学稳定性和反应选择性,且在空间构型上更具限制。
5.共轭体系:共轭体系是指有机分子中两个或多个相邻的碳碳双键或三键之间存在一个或多个相邻的单键,这些单键上存在π电子。
共轭体系的存在使得有机化合物具有共振稳定性和一系列共轭体系特有的化学性质,如吸收紫外线和可见光、发生光化学反应等。
6.分支链构型:有机化合物可以有直链、支链或环状的结构。
直链有机化合物是由一系列连接的碳原子组成的,支链有机化合物是在直链上一些碳原子上连接有其他碳链或基团,环状有机化合物则是由碳原子形成的环。
不同的结构会对有机化合物的性质和物理化学行为产生很大的影响。
总之,有机化合物的结构特点主要包括碳骨架、官能团、立体化学、键的类型、共轭体系和分支链构型等。
这些特点决定了有机物的物理化学性质、反应性质以及生物活性,对于深入理解和研究有机化学、有机合成和生物化学起着重要的作用。
_1.2有机化合物的结构特点(

对称点 ③ ② ① ② ③ CH3-CH2-CH-CH2-CH3
② CH2 ③
对称点
① ①
对称面
a b
③
CH3
b
a
CH3
②
CH3 – C – CH2- CH3
①
b
a a
b
CH3
有机化合物的同分异构现象
等效氢原子的判断
1.同一碳原子所连的氢原子是等效的; 2.同一碳原子所连甲基上的氢原子是等效的; 3.处于镜面对称位置上的氢原子是等效的。
CH3
碳链异构
有机化合物的同分异构现象
4、同分异构体的书写
㈠ 碳链异构
学与问:书写C6H14的同分异构体
方法:减链法 原则:
主链由长到短;(不少于n/2) 位置由心到边; 支链由整到散; 排布由同到邻再到间。
成碳链,一条线; 摘一碳,挂中间; 往外移,不到边; 摘两碳,成乙基; 二甲基,同邻间; 不重复,要写全。
分子 决定 的稳 定性
键长 键角
决定 分子
空间 构型
有机化合物的同分异构现象
思考与交流 回忆:C5H12的三种同分异构体的结构简式 结构特点 沸点 球棍模型 支
CH3CH2CH2CH2CH3 链状、无支链 CH3CH2CHCH3 CH3 链状、有支链 CH3 CH3CHCH3 CH3 链状、多支链
— —
C
C 7、C—C—C—C—C — C C — C — — C
9、C—C—C—C
—
C
有机化合物的同分异构现象
㈡ 位置异构
例:写出分子式为C4H8的烯烃的同分异构体
⒈碳链异构(碳骨架)
C
C
C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
位置异构
5. 同分异构体的书写
练习:书写 练习:书写C6H14的同分异构体: 【交流总结】书写同分异构体的有序性 】
同分异构体的书写口诀: 同分异构体的书写口诀: 主链由长到短; 主链由长到短; 减碳架支链; 减碳架支链 支链由整到散; 支链由整到散; 位置由心到边; 位置由心到边; 排布由对到邻再到间。 排布由对到邻再到间。
2、主链少一个碳 、
C -C - C - C - C - C - C ∣ ∣ C C C -C - C - C - C - C ∣ C
3、主链少二个碳 、 (1)支链为乙基
C -C - C - C - C - C- C ∣ ∣ × C C ∣ ∣ C C
(2)支链为两个甲基 )
C ∣ C -C - C - C - C- C- C ∣ C
√
的同分异构体。 【练习2】写出分子式为 5H10的同分异构体。 练习 】写出分子式为C ①按位置异构书写 ②按碳链异构书写 ③按官能团异构书写
【随堂练习】 随堂 】 碳原子最外层含有____个电子, ____个电子 1. 碳原子最外层含有____个电子,一个碳原子可以跟 其他非金属原子形成____个 ____键 其他非金属原子形成____个 ____键,碳原子之间也 ____ 能以共价键相结合,形成____键 ____键 能以共价键相结合,形成____键____ 键或 ____键 。 ____
A、两甲基在同一个碳原子上 、
C ∣ C -C - C - C - C ∣ C C ∣ C -C - C - C - C ∣ C
两者是一样的 两者是一样的
A、两甲基在同一个碳原子上 、
C -C - C - C - C ∣ ∣ ∣ ∣ C C C C C -C - C - C - C ∣ ∣ ∣ C C C
特点: 特点: (1)杂化前后原子轨道的数目不变 (2)杂化后各个杂化轨道的能量完全一样
甲烷分子就是碳原子的sp 杂化轨道与氢原子的1s 1s轨道沿对称 甲烷分子就是碳原子的sp3杂化轨道与氢原子的1s轨道沿对称 轴重叠形成了碳氢σ键,这就构成了甲烷分子的正四面体结构。 轴重叠形成了碳氢 键 这就构成了甲烷分子的正四面体结构。
注意
三个相同: 分子组成相同、 三个相同: 分子组成相同、相对分子
质量相同、 质量相同、分子式相同
两个不同: 结构不同、 两个不同: 结构不同、性质不同
3. 碳原子数目越多,同分异构体越多 碳原子数目越多,
碳原子 1 数 同分异 构体数 2 3 4 5 6 7 8 9 10
1 1 1 2 3 5 9 18 35 75
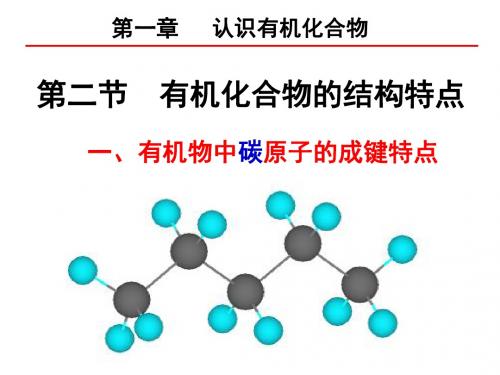
二、有机化合物中碳原子的成键特点
1、每个碳原子以轨道杂化的方式能与其他 、 原子形成4个共价键 个共价键, 原子形成 个共价键,而且碳原子之间也能以共 价键结合。 价键结合。 2、碳原子之间不仅可以形成单键,还可以 、碳原子之间不仅可以形成单键, 形成稳定的双键或三键。 形成稳定的双键或三键。
碳原子与氢原子形Βιβλιοθήκη 共价键【判断】下列异构属于何种异构? 判断】下列
1 1-丙醇和2-丙醇 2 CH3COOH和 HCOOCH3 3 CH3CH2CHO和 CH3COCH3
位置异构 官能团异构 官能团异构
碳链异构 4 CH3 -CH-CH3和 CH3-CH2-CH2-CH3
CH3 5 CH3CH=CHCH2CH3和 CH3CH2CH = CHCH3
物质名称 正戊烷 结构式 相同点 不同点 沸点
异戊烷
新戊烷
分子组成相同, 分子组成相同,链状结构 结构不同, 结构不同,出现带有支链结构 36.07℃ . ℃ 27.9℃ . ℃ 9.5℃ . ℃
二、有机化合物的同分异构现象
1. 同分异构现象 化合物具有相同的分子式, 化合物具有相同的分子式,但具有 具有相同的分子式 不同的结构现象 叫做同分异构体现象。 现象, 不同的结构现象,叫做同分异构体现象。 2.同分异构体 同分异构体 具有同分异构体现象的化合物互称 为同分异构体。 为同分异构体。
有机化合物的结构特点
一、现代价键理论
1、共价键的概念: 共价键的概念: 原子之间通过共用电子对(即电子云的重叠) 原子之间通过共用电子对(即电子云的重叠) 而形成的化学键。 而形成的化学键。 2、共价键的本质: 共价键的本质: 两原子核对共用电子对的相互静电作用。 两原子核对共用电子对的相互静电作用。
4.写出C4H8的所有同分异构体
B
支 链 邻 位 支 链 间 位
4、主链少三个碳原子 、
C ∣ C -C - C - C - C - C - C ∣ ∣ C C
4、主链少三个碳原子 、
C C ∣ ∣ C -C - C - C ∣ ∣ C C
的烷烃在结构式中含有 在结构式中含有3 【观察】分子式为C6H14的烷烃在结构式中含有3个 观察】分子式为 甲基的同分异构体有( 甲基的同分异构体有( )个 ( A) 2 个 ( B) 3 个 (C)4 个 (D)5 个
12 355 … … 15 4347 20 366319
碳原子 11 数 同分异 159 构体数
同分异构 异构类型 4. 同分异构类型
异构 类型 示例 产生的原因
碳链 异构 位置 异构 官能团 异构
C-C-C-C、C-C-C 碳链骨架(直链,支链, ׀ 环状)的不同而产生的 C 异构 C=C-C-C、 碳碳双键在碳链中的位 置不同而产生的异构 C-C=C-C CH3CH2OH CH3OCH3 官能团种类不同而产 生的异构
S-Sσ键 键
S-Pσ键 键
P-Pσ键 键
σ键的特征:强度较大,组成的两个原子可 键的特征:强度较大, 键的特征 以围绕键轴旋转,不影响键的强度; 以围绕键轴旋转,不影响键的强度;
π键 b 、 p -p π 键
“肩并肩” 肩并肩”
P
p-pπ键 键 π键不如 键牢固比较容易断裂 键不如σ键牢固比较容易断裂 键不如
碳原子也碳原子形成共价键
3、多个碳原子可以相互结合成链状,也 、多个碳原子可以相互结合成链状, 可以结合成环状,还可以带支链, 可以结合成环状,还可以带支链,碳链和 碳环也可以相互结合。 碳环也可以相互结合。
每种化合物均有特定的化学式表示其 组成,是否每一分子式表示一种化合物呢? 组成,是否每一分子式表示一种化合物呢?
②形成共价键时,原子轨道尽可能最大重叠; 形成共价键时,原子轨道尽可能最大重叠; 由于原子轨道又有着不同的空间伸展方向, 由于原子轨道又有着不同的空间伸展方向, 故共价键要得到最大重叠必须沿不同方向。 故共价键要得到最大重叠必须沿不同方向。 即共价键具有方向性 方向性。 即共价键具有方向性。
③共价键可形成两种键型: 共价键可形成两种键型: a、σ键 、 键 “头碰头” 头碰头”
2. 如果甲烷分子中的四个氢原子被四个 -CH3取代, 取代, 生成物的分子式是_______ 生成物的分子式是_______ 生成物中氢的连接方式和在碳链中的位置是否相同? 生成物中氢的连接方式和在碳链中的位置是否相同? 如果生成物中的一个氢被氯原子取代, 如果生成物中的一个氢被氯原子取代, 写出它的结构简式______________。 写出它的结构简式______________。 ______________
最后用氢原子补足碳原子的四个价键。 最后用氢原子补足碳原子的四个价键。
练习:书写 练习:书写C7H10 的同分异构体 1、一直链 、 H H H H H H H ∣ ∣ ∣ ∣ ∣ ∣ ∣ H - C- C- C- C- C - C- C-H ∣ ∣ ∣ ∣ ∣ ∣ ∣ H H H H H H H
3、现代价键理论的基本要点: 现代价键理论的基本要点:
①原子中必须有自旋相反的成单电子才可形成 稳定的化学键; 稳定的化学键; 每个原子成键的总数是一定的, 每个原子成键的总数是一定的,这是因为 每个原子能提供的轨道和成单电子数目是一定 即共价键具有饱和性; 的,即共价键具有饱和性; 如不存在H3、H2Cl、Cl3分子 如不存在H Cl、
P
结合C原子的核外电子排布, 结合C原子的核外电子排布,用以 上知识推测一下碳元素的成键情况
④用“杂化”及“杂化轨道”理论解释一 杂化” 杂化轨道” 些物质的形成, 些物质的形成,如CH4。
复习: 复习:甲烷的结构
分子式 电子式 H ·· H C H ·· H ·· ·· 结构式 H H C H H 比例模型 正四面体 空间结构
3.下列各组物质中,哪些属于同分异构体,是同分 下列各组物质中,哪些属于同分异构体, 下列各组物质中 异构体的属于何种异构? 异构体的属于何种异构? ① H2N—CH2—COOH 和 ② CH3COOH和 HCOOCH3 ③ CH3CH2CHO和 CH3COCH3 H3C-CH2—NO2
④ CH3CH2CH2OH 和 CH3CH2OCH3
CH4
球棍摸型
杂化轨道理论: 杂化轨道理论:
定义:在形成分子时,由于原子间的相互影响, 定义:在形成分子时,由于原子间的相互影响, 若干不同类型能量相近的原子轨道混杂起来, 能量相近的原子轨道混杂起来 若干不同类型能量相近的原子轨道混杂起来,重 新组合成一组新轨道。 新组合成一组新轨道。这种轨道重新组合的过程 叫做杂化 所形成的新轨道就称为杂化轨道 杂化, 杂化轨道。 叫做杂化,所形成的新轨道就称为杂化轨道。
