第9章烷基化反应
第九章-苯及芳香化学

9.1.4 苯的分子轨道 •六个碳均为 sp2杂化 •六个离域的电子总能量较 低.苯中所有碳碳键都相等. 键长也完全相等(0.139nm) 闭 合 共 轭 体 系
H H
H H
H
苯的p轨 道交盖
H
大键
苯的离域 分子轨道
•位相符号+,-. 节点,节面
反键轨道
•苯的基态是三个成 键轨道的叠加
成键轨道
(1) 加氢
(2) 加氯(在紫外线照射下)
•六氯化苯简称六六六,有八种异构体,只有异构体具 有杀虫活性,占化合物的18%.
9.4.2 芳烃侧链反应 (1) 氧化反应 • 常见的氧化剂:高锰酸钾,重铬酸钾加硫酸,稀硝酸等, 只使侧链发生氧化:
KMnO 4
CH3
COOH 苯甲酸
H3C
CH3
稀 HNO 3
HOOC
COOH
150~160℃,1~1.5MPa
对苯二甲酸
• 在过量氧化剂存在下,无论支链长短,最后都氧化成 苯甲酸(说明的活泼性):
KMnO 4
CH2CH3
COOH
注意: 叔丁基苯 由于无 ,在一般情况下 不氧化,但在强烈条件下,环破裂(P307).
CH3
均有,直接 氧化到苯甲酸
CH3
Cl2 日光或热
CH2Cl
Cl2 日光或热
CHCl2
Cl2
日光或热
CCl3
•苯环上H的取代(离子型): CH3 + Cl2
Fe或 FeCl3
CH3 Cl
+ 邻位
CH3
+2HCl
Cl 对位
[问] 为什么在高温或光照下,主要生成苯一氯甲烷? • 自由基型取代反应,生成的苄基自由基 CH2•
华理有机6-9章答案

答案: (a) C3H7NO 答案:
(b)
C2H3OCl
习题 6-2 试说明 2 己烯质谱中 m/z=41,55 和 84 的离子峰是怎样形成的。
b
CH3CH=CH CH2
a
CH2CH3 m/z=84
a -CH2CH3
CH3CH CHCH2 m/z=55
b - CH2CH2CH3
第6章
有机化合物的结构解析 思考题答案
思考题6-1 分别写出CH3Br,CH2Br2这二种化合物的同位素峰的类型及相应的峰强度的比值。 答案:CH3Br M:M+2 = 1:1 CH2Br2 M:M+2:M+4 = 1:2:1 思考题6-2 比较甲苯、顺丁二烯、环己烷和乙醇分子离子的稳定性。 答案:甲苯 >顺丁二烯 >环己烷 >乙醇 思考题6-3 当体系的共轭双键增多时,紫外光谱会发生什么变化,解释其原因。 答案:随着共轭双键的增长,分子的 π -π 共轭增强,减低了π →π 跃迁所需的能量,发色团吸收波 长向长波长方向移动,产生红移现象。 思考题6-4 CH3CN的最低能量跃迁是什么跃迁,请判断CH3CN是否有发色团。 答案:CH3CN分子内最低的能量跃迁是n→π ,CN基团是发色团。 思考题6-5 判断2,3-二甲基-2-丁烯是否有双键的红外吸收,解释其原因。 答案: 2,3-二甲基-2-丁烯是一个对称性很高的分子, 没有偶极距的变化, 因此没有双键的红外吸收。 思考题6-6 比较乙酸乙酯,乙酰氯,乙酰胺三个化合物的羰基伸缩振动峰的大小? 答案:乙酰氯(1800cm )> 乙酸乙酯(1735cm )> 乙酰胺(1690cm ) 习题答案 习题 6-1 化合物 A,B 的质谱数据列于表中,试确定其分子式。
有机化学第二版 高占先 第八九章答案

第八章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNKOH 25(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 2OCCH 3OBrBrBrCNCH 2CHCH 3Br CH=CHCH 3CH 3Br2NH 3(l)CH 3NH 2CH 32+ClClNO 22OHClNO 2ZnCl 2(HCHO + HCl)+CH 2ClMgCH 2MgClCH 2COOHClCH 2CHCH 2CH 2CH 3PhCH 2MgCl 3+PhCH 2CH 2CHCH 2CH 2CH 33(7)(8)(9)(10)3RC CLi(11)RCCR'RC CCOOHRC CCH 2CH 2OHCHBr3BrBr(12)8-3 写出下列反应主要产物的构型式。
C2H5CH3NaI+C2H5CH3NaINaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3H2(CH2)4CH3HOCBrBrCH2CH2CH3CCH2CH32Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3Ph PhC6H5H3C HC6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H Br2CH3H BrC2H5CH325Znt-BuOKt-BuOH, △(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-6 把下列各组化合物按发生S N1反应的活性排列成序。
天然气化工工艺学 第09章 天然气制合成油(GTL-FT)

煤炭希恩结构(Coal Shinn Structure)
《天然气化工工艺学》第9章
2-1. 煤气化化学反应 (I. 水-煤浆气化)
(1) 煤气化反应 ∆H >>0
《天然气化工工艺学》第9章
(总反应)
T > 815.6 oC (2) 水煤气变换 ∆H= - 9.839 kcal/kmol (3) 发生炉煤气化反应 ∆H = 41.220 kcal/kmol (4) 水煤浆气化反应 (主) ∆H = 31.38 kcal/kmol (5) CH4水蒸气重整反应 ∆H = 49.271 kcal/kmol
1993年,马来西亚Bintulu天然 气合成油厂 计划在印度尼西亚和委内瑞拉 分别建设7x104 bbl/d和1.5x104 bbl/d工业装置 2002年,澳大利亚Burrup Peninsula合成液体烃厂 1套200 bbl/d中试装置在运转, 在阿拉斯加州普拉德霍湾和卡 塔尔各建1套105 bbl/d工业装置 印度孟买天然气合成油厂, 2001年投产。 1套400 bbl/d 中试装置 2002年 投产; 6×104 bbl/d工业装置计 划2007年投产。
1923年由德国科学家Frans Fischer和Hans Tropsch发 明的,简称费托 (F-T)合成。 1936年首先在德国实现工业化,并在南非发展成煤基合 成气制油的燃料工业,到1945年为止,共建了16 套以煤基 合成气为原料的合成油装置,主要使用钴-钍-硅藻土催化剂。 2010年神华集团直捣煤液化核心,成功开发煤基浆态床 费托合成催化剂及工艺。
《天然气化工工艺学》第9章
(b) Texaco煤炭气化典型技术指标
1.汽化条件:P=2.7-6.5MPa; T=1300-1500℃;煤浆浓度 >60%,粒度分布70%以上大于200目(<6nm)
高等教育有机化学 第九章

RCOOH
2CH3CH2OH + Cr2O7
橙红
+ Cr3+ 绿色 K2Cr2O7 CH3COOH
仲醇氧化生成酮
RCH 2OH OH
[O]
RCHO K2 Cr2 O7 - 稀H2 SO4
[O]
ROOH =O (85%)
——叔醇无α﹣氢原子,在碱性条件下不易被 氧化,在酸性(例:硝酸)条件下脱水生成烯 烃,然后氧化断链生成小分子化合物(无实用 价值)
CH3OH>RCH2OH>R2CHOH>R3COH
RCH2O-溶剂化作用大、稳定,因此RCH2OH中的
质子易于离解,酸性大;R3CO-溶剂化作用小, 不如RCH2O-稳定,因此R3COH中质子不易离解
醇金属
醇与金属钠反应发生氢氧键的断裂,放出氢
气,生成醇钠
ROH + M → ROM + H2↑ M = K、Na、Mg、Al
命名
酚的物理性质
纯净的苯酚是没有颜色的晶体,具有特殊气
味,熔点是 43℃。常温时,苯酚在水里溶解 度不大,当温度高于70℃时,能跟水以任意 比互溶。 苯酚易溶于乙醇、乙醚等有机溶剂。苯酚有 毒,它的浓溶液对皮肤有强烈的腐蚀性
一元酚的反应
1.弱酸性:
苯酚羟基上氢原子可有少量电离 而呈现弱酸性,其pKa=9.98。 a. 若苯环邻、对位有强吸电子基降低氧原 子电子云密度,酸性增强。 如:邻硝基酚pKa=7.23;2,4—二硝基苯的 pKa为4.0;2,4,6—三硝基苯酚pKa为 0.71,已属于有机强酸了。
CH3CH2OH + Na → CH3CH2ONa + H2↑ (CH3)3COH + K → (CH3)3COK + H2↑ CH3CH(OH)CH3 + Al → ((CH3)2CHO)3Al + H2↑
烃化_精品文档

O +
CH2Br
DMF OCH2Ph
CF3CH2OH CH2Ph OH
2.1.3醇、酚羟基的保护
在有醇、酚羟基的化合物中,同时存在其他的官 能团,这些官能团发生转换、氧化或还原反应 时,为了不使羟基发生变化,可先将羟基与某些 试剂反应,生成稳定的衍生物,待其他的官能团 转化完成后,再脱除保护基,恢复羟基。
叔卤代烃在强碱中优先发生消除反应,而不 是O-烃化反应。
CH3
CH3O C CH3 的合成
CH3
(1)CH3ONa
+ Cl
CH3 C CH3 CH3
消除 -HCl
CH3
碱
(2)CH3Cl + HO C CH3
CH3
CH3 CH3 C CH2
稳定
CH3O
CH3 C CH3 CH3
在中性或弱碱性条件下,叔卤代烃也可以进 行单分子的亲核取代反应(SN1),也可得 到O-烃化产物。
ROH RCl / R2SO4
• 混合醚:
ROR
ROH + R'Cl
ROR'
• 醇进行O-烃化反应的烃化剂有:
卤代烃RX
硫酸酯(芳磺酸酯)R2SO4、R 环氧烷,如:环氧乙烷
SO3R'
其他的烃化剂
卤代烃RX为烃化剂:
醇在碱(钠、氢氧化钠、氢氧化钾)存在下与 卤代烃RX反应制备混醚,称为威廉森法 (Williamson)。
NO2 非那西丁的中间体
叔卤代烃在强碱中优先发生消除反应,而不是 O-烃化反应。
在中性或弱碱性条件下,叔卤代烃也可以进行 单分子的亲核取代反应(SN1),也可得到O-烃 化产物。
• (2) 醇的影响
(完整word版)第九章卤代烃

第九章 卤代烃教学要点:1.介绍了卤代烃的分类及同分异构现象、卤代烃的命名、卤代烷的结构和物理性 质、化学性质、制备方法。
2.介绍了一卤代烷的取代反应、消去反应(查依采夫规则)、还原反应。
几种常见 的有机金属化合物。
3.介绍了S N 1和S N 2反应历程、碳正离子的生成、结构、不同结构碳正离子的相对稳定性。
4.一卤代烯烃和一卤代芳烃的分类、物理性质、化学性质、有机氟化合物的特性、有机氟化合物的应用。
本章重点:卤代烷的结构,卤代烷的化学反应,亲核取代反应的机理,一卤代烯烃和一卤代芳烃,卤代烃的制备方法,几种常见的有机金属化合物。
本章难点:卤代烷的化学反应,亲核取代反应的机理。
考核要求:识记:卤代烷的命名,一卤代烷的结构。
领会:亲核取代反应的机理。
综合分析:SN1和SN2反应立体化学及影响因素。
熟练应用:一卤代烷的化学反应,卤代烃的制备方法,几种常见的有机金属化合物。
教学时数:6学时 教学内容:第一节 卤代烃的分类、命名及同分异构现象;第二节 卤代烃;第三节 亲核取代反应历程;第四节 一卤代烯烃和一卤代芳烃;第五节 卤代烃的制法; 第六节 重要的卤代烃;第七节 有机氟化合物;第二十四次课 (第47~48学时)卤代烃可以看作是烃分子中一个或多个氢原子被卤原子取代后所生成的化合物。
卤原子是卤代烃的官能团。
常所说的卤代烃是指氯代烃、溴代烃和碘代烃。
而氟代烃的性质和制法都较为特殊。
一卤代烃的性质比较活泼,能发生多种化学反应转化成各种其他类型的化合物。
所以卤代烃是重要的合成中间产物。
第一节 卤代烃的分类、同分异构和命名一、分类 二、命名 三、同分异构现象一、分类卤代烃氟代烃碘代烃溴代烃氯代烃一卤代烃多卤代烃根据卤代烃分子中所含卤原子的数目:根据卤代烃分子中所含卤原子的种类:根据卤代烃分子中烃基的类型:饱和卤代烃不饱和卤代烃芳香族卤代烃根据和卤原子直接相连的碳原子类型:一级卤代烃(伯卤代烃) R -CH 2-X 10-X 二级卤代烃(仲卤代烃) R 2CH-X 20-X 三级卤代烃(叔卤代烃) R 3C-X 30-X二、命名 1.简单的卤代烃,按卤原子相连的烃基的名称来命名,称为卤代某烃或某基卤。
有机化学第二版(全14章答案完整版) _第8-14章
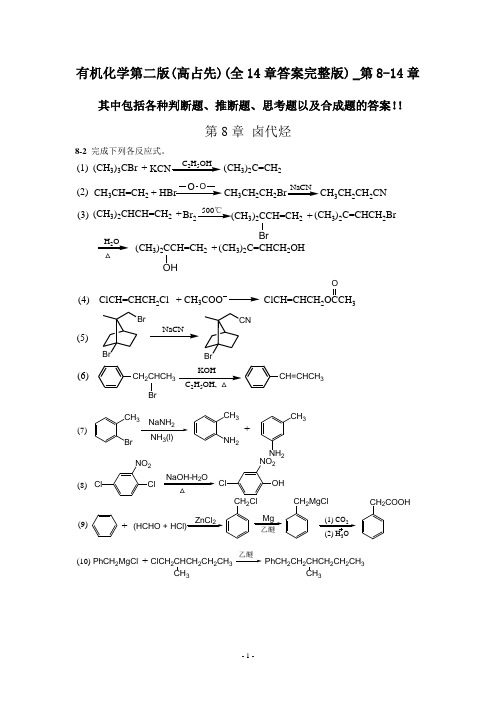
有机化学第二版(高占先)(全14章答案完整版) _第8-14章其中包括各种判断题、推断题、思考题以及合成题的答案!!第8章 卤代烃8-2 完成下列各反应式。
(CH 3)3CBr C 2H 5OH(CH 3)2C=CH 2+CH 3CH=CH 2HBr+O OCH 3CH 2CH 2CH 3CH 2CH 2CNNaCN(1)(2)(CH 3)2CHCH=CH 2Br +500℃(CH 3)2CCH=CH 2BrH 2O (CH 3)2C=CHCH 2Br+(CH 3)2CCH=CH 2OH(CH 3)2C=CHCH 2OH+(3)NaCNKOH 25(4)(5)(6)ClCH=CHCH 2Cl CH 3+ClCH=CHCH 23OBrBrBrCNCH 2CHCH 3Br CH=CHCH 3CH 3Br2NH 3(l)CH 3NH 2CH 3NH 2+ClClNO 2NaOH-H 2OOHClNO 2ZnCl 2(HCHO + HCl)+CH 2ClMgCH 2MgClCH 2COOHClCH 2CHCH 2CH 2CH 3PhCH 2MgCl CH 3+PhCH 2CH 2CHCH 2CH 2CH 3CH3(7)(8)(9)(10)3RC CLi (11)RC CR'RC CCOOHRC CCH2CH2OH CHBr350%NaOH(aq)BrBr(12)8-3写出下列反应主要产物的构型式。
C2H5CH3NaI+C2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3ICH2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrBrCH2CH2CH3CCH2CH3H2Lindar催化剂C CCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么?(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点?(1)产物发生Walden转化;S N2(2)增加溶剂的含水量反应明显加快;S N1(3)有重排反应产物;S N1(4)反应速率明显地与试剂的亲核性有关;S N2(5)反应速率与离去基的性质有关;S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4,醛、酮
HCHO, CH3CHO, C3H7CHO, Ph-CHO,
CH3COCH3,
O
工业上付-克芳烃烷基化反应最常用的烷基化试 剂是烯烃和卤烷,其次是醇、醛和酮。
二、芳环结构对C-烷基化的影响
1,芳环上有给电子基团
(1)烷基,有利于反应 (2)-NH2、-OR、—OH等,与催化剂络合而降低 芳环上的电子云密度而不利于反应。
最常用的是对甲苯磺酸甲酯
四、用环氧乙烷的N-烷基化
环氧乙烷是一种活性较强的烷基化剂,容 易开环,和分子中有活性氢的化合物(如水、 醇、氨、胺、羧酸及酚等)发生加成反应。
环氧乙烷的蒸气与空气的混合物的爆炸范围 很宽,空气含量为3%~98%时都在爆炸范围内。
特点
50
(1)反应活性高,在N上引入CH2CH2OH; (2)连串反应;
HO
CH3
+ 2 H2C
CH3 浓 2SO4 H C CH3
C(CH3)3 HO CH3 C(CH3)3
抗氧剂264
5. 烷基苯胺
是制造农药除草剂拉索的重要中间体,此外 还是制备杀虫剂、植物生长调节剂、医药和染 料中间体。汽油抗爆剂、橡胶抗臭氧剂。 由苯胺与烯烃经烷基化制取。
NH2 C2H5 + 2 H2C CH2 Al(NHC6H5)3
2. 异丙基甲苯
用途: 氧化和酸解可得到混合甲酚和丙酮,间甲酚 是生产彩色电影胶片和高效、低毒农药的原料, 并可用于制造树脂、增塑剂和香料。 甲苯与丙烯烷基化,得到邻、间和对位异丙 基甲苯的混合物。
工艺条件
反应可在釜式串联反应器或塔式反应器中以间 歇或连续方法进行。
CH3
3 + CH2=CH-CH3 100oC
NH2
+
CH2Cl
NH
CH2
+ HCl
(3)反应中有HX产生,易与芳胺成盐
NH2·HCl
常用缚酸剂如:NaOH、Na2CO3、MgO、Ca(OH)2等
(4)R-X的沸点较低,反应宜在压力下进行 如:氯甲烷的沸点:-23.7℃,氯乙烷的沸点 13℃
主要产品:N-乙基-N-苄基苯胺
NHC2H5 + ClCH2
C4H9
浓H 2SO4 C4H9OH 发烟硫酸 磺化 NaOH 中和
C4H9 SO3Na
C4H9
渗透剂BX(拉开粉)
C4H9
在合成橡胶生产中用作乳化剂,在纺织印染 工业中大量用作渗透剂。
B、醛类作为C-烷基化试剂 DDT滴滴涕(1,1,1-三氯-2,2’-双(对氯苯基)乙烷)
O Cl3C-C-H + 2
特点:
(1)烷化剂活泼性
R越长,RX的活性越低 卤代烃的活性与C-X键的键能成反比。 RI > RBr > RCl > RF 卤素相同时
CH3X
RCH2X > R2CHX > R3CX >
(2)反应不可逆,为连串反应
ArNH2 + RX → ArNHR + HX ArNHR + RX → ArNR2 + HX
2,芳环上有吸电子基团
(1)-X、羰基、羧基等,反应需要较苛刻条件。 (2)硝基(-NO2),腈基(-CN),不能进行反 应。
3,烷基进入芳环的位置 (1)低温、低浓度、弱催化剂、短时间,烷基
进入的位置遵循亲电取代反应的规律.
(2)不在上述条件下,烷基进入的位置缺乏规
律.
三、C-烷基化反应的催化剂
(含量0.5%)
用来制备染料、橡胶硫化促进剂、炸药和医药中间体。
Al2O3 . SiO2
NH3 + CH3OH
CH3NH2 + H2O
350℃~500℃
500℃反应时,NH3:CH3OH为2.4:1时,产物比例: 一甲胺54%,二甲胺26%,三甲胺20%.
二、用卤烷作烷化剂的N-烷化反应
卤烷是N-烷基化常用的烷基化剂,其反应活 性较醇强。当需要引入长碳链的烷基时,由于 醇类的反应活性随碳链的增长而减弱,此时就 要用卤烷作烷基化剂。
C-H → C-R N-H → N-R O-H → O-R
烷基化种类
+
H2C
CH CH3
CH3 CH CH3
N(CH3)2
NH2
+ 2CH3OH
H2SO 4
OH
+ CH3Cl
OCH3
§9.2 C-烷基化反应
一、C-烷化剂
1,卤烷
烷基相同时,反应活性为 RCl > RBr > RI 卤原子相同时
烷化试剂:醇、卤代烷、酯、烯烃、醛和酮、 环氧乙烷等。 用途:(1)引入-CH2CH2OH、-CH2CH2CN极性、 非水溶性基团; (2)制备季铵盐型阳离子化合物; (3)其它助剂、医药中间体。
一、用醇或醚的N-烷基化
反应历程
ROH + H+ R+-OH2 R+ + H2O
Ar-NH2 + R+
1.异丙苯
用途: 航空汽油的添加剂,提高油品的辛烷值。 经过氧化和分解,制备苯酚和丙酮。 工业上苯和丙烯的连续烷基化用液相和气 相两种方法均可生产。
+
AlCl3: H3PO4(固) 6~7
CH2=CH-CH3
1
CH3 CH CH3
95~100 ℃,0.2~0.3MPa 170-190 ℃,2~4MPa
用硫酸酯的N-烷化 (1)可在-NH2的N上烷基化而不影响-OH; (2)有多个氨基时,可根据N原子的碱性,选 择性地对一个N烷基化; (3)缺点:毒性大。
R'NH2 + ROSO2R R'NHR + ROSO2OH
R'NH2 + ROSO2Na
R'NHR + NaHSO4
最常用的是硫酸二甲酯。
C、酮类作为C-烷基化试剂 双酚A(2,2’-双(4-羟基苯基)丙烷)
O CH3-C-CH3 + 2
过量
OH 酸性催化剂 脱水缩合
HO
CH3 C CH3
双酚A
OH
§9.3 N-烷基化反应
氨基上的氢原子被烷基取代,或者通过 直接加成而在氮原子上引入烷基的反应,叫 做N-烷基化反应。 ArNH2 + R-Z → ArNHR + HR ArNHR + R-Z → ArNR2 + HR
<100 C 水介质
o
C2H5 N CH2 + HCl
用途:用作酸性橙50;酸性红119;酸性蓝5、7; 酸性绿5、15、65;阳离子兰65等染料的中间体。
三、用酯作烷化剂的N-烷基化
O R-O-S-O-R O
O Ar-S-OR O
O HO-P-OR OH
硫酸二烷基酯
芳磺酸酯
磷酸单酯
都是很强的烷基化试剂,反应可在常压下进 行,但是有些价格高,限制其应用。
三氯乙醛
Cl
浓H 2SO4 o 15-30 C
Cl
H C CCl3
Cl
农药
扩散剂N的制备
SO3H 2 + CH2O 130℃
H2 C + H2O HO3S SO3H
纺织印染的重要助剂
4,4’-二氨基二苯甲烷
NH2
2
+ CH2O
HCl 100℃
H2N
H2 C
NH2
+ H2O
偶氮染料的重氮组分,又是制造压敏染料的 中间体。
路易斯酸 质子酸 酸性氧化物 烷基铝 (AlR3)
1,路易斯酸
质子酸
酸性氧化物
烷基铝
四、烷基化反应历程
催化剂的作用下使烷基化剂强烈极化成为活 泼的亲电质点 亲电质点进攻芳环生成σ-络合物 脱去质子变为最终产物
烯烃做烷基化剂时:
+ R CH CH3 AlCl4
慢
H + CH CH3 AlCl4R
用磷酸酯的N-烷化
磷酸酯与苯胺或其他芳香胺反应可以得到收 率较好、纯度较高的N,N-二烷基芳胺。
NH2 3 + 2(RO)3PO 3 NR2 + 2H3PO4
用芳磺酸酯的N-烷化
ArNH2 + ROSO2Ar'
ArNHR + Ar'SO3H
烷基化用的芳磺酸酯应在反应前制备:芳磺酰 氯与相应的醇在氢氧化钠存在下于低温反应,可 得到芳磺酸酯。/
伯胺
H Ar-N+-R H
Ar-N-R + H+ H 仲胺 R+
R Ar-N-R + H+
叔胺
R Ar-N+-R H
R
+
R Ar-N+-R R
季铵盐
特点 (1)以R+为活性质点的亲电取代反应; (2)使用强酸性催化剂以提供质子; (3)连串反应; (4)可逆反应。
Ar-NH2 + ROH Ar-NHR + ROH K1 K2 ArNHR + H2O ArNR2 + H2O
苯分子引入乙基或异丙基后,进一步烷基化的速 度比苯快1.5~3.0倍。
(2)C-烷基化反应是可逆反应烷基的转移和歧化 (3)烷基可能重排 1-氯丙烷与苯反应产物
六、用烯烃的C-烷基化
在C-烷基化剂中,烯烃是最便宜和活泼的烷基 化剂,广泛应用于工业上芳烃、芳胺和酚类的C烷基化。
液相法:路易斯酸和质子酸为催化剂。 气相法:固体酸催化剂(如:磷酸-硅藻土, BF3-γ-Al2O3)
