测定反应速度 (1)
化学反应速度的测定与反应速度常数

化学反应速度的测定与反应速度常数化学反应速度是反应物转化为产物的速率。
了解反应速度及其常数对于探究反应性质以及优化反应过程至关重要。
本文将介绍化学反应速度的测定方法,以及如何计算反应速度常数。
一、化学反应速度的测定方法化学反应速度的测定方法有多种,下面将分别介绍几种常用的方法。
1. 观察法观察法是最简单直观的测定反应速度的方法。
通过观察反应物消失或产物生成的程度和时间之间的关系来确定反应速度。
例如,可以通过观察溶液颜色的变化、气体的体积变化或沉淀的形成来判断反应速度的快慢。
2. 收集气体法对于气体反应,可以使用收集气体法来测定反应速度。
该方法通过测量反应物或产物产生的气体体积的变化来确定反应速度。
常见的收集气体法包括水滴法、气体体积计法等。
3. 导电法某些反应会导致电导率的变化,从而可以使用导电法来测定反应速度。
该方法通过测量反应物浓度变化对电导率的影响来确定反应速度。
4. 滴定法滴定法是一种常用的测定反应速度的方法,特别适用于酸碱滴定反应。
通过滴定剂滴加到反应体系中,测量滴定剂消耗的体积和时间的关系来计算反应速度。
二、反应速度常数的计算反应速度常数是描述反应速率的物理量,可以通过实验测定来计算。
下面将介绍两种常见的计算反应速度常数的方法。
1. 初始速率法初始速率法是一种测定反应速度常数的常用方法。
它基于反应速率与反应物浓度的关系,在反应初期测得几组不同浓度下的反应速率,然后利用速率方程求解反应速度常数。
2. 积分法积分法是另一种计算反应速度常数的方法,适用于一阶反应。
该方法通过测定不同时间点上反应物浓度的变化,并绘制反应物浓度与时间的关系曲线,从曲线的斜率计算出反应速度常数。
三、应用与意义了解反应速度及其常数对于化学工业、环境科学、生物化学等领域具有重要意义。
它可以帮助我们优化反应条件,提高反应效率;了解反应机理,预测反应过程及产物生成;探究化学动力学,揭示反应物质转化的规律性。
总结:本文介绍了化学反应速度的测定方法,包括观察法、收集气体法、导电法和滴定法等。
化学反应速度、反应级数和活化能的测定

化学反应速度、反应级数和活化能的测定一、实验目的(1)了解浓度、温度和催化剂对反应速度的影响。
(2)测定过二硫酸铵与碘化钾反应的平均反应速度、反应级数和活化能。
二、预习与思考(1)预习化学反应速度理论以及浓度、温度和催化剂对反应速度的影响等有关内容。
(2)思考下列问题:①在向KI 、淀粉和Na 2S 2O 3混合溶液中加入(NH 4)2S 2O 8时,为什么必须越快越好? ②在加入(NH 4)2S 2O 8 时,先计时后搅拌或者先搅拌后计时,对实验结果有什么影响?三、基本原理在水溶液中,过二硫酸铵与碘化钾发生如下反应,即(NH 4)2S 2O 8+3KI====(NH 4)2SO 4+K 2SO 4+KI 3反应的离子议程式为--+I O S 3282====--+3242I SO (1) 该反应的平均反应速度与反应物物质的量的浓度的关系可用下式表示n m I c O S kc tO S c )()()(282282---∙≈∆∆-=υ式中,)(282-∆O S c 为-282O S 在t ∆时间内物质的量浓度的改变值;)(282-O S c 、n I c )(-分别为两种离子初始物质的量浓度(mol·L -1);k 为反应速度常数;m 和n 为反应级数。
为了能够测定)(282-∆O S c ,在混合(NH 4)2S 2O 8和KI 溶液时,同时加入一定体积的已知浓度的Na 2S 2O 3溶液和作为指示剂的淀粉溶液,这样在反应(1)进行的同时,也进行如下的反应--+32322I O S ====--+I O S 3262 (2) 反应(2)进行得非常快,几乎瞬间完成,而反应(1)却慢得多,所以由反应(1)生成的-3I 立即与-232O S 作用生成无色的-262O S 和-I 。
因此,在反应开始阶段,看不到碘与淀粉作用而产生的特有的蓝色,但是一旦Na 2S 2O 3耗尽,反应(1)继续生成的微量的-3I 立即使淀粉溶液显示蓝色。
化学反应速率的测定方法

化学反应速率的测定方法化学反应速率是描述化学反应快慢的指标,对于研究和控制化学反应过程具有重要意义。
因此,准确测定化学反应的速率是化学研究和工业生产中必不可少的一项工作。
本文将介绍几种常用的化学反应速率的测定方法。
一、初始速率法初始速率法是最常用的一种测定化学反应速率的方法。
其基本原理是在反应初期的一个较短时间段内,通过测定反应物浓度的变化来确定反应的速度。
具体步骤如下:1. 准备一定浓度的反应物溶液,并将其加入反应容器中。
2. 在反应开始后的几秒钟内,快速取出一小部分反应混合物。
3. 使用适当的分析方法(如色谱法、比色法等)测定取出的反应混合物中反应物的浓度变化。
4. 根据反应物浓度的变化来确定初始速率。
初始速率法的优点是可以测定反应初期的速率,对于反应机理和影响因素的研究具有重要意义。
二、等温反应速率法等温反应速率法适用于在相对恒定的温度下进行反应速率的测定。
其基本原理是通过监测反应物浓度变化的方式来确定反应速率。
具体步骤如下:1. 准备一定浓度的反应物溶液,并将其加入反应容器中。
2. 将反应容器置于恒温槽中,并使温度保持恒定。
3. 通过适当的分析方法(如光谱法、电化学法等)测定反应物浓度的变化。
4. 根据反应物浓度变化的速率来确定反应速率。
等温反应速率法的优点是能够在恒定温度下进行测定,适用于需要长时间进行反应的情况。
三、滴定法滴定法是一种常用的化学分析方法,也可以用于测定化学反应速率。
其基本原理是通过滴定试剂与反应物之间的反应,来确定反应速率。
具体步骤如下:1. 准备一定浓度的反应物溶液,并将其放置于滴定容器中。
2. 加入适量的试剂溶液,并开始滴定。
3. 在滴定过程中,记录试剂溶液的滴定量与时间的变化。
4. 根据滴定量与时间的关系来确定反应速率。
滴定法的优点是操作简单,结果可靠,适用于一些需要获得实时反应速率的情况。
四、光度法光度法是一种基于反应物溶液的吸光度变化来测定反应速率的方法。
其基本原理是通过测定反应物和产物溶液的吸光度,来确定反应速率。
测定反应速率实验报告

测定反应速率实验报告测定反应速率实验报告引言:反应速率是化学反应中一个重要的物理量,它描述了反应物转化为产物的速度。
测定反应速率的实验是化学实验中常见的一种实验,通过测量反应物浓度的变化来确定反应速率。
本实验旨在通过测定不同反应物浓度下的反应速率,探究反应速率与反应物浓度之间的关系。
实验方法:1. 实验器材准备:- 反应瓶:用于反应物混合的容器,具有透明度好的特点,以便观察反应过程。
- 稀释瓶:用于制备不同浓度的反应物溶液。
- 秒表:用于测量反应时间。
- 试剂:根据实验需求选择适当的反应物和催化剂。
2. 实验步骤:1) 制备不同浓度的反应物溶液:根据实验要求,在稀释瓶中按照一定比例配制不同浓度的反应物溶液。
2) 将反应物溶液倒入反应瓶中:将事先准备好的不同浓度反应物溶液倒入反应瓶中,注意避免溅出。
3) 加入催化剂:根据实验需求,在反应瓶中加入适量的催化剂,以促进反应的进行。
4) 开始计时:在加入催化剂后立即开始计时。
5) 观察反应过程:通过观察反应瓶中的变化,如颜色、气泡等,来判断反应的进行情况。
6) 记录反应时间:当反应达到一定程度时,停止计时,并记录下反应时间。
7) 重复实验:重复以上步骤,进行多次实验,并取平均值。
实验结果与数据处理:根据实验步骤所得到的数据,我们可以进行数据处理和分析,以得出反应速率与反应物浓度之间的关系。
以反应物A的浓度为自变量,反应速率为因变量,绘制反应速率与反应物浓度的曲线图。
根据实验数据,我们可以得到一个直观的图像,进一步分析反应速率与反应物浓度之间的关系。
通过数据处理和图像分析,我们可以得出以下结论:1. 反应速率随着反应物浓度的增加而增加,呈正相关关系。
2. 当反应物浓度达到一定值后,反应速率趋于稳定,不再显著增加。
3. 反应速率与反应物浓度之间存在一定的函数关系,可以通过拟合曲线来确定具体的函数关系。
讨论与误差分析:在实验过程中,可能会存在一些误差,如仪器误差、操作误差等。
测定反应速度

P104 测定反应速度本“探究”不单纯是要求学生展开测定反应速度的活动,而是更加注重培养学生提出问题的水平,引导学生尝试设计实验,并由此增强学生探究活动的自主性。
这是第一次由学生自己独立完成一个完整的探究活动,包括从提出问题、作出假设、制订计划到实施计划和得出结论的全过程。
为此,教师应做好充分的准备工作,如教师能够在完成第一节课(相关反射的)教学时,布置各学生小组围绕“测定反应速度”作探究设计;要求在第二节课(完成相关反射弧的教学)前各小组应就设计方案与教师交流,教师应给予协助和指导。
第二节课堂上,教师能够先安排一定的时间让学生交流设计方案,然后教师应引导学生剖析点评一个有创意的设计。
教师应鼓励和表扬有创意的假设和可操作的设计方案。
1、提出问题情景:由1、抢凳子2、倒写数字3、音乐声中做相反动作4、按抢答器、体育运动中传球、救球、投球等游戏引入。
相关“提出问题”局部的要求:①要与该课题——人的反应速度有密切关系。
②所提问题最好有发散性,如人的反应速度与测量方式(如两手指张开的角度、手的姿势)相关吗?与测量用具(尺子材料和长短等)相关吗?人的反应速度与测量的时间(如早上、夜晚)相关吗?人的不同结构部位(左、右手或手指搭配不同)反应速度相同吗?与身体状况、注意力集中与否、爱好兴趣等相关吗?与人的年龄、性别、性格相关吗?各人对不同事物的反应如光、色、重量、形状等的反应速度一样吗?人的反应与训练相关吗?2、相关“作出假设”局部的要求,应与提出的问题具有相关性。
1、相关“制定计划”的要求是,①操作性强;②能控制可变因素(设置对照实验);③能注意设置重复实验;④所获取数值的方法应一致。
教师协助分析实验方案中的科学性与不科学性,严谨性与不严谨性,由此肯定或否认学生的实验方案。
下面是供参考的案例:提出问题:人的反应速度与性别相关吗?作出假设:人的反应速度与性别相关制定计划:①用书中提供的测量方法测试②用长度为30厘米的尺子测试③在所有的测量中,受试者的拇指、食指都要距尺子刻度值为0的一端同样远④读取刻度值时均以拇指上缘为准。
实验报告化学反应速率的测定

实验报告化学反应速率的测定实验报告:化学反应速率的测定一、引言化学反应速率是描述化学反应中物质转化速度的指标,该指标对于了解反应过程、优化反应条件以及探索新领域的应用都具有重要意义。
本实验旨在通过观察不同条件下的反应速率变化,探究影响反应速率的因素,并利用适当的实验数据处理方法确定反应速率的变化规律。
二、实验目的1. 使用废酸与碱的中和反应,测定不同浓度下化学反应的速率。
三、实验原理反应速率表示单位时间内反应物消耗及生成物生成的量,反应速率的测定可通过反应物的消失或生成物的增加来体现。
本实验选取酸与碱的中和反应作为研究对象,反应方程式如下:H3PO4 + NaOH → NaH2PO4 + H2O四、实验步骤1. 预先准备不同浓度的稀硫酸和氢氧化钠溶液。
2. 将一定量的稀硫酸溶液倒入反应烧瓶中,加入适量的酚酞指示剂。
3. 通过滴管向烧瓶中加入稀碱溶液,边滴加边快速摇晃烧瓶。
4. 当溶液由粉红色变为无色时,立即停止滴加,并记录停止滴加时的时间。
5. 重复以上步骤,使用不同浓度的碱溶液进行实验,记录实验数据。
五、实验数据与结果按照上述步骤进行了一组实验,使用了不同浓度的碱溶液,实验数据如下表所示:实验组别 | 碱溶液浓度(mol/L) | 一阶速率常数(k)(s⁻¹)-----------|-------------------|---------------------实验组1 | 0.02 | 0.002实验组2 | 0.04 | 0.004实验组3 | 0.06 | 0.006实验组4 | 0.08 | 0.008实验组5 | 0.10 | 0.010根据实验数据可以得出:随着碱溶液浓度的增加,反应速率显著上升。
碱溶液浓度和反应速率呈正比关系,反应速率与碱溶液的浓度之间存在着一定的线性关系。
六、数据处理与分析本实验所得到的实验数据可以用于进一步分析。
根据反应物和生成物的浓度变化关系及反应速率的定义,可以建立起速率方程:速率 = k * [碱溶液]其中,k为一阶速率常数,[碱溶液]表示碱溶液的浓度。
反应速度测试实验报告
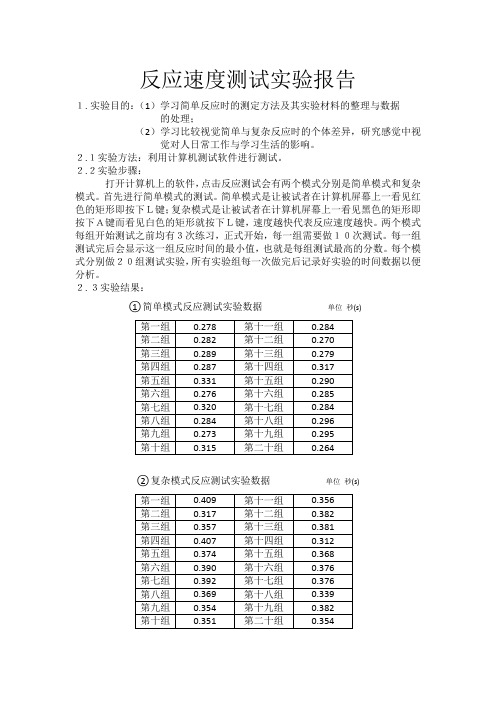
反应速度测试实验报告1.实验目的:(1)学习简单反应时的测定方法及其实验材料的整理与数据的处理;(2)学习比较视觉简单与复杂反应时的个体差异,研究感觉中视觉对人日常工作与学习生活的影响。
2.1实验方法:利用计算机测试软件进行测试。
2.2实验步骤:打开计算机上的软件,点击反应测试会有两个模式分别是简单模式和复杂模式。
首先进行简单模式的测试。
简单模式是让被试者在计算机屏幕上一看见红色的矩形即按下L键;复杂模式是让被试者在计算机屏幕上一看见黑色的矩形即按下A键而看见白色的矩形就按下L键,速度越快代表反应速度越快。
两个模式每组开始测试之前均有3次练习,正式开始,每一组需要做10次测试。
每一组测试完后会显示这一组反应时间的最小值,也就是每组测试最高的分数。
每个模式分别做20组测试实验,所有实验组每一次做完后记录好实验的时间数据以便分析。
2.3实验结果:○1简单模式反应测试实验数据单位秒(s)○2复杂模式反应测试实验数据单位秒(s)3.实验不足与完善:(1)这次实验不足分为三个方面。
首先,由于时间方面条件的限制,测试实验的实验组偏少导致数据偏少,这样无法准确地得出结论。
其次就是环境因素对被试者的影响,被试者是一起在同一间计算机室操作,有时候其他人的肢体动作、说话声音会互相影响到测试时候的反应时间,甚至有些测试者为了快点可以结束而不休息地测试,长时间地看着计算机的屏幕,导致用眼疲劳从而影响反应的时间。
还有可能被试者的身体状态并不是很好,导致注意力不集中,这样也影响到反应的时间。
最后,可能就是仪器的选择问题,被试者需要用计算机上的软件操作这次的反应测试实验,则当被试者按下键盘上的按钮到传达到计算机上的时间可能也会因为计算机的好坏而影响到被试者真实的反应时间。
(2)实验的完善:时间方面可以选择一个绝大多数被试者都有十分空闲的时间段,而场地可选择有适当间隔的、互不影响的计算机室。
被试者应当在测试前确定身体状态是否良好,不能在身体状态可能会影响注意力的情况下还勉强测试,且应当在测试完五至六组实验后适当休息眼睛降低或者避免用眼疲劳。
测定反应速度

3、反应速度的快慢跟个性差异有关,还与身体 状况,注意力是否集中,不同的神经通路有关。
4、直尺测速法:利用自由落体的原理,是最简 易的测试反应速度的方法,测试方法是测试者捏住 直尺的末端(刻度最大)将直尺提起,受试者将右 手的拇指和食指分开,并将两手指放在直尺起始端 零刻度的位置的两边,眼睛盯住测试者捏的尺。当 测试者将手松开,直尺会自由落下,此时受试者的 拇指和食指立即合拢将下落的直尺捏住,并记录拇 指上缘的直尺刻度。直尺落下的刻度大致体现了受 试者反应速度的快慢。利用自由落体的计算公式 H=1/2gt2,可计算出被测者产生反应的时间。
二、活动方案
㈠目的要求:
通过实验,了解反应速度与个性差异、
注意力是否集中有关。养成严谨的科学
态度。
㈡材料用具:
直尺(30公分木尺)
㈢制定并实施计划:
1.提出问题:
。பைடு நூலகம்
2.作出假设:
。
3.制定计划: ⑴分组,以两人为一实验小组,两人轮流提任测 试者、被测者。 ⑵测试常态(集中注意力)下每人的反应速度。
探究:测定反应速度
40课时
一、知识准备 1、反应速度是指从某个反射弧的感 受器接受刺激开始,经过产生兴奋, 传导神经冲动,最后到效应器完成反 射所需要的全部时间。反应速度又叫 反射时。 2、反射弧是完成反射的神经结构, 完整的反射弧是由感受器,传入神经, 神经中枢,传出神经和效应器等五部 分组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1、学会测量测定反应速度。 2、说出探究的一般过程。通过“测定反应速
度”这个完整的探究活动,进一步提高学 生的合作能力,探究能力,对数据的处理 和分析能力。 3、认同“勤能补拙”的道理 。
想一想测定反应速度有哪些方法?
秒表
电脑
直尺
2人一组利用直尺测量法练习 要求
(1) 安静有素的进行活动 (2)求算每个人的反应平均速
放在0刻度上 6、受测者尽量以相同的状态投入每次测试 7、测试过程中务必保持安静
展示成果
小组主动展示统计表
讨论
1、实验只测量一次可以吗? 2、探究实验一定要设定对照
实验吗? 3、以上活动是反射吗?
影响反应速度的因素有哪些?
1、干扰如注意力是否集中 2、睁眼闭眼 3、不同直尺长度 4、不同类型尺子 5、性别 6、年龄 7、疲劳度 8、不同直尺长度工具准确度 9、健康状况
度
(3)绘制一人的反应速度统计 表
⑴分组,以两人为一实验小组,两人轮流提 任测试者、被测者。
⑵测试常态(集中注意力)下每人的反应速 度。
①测试者将直尺末端(刻度最大)捏住,并 将直尺坚直提起。
②被测者的拇指和食指分开,放在直尺零刻 度的两边,两指分别距直尺一厘米不,集中 注意力眼睛盯住直尺。 ③测试者松开手,直尺下落。
④被测者看到直尺下落立即合拢手指夹 住尺。
⑤读出并记录拇指上缘对应的刻度。重 复测试5次。 ⑥两人轮换,也重复测试5次。 ⑶测试在有干扰(注意力不集中)状态 下人的反应速度,也是每人重复测试5 次。并记录数据。
注意事项
1、测试者不要给受测者任何暗示 2、直尺不要在测试者手中停留时间过长 3、测试者不要晃动直尺,不要做出欺骗行为 4、直尺下方要有足够空间 5、受测者尽量手指与直尺保持1厘米距离,
提高反应速度有什么意义
在赛场上提高运动成绩
避免交通事故发生
在课堂上提高学习效率
这节课学到了哪些知识?
我学到了。。。。。。。
1.当你用拇指和食指速夹住垂直落下的尺予 时,尺子刻度值的大小可反应你的如图为测 定开始和结束手的位置,请你准确读取尺子
上能够反映的刻度值(单位cm)( C )
A.1cm
