测定纤维素酶活实验方法总结及优化方案
纤维素酶酶活的测定方法

检测分析纤维素酶酶活的测定方法河南省科学院生物研究所 刘德海 杨玉华 安明理河南省饲料产品质量监督检验站 陈小鸽 饲用纤维素酶在饲料工业中已普及应用,对其质量检测显得日益重要。
纤维素酶是一种复合酶,按作用底物的能力划分为两部分,一部分是对棉花纤维素能起催化水解作用的酶,称为C1酶;另一部分是对羧甲基纤维素钠(Na-CMC)起水解作用的酶,称为C x酶。
据此,一般采用两种测定方法,一种是适用于C X酶的CMC法,另一种是适用于C1酶的滤纸法。
下面就此两种方法作一介绍。
1 C MC(羧甲基纤维素)法1.1 材料1.1.1 饲用纤维素酶 由河南省科学院生物研究所提供。
1.1.2 试剂 磷酸氢二钠、柠檬酸、羧甲基纤维素、3,5-二硝基水杨酸、氢氧化钠、酒石酸钾钠、亚硫酸钠、苯酚。
1.1.3 仪器 721型分光光度计、恒温水浴锅、PHS-2酸度计、秒表。
1.1.4 试剂配制1.1.4.1 pH5.0柠檬酸缓冲液 制取0.2mol/L 磷酸氢二钠液(称取7.16g磷酸氢二钠溶解于蒸馏水中,定容至100mL)和0.1mol/L的柠檬酸液(称取2.1g柠檬酸溶解于蒸馏水中,定容至100 mL),取磷酸氢二钠液24.3mL、柠檬酸液25.7mL 混匀,用精密酸度计测至pH值为5.0。
1.1.4.2 羧甲基纤维素溶液 准确称取2.0g羧甲基纤维素钠盐溶于200mL水中,沸水浴中加热至溶化,过滤,取滤液100mL,加柠檬酸缓冲液20 mL、蒸馏水40mL,混匀,贮存于冰箱中备用。
1.1.4.3 3,5-二硝基水杨酸显色液 准确称取6.3g3,5-二硝基水杨酸置于2mol/L氢氧化钠262mL溶液中,然后加酒石酸钾钠的热溶液(182.0g酒石酸钾钠溶于500mL水中),再加5.0 g苯酚和5.0g亚硫酸钠,搅拌至溶解,冷却后定容至1000mL,贮于棕色瓶中置冰箱中备用。
1.1.4.4 0.1%标准葡萄糖溶液 准确称取经105℃烘至恒重的无水葡萄糖250.000mg,溶于蒸馏水中,定容至250mL。
纤维素酶活测定
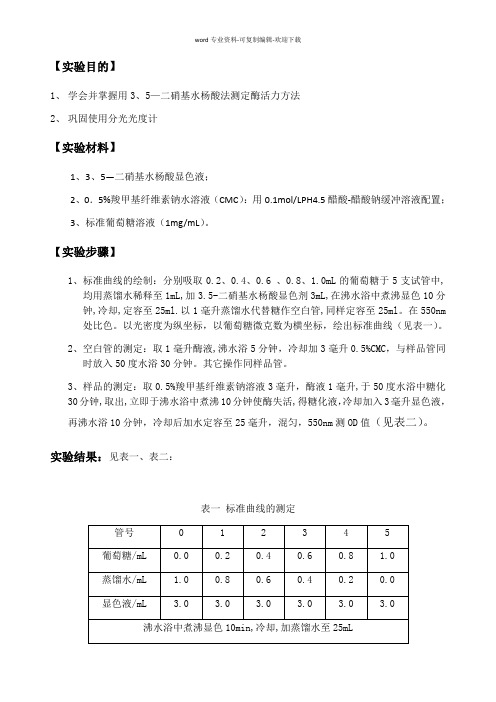
【实验目的】1、学会并掌握用3、5—二硝基水杨酸法测定酶活力方法2、巩固使用分光光度计【实验材料】1、3、5—二硝基水杨酸显色液;2、0.5%羧甲基纤维素钠水溶液(CMC):用0.1mol/LPH4.5醋酸-醋酸钠缓冲溶液配置;3、标准葡萄糖溶液(1mg/mL)。
【实验步骤】1、标准曲线的绘制:分别吸取0.2、0.4、0.6 、0.8、1.0mL的葡萄糖于5支试管中,均用蒸馏水稀释至1mL,加3.5-二硝基水杨酸显色剂3mL,在沸水浴中煮沸显色10分钟,冷却,定容至25ml.以1毫升蒸馏水代替糖作空白管,同样定容至25ml。
在550nm 处比色。
以光密度为纵坐标,以葡萄糖微克数为横坐标,绘出标准曲线(见表一)。
2、空白管的测定:取1毫升酶液,沸水浴5分钟,冷却加3毫升0.5%CMC,与样品管同时放入50度水浴30分钟。
其它操作同样品管。
3、样品的测定:取0.5%羧甲基纤维素钠溶液3毫升,酶液1毫升,于50度水浴中糖化30分钟,取出,立即于沸水浴中煮沸10分钟使酶失活,得糖化液,冷却加入3毫升显色液,再沸水浴10分钟,冷却后加水定容至25毫升,混匀,550nm测OD值(见表二)。
实验结果:见表一、表二:表一标准曲线的测定表二样品的测定图一:标准葡萄糖光吸收曲线结果分析:拟合所得的标准曲线为:Y=7.439×10-4X-0.00243。
拟合度为0.99917。
由样品的A值,可得三份溶液的葡萄糖含量分别为:652.5ug,648.5ug,653.9ug。
所以平均含量:651.6ug。
纤维素酶活力单位=651.6/0.01×30=2172 ug/mg×min【思考与讨论】1、在测定时为使各样品和空白管处理一致,应同时加入试剂,同时放入水浴中,同时取出水浴,以使反应得进行程度一致。
2、在测溶液的OD值之前,应将溶液摇匀,摇匀的方法是用保鲜膜蒙住试管口,然后来回震荡试管。
纤维素酶活力的测定

实验二十纤维素酶活力的测定一、目的学习和掌握3,5-二硝基水杨酸(DNS)法测定纤维素酶活力的原理和方法,了解纤维素酶的作用特性。
二、原理纤维素酶是一种多组分酶,包括C 酶、C 酶和 |?-葡萄糖苷酶三种主要组分。
其中C1 X 1酶的作用是将天然纤维素水解成无定形纤维素,C 酶的作用是将无定形纤维素继续水解成X纤维寡糖,|?-葡萄糖苷酶的作用是将纤维寡糖水解成葡萄糖。
纤维素酶水解纤维素产生的纤维二糖、葡萄糖等还原糖能将碱性条件下的3,5-二硝基水杨酸(DNS)还原,生成棕红色的氨基化合物,在540nm波长处有最大光吸收,在一定范围内还原糖的量与反应液的颜色强度呈比例关系,利用比色法测定其还原糖生成的量就可测定纤维素酶的活力。
三、实验材料、主要仪器和试剂1.实验材料(1)纤维素酶制剂 500mg(2)新华定量滤纸 50mg / 份 4(3)脱脂棉花 50mg / 份 4(4)羧甲基纤维素钠(CMC) 510mg(5)水杨酸苷 500mg2.主要仪器(1)722 型或其他型号的可见分光光度计(2)恒温水浴 2 台(3)沸水浴锅(4)电炉子(5)剪刀(6)万分之一分析天平(7)恒温干燥箱(8)冰箱(9)试管架(10)胶头滴管(11)具塞刻度试管 20mL24(12)移液管或加液器 0.5 mL3;2mL7(13)容量瓶 100 mL6;1000 mL3(14)量筒 50 mL2;100 mL1;500 mL1(15)烧杯 100 mL6;500mL3;1 000 mL13.试剂(均为分析纯)(1)浓度为 1mg/mL的葡萄糖标准液将葡萄糖在恒温干燥箱中105℃下干燥至恒重,准确称取100mg 于100mL小烧杯中,用少量蒸馏水溶解后,移入100mL容量瓶中用蒸馏水定容至 100mL,充分混匀。
4℃冰箱中保存(可用 12~15 天)。
(2)3,5-二硝基水杨酸(DNS)溶液准确称取DNS 6.3g于500mL大烧杯中,用少量蒸馏水溶解后,加入2mol/L NaOH 溶液 262mL,再加到 500mL含有 185g酒石酸钾钠(C H O KNa ! 4H O,MW=282.22)的热4 4 6 2水溶液中,再加5g结晶酚(C H OH,MW=94.11)和5g无水亚硫酸钠(Na SO ,MW=126.04),6 5 2 3搅拌溶解,冷却后移入1 000mL容量瓶中用蒸馏水定容至1 000mL,充分混匀。
DNS法测定纤维素酶活实验方法总结及优化方案
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
1、葡萄糖标准曲线制作:
530nm比色。
2、酶活测定方法:
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致。
单位酶活的计算:T n k OD ml U 1000
1
)/(⨯⨯⨯=酶活力 n :稀释倍数; K :曲线斜率; T :反应时间,min ; 1000:mg 换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法。
纤维素酶酶活测定

纤维素酶酶活测定纤维素酶活测定方法一、原理纤维素酶能将纤维素降解成纤维二糖和葡萄糖,具有还原性末端的纤维二糖糖和有还原基团的单糖在沸水浴条件下可与DNS试剂发生显色反应。
反应颜色强度与酶解产生的还原糖量成正比,而还原糖量又与反应液中的纤维素酶的活力成正比。
酶活定义纤维素酶活力单位是指55℃、pH5.0的条件下,以每分钟催化羧甲基纤维素钠水解生成1μmol还原糖所需的酶量定义为一个酶活力单位U。
二、实验试剂羧甲基纤维素钠(聚合度1700-2000),内切纤维素酶(苏柯汉)50mmol NaAC-HAC、DNS试剂三、实验仪器容量瓶(1000ml ×2、500 ml×3、100 ml ×4、50ml×4 ml)、移液器、烧杯(500ml×3、50ml×3)、具塞试管、电热套、水浴锅、分光光度计、pH计、电子天平四、标准曲线的绘制五、酶活测定由于苏柯汉给定的pH范围为4.8-5.2,故选用pH 5.0的50mmol NaAC-HAC缓冲液测定纤维素酶酶活。
1、样品的制备CMC-Na溶液的制备:用pH 5.0的50mmol NaAC-HAC缓冲液配置0.5%的CMC-Na (羧甲基纤维素钠)溶液,准确称量CMC-Na0.05g,精确至0.001g,溶于蒸馏水中,45℃水浴锅中搅拌溶解,冷却后定容至100ml。
纤维素酶液的制备:准确称取纤维素酶,精确到0.001g。
用50mmol NaAC-HAC pH5.0的缓冲液配置成适当的浓度10000倍,保证吸光度在0.2-0.6之间。
2、DNS法测酶活:取1.8ml 0.5% CMC-Na的溶液于25ml 具塞刻度试管中,55℃预热10min左右,加入0.2ml 适当稀释的酶液,于55℃水浴锅中保温30min后,然后加2ml DNS,混匀,沸水浴5min,冷却至室温,定容到25ml。
混匀测OD540nm。
DNS法测定纤维素酶活实验方法总结及优化方案
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
1、葡萄糖标准曲线制作:
530nm比色。
2、酶活测定方法:
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致。
单位酶活的计算:T n k OD ml U 1000
1
)/(⨯⨯⨯=酶活力 n :稀释倍数;
K:曲线斜率;
T:反应时间,min;
1000:mg换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法。
纤维素酶的三种活力测定方法

纤维素酶的三种活力测定方法纤维素酶是一种广泛存在于自然界中的酶类,具有重要的降解纤维素的功能。
对于工业生产、环境保护及生物能源等领域都有着极为广泛的应用。
因此,纤维素酶的测定方法也越来越受到研究者的关注。
本文将针对纤维素酶的三种活力测定方法进行详细介绍。
一、滴定法滴定法是最为简单、传统的纤维素酶活力测定方法。
其操作步骤相对较简单,但由于其受试物中的葡萄糖数量较小,因此准确度不如其他测定方法。
滴定法的具体操作步骤如下:1.采用苯酚褐或者硫酸铜-硫氰化钾将葡萄糖转化为光滑葡萄糖2.使用离子交换树脂净化试样3.通过酸水解,将可分离出的光滑葡萄糖转化为葡萄糖4.通过NaOH溶液中添加试样,测定试样所需要的NaOH溶液的体积二、反向相色谱法反向相色谱法是一种基于色谱技术的测定方法。
比滴定法更加准确且可靠。
反向相色谱法可以通过改变样品与固相载体的交互时间,实现对样品组分的分离。
其操作步骤如下:1.使用有机溶剂混合纤维素样品2.净化溶液,分离部分有机溶剂和水3.试样在反向相色谱柱上,随柱子流动4.通过检测器检测滴量,确定样品的浓度三、淀粉-纤维素显色法淀粉-纤维素显色法是一种基于酶法和化学显色技术结合的测定方法。
其同时测定酶反应的数量和反应的速率,可以获得相对准确的数据。
具体操作过程如下:1.样品中的淀粉与纤维素同时与碘反应2.通过求字头光度的变化及测试时间的变化,测定酶的活力3.以酶动力学为基础,通过数据分析得到相应的酶反应速率总结起来,以上三种方法均可用于纤维素酶的活力测定。
针对不同的需求,可以选择适当的方法进行测定。
其中,受试物的纯度和净化程度是影响精度的关键因素,因此在测定前要进行适当的纯化。
在生产过程中,可以选择淀粉-纤维素显色法作为主要测定方法,以保证产物质量的稳定性和可控性。
纤维素酶活的测定(优选.)

纤维素酶活的测定一纤维素酶活力单位定义在37℃、pH值为5.50的条件下,每分钟从浓度为4mg/ml的羧甲基纤维素钠溶液中降解1umol还原糖所需要的酶量为一个酶活力单位U。
二测定原理纤维素酶能将羧甲基纤维素降解成寡糖和单糖。
具有还原性末端的寡糖和有还原集团的单糖在沸水浴条件下可以与DNS试剂发生显色反应,反应颜色的强度与酶解产生的还原糖量成正比,而还原糖的生成量又与反应液中的纤维素酶的活力成正比。
因此,通过分光比色测定反应液颜色的强度,可以计算反应液中的纤维素酶的活力。
三试剂与溶液除特殊说明外,所用的试剂均为分析纯,水均为符合GB/T6682中规定的三级水。
3.1 葡萄糖溶液,c(C6H12O6)=10.0mg/ml称取无水葡萄糖1.000g,加水溶解,定容至100ml。
3.2 乙酸溶液,c(CH3COOH)=0.1mol/L吸取冰乙酸0.60ml,加水溶解,定容至100ml。
3.3 乙酸钠溶液,c(CH3COONa)=0.1 mol/L称取三水乙酸钠1.36g,加水溶解,定容至100ml。
3.4 氢氧化钠溶液,c(NaOH)=200g/L称取氢氧化钠20.0g,加水溶解,定容至100ml。
3.5 乙酸-乙酸钠缓冲溶液,c(CH3COOH-CH3COONa)称取三水乙酸钠11.57g,加入冰醋酸0.85ml,加水溶解,定容至1000ml,测定溶液的pH值,如果pH偏离5.50,用乙酸溶液(3.2)或乙酸钠溶液(3.3)调至5.50.3.6 羧甲基纤维素钠溶液,0.8%(w/v)称取羧甲基纤维素钠(Sigma C5678)0.40g,加入到盛有30ml3.5缓冲溶液的烧杯中,磁力搅拌,同时缓慢加热,直至羧甲基纤维素钠完全溶解(在搅拌加热过程中可以补加适量的缓冲液,但是溶液的总体积不能超过50ml),停止搅拌,用3.5缓溶将其定容至50ml,羧甲基纤维素钠溶液能立即使用,使用前适当摇匀。
4℃避光保存,有效期为3天。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DNS法测定酶活实验方法总结及优化方案
目前纤维素酶没有统一的测定方法,诸多因素影响纤维素酶酶活测定大小的比较。
选择适宜的酶活测定条件,提高测定结果的准确性,可根据有关资料中采用的测定条件,以及通过控制变量法对酶活力测定中的主要影响因素进行研究。
目前实验室采用测酶活方法:
1、葡萄糖标准曲线制作:
530nm比色。
2、酶活测定方法:
考虑到酶液中培养基成分会对吸光值造成一定的影响,所以空白管0还是采用先将酶高温灭活的方法,后面保持实验条件一致,显色时间与标准曲线的显色时间保持一致。
单位酶活的计算:T n k OD ml U 1000
1
)/(⨯⨯⨯=酶活力 n :稀释倍数; K :曲线斜率; T :反应时间,min ; 1000:mg 换算成ug.
以下是近期所做的实验结果:
葡萄糖标准曲线
两种产纤维素酶细菌不同测试结果
测定结果
实验结论:从以上几种对酶液的处理方法来看,183的酶活要比R2高,两种菌都是以胞外酶为主。
目前尚没找到有关于加缓冲溶液并且超声破碎的文献,所得测量结果与前面三种方法均不符,这一步需另外探索。
根据《纤维素酶活力测定条件研究》(夏服宝等,《饲料工业》2005年第26卷第16期)和《影响纤维素酶活力测定的几个因素》(刘妙莲等,中国食品发酵工业研究所)这两篇文献,实验室可先从底物浓度、温度、DNS用量、显色时间以及对菌体的超声破碎时间这几方面进行探索,进而优化实验方法。
刚果红染色法:常用的刚果红染色法有两种,
一种是先培养微生物,再加入刚果红进行颜色反应,另一种是在倒平板
时就加入刚果红。
方法一在长出茵落的培养基上,覆盖质量浓度为1 mg
/mI。
的CR溶液,10~15 min后,倒去CR溶液,加入物质的量浓度为l mol/I。
的NaCI溶液,15 min后倒掉NaCl溶液,此时,产生纤维素酶的
茵落周围将会出现透明圈。
方法二配制质量浓度为10 mg/mI。
的CR溶液,灭菌后,按照每200 mI。
培养基加入1 mI。
的比例加入CR溶液,混匀后倒平板。
等培养基上长
出茵落后,产生纤维素酶的菌落周围将会出现明显的透明圈。
两种刚果红染色法的比较刚果红在筛选纤维素分解菌上的应用已经
有超过20年的历史,课本中给出了两种方法。
方法一是传统的方法,缺点是操作繁琐,加入刚果红溶液会使菌落之间
发生混杂;其优点是这样显示出的颜色反应基本上是纤维素分解菌的作用。
方法二的优点是操作简便,不存在菌落混杂问题,缺点是由于在纤维素
粉和琼脂、土豆汁中都含有淀粉类物质,可以使能够产生淀粉酶的微生物出
现假阳性反应。
但这种只产生淀粉酶的微生物产生的透明圈较为模糊,因为培养基中纤维素占主要地位,因此可以与纤维素酶产生的透明圈相区分。
方法二的另一缺点是:有些微生物具有降解色素的能力,它们在长时间培养过程中会降解刚果红而形成明显的透明圈,与纤维素分解菌不易区分。
测酶活的方法主要有这两种刚果红法主要是操作简便,但是准确率不高。
DNS 法操作很烦但是准确率较高。
