广东省惠阳区高三化学 每天一练99
惠州市2023届高三第一次模拟考试试题 化学

选择题下列关于化学反应速率的说法正确的是()A. 增大压强,反应速率一定加快B. 升高温度,反应速率一定加快C. 催化剂只能加快化学反应速率D. 使用催化剂可以改变反应物的转化率下列关于元素周期表的说法中,正确的是()A. 第IA族元素都是金属元素B. 第VIA族元素从上到下,非金属性逐渐增强C. 同一周期元素的原子半径从左到右逐渐减小D. 同一主族元素的原子序数差不可能为16下列实验操作或说法正确的是()A. 容量瓶和锥形瓶在使用前都要检查是否漏水B. 蒸发结晶时,当蒸发皿中出现较多固体时,停止加热C. 配制一定物质的量浓度的溶液时,定容时俯视刻度线会导致所配溶液浓度偏低D. 用托盘天平称量药品时,应将药品放在右盘,砝码放在左盘下列关于化学平衡的说法中,错误的是()A. 化学平衡是一个动态平衡B. 催化剂能改变达到平衡的时间,但不能改变平衡状态C. 当正逆反应速率相等时,反应达到平衡状态D. 增大反应物浓度,正反应速率增大,逆反应速率减小下列离子方程式书写正确的是()A. 氢氧化钡溶液与稀硫酸反应:Ba²⁺ + SO₄²⁻ = BaSO₄↓B. 碳酸钙与盐酸反应:CO₃²⁻ + 2H⁺ = H₂O + CO₂↑C. 铁与稀硫酸反应:Fe + 2H⁺ = Fe²⁺ + H₂↑D. 氢氧化铜与稀硝酸反应:H⁺ + OH⁻ = H₂O填空题已知某气体的摩尔质量为Mg/mol,在标准状况下,该气体的密度为_______g/L。
在化学反应A + B = C + D中,已知25gA和10gB恰好完全反应,生成5gC,则生成D的质量为_______g。
在一定条件下,将A、B两种气体通入1L密闭容器中,发生反应:2A(g) + B(g) ⇌ 2C(g)。
反应达到平衡时,测得c(A) = 0.1mol/L,则平衡时B的转化率为_______(保留两位小数)。
写出硫酸氢钠在水中的电离方程式:_______。
广东省惠州市化学高三上学期试题与参考答案

广东省惠州市化学高三上学期模拟试题与参考答案一、单项选择题(本大题有16小题,每小题3分,共48分)1、下列关于化学键的说法正确的是:A、离子化合物中只存在离子键。
B、共价化合物中可能含有离子键。
C、非金属元素之间形成的化学键一定是共价键。
D、由非金属元素组成的化合物一定是共价化合物。
答案:C解析:选项A错误,因为离子化合物中除了离子键外还可能存在其他类型的键,比如氢键;选项B错误,因为共价化合物定义就是通过共价键形成的化合物,不会含有离子键;选项C正确,因为在周期表中,非金属元素通常形成共价键来达到稳定的电子构型;选项D错误,因为即使是由非金属元素组成的化合物也可能是离子化合物,如NH₄Cl就是一个例子,其中含有离子键。
2、下列物质中,不属于酸碱中和反应生成物的是:A、水B、硫酸钠C、氢氧化铝D、氯化钠答案:D解析:酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
选项A中的水是酸碱中和反应的产物,选项B中的硫酸钠是由硫酸(酸)和氢氧化钠(碱)中和反应生成的盐,选项C中的氢氧化铝是由硫酸(酸)和氢氧化铝(碱)中和反应生成的盐。
而选项D中的氯化钠不是由酸碱中和反应生成的,而是由盐酸(酸)和氢氧化钠(碱)反应生成的盐,因此不属于酸碱中和反应的生成物。
3、下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是:A. Na2CO3B. Al(OH)3C. MgOD. CuSO4答案:B. Al(OH)3解析:选项分析如下:A. Na2CO3 可以与盐酸反应生成二氧化碳气体、水和氯化钠,但它不会与氢氧化钠反应;B. Al(OH)3 是一种两性氢氧化物,既可以作为碱与酸反应,也可以作为酸与强碱反应,因此它既可以与盐酸反应生成铝盐和水,也可以与NaOH反应生成偏铝酸钠(NaAlO2)和水;C. MgO 作为一种碱性氧化物,可以与酸反应但不与碱如NaOH反应;D. CuSO4 不会与盐酸反应,并且作为一种盐,也不会与NaOH发生反应。
广东省惠阳区高三化学 每天一练23
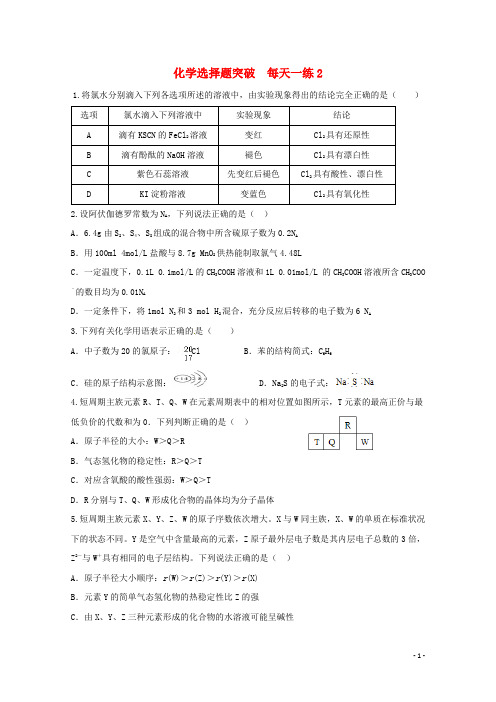
化学选择题突破每天一练21.将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是()选项氯水滴入下列溶液中实验现象结论A 滴有KSCN的FeCl2溶液变红Cl2具有还原性B 滴有酚酞的NaOH溶液褪色Cl2具有漂白性C 紫色石蕊溶液先变红后褪色Cl2具有酸性、漂白性D KI淀粉溶液变蓝色Cl2具有氧化性2.设阿伏伽德罗常数为N A,下列说法正确的是()A.6.4g由S2、S4、S8组成的混合物中所含硫原子数为0.2N AB.用100ml 4mol/L盐酸与8.7g MnO2供热能制取氯气4.48LC.一定温度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO ﹣的数目均为0.01NAD.一定条件下,将1mol N2和3 mol H2混合,充分反应后转移的电子数为6 N A3.下列有关化学用语表示正确的是()A.中子数为20的氯原子:Cl B.苯的结构简式:C6H6C.硅的原子结构示意图: D.Na2S的电子式:4.短周期主族元素R、T、Q、W在元素周期表中的相对位置如图所示,T元素的最高正价与最低负价的代数和为0.下列判断正确的是()A.原子半径的大小:W>Q>RB.气态氢化物的稳定性:R>Q>TC.对应含氧酸的酸性强弱:W>Q>TD.R分别与T、Q、W形成化合物的晶体均为分子晶体5.短周期主族元素X、Y、Z、W的原子序数依次增大。
X与W同主族,X、W的单质在标准状况下的状态不同。
Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。
下列说法正确的是()A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)B.元素Y的简单气态氢化物的热稳定性比Z的强C.由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性D.化合物X2Z2与W2Z2所含化学键类型完全相同6.新型纳米材料氧缺位铁酸盐(MFe2O x)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质.转化流程如图所示:有关上述转化过程下列叙述正确是()A.MFe2O4表现了还原性 B.MFe2O x表现了还原性C.SO2和NO2表现了还原性 D.SO2和NO2发生了分解反应7.下列图示实验操作正确的是()8.碘是一种与人生命活动密切相关的元素,已知I2能溶于NaOH或KI溶液,反应方程式分别为:3I2+6OH﹣═5I﹣+IO3-+3H2O(HIO不稳定,易发生歧化反应)和I2+I﹣═I3-,溴化碘(IBr)是一种卤素互化物,具有与卤素单质相似的性质,下列反应方程式中不正确的是()A.IBr加入Na2S溶液中产生黄色浑浊:IBr+S2﹣═I﹣+Br﹣+S↓B.IBr加入KI溶液中:IBr+2I﹣═Br﹣+I3-C.IBr加入NaOH溶液中:IBr+2OH﹣═BrO﹣+I﹣+H2OD.IBr加入AgNO3溶液中:3IBr+5Ag++3H2O═3AgBr↓+2AgI↓+IO3-+6H+9.物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是()选项物质及其杂质检验除杂A Cl2(HCl)湿润的淀粉KI试纸饱和食盐水B NO(NO2)观察颜色或湿润的淀粉KI试纸水C CO2(HCl)AgNO3溶液(含稀硝酸)饱和Na2CO3溶液D NaHCO3溶液(Na2CO3)Ca(OH)2溶液过量CO210.下列物质中含有非极性键的共价化合物是()A.CCl4 B.Na2O2 C.C2H4 D.CS211.下列原理正确且离子方程式也正确的是()A.向次氯酸钠溶液中通入足量SO2气体:ClO﹣+SO2+H2O═HClO+HSO3﹣B.F e2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I﹣=2Fe2++I2+3H2OC.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4﹣+6H++5H2O2=2Mn2++5O2↑+8H2OD.0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4+AlO2 -+2H2O12.下列有关实验装置进行的相应实验,不能..达到实验目的的是()A.用装置甲制取氯气 B.用装置乙除去氯气中的少量氯化氢和水蒸气C.用装置丙可证明Cl2的氧化性强于S D.用装置丁可以完成“喷泉”实验13.下列装置能达到实验目的是()A.加热烧杯,可用来分离NaCl和NH4Cl B.石蜡油分解实验C.比较MnO2、Cl2、S的氧化性 D.收集干燥的氨气14.已知酸性K2C r2O7溶液可与FeSO4反应生成Fe3+和Cr3+.现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI 的物质的量的变化关系如图所示,下列说法中不正确的是()A.图中AB段的氧化剂为K2Cr2O7B.图中BC段发生的反应为2Fe3++2I﹣=2Fe2++I2C.开始加入的K2Cr2O7为0.25 molD.K2Cr2O7可与FeSO4反应的物质的量为1:315.有一混合溶液,其中只含有Fe2+、Cl﹣、Br﹣、I﹣(忽略水的电离),其中Cl﹣、Br﹣、I﹣的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl﹣和Br﹣的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为()A.7:1 B.7:2 C.7:3 D.7:4化学选择题突破每天一练2姓名:_________________ 班级:________________题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 答案化学选择题突破每天一练2答案详解1.D解析:A、氯水滴入有KSCN的FeC12溶液中,氯气能将亚铁离子氧化为铁离子,铁离子遇KSCN溶液变红,则氯气具有氧化性,故A错误;B、氯水滴入有酚酞的NaOH溶液中,氯气和水反应生成酸,再发生酸碱中和,NaOH被反应掉,则颜色褪去,而氯气本身不能电离出氢离子,或者反应生成次氯酸,漂白使溶液颜色褪去,故B错误;C、氯水滴入紫色石蕊溶液中,氯气和水反应生成盐酸和次氯酸,酸使石蕊变红,次氯酸使其褪色,则次氯酸具有漂白性,而干燥的氯气不具有漂白性,故C错误;D、氯水滴入KI﹣淀粉溶液,氯气能将碘离子氧化为碘单质,碘单质遇淀粉变蓝,则氯气具有氧化性,故D2.A解析:A、S2、S4、S8均由硫原子构成,故6.4gS2、S4、S8混合物中含有的氧原子的物质的量n==0.2mol,即0.2N A个,故A正确;B、MnO2只能与浓盐酸反应,与稀盐酸不反应;,故当盐酸变稀时,与MnO2的反应会停止,即盐酸不能反应完全,故生成的氯气的量无法计算,况且选项中所给的氯气所处的状态不明确,不一定是标况,物质的量也不一定是0.2mol,故B错误;C、CH3COOH是弱电解质,不能完全电离,故两溶液中的CH3COO﹣的均小于0.01N A个,故C错误;D、合成氨的反应为可逆反应,不能进行彻底,故反应转移的电子的物质的量小于6mol,即小于6N A个,故D错误.3.C解析:A、中子数为20的氯原子中,质子数是17,但是质量数是37,中子数为20的氯原子为Cl,故A错误;B、苯的结构简式是,故B错误;C、硅是14号元素,它的原子结构示意图为:,故C正确;D、硫化钠是钠离子和硫离子构成的离子化合物,Na2S的电子式是,故D错误;4.B解析:由短周期主族元素R、T、Q、W在元素周期表中的相对位置,可知R处于第二周期,T、Q、W处于第三周期,T元素的最高正价与最低负价的代数和为0,则最外层电子数为4,故T为Si、Q为P、R为O、W为Cl,A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:Q>W>R,故A错误;B.非金属性O>P>Si,故氢化物稳定性:H2O>PH3>SiH4,故B正确;C.非金属性W>Q>T,故最高价含氧酸的酸性:W>Q>T,不是最高价含氧酸,酸性不一定,故C错误;D.P元素的氧化物、Cl元素氧化物均为分子晶体,而二氧化硅属于原子晶体,故D错误,5.C解析:Y元素空气中含量最高,则Y为N元素;Z原子最外层电子数是其内层电子总数的3倍,即核外电子排布为2、6结构,故Z元素为O,Z2-与W+具有相同的电子层结构,则W元素为Na;X与W同主族,X、W的单质在标准状况下的状态不同,则X元素为H。
广东省惠阳区高三化学 每天一练88

化学方程式突破每天一练81、浓硫酸与C反应化学方程式2、硝酸见光分解化学方程式3、氢氟酸雕刻玻璃化学方程式4、氢氧化铁胶体的制备化学方程式5过氧化钠与水反应离子方程式 6、惰性电极电解硫酸铜溶液总反应7、工业生产漂粉精化学方程式 8、实验室制取氯气离子方程式9、可溶性偏铝酸盐中通入少量CO2离子方程式10、草酸使酸性高锰酸钾褪色离子方程式11、工业制取硝酸所包含化学方程式12、Ba(OH)2与NaHSO4溶液反应离子方程式溶液呈中性:溶液呈碱性:13、Fe与稀HNO3溶液反应离子方程式Fe过量: HNO3过量:14、向含有H+、Al3+、NH4+的溶液中,逐滴加入NaOH溶液至过量,反应的离子方程式依次为?15、(2012年全国卷)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3与KClO在强碱性条件下反应可制取K2FeO4,反应的离子方程式为:与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为:该电池总反应的离子方程式为:化学方程式突破每天一练8答案1、浓硫酸与C反应化学方程式2、硝酸见光分解化学方程式2H2SO4(浓)+C △CO2↑+2SO2↑+2H2O 4HNO3=4NO2↑+O2↑+2H2O(见光或受热分解)3、氢氟酸雕刻玻璃化学方程式4、氢氧化铁胶体的制备化学方程式4HF+SiO2=SiF4↑+2H2O FeCl3+3HCl △Fe(OH)3(胶体)+3HCl5过氧化钠与水反应离子方程式 6、惰性电极电解硫酸铜溶液总反应2Na2O2+2H2O=4Na++4OH-+O2↑ 2CuSO4+2H2O 电解2Cu +O2↑+2H2SO47、工业生产漂粉精化学方程式 8、实验室制取氯气离子方程式2Cl2+2Ca(OH)2=Ca Cl2+Ca(ClO)2+2H2O 4H++2Cl-+MnO2△Mn2++Cl2↑+2H2O9、可溶性偏铝酸盐中通入少量CO2离子方程式2AlO-+CO2+3H2O=2Al(OH)3+CO32-10、草酸使酸性高锰酸钾褪色离子方程式5H2C2O4+2MnO4-+6H+=2Mn2++10CO2↑+8H2O11、工业制取硝酸所包含化学方程式①4NH3+5O2催化剂△4NO+6H2O ②2NO+O2=2NO2 ③3NO2+H2O=2HNO3+NO12、Ba(OH)2与NaHSO4溶液反应离子方程式溶液呈中性:溶液呈碱性:Ba2++2OH-+2H++SO42- =BaSO4↓+2H2O Ba2++OH-+H++SO42- =BaSO4↓+H2O13、Fe与稀HNO3溶液反应离子方程式Fe过量: HNO3过量:3Fe+2NO3-+8H+=3Fe3++2NO↑+4H2O Fe+NO3-+4H+=Fe3++2NO↑+2H2O14、向含有H+、Al3+、NH4+的溶液中,逐滴加入NaOH溶液至过量,反应的离子方程式依次为?H++OH- =H2O Al3++3OH-=Al (OH)3↓NH4++OH-=NH3·H2O Al(OH)3+3OH-=AlO2-+2H2O16、(2012年全国卷)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
广东省惠阳区高三化学 每天一练22

化学选择题突破每天一练11.设N A代表阿伏加德罗常数的值,下列有关叙述正确的是()A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2N AB.标准状况下,44.8LNO与22.4LO2混合后气体中分子总数等于2N AC.NO2和H2O反应每生成2molHNO3时转移的电子数目为2N AD.lmolFe在氧气中充分燃烧失去3N A个电子2.用下列装置进行相应实验、能达到实验目的的是()A.图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体B.图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠C.图3所示装置配制100 mL 0.1 mol-L-1的硫酸D.图4所示装置用于分离出溴苯3.下列各表中数字代表是元素的原子序数.表中数字对应的元素与它们在周期表中的位置相符的是()A. B. C. D.4.下列表示电子式的形成过程正确的是()A. B.C.D.5.在下列各反应的离子方程式书写中,正确的是()A.将Na2O2放入水中发生的反应:Na2O2+2H2O=2Na++2OH﹣+O2↑B.除去CuSO4溶液中的Fe3+:2 Fe3++3Cu=2Fe+3Cu2+C.在KOH溶液中,甲烷﹣氧气燃料电池放电时的反应:CH4+2O2+2OH﹣=CO32﹣+3H2OD.电解饱和食盐水制备H2和Cl2:2Cl﹣+2H+Cl2↑+H2↑6.25℃时,下列各组离子在指定溶液中一定能大量共存的是()A.pH=1的溶液中:Na+、NH4+、NO3-、ClO-B .=10—10的溶液中:K+、Ba2+、NO3-、Cl-C.0.1 mol·L—1NaAlO2溶液中:Na+、Al3+、HCO3—、SO42-D.常温下,在c(H+)水·c(OH-)水=10—26的溶液中:K+、Fe2+、Cl-、NO3-7.下列实验的现象、解释或结论正确的是()8.某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气.若生成的二氧化氮和氧气的物质的量之比为8:1,则金属元素的化合价在反应过程中的变化是()A.降低 B.不变 C.升高 D.无法确定9.如图是元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子最外电子层电子数是其内层电子数的,则下列说法中不正确的是()A.X元素的氢化物水溶液呈碱性B.气态氢化物的稳定性:Y>ZC.最高氧化物对应水化物的酸性:W>ZD.阴离子半径从大到小排列的顺序:Y>Z>W10.实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是()A.此实验表明氯水具有酸性、漂白性B.内环呈白色,外环呈红色或浅红C.内外环上颜色的差异表明氯水中含有H+、HClO 等粒子D.久置的氯水滴到蓝色石蕊试纸上,会出现与上述相同的现象11.已知还原性 I﹣>Fe2+>Br﹣,在只含有I﹣、Fe2+、Br﹣溶液中通入一定量的氯气,关于所得溶液离子成分分析正确的是(不考虑Br2、I2和水的反应)()A.I﹣、Fe3+、Cl﹣B.Fe2+、Cl﹣、Br- C.Fe2+、Fe3+、Cl﹣D.Fe2+、I﹣、Cl﹣12.建构数学模型来研究化学问题,既直观又简洁。
广东省惠州市惠阳高级中学高三化学测试题含解析

广东省惠州市惠阳高级中学高三化学测试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下列说法中正确的是A.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取金属MgB.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂C.BaCl2溶液能使含酚酞的Na2CO3溶液红色褪去,其原因是BaCl2溶液呈酸性D.硬水含有Ca2+、Mg2+、HCO3-、SO42-,煮沸可以完全除去其中的Ca2+、Mg2+参考答案:B略2. 分子式为C4H8Cl2的有机物共有(不含立体异构)A.7种B.8种C.9种D.10种参考答案:C试题分析:分子式为C4H8Cl2的有机物可看成是丁烷C4H10中的两个H原子被两个Cl原子取代,C4H10有正丁烷CH3CH2CH2CH3和异丁烷CH3CH(CH3)CH3两种,正丁烷中2个H原子被Cl原子取代,有6种结构,异丁烷中2个H原子被Cl原子取代,有3种结构,共有9种。
考点:同分异构体的判断3. 能正确表示下列反应的离子方程式是A.将铜屑加入溶液中:B.将磁性氧化铁溶于盐酸:C.将氯化亚铁溶液和稀硝酸混合:D.将铁粉加入稀硫酸中:参考答案:A4. 通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图3所示),是一种较为理想的减排方式,下列说法正确的是A.CO2高温催化分解为C、CO、O2的反应为放热反应B.除去碳酸钠固体中少量NaHCO3可用热分解的方法C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同D.CO2合成甲醇及碳酸二甲酯,原子利用率为100%参考答案:B5. NaCl是一种化工原料,可以制备一系列物质如右图。
下列说法正确的是A.25℃,NaHCO3在水中的溶解度比Na2CO3的大B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应D.如图所示转化反应都是氧化还原反应参考答案:B略6. 将x mol O2、y mol CH4、z mol Na2O2投入密闭容器内,在150℃条件下,电火花引发反应后,反应物均无剩余, 容器内压强为零,则下列x、y、z之间的关系式中正确的是()A. Z= 3X + 2YB. 4Y = 2X + ZC. 3X =Y + 5ZD. 6Y= 2X + Z参考答案:B略7.参考答案:D略8. 下列有关物质性质与用途具有对应关系的是A. 氢氟酸呈酸性,可用于在玻璃器皿上刻蚀标记B. CaO能与SO2反应,可作工业废气脱硫剂C. Na的熔点很低,可用于高温下与TiCl4反应制备TiD. Na2S具有还原性,可作废水中Cu2+和Hg2+的沉淀剂参考答案:BA.氢氟酸与二氧化硅反应生四氟化硅和水,所以可用氢氟酸在玻璃器皿上刻蚀标记,但不是由于氢氟酸呈酸性,故A错误;B.氧化钙和二氧化硫反应得到亚硫酸钙,亚硫酸钙被氧化得到硫酸钙,避免生成污染气体,故可以用作脱硫剂,故B正确;C. Na具有强还原性,可用于冶炼金属,可用于高温下与TiCl4反应制备Ti,故C错误;D. 硫化钠与Cu2+和Hg2+反应生成硫化物沉淀,发生复分解反应,不发生氧化还原反应,没有体现还原性,故D错误。
广东省惠阳区高三化学每天一练55.docx

化学选择题突破每天一练51.下列有关“化学与生活”的叙述不正确的是• • •A.点燃爆竹后,硫燃烧生成SOsB.中国古代利用明矶溶液的酸性清除铜镜表面的铜锈C.服用阿司匹林出现水杨酸反应时,用NaHC()3溶液解毒D.使用含钙离子浓度佼大的地下水洗衣服,肥皂去污能力减弱2、某化合物由两种单质直接反应生成,将其加入BaIIC03溶液中同时有气体和沉淀产生。
下列化合物中符合上述条件的是:C、FeCl2D、S102A、A1CLB、Na^O3、下列表示对应化学反应的离子方程式正确的是:A、向稀HNOs.中滴加MmSOs溶液:S032_+2H=S02 t +H20B、向NazSiOs溶液中通入过量S02: SiO32-+ S02+ H2O=H2SiO31 +S032'C、向AL (SO J 3 溶液中加入过量的NH3 - H20: Al'% NH3• H2O=[A1 (0H)4]_+4NH4+D、向CuSO4溶液中加入Na2O2: 2 Na202+2Cu2++2H20=4Na+2Cu(OH)21 +0214.纯净物X、Y、Z转化关系如右图所示,下列判断正确的是A.X可能是金属铜B.Y不可能是氢气C.Z可能是氯化钠z的水溶液b畫土空-zD.Z可能是二氧化硫5.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S (s) +2KNO3 (s) +3C (s) ==K2S (s)+N2 (g) +3CO2 (g) A/A x kJ* mol-1 已知碳的燃烧热A//= a kJ •mol-1S(S)+2K(S)==K2S(S) 汙方kJ ・ mol-12K (s) +N2 (g) +302 (g) ==2KN0a (s) A 必二c kJ • moL 则x为A.3护方——cB. c +3自——bC. ——cD. c^a——b6.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
2022年4月惠州市高三模拟考化学试题和参考答案word模拟考

2022年4月惠州市高三模拟考化学试题和参考答案word:模拟考2022 届高三惠州市模拟测试化学试题和参考答案选择题〔本部分共 7 小题,共 42 分〕命题人:张景伟7.我国古代文人常用诗词古语表达情意,闪耀着博大精深的智慧光芒。
以下诗词文化中所蕴藏的化学知识表述正确的选项是A.“遥知不是雪,为有暗香来”,说明分子是由原子构成的B.“爆竹声中一岁除,春风送暖入屠苏”,说明有能量的变化就有化学变化C.“万顷江田无烟波,千帆竞发好风景”中的“烟”属于胶体D.“千淘万漉虽辛苦,吹尽狂沙始到金”,说明金在自然界中以化合态存在砂石中8.用如下列图装置进展以下实验:将①中溶液滴入②中,预测的现象与实际相符的是9.以下说法不正确的选项是A.油脂属于酯类,除可以食用外,还可用于肥皂消费和油漆制造等B.乙炔和丙烯不是同系物,分别与氢气充分反响后的产物也不是同系物C.的核磁共振氢谱有 7 组峰D.中的所有原子均可能共平面10.南开大学化学学院陈军教授团队研究的“可充电钠—二氧化碳电池”〔如以下列图〕。
该电池放电时总反响为:4Na+3CO 2 ===2Na2CO3+C,以下说法错误的选项是A.放电时,Na +由钠箔端向多壁碳纳米管端挪动选项①中物质②中物质预测②中的现象A 浓硝酸用砂纸打磨过的铝条产生大量红棕色气体B 氯化铝溶液浓氢氧化钠溶液产生大量白色沉淀C 氯水淀粉—KIO3 溶液溶液变蓝色D 稀盐酸苯酚钠溶液溶液变浑浊RT Q WB.放电时,正极的电极反响为:4Na ++3CO2+4e-===2Na2CO3+CC.充电时,钠箔与外接电的负极相连D.该电池充电时吸收二氧化碳,放电时放出二氧化碳11.短周期元素 R、T、Q、W 在元素周期表中的相对位置如下列图,其中 T 所处的周期序数与族序数相等。
以下判断不正确的选项是 A.最简单气态氢化物的热稳定性:R>Q B.原子半径:T>Q>RC.含 T 元素的盐溶液一定显酸性 D.最高价氧化物对应水化物的酸性:Q。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学方程式突破每天一练9
1、硫酸铝与氨水反应离子方程式
2、化学方程式除去FeCl2中的FeCl3
3、二氧化硅与NaOH反应化学方程式
4、氯气尾气吸收化学方程式
5、二氧化硫与硫化氢化学方程式
6、FeO溶于稀硝酸化学方程式
7、铁离子遇硫氰酸钾显血红色原理(离子方程式)
8、实验室制取NO化学方程式
9、漂白粉生效原理
10、惰性电极电解硝酸银溶液电极反应和总反应方程式
11、工业制取硫酸所包含化学方程式
12、氢氧燃料电池电极反应方程式和总反应
酸性:碱性:
13、NH4HSO4溶液与NaOH溶液的反应离子方程式
NaOH不足: NaOH过量:
14、FeBr2溶液中通入少量Cl2离子方程式:
FeBr2溶液中通入等物质的量Cl2离子方程式:
FeBr2溶液中通入足量Cl2离子方程式:
15、(2020年全国卷)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气(COCl2),写出化学方程式。
化学方程式突破每天一练9答案
1、硫酸铝与氨水反应离子方程式
2、除去FeCl2中的FeCl3化学方程式Al3++3NH3·H2O=Al(OH)3↓+3NH4+2FeCl3 + Fe = 3FeCl2
3、二氧化硅与NaOH反应化学方程式
4、氯气尾气吸收化学方程式
SiO2 + 2NaOH = Na2SiO3 + H2O Cl2+2NaOH=NaCl+NaClO+H2O
5、二氧化硫与硫化氢化学方程式
6、FeO溶于稀硝酸化学方程式
SO2 + 2H2S=3S↓+2H2O 3FeO+10HNO3=3Fe(NO3)3+NO↑+5H2O 7、铁离子遇硫氰酸钾显血红色原理(离子方程式)
Fe3++3SCN-=Fe(SCN)3
8、实验室制取NO化学方程式
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
9、漂白粉生效原理
Ca(ClO)2+2HCl=CaCl2+2HClO 或 Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO
10、惰性电极电解硝酸银溶液电极反应和总反应方程式
阳极:4OH--4e-=O2↑+2H2O 阴极:4Ag++4e-=4Ag
总反应:4AgNO3+2H2O 电解
4Ag+O2↑+4HNO3
11、工业制取硫酸所包含化学方程式
①S+O2点燃
SO2 或 4FeS2+11O2
点燃
2F e2O3+8SO2
①2SO2+O22SO3 ③SO3+H2O=H2SO4
12、氢氧燃料电池电极反应方程式和总反应
酸性:正极:O2+4H++4e-=2H2O碱性:正极:O2+2H2O+4e-=4OH-
负极:2H2-4e-=4H+ 负极:2H2+4OH--4e-=2H2O
总反应:2H2+O2=2H2O 总反应:2H2+O2=2H2O
13、NH4HSO4溶液与NaOH溶液的反应离子方程式
NaOH不足:H++OH-=H2O NaOH过量:NH4++H++2OH-=NH3·H2O+H2
14、FeBr2溶液中通入少量Cl2离子方程式:2Fe2++Cl2 =2Fe3++2Cl-
FeBr2溶液中通入等物质的量Cl2离子方程式:2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl-
FeBr2溶液中通入足量Cl2离子方程式:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
15、(2020年全国卷)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气(COCl2),写出化学方程式。
CHCl3+H2O2=HCl+H2O+COCl2。
