天津大学化工传质分离资料第2章传质分离过程的热力学基础
天大分离工程试题库-(填写答案版)

118.吸附负荷曲线是分析( 119.透过曲线是以(时间 120. 121. 122. 透过曲线是分析(
透过曲线是以(流出物中吸附剂的浓度
透过曲线与吸附符合曲线是(镜面对称相似关系)相似关系。
6
第二部分 选择题
1. 计算溶液泡点时,若 K i X i 1 0 ,则说明 C a.温度偏低 b.正好泡点 c.温度偏高 2. 在一定温度和压力下,由物料组成计算出的 K i X i 1 0 ,且 Z i / K i 1 ,该 进料状态为 C a.过冷液体 b.过热气体 c.汽液混合物 3. 计算溶液露点时,若 yi / K i 1 0 ,则说明 22 A a.温度偏低 b. 正好泡点 c.温度偏高 4. 进行等温闪蒸时,对满足什么条件时系统处于两相区 22A a. K i Z i 1且 Z i / K i 1 b. K i Z i 1且 Z i / K i 1 c. K i Z i 1且 Z i / K i 1 d.
70. 低压下二元非理想农液的对挥发度 α12 等于( 71. 气液两相处于平衡时, ( 73. 逸度是(修正的 )压力
72. Lewis 提出了等价于化学位的物理量( 逸度) 。 74. 在多组分精馏中塔顶温度是由( 75. 露点方程的表达式为( ΣKixi=1 76. 泡点方程的表达式为( 露点议程)方程求定的。 ) )
3
)方程求 V j ,由( S )方程求 T j 。
41. 对窄沸程的精馏过程,其各板的温度变化由(组成的改变)决定,故可由(相
51. 为表示塔传质效率的大小,可用(级效率)表示。 52. 对多组分物系的分离,应将(分离要求高 )或(最困难)的组分最后分离。 )所消耗的净功之比。 53. 热力学效率定义为(系统)消耗的最小功与(过程 耗的功。 55. 在相同的组成下,分离成纯组分时所需的功(大于)分离成两个非纯组分时 所需的功。 56. 超临界流体具有类似液体的(溶解能力)和类似气体的(扩散能力) 。 57. 泡沫分离技术是根据(表面吸附)原理来实现的,而膜分离是根据(膜的选 择渗透作用)原理来实现的。 58. 新型的节能分离过程有(膜分离) 、 (吸附分离) 。 59. 常用吸附剂有(硅胶) , (活性氧化铝) , (活性炭 61. 离程分为( 机械分离 62. 传质分离过程分为( 63. 分离剂可以是(能量 64. 机械分离过程是( )和( 传质分离 ) 。 ) 。 ) 。 60. 54A 分子筛的孔径为( 5 埃 ) ,可允许吸附分子直径(小于 5 埃)的分子。 )两大类。 速率控制过程)两大类。 平衡分离过程 )和( )和(物质 吸收、萃取) 。 吸收、萃取) 。膜分离。渗透。
泡点和露点计算
正丁烷 (1)
2.1
0.315
正戊烷 (2) 0.71
0.284
正己烷 (3) 0.25
0.1125
∑ 0.7115
传质分离过程
设温度为60℃,查P-T-K 图得K,将K值列于下表
组分 正丁烷 正戊烷 正己烷
∑
Ki
2.8
0.93
0.36
Kixi
0.42
0.372 0.162 0.954
yi
0.42
Ki f T, P, xi , yi
计算步骤:
L i
Pi S
iS
ˆ Vi P
exp ViL
P PiS RT
已知p,假设T 求出(或查出)各组分的相应参数
由已知的 x按i 理想状态求出Ki,初步算出 yi
求出 Ki,由已知的xi yi Ki xi
Ki xi 1 (通常取为0.005) 泡点T
如果 Ki xi 1 ; 升高T,重新计算。 Ki xi 1 ; 降低T,重新计算。
传质分离过程
开始 Y
输入P、y及有关参数
设T并令 1 作第一次迭代
计算PiS ,ViL ,iS ,ˆiV
调整T
计算 K i和xi 计算 xi
是否第一次迭代
圆整 xi
计算 i
Y
N
xi有无变化
N
xi 1 N
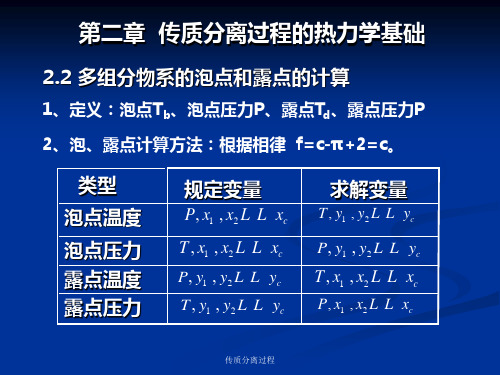
第二章 传质分离过程的热力学基础
2.2 多组分物系的泡点和露点的计算
1、定义:泡点Tb、泡点压力P、露点Td、露点压力P 2、泡、露点计算方法:根据相律 f=c-π+2=c。
类型 泡点温度
泡点压力 露点温度 露点压力
规定变量
P, x1 , x2 L L xc
天津大学化工学院化学工程专业导师研究方向介绍
38 李凭力 副研究员
博士 1961。12
39 王化淳 研究员
学士 1944。01
40 汪宝和 副研究员
硕士 1964。09
41 宋光复 研究员
学士 1945。07
42 刘 成
副教授
硕士 1964。11
43 高瑞昶 副研究员
博士
1965.12
2.海水淡化 1.传质与分离工程 2.非牛顿流体中的气泡行为及 传质特性 3。新分离技术 4。化工热力学及流体力学 1.现代传质理论 2.复合新分离过程 1.酶工程 2.制药工程 1.传质与分离工程 2.双膜萃取技术 3.精细化工 1.传质过程 2.计算流体力学 3.多级分离 1.传质与分离工程 2.精细化工产品及其新分离过
强化。 2.分子印迹(合) 1。环境水化学 2.微量元素物理化学 1. 传质与分离工程 2. 环境化学工程 3. 化工热力学基础数据 1。膜分离技术
2。海水淡化技术
57 王纪孝 副教授
博士
196404
58 齐崴
副教授
博士
1973.09
59 徐世昌 副研究员
硕士 1966。12
60 崔现宝 副教授
博士 1971。11
1.酶工程
58
2.药物控制释放技术
1.燃料电池 2.传质与分离 3.膜分离 4.酶工程 5.生物分离 1.传质与分离工程 2.化工过程系统工程 1.精细化工分离技术及设备 2.分批精馏、反应精馏、特殊精馏
及萃取结晶过程 1.传质与分离工程 2.精馏基础理论 3.新型精馏设备 1. 传质与分离工程 2. 环境化学工程 3. 生物分离工程 4.人工器官传递过程
天津大学化工学院化学工程专业导师研究方向介绍
序 姓名
天津大学化工原理(第二版)各章复习思考题

第一章复习思考题1、何谓不可压缩流体和可压缩流体?2、简述密度和比容的定义和单位。
影响流体密度的因素有哪些?气体的密度如何计算?3、简述压强(压力)的定义。
压力的常用单位有哪些?它们之间如何换算?4、何谓绝对压力、表压和真空度?它们之间有何关系?5、简述流体粘度的定义、物理意义及粘度的单位(SI和物理单位)。
6、写出流体静力学基本方程式,说明该式应用条件。
7、简述静力学方程式的应用。
8、写出U形管压差计计算压差的公式。
9、何谓稳定流动和不稳定流动?10、说明流体的体积流量、质量流量、流速(平均流速)及质量流速的定义及相互关系。
11、写出连续性方程式,说明其物理意义及应用。
12、分别写出理想流体和实际流体的柏努利方程式,说明各项单位及物理意义。
13、应用柏努利方程式时,应注意哪些问题?如何选取基准面和截面?14、应用柏努利方程式可以解决哪些问题?15、何谓牛顿型流体和非牛顿型流体?16、写出牛顿粘性定律。
说明式中各项的意义和单位。
17、流体的流动类型有哪几种?如何判断?18、雷诺准数(Re)的物理意义是什么?如何计算?19、写出流体在圆管中流体流动时的速度分布情况,最大流速与平均流速的关系如何?20、写出流体在直管中流动时流动阻力的计算式。
21、写出层流时摩擦系数计算式。
22、如何由摩擦系数图(λ-Re,ε/d)查取摩擦系数?图上可分几个区域?各区域有何特点?23、何谓水力半径与当量直径?如何计算?24、计算管路局部阻力的方法有几种?如何计算?25、何谓简单管路?简单管路的计算有几类?它们的计算方法有何特点?26、比较测速管、孔板流量计及转子流量计,它们的测量原理、计算方法及应用场合等有何类同?1、流体输送机械根据其工作原理可分为哪几种类型?2、简述离心泵的工作原理及主要部件。
3、离心泵的叶轮有哪几种类型?离心泵的蜗形外壳有何作用?4、离心泵在启动前为什么要在泵内充满液体?5、离心泵的主要性能参数有哪些?各自的定义和单位是什么?6、扬程和升扬高度是否相同?7、气缚现象和汽蚀现象有何区别?8、离心泵的特性曲线包括哪几条曲线?如何绘出特性曲线?9、何谓管路特性曲线?何谓工作点?10、离心泵流量调节方法有哪几种?各有何优缺点。
其它课程-分离课后习题及答案.

分离课后习题及答案.【注意事项】1.因时间关系,详细复习总结的电子版没时间做了,大家抽空多看看课本,考试以课本基础知识为主,书上找不到答案的不会考。
2.这里主要总结了老师上课讲的课后题参考答案,以及部分往届复习的名词解释整合,大家参考记忆。
3.考试题型:6-7个名词解释,6-7个选择题(考察细节掌握,一个两分),填空,简答论述(接近50分)。
4.不考计算题,但依然会考公式的其他应用,复习时自己注意。
5.【P22】【P24】【P44-45】【P216-217】这几页的图和表必须会解读,【P191-192】这两页表必须背过,必考重点!考试没有画图题,但可能有读图题,常见的重点图示必须熟悉。
6.抓紧时间好好复习,今年监考比历届都要严,不要因小失大!!!7.最后,祝都过。
***感谢冯晓博、马阿敏、张雪琴三位热心的好学霸肯抽出时间为大家整理资料***第一章绪论1.分离技术的三种分类方法各有什么特点?答:(1)按被分离物质的性质分类分为物理分离法、化学分离法、物理化学分离法。
(2)按分离过程的本质分类分为平衡分离过程、速度差分离过程、反应分离过程。
(3)场流分类法2.分离富集的目的?答:①定量分析的试样通常是复杂物质,试样中其他组分的存在常常影响某些组分的定量测定,干扰严重时甚至使分析工作无法进行。
这时必须根据试样的具体情况,采用适当的分离方法,把干扰组分分离除去,然后才能进行定量测定。
②如果要进行试样的全分析,往往需要把各种组分适当的分离,而后分别加以鉴定或测定。
③而对于试样中的某些痕量组分,进行分离的同时往往也就进行了必要的浓缩和富集,于是就便于测定。
因此物质的化学分离和测定具有同样重要意义。
3.什么是直接分离和间接分离?答:直接分离是将待测组分从复杂的干扰组分分离出来;间接分离是将干扰组分转入新相,而将待测组分留在原水相中。
4.阐述浓缩、富集和纯化三个概念的差异与联系?答:富集:通过分离,使目标组分在某空间区域的浓度增大。
授课教案 (Teaching plan)

授课教案(Teaching plan)培养目标作为现代高等教育的发端,天津大学在一百一十多年的办学实践中,秉承“实事求是”校训和“严谨治学、严格教学要求”的双严方针,牢固树立学校以育人为本、育人以教育为先、质量是学校的生命线、教学工作在学校具有优先地位的理念。
强化教学管理,深化教学改革,逐步构建了具有天大特色的本科创新人才培养体系。
努力培养专业口径宽、理论基础厚、实践能力强、综合素质高,具有创新精神和国际视野的高层次人才,使之成为推动科技创新、经济发展、社会进步的栋梁。
本课程是高等学校化学工程及工艺专业(本科)的一门专业基础课,是学生在具备了物理化学、化工原理、化工热力学等技术基础知识后的一门专业主干课。
本课程主要讲授化工生产实际中复杂物系的分级、分离、浓缩、提纯等技术。
通过该课程的学习,使学生掌握各种常用分离过程的基本理论,操作特点,简捷和严格计算方法以及强化改进操作的途径,并对一些新型分离技术有一定的了解,能够根据具体的分离任务和分离要求,选择适宜的分离方法,设计合理的分离序贯。
围绕本课程的实验教学、仿真实习、工程案例教学环节使分离理论与实践有机结合,显著增强了课程的工程实践特色,符合工科创新性人才的培养目标。
重点难点(1)课程的重点、难点化工分离过程属于理论性较强的课程,综合运用化工原理、物理化学、化工热力学、传递过程等课程的理论知识,针对化工生产中经常遇到的多组分非理想性物系,从分离过程的共性出发,讨论各种分离方法的特征。
本课程着重基本概念的理解,为分离过程的选择、特性分析和计算奠定基础。
在以基础知识、基本理论为重点的基础上,强调将工程与工艺相结合的观点,以及设计和分析能力的训练;强调理论联系实际,以提高解决实际问题的能力。
另外,在讲授传统分离技术的同时,还不断引进新型分离技术的有关内容,并逐渐加强其重要性,以拓宽学生在分离工程领域的知识面,从而适应多种专业化方向的要求。
难点在于本课程中应用到很多化工热力学和传递过程理论,内容较为深奥和抽象。
天津大学化工传质分离资料第2章传质分离过程的热力学基础

For the liquid-liquid case, relative selectivity is
K Di ij K Dj
分离因子与1的偏离程度表示组分间分离的难易程度。
2.1.1 汽液平衡 Vapor-liquid equilibria
At vapor-liquid equilibrium,
相平衡关系的表示方法: 1. 相图 yi
0 2. 相平衡常数:
xi
K i yi / xi
Ki ij xi /x j K j yi /y j
3. 分离因子:
二、相平衡常数
相平衡常数(Ki)--- Equilibrium Ratio
K i yi / xi
Equilibrium Ratio is the ratio of mole fractions of a species present in two phases at equilibrium.
知识点
1. 相平衡常数计算:状态方程法,活度系数法 2. 泡点、露点计算 (1)泡点计算:在一定P(或T)下,已知xi,确 定Tb(或Pb)和yi。 (2)露点计算 3. 等温闪蒸和绝热闪蒸计算:给定物料的量与组成, 计算在一定 P 和 T 下闪蒸得到的汽相量与组成,以 及剩余的液相量与组成。
2.1 相平衡基础(Phase Equilibria)
Extent = Thermodyanmics Rate = Transport
Contents
2.1 Phase Equilibria 2.1 相平衡基础 2.1.1 Vapor-Liquid Equilibrium 2.1.1气液平衡 2.1.2 Liquid-Liquid Equilibrium 2.1.2液液平衡 2.2 多组分物系的泡点和露点计算 2.2 Bubble-point, and Dew-point Calculation for Multicomponent 2.2.1 泡点温度和压力的计算 Mixtures 2.2.2 露点温度和压力的计算 2.2.1 Bubble-point Temperature and 2.3 多组分闪蒸计算 Pressure Calculation 2.3.1 等温闪蒸和部分冷凝过程 2.2.2 Dew-point Temperature and 2.3.2 绝热闪蒸过程 Pressure Calculation 2.4 液液平衡过程的计算 2.3 Flash Calculation 2.5 多相平衡过程 2.3.1 Isothermal Flash and Partial Coic Flash
化工分离过程 教学大纲

教学大纲课程名称:化工分离过程英文名称:Separation Processes学分:3.5学时:48教学对象:化学工程与工艺专业四年级本科生预修课程:物理化学、化工原理、化工热力学、传递过程。
授课教材:刘家祺主编. 《传质分离过程》,高等教育出版社,2005年.参考教材:陈洪纺,刘家祺编. 《化工分离过程》,化学工业出版社,1995年.J D Seader, E J Henley. Separation Process Principles, John Wiley andSons, Inc., 2011年.教学目的:利用已学的物理化学、化工原理、化工热力学、传递过程等课程中有关系相平衡热力学、动力学、分子及共聚状态的微观机理,传热、传质和动量传递理论来研究化工生产实际中复杂物系的分离和提纯技术。
着重基本概论的理解,为分离过程的选择、特性分析和计算奠定基础。
从分离过程的共性出发,讨论各种分离方法的特征。
强调将工程和工艺相结合的观点,进行设计和分析能力的训练;强调理论联系实际,提高解决问题的能力。
总体要求:通过本课程学习,使学生掌握各种常用传质分离过程的基本原理,操作特点,简捷和严格计算方法,强化改进操作的途径,了解一些新分离技术。
对于给定的混合物体系和产物分离要求,能够选择和设计适宜的分离过程。
教学内容:第一章绪论本章包括3节,共3 学时第1节课程概述本节为1 学时的课堂教学第2节传质分离过程的分类本节为1 学时的课堂教学第3节分离过程的研究开发现状与发展趋势本节为1 学时的课堂教学基本要求:了解分离过程在化工生产中的重要性;分类过程的分类;常用的化工分离操作过程;分离过程研究和技术开发的现状和未来。
重点:平衡分离过程和速率分离过程难点:工业上常用的基于平衡分离过程的分离单元操作及其基本原理;分离媒介;典型应用实例。
第二章传质分离过程的热力学基础本章包括6 节,共9 学时第1节相平衡基础本节为3 学时的课堂教学2.1.1汽液平衡2.1.2液液平衡第2节多组分物系的泡点和露点计算本节为2 学时的课堂教学2.2.1 泡点温度和压力的计算2.2.2 露点温度和压力的计算第3节闪蒸过程的计算本节为2 学时的课堂教学2.3.1 等温闪蒸和部分冷凝过程2.3.2 绝热闪蒸过程第4节液液平衡过程的计算本节为0.5 学时的课堂教学第5节多元相平衡过程本节为0.5 学时的自主学习第6节共沸系统和剩余曲线本节为1 学时的课堂教学基本要求:在“化工热力学”课程有关相平衡理论的基础上,较为全面的了解化工过程中经常遇到的多组分外系的气液平衡,即各种单级平衡过程的计算问题。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
For a pure ideal gas, fugacity is equal to the pressure, and for a component in an ideal gas mixture, the partial fugacity is equal to its partial pressure, pi yi p . Dalton’s law
Chemical potential cannot be expressed as an absolute quantity, and the numerical values of chemical potential are difficult to relate to more easily understood physical quantities. Furthermore, the chemical potential approaches an infinite negative value as pressure approaches zero. For these reasons, the chemical potential is not favored for phase equilibria calculations. Instead, fugacity, invented by G. N. Lewis in 1901, is employed as a surrogate.
一、相平衡关系
(2)相平衡条件(准则): 各相的温度相等、压力相等,每个组分的化学位相等。
T T T ......
P P P ......
......
' i '' i ''' i
Chemical potential
(1)什么是相平衡? 混合物所形成的若干相保持物理平衡而共存的状态。 热力学:整个物系的自由能最小。 At equilibrium, the total Gibbs free energy (G) for all phases is a minimum. 动力学:相间表观传递速率为零。 The apparent rate of mass transfer across the phase interface is zero.
The rate of separation is governed by mass transfer, while the extent of separation is limited by thermodynamics equilibrium. 极限程度------ 热力学 分离速率------ 动力学
yi Ki xi
yi---Concentration of any component in vapor xi---Concentration of any component in liquid
For the liquid-liquid case(eg. Extraction), the constant is referred to as the distribution coefficient (分配系数)or liquid-liquid equilibrium ratio(液液平衡常数).
For the liquid-liquid case, relative selectivity is
K Di ij K Dj
分离因子与1的偏离程度表示组分间分离的难易程度。
2.1.1 汽液平衡 Vapor-liquid equilibria
At vapor-liquid equilibrium,
K Di x / x
(1) i
( 2) i
xi(1)---Concentration of any component in extract
xi(2)---Concentration of any component in raffinate
Calculation of Equilibrium Ratio
Extent = Thermodyanmics Rate = Transport
Contents
2.1 Phase Equilibria 2.1 相平衡基础 2.1.1 Vapor-Liquid Equilibrium 2.1.1气液平衡 2.1.2 Liquid-Liquid Equilibrium 2.1.2液液平衡 2.2 多组分物系的泡点和露点计算 2.2 Bubble-point, and Dew-point Calculation for Multicomponent 2.2.1 泡点温度和压力的计算 Mixtures 2.2.2 露点温度和压力的计算 2.2.1 Bubble-point Temperature and 2.3 多组分闪蒸计算 Pressure Calculation 2.3.1 等温闪蒸和部分冷凝过程 2.2.2 Dew-point Temperature and 2.3.2 绝热闪蒸过程 Pressure Calculation 2.4 液液平衡过程的计算 2.3 Flash Calculation 2.5 多相平衡过程 2.3.1 Isothermal Flash and Partial Condensation 2.6共沸系统和剩余曲线 2.3.2 Adiabatic Flash
相平衡关系的表示方法: 1. 相图 yi
0 2. 相平衡常数:
xi
K i yi / xi
Ki ij xi /x j K j yi /y j
3. 分离因子:
二、相平衡常数
相平衡常数(Ki)--- Equilibrium Ratio
K i yi / xi
Equilibrium Ratio is the ratio of mole fractions of a species present in two phases at equilibrium.
i ˆ C exp f i RT
一、相平衡关系
(2)相平衡条件(准则): 各相的温度相等、压力相等,每个组分的逸度相等。
T T T ......
P P P ......
ˆ ˆ ˆ f i f i f i ......
and
L ˆL ˆ f i i xi p
(2-8)
ˆV f ˆL f i i
Therefore,
L ˆV ˆ y p i i i xi p
(2-10)
a so-called equation-of-stare form of the K-value is obtained:
ˆ iL yi Ki V ˆ xi i
Case 1—纯组分
V L ˆ ˆ fi fi
逸度等于纯组分的逸度
For a pure component, the partial fugacity, the pure-component fugacity, Case 2---理想气体混合物
fˆi , becomes
fi
. 逸度等于组分的分压
平衡分离过程,常采用分离因子表示平衡关系。
For the vapor-liquid case, separation facor is
Ki ij xi /x j K j
yi /y j
relative volatility(相对挥发度) for Distillation
相对挥发度对温度和压力变化不敏感,常视为常数,简化计算。
传 质 分 离 过 程
第二章 传质分离过程的热力学基础
?
Chapter 2 Thermodynamics of Separation Operation
For mass transfer separation processes, the separation is achieved by enhancing the rate of mass transfer by diffusion of certain species relative to mass transfer of all species by bulk movement within a particular phase.
yi xi
i f ioL
ˆV i p
应用状态方程计算汽相逸度系数,应用活度系数方程计算活度系数。
2.1.1 汽液平衡 Vapor-liquid equilibria
相平衡常数计算的两种方法: 状态方程法
ˆ iL yi Ki V ˆ xi i
yi Ki xi
Ki的计算: Case 1---理想体系的吸收过程: 亨利定律(Henry’s Law) Case 2---理想体系的精馏过程 拉乌尔定律(Raoult’s Law) Case 3---非理想体系 用气相逸度和液相活度系数来计算。
三、分离因子 Separation Factor
2.1.1 汽液平衡 Vapor-liquid equilibria
Case 3---真实混合物 用逸度系数或活度系数计算逸度
For a real mixture, partial fugacity coefficients are defined by
ˆV ˆV f i i yi p
(2-7)
ˆL f i i 0L ˆ x f
i iห้องสมุดไป่ตู้
Fugacity under standard state
(2-9)
通常取纯组分i的液体在系统温度 和压力下的逸度。
a so-called activity coefficient form of the K-value is obtained:
Ki
