高三化学试题-高三化学专项训练三 最新
高三毕业班第三次教学质量监测三模理科综合化学试题(解析版)

A.地沟油可以用来制肥皂和生物柴油
B.白砂糖的主要成分是蔗糖,蔗糖属于天然高分子化合物
C.向煤中加入生石灰,可减少SO2的排放量
D.天然气、水煤气分别属于一次能源、二次能源
【答案】B
【解析】
【详解】A.地沟油的主要成分是油脂,利用水解反应可制肥皂、提取甘油,通过酯交换或热化学工艺制成的可代替石化柴油的再生性柴油燃料,故A正确;
D.根据分析,a极负极,电极反应式:N2H4+4OH–-4e–=N2↑+4H2O,故D错误;
答案选D。
5.下列实验操作、实验现象和实验结论均正确的是()
选项
实验操作
实验现象
实验结论
A
常温下,向含溶解足量NH3的饱和食盐水中通入过量CO2
析出白色固体
溶解性:NaHCO3<NH4Cl
B
将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液
B.相对分子质量大于10000的属于高分子化合物,蔗糖相对分子质量为342,属于小分子化合物,故B错误;
C.在煤燃烧过程中生成二氧化硫,加入生石灰可与二氧化硫反应,可减少SO2排放,可以减少酸雨的形成,故C正确;
D.直接由自然界获得的能源为一次能源,天然气属于一次能源,二次能源则是指由一次能源直接或间接转换成其他种类和形式的能量资源,水煤气是由一次能源煤炭转化而成的能源,属于二次能源,故D正确;
C.次氯酸钠具有强氧化性,能漂白pH试纸,所以不能用pH试纸测定次氯酸钠溶液pH值,无法比较HClO和CH3COOH的酸性强弱,故C错误;
D.向2mL0.1mol·L–1AgNO3溶液中滴加1~2滴NaCl溶液,有AgCl白色沉淀生成,但AgNO3过量,再滴加2滴Na2S溶液,产生的黑色沉淀生成为过量的AgNO3与Na2S溶液反应产生,则不能比较Ksp(Ag2S)与Ksp(AgCl)大小,故D错误;
高三化学试题大全及答案

高三化学试题大全及答案一、选择题(每题3分,共30分)1. 下列关于原子结构的说法中,正确的是:A. 原子核由质子和中子组成B. 原子核由质子和电子组成C. 原子核由电子和中子组成D. 原子核由电子和质子组成答案:A2. 元素周期表中,元素的排列顺序是根据:A. 原子序数B. 原子量C. 电子数D. 质子数答案:A3. 下列化合物中,属于共价化合物的是:A. NaClB. H2OC. MgOD. NaOH答案:B4. 化学反应中,能量变化主要表现为:A. 光能B. 热能C. 电能D. 机械能答案:B5. 下列物质中,属于非电解质的是:A. HClB. NaClC. H2OD. CH4答案:D6. 金属元素的活泼性顺序是:A. Na > Mg > AlB. Mg > Al > NaC. Al > Mg > NaD. Na > Al > Mg答案:A7. 下列物质中,属于强酸的是:A. H2SO4B. HClC. CH3COOHD. H2CO3答案:A8. 氧化还原反应中,氧化剂和还原剂之间的关系是:A. 氧化剂被还原B. 还原剂被氧化C. 氧化剂被氧化D. 还原剂被还原答案:A9. 根据勒夏特列原理,当一个平衡系统受到外部条件变化时,系统会:A. 保持不变B. 向减弱外部条件影响的方向移动C. 向加强外部条件影响的方向移动D. 随机移动答案:B10. 下列物质中,属于强碱的是:A. KOHB. NH3C. Na2CO3D. Ca(OH)2答案:A二、填空题(每题4分,共20分)1. 元素周期表中,第IA族元素的价电子数为______。
答案:12. 化学反应中,当反应物的摩尔比为1:1时,该反应为______反应。
答案:等摩尔3. 金属元素的活泼性顺序中,位于氢前面的金属元素能与酸反应生成氢气,这是基于金属的______性。
答案:还原4. 氧化还原反应中,氧化剂失去电子,被还原,其化合价______。
高三化学试题卷子及答案

高三化学试题卷子及答案一、选择题(每题3分,共30分)1. 下列物质中,属于电解质的是:A. 蔗糖B. 酒精C. 硫酸D. 氯化钠答案:D2. 化学反应速率与下列哪个因素无关?A. 反应物浓度B. 温度C. 催化剂D. 反应物的物理状态答案:D3. 下列化合物中,属于共价化合物的是:A. NaClB. CaOC. HClD. MgO答案:C4. 根据元素周期表,下列元素中属于金属元素的是:A. 氢B. 氧C. 钠D. 氯答案:C5. 根据酸碱中和反应的原理,下列物质中可以中和盐酸的是:A. 氢氧化钠B. 硫酸C. 硝酸D. 碳酸钠答案:A6. 下列反应中,属于氧化还原反应的是:A. 2H2 + O2 → 2H2OB. 2NaOH + H2SO4 → Na2SO4 + 2H2OC. 2H2O → 2H2 + O2D. NaCl + AgNO3 → AgCl + NaNO3答案:A7. 下列物质中,可以作为干燥剂的是:A. 浓硫酸B. 浓盐酸C. 酒精D. 蒸馏水答案:A8. 在化学反应中,下列物质中可以作为还原剂的是:A. 氧气B. 氢气C. 氯气D. 铁答案:B9. 根据化学平衡原理,下列反应中,平衡常数Kc最大的是:A. 2NO2(g) ⇌ N2O4(g)B. 2HI(g) ⇌ H2(g) + I2(g)C. 2SO2(g) + O2(g) ⇌ 2SO3(g)D. 2H2(g) + O2(g) ⇌ 2H2O(g)答案:A10. 根据原子结构,下列元素中,最外层电子数为8的元素是:A. 氦B. 氧C. 氟D. 氖答案:D二、填空题(每题4分,共20分)1. 写出下列化合物的化学式:硫酸铜______。
答案:CuSO42. 写出下列化合物的化学式:碳酸钠______。
答案:Na2CO33. 写出下列化合物的化学式:硝酸钾______。
答案:KNO34. 写出下列化合物的化学式:氯化铵______。
全国高三高中化学专题试卷带答案解析

全国高三高中化学专题试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.关于铅蓄电池的说法正确的是 ( )。
A .在放电时,正极发生的反应是Pb(s)+SO 42-(aq)-2e -=PbSO 4(s) B .在放电时,该电池的负极材料是铅板 C .在充电时,电池中硫酸的浓度不断变小D .在充电时,阳极发生的反应是PbSO 4(s)+2e -=Pb(s)+SO 42-(aq)2.下图装置中发生反应的离子方程式为:Zn +2H +=Zn 2++H 2↑,下列说法错误的是( )。
A .a 、b 可能是同种材料的电极B .该装置可能是原电池,电解质溶液为稀硝酸C .该装置可能是电解池,电解质溶液为稀盐酸D .该装置可看作是铜-锌原电池,电解质溶液是稀硫酸3.用阳极a 和阴极b 电解c 的水溶液一段时间,然后加入d ,能使溶液恢复到电解前状态,a 、b 、c 、d 正确组合是( )。
二、填空题1.电解法在金属精炼、保护环境、处理废水中起着十分重要的作用。
(1)如图为电解精炼银的示意图,________(填a 或b)极为含有杂质的粗银,若b 极有少量红棕色气体生成,则生成该气体的电极反应式为______________________。
AgNO 3—HNO 3溶液(2)电解法处理酸性含铬废水(主要含有Cr 2O 72-)时,以铁板作阴、阳极,处理过程中存在反应Cr 2O 72-+6Fe 2++14H +=2Cr 3++6Fe 3++7H 2O ,最后Cr 3+以Cr(OH)3形式除去。
回答下列问题: ①写出电极反应式:阴极________________,阳极________________。
②当生成1 mol Cr(OH)3时,电路中转移电子的物质的量至少为________mol 。
③电解过程中有Fe(OH)3沉淀生成,原因是___________________________。
全国高三高中化学专题试卷带答案解析

全国高三高中化学专题试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.对于反应CO (g )+H 2O (g ) CO 2(g )+H 2(g ) ΔH<0,在其他条件不变的情况下( ) A .加入催化剂,改变了反应的途径,反应的ΔH 也随之改变 B .改变压强,平衡不发生移动,反应放出的热量不变 C .升高温度,反应速率加快,反应放出的热量不变 D .若在原电池中进行,反应放出的热量不变2.反应X (g )+Y (g ) 2Z (g ) ΔH<0,达到平衡时,下列说法正确的是( ) A .减小容器体积,平衡向右移动 B .加入催化剂,Z 的产率增大 C .增大c (X ),X 的转化率增大 D .降低温度,Y 的转化率增大3.一定条件下存在反应:CO (g )+H 2O (g ) CO 2(g )+H 2(g ),其正反应放热。
现有三个相同的2L 恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在I 中充入1 mol CO 和1 mol H 2O ,在Ⅱ中充入1 mol CO 2和1 mol H 2,在Ⅲ中充入2 mol CO 和2 mol H 2O,700℃条件下开始反应。
达到平衡时,下列说法正确的是( ) A .容器Ⅰ、Ⅱ中正反应速率相同 B .容器Ⅰ、Ⅲ中反应的平衡常数相同C .容器Ⅰ中CO 的物质的量比容器Ⅱ中的多D .容器Ⅰ中CO 的转化率与容器Ⅱ中CO 2的转化率之和小于14.某温度下,向2 L 恒容密闭容器中充入1.0 mol A 和1.0 mol B ,反应A (g )+B (g ) C (g ),经过一段时间后达到平衡。
反应过程中测定的部分数据如表,下列说法正确的是A.反应在前5 s 的平均速率v (A )=0.17 mol·L -1·s -1B .保持其他条件不变,升高温度,平衡时c (A )=0.41 mol·L -1,则反应的ΔH>0 C .相同温度下,起始时向容器中充入2.0 mol C ,达到平衡时,C 的转化率大于80%D .相同温度下,起始时向容器中充入0.20 mol A 、0.20 mol B 和1.0 mol C ,反应达到平衡前v (正)<v (逆) 5.在一定条件下的恒容密闭容器中发生反应:CO 2(g )+3H 2(g )CH 3OH (g )+H 2O (g ),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化。
高三三检化学试题及答案

高三三检化学试题及答案一、选择题(每题3分,共30分)1. 下列物质中,属于离子化合物的是:A. HClB. NaClC. H2OD. O2答案:B2. 金属钠与水反应生成氢气,其化学方程式为:A. 2Na + 2H2O → 2NaOH + H2B. Na + H2O → NaOH + H2C. 2Na + H2O → 2NaOH + H2D. Na + 2H2O → NaOH + 2H2答案:C3. 氧化还原反应中,氧化剂和还原剂的判断依据是:A. 得电子的物质是氧化剂B. 失电子的物质是还原剂C. 得电子的物质是还原剂D. 失电子的物质是氧化剂答案:A4. 下列化合物中,属于共价化合物的是:A. NaClC. HClD. SO2答案:D5. 根据元素周期表,下列元素中,最外层电子数最多的是:A. NaB. ClC. KD. Ca答案:B6. 溶液的pH值小于7,说明溶液呈:A. 中性B. 碱性C. 酸性D. 无法确定答案:C7. 根据勒夏特列原理,下列情况中,平衡不会发生移动的是:A. 增加反应物浓度B. 增加生成物浓度C. 增加惰性气体D. 改变温度答案:C8. 下列元素中,属于非金属元素的是:B. FeC. ClD. Mg答案:C9. 根据阿伏伽德罗定律,1摩尔气体在标准状况下的体积是:A. 22.4LB. 22.4mLC. 224LD. 224mL答案:A10. 金属的活泼性顺序中,最活泼的金属是:A. KB. CaC. NaD. Mg答案:A二、填空题(每题4分,共20分)1. 元素周期表中,第IA族元素的名称是________。
答案:碱金属2. 化学反应速率的快慢可以用________来表示。
答案:反应速率3. 根据化学键的类型,水分子中的化学键是________。
答案:极性共价键4. 原子核外电子排布遵循的规律是________。
答案:泡利不相容原理5. 根据酸碱质子理论,能够释放质子的物质是________。
全国高三高中化学专题试卷带答案解析
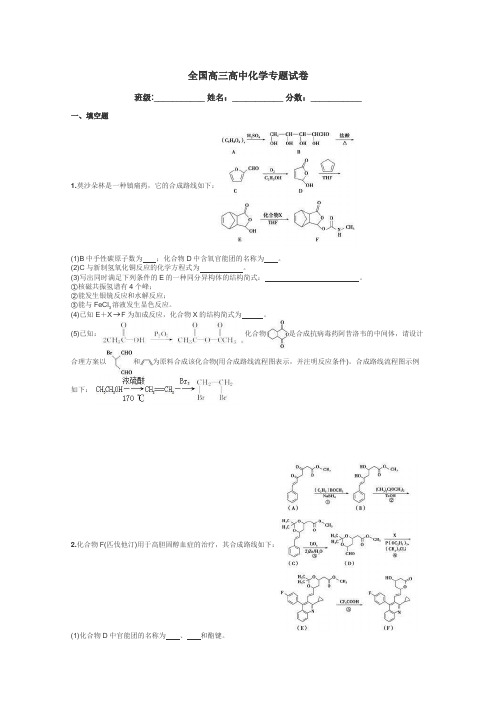
全国高三高中化学专题试卷班级:___________ 姓名:___________ 分数:___________一、填空题1.莫沙朵林是一种镇痛药,它的合成路线如下:(1)B中手性碳原子数为;化合物D中含氧官能团的名称为。
(2)C与新制氢氧化铜反应的化学方程式为。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:。
①核磁共振氢谱有4个峰;②能发生银镜反应和水解反应;③能与FeCl溶液发生显色反应。
3(4)已知E+X F为加成反应,化合物X的结构简式为。
(5)已知:化合物是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以和为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。
合成路线流程图示例如下:2.化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下:(1)化合物D中官能团的名称为、和酯键。
(2)A→B 的反应类型是 。
(3)写出同时满足下列条件的A 的一种同分异构体的结构简式: 。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O —O —。
(4)实现D→E 的转化中,化合物X 的分子式为C 19H 15NFBr ,写出其结构简式: 。
(5)已知:化合物E 在CF 3COOH 催化作用下先转化为,再转化为F 。
你认为合成路线中设计步骤②的目的是 。
(6)上述合成路线中,步骤③的产物除D 外还生成,该反应原理在有机合成中具有广泛应用。
试写出以为主要原料制备的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:3.托卡朋是基于2012年诺贝尔化学奖的研究成果开发的治疗帕金森氏病药物,《瑞士化学学报》公布的一种合成路线如下:(1)C→D 的反应类型为 。
(2)化合物F 中的含氧官能团有羟基、 和 (填官能团名称)。
(3)写出同时满足下列条件的D 的一种同分异构体的结构简式: 。
①能与Br 2发生加成反应;②是萘()的衍生物,且取代基都在同一个苯环上;③在酸性条件下水解生成的两种产物都只有4种不同化学环境的氢。
高三化学选择题专项训练及答案

高三化学选择题专项训练(1)一、选择题 (本题涉及8小题,每小题4分,共32分。
每小题只有一个选项符合题意)1、近年来,新疆、黑龙江、山西等地相继发生煤矿爆炸事故,吉林也发生化工厂爆炸事故,给人民生命和国家财产导致重大损失,安全生产已成为工业生产中的头等大事。
下列防止或解决事故的方法可行的是A 、煤矿工人可以先用明火伸入矿井以检测瓦斯的存在B 、若硝基苯污染水源,可用活性炭吸附硝基苯以减少水体污染C 、可以给矿井中充入大量的氮气以防止瓦斯爆炸D 、化工厂爆炸时可用湿布捂住鼻孔、眼睛等并躲在下风的低洼处2、有机化合物环丙叉环丙烷,由于其特殊的电子结构一直受到理论化学家的注意,如图是它的结构示意图。
下列关于环丙叉环丙烷的有关说法中错误的是A 、环丙叉环丙烷的二氯取代物有四种B 、环丙叉环丙烷不也许是环丙烷的同系物C 、环丙叉环丙烷与环己二烯互为同分异构体D 、环丙叉环丙烷所有的原子均在同一平面上3、将 和353)(OH H C (甘油)以一定比例混合,测得混合物含碳51.3%,那么氧元素的质量分数是A .40%B .35%C .30%D .无法计算4、具有不同碳原子数烷基的同分异构体数列表如下,请推测分子式为C 4H 11N 的同分异构体数为 甲基(-CH 3) 乙基(-C 2H 5) 丙基(-C 3H 7) 丁基(-C 4H 9) 戊基(-C 5H 11) 1 1 2 4 8A .4B .6C .7D .85、在101 kPa 时燃烧1 t 含FeS 2质量分数为70%的黄铁矿生成固态Fe 2O 3和气态SO 2,放出4.98×106 kJ 的热量,表达上述反映的热化学方程式对的的是A .4FeS 2(s)+11O 2(g) = 2 Fe 2O 3(s)+8SO 2(g);△H = +853.7 kJ ·mol -1B .FeS 2(s)+411O 2(g) = 21Fe 2O 3(s)+2SO 2(g);△H =-853.7 kJ ·mol -1 C .4FeS 2(s)+11O 2(g) = 2 Fe 2O 3(s)+8SO 2(g);△H = +3414.8 kJ ·mol -1D .FeS 2(s)+411O 2(g) = 21Fe 2O 3(s)+2SO 2(g);△H =-3414.8 kJ ·mol -1 6、2个氨基酸( ,烃基R 可同可不同)失去1个H 2O 缩合成二肽化合物,现有分子式为C 36H 57O 18N 11的十一肽化合物完全水解生成甘氨酸(C 2H 5O 2N )、丙氨酸(C 3H 7O 2N )、谷氨酸(C 5H 9O 4N ),在缩合成十一肽化合物时,这三种氨基酸的物质的量之比为A .3 : 3 : 5B .3 : 5 : 3C .5 : 3 : 3D .8 : 7 : 77、鸦片最早用于药物(有止痛、止泻、止咳作用),长期服用会成瘾。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选择题错漏专题训练(三)
一、单项选择题(每小题只有一个选项符合题意,每小题3分,共24分)
1、用铁酸钠(Na 2FeO 4)对来自河湖的淡水消毒净化是城市饮用水处理新技术,下列对用于饮用水净化处理的分析正确的是 C
A 、 Na 2FeO 4的溶液显强碱性,能消毒杀菌
B 、 在Na 2FeO 4中Fe 为+6价,具有强氧化性,能消毒杀菌
C 、 N a 2FeO 4的还原产物Fe 3+
易水解为Fe(OH)3 胶体,可使水中悬浮物凝聚沉降 D 、Na 2FeO 4的还原产物Fe 2+易水解为Fe(OH)2 胶体,可使水中悬浮物凝聚沉降
2、下列各组物质,可用一种试剂加以区别的是 D
①四种黑色固体:FeO 、Fe 、CuO 、C ②四种白色粉末:(NH 4)2SO 4、NH 4Cl 、Na 2SO 4 NaCl ③四种无色溶液:乙醛、乙酸、甲酸、甲酸甲酯 ④四种有机物:苯、四氯化碳、乙烯、无水乙醇
A 、只有①②
B 、只有③④
C 、只有①②④
D 、全部
3、用H 2 还原mgCuO ,当大部分固体变红时停止加热,冷却后称量,知残留固体质量为 ng ,共用去WgH 2 ,则被还原的CuO 的质量为 C
A 、40W g
B 、80m 64
g C 、5(m -n)g D 、mg 4、下列物质中,均直接由原子构成的是 C
①二氧化碳 ②二氧化硅 ③铁蒸气 ④金刚石 ⑤单晶硅 ⑥白磷 ⑦硫磺 ⑧氨 ⑨钠 ⑩氖晶体
A 、②③④⑤
B 、②③④⑤⑨⑩
C 、②③④⑤⑩
D 、②④⑤⑥⑦⑨⑩
5、一定条件下,可逆反应C(s) + CO 2(g )
2CO(g);△H >0,达到平衡状态,现进行如
下操作:①升高反应体系的温度; ②增加反应物C 的用量; ③缩小反应体系的体积; ④减少体系中CO 的量。
上述措施中一定能使反应的正反应速率显著加快的是 B
A 、①②③④
B 、①③
C 、①②
D 、①③④
6、必须加入氧化剂才能实现的是 B
A 、Cl 2 → NaClO
B 、Fe 2+ → Fe 3+
C 、H 2S → S
D 、Na 2SO 3 → Na 2SO 4 7、某一元弱酸稀溶液和某一元强碱稀溶液等体积混合后,其pH 等于7.0。
则下列叙述正确的是 A
A 、 酸溶液的物质的量浓度大于碱溶液的物质的量浓度
B 、 酸溶液中H +的浓度大于碱溶液中的OH -
的浓度
C、酸溶液的物质的量浓度小于碱溶液的物质的量浓度
D、酸溶液中H+浓度小于碱溶液中H+的浓度
8、下列变化属于物理变化的是A
A、浓硫酸镁溶液与蛋白质溶液混合
B、石墨转变为金刚石
C、稀硫酸溶液导电
D、块状纯碱在干燥空气中变成粉末
二、选择题(本题共11题,每小题可能有1到2个选项符合题意,每小题4分,共44分)
9、在相同条件下,学生甲取100gKNO3饱和溶液,学生乙取50gKNO3饱和溶液,加热,分别蒸发掉10g水,分别冷却到原来温度,则析出KNO3晶体的质量是C
A、甲比乙少
B、乙比甲少
C、一样多
D、无法比较
10、下列各组中,两种气体的分子数一定相等的是D
A、温度相同,体积相同的O2和N2
B、压强相同,体积相同的O2和N2
C、体积相等,密度相等的CO和NO
D、质量相等,密度不等的C2H4和N2
11、根据热化学方程式:S(s)+O2(g) =SO2(g);△H=-297.23kJ/mol,分析下列说法中正确的是C
A、S(g)+O2(g) =SO2(g);△H= Q kJ/mol 。
Q的值大于297.23
B、S(g)+O2(g) =SO2(g);△H= Q kJ/mol 。
Q的值等于297.23
C、1molSO2的键能总和大于1molS和1mol O2的键能总和
D、1molSO2的能量总和大于1molS和1molO2的能量总和
12、已知HF酸性比HCN的酸性强,现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所有离子数目为n1,后者的所有离子数目为n2,下列关系式正确的是BD(错选A)
A.n1 = n2B.n1 > n2C.n1 < n2D.[F-] > [CN -]
13、下列物质与水的混合物用分液漏斗分离时,该物质应从分液漏斗下端流出的是AB
A、硝基苯
B、溴苯
C、苯
D、己烷
14、下列事实可以证明氨水是弱碱的是BC
A、0.1mol/L的氨水可以使酚酞试液变红
B、0.1mol/L的氯化铵溶液的pH约为5
C、在相同条件下,氨水溶液的导电性比强碱溶液弱
D、铵盐受热易分解
15、已知K2HPO4溶液中HPO42—的水解程度大于其电离程度,对于平衡
HPO42—+ H2O PO43—+ H3O+,欲使溶液中C(HPO42—)、C(H3O+)、C(PO43—)均减小,可以采取的方法是C
A、加水
B、加热
C、加消石灰
D、加硝酸银
16、能正确表示下列化学反应的离子方程式的是BD较多同学漏选B
A、稀硝酸与锌的反应:2H+ + Zn = H2↑+ Zn2+
B、二氧化氮通入水中:3NO2 + H2O = 2H+ + 2NO3—+ NO
C、过氧化钠和水反应:Na2O2 + H2O = 2Na+ + 2OH—+O2↑
D、过量二氧化碳通入少量澄清石灰水中:CO2 + OH—= HCO3—
17、膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有。
它的分子是三角锥形,以下关于PH3的叙述正确的是BD很多漏选B A.PH3是非极性分子B.PH3分子中有未成键的电子对
C.PH3是一种强氧化剂D.PH3分子中的P—H键是极性键
18、已知298时,2SO2(g)+O2(g)2SO3(g);△H = -197kJ·mol-1。
在相同温度和压强下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量为Q1;向另一个体积相同的容器中通入1molSO2、0.5molO2和1molSO3,达到平衡时放出热量为Q2。
则下列关系正确的是 A
A.Q2<Q1< 197kJ B.Q2=Q1=197kJ C.Q1<Q2<197kJ D.Q1=Q2<197kJ
19、一定条件下,4g和14g的混合气体体积为448mL,相同状况下,8gA和17gB的混合气体体积为672mL,A、B可能是下列各组的C
A.乙烯和乙炔B.乙炔和苯C.甲烷和甲醇D.环己烷和1—丁烯。
