河北省2018_2019学年高二化学寒假作业6(无答案)
河北省2018_2019学年高二化学寒假作业9(无答案)

寒假作业9一.选择题(共 10 小题)1.下列物质在水溶液中的电离方程式书写正确的是()A.CH3COOH H++CH3COO﹣B.NaHSO4═Na++HSO4﹣C.H3PO4 3H++PO43﹣D.NaHCO3 Na++H++CO32﹣2.下列电离方程式正确的是()A.Ba(OH)2═Ba2++2OH﹣B.H2CO3═2H++CO32﹣C.H2SO4═2H++S6++4O2﹣D.Na2CO3═Na2++CO32﹣3.下列叙述正确的是()A.次氯酸的电离方程式为HClO═H++ClO﹣B.pH=7 的溶液一定是中性溶液C.在 CH3COONa 溶液中,c(CH3COO﹣)<c(Na+)D.0.2 mol•L﹣1CH3COOH 溶液中的 c(H+)是0.1 mol•L﹣1 HCl 溶液中的 c(H+)的 2 倍4.下列电离方程式正确的是()A.NaHS 溶于水:NaHS═Na++HS﹣,HS﹣+H2O⇌H3O++S2﹣B.KH2PO4溶于水:H2PO4﹣2H++PO43﹣C.HF 溶于水:HF═H++F﹣D.NH4Cl 溶于水:NH4++2H2O NH3•H2O+H3O+5.下列有关电解质的说法正确的是()A.强电解质的溶液一定比弱电解质的溶液导电性强B.易溶性强电解质的溶液中不存在溶质分子第1页(共4页)C.强电解质都是离子化合物,而弱电解质都是共价化合物D.由于硫酸钡难溶于水,所以是弱电解质6.下列说法正确的是()A.强电解质一定是离子化合物,弱电解质一定是共价化合物B.强电解质一定是易溶化合物,弱电解质一定是难溶化合物C.SO3溶于水后水溶液导电性很强,所以 SO3是强电解质D.强电解质与弱电解质的本质区别是在水溶液中能否完全电离7.关于相同体积 pH 均为 3 的醋酸和盐酸,下列说法正确的是()A.稀释 10 倍后,两者的 pH 变化醋酸大于盐酸B.中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸C.加人一定量的锌粉,产生气体的体积相同,则醋酸一定过量D.加人足量的锌粉,产生氢气的速率随时间的变化如图所示8.25℃时,几种弱酸的电离常数如表:下列说法正确的是()A.等物质的量浓度的各溶液 pH 关系为:pH(CH3CO0Na)>pH(Na2S)>pH (NaCN)B.a mol•L﹣1HCN 溶液与b mol•L﹣1 NaOH 溶液等体积混合,所得溶液中 c (Na+)>c(CN﹣)则 a 一定小于 b C.在 Na2S 的稀溶液中存在 c(OH﹣)=c (HS﹣)+2c(H2S)+c(H+)D.某浓度的 NaCN 溶液的 pH=d,则其中由水电离出的c(OH﹣)=10﹣d mol•L﹣1第2页(共4页)9.能证明碳酸的酸性比硅酸强的事实是()A.CO2溶于水生成碳酸,SiO2不溶于水也不能与水直接反应生成硅酸B.在高温条件下,SiO2能与 Na2CO3反应C.SiO2的熔点比 CO2的熔点高D.CO2通入到 Na2SiO3溶液中生成白色絮状沉淀10.能证明硅酸的酸性弱于碳酸酸性的实验事实是()A.CO2溶于水形成碳酸,SiO2难溶于水B.CO2通入可溶性硅酸盐中析出硅酸沉淀C.高温下 SiO2与碳酸盐反应生成 CO2D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀二.填空题(共 2 小题)11.按要求填空:(1)电离方程式:硫酸铁:;碳酸氢钠:;(2)以下物质:①NH3②CaCO3③酒精④饱和食盐水⑤Cu⑥KOH⑦HCl⑧稀硫酸,属于电解质的有(填编号);(3)14.7 gH2SO4分子所含氢原子数与L (标准状况下)NH3所含氢原子数相等;等质量的 N2和 N4所含的原子个数之比是.12 .有下列物质:①NaCl②K2SO4③AlCl3 ④CuSO4⑤CH3COOH ⑥ 蔗糖⑦BaSO4 ⑧NaOH溶液(1)属于弱电解质的是(填序号,下同),能导电的物质是(2)加热蒸干 AlCl3水溶液并灼烧,得到物质的化学式为。
2018_2019学年高二化学上学期寒假作业六word版本

河北省武邑中学2018-2019学年高二化学上学期寒假作业(六)选择题(每小题只有一个选项符合题意)1.近年来,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点.假如硅作为一种普遍使用的新型能源被开发利用,其有利因素的下列说法中你认为不妥当的是()A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料B.硅的来源丰富,易于开采,且可再生C.硅燃料放出的热量大,且燃料产物对环境污染较低,容易有效控制D.寻找高效催化剂,使二氧化硅分解产生硅的同时释放能量,是硅能源大规模开发利用的一项关键技术2.已知:①2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ•mol﹣1②H2(g)+S(g)=H2S(g)△H=﹣20.1kJ•mol﹣1.下列判断正确的是()A.1 mol氢气完全燃烧吸热241.8 kJB.l mol H2O(g)和1 mol H2S(g)的能量相差221.7 kJC.由①②知,水的热稳定性小于硫化氢D.若反应②中改用固态硫,1 mol S(s)完全反应,放出的热量小于20.1 kJ3.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是A.加催化剂同时升高温度B.加催化剂同时增大压强C.升高温度同时充入N2 D.降低温度同时增大压强4.下列条件一定能使反应速率增大的是()①增加反应物的物质的量②升高温度③缩小反应容器的体积④不断分离出生成物⑤加入MnO2A.全部 B.①②⑤ C.②③ D.②5.现有16.8g由Fe、Fe2O3、Al、Al2O3组成的混合物,将它完全溶解在600mL2mol/L的硫酸溶液中,收集到标准状况下的气体8.96L.已知混合物中Fe、Fe2O3、Al、Al2O3的质量分数分别为16.7%、16.1%、38.1%、29.1%,欲使溶液中的金属离子完全沉淀,至少应加入3mol/LNaOH溶液的体积是()A.800mL B.300mL C.600mL D.900mL6.(双选)已知反应①101kPa时,2C(s)+O2(g)=2CO(g)△H=﹣221kJ/mol②稀溶液中,H+(aq)+OHˉ(aq)=H2O(l)△H=﹣57.3kJ/mol下列结论正确的是()A.碳的燃烧热大于110.5 kJ/mol B.①反应的焓变为-221 kJ/mol C.稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/molD.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量7.一定条件下,下列反应呈平衡状态时的平衡常数:2N2(g) + 6H2(g) 4NH3(g) K1 2NH3(g) N2(g) + 3H2(g) K2。
河北石家庄18-19高二下学期年末-化学

河北石家庄18-19高二下学期年末-化学河北省石家庄市2018—2018学年度下学期期末考试高二化学试题可能用到的相对原子质量:C:12H:1O:16Na:23Si:28Cr:52Mn:55Br:80Ba:137第I卷〔选择题60分〕【一】选择题〔共15小题,每题2分,共30分。
每题只有一个选项符合题意〕1.以下说法中不正确的选项是()A.维勒用无机物合成了尿素,突破了无机物与有机物的界限B.开发核能、太阳能等新能源,推广乙醇汽油,使用无磷洗涤剂都可直截了当降低碳排放量C.红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析D.尼龙、棉花、天然橡胶、ABS树脂基本上由高分子化合物组成的物质2.既有离子键又有共价键和配位键的化合物是〔〕A.NH4NO3B.NaOHC.H2SO4D.H2O3.以下分子中心原子是sp2杂化的是〔〕A.PBr3B.CH4C.BF3D.H2O4.常温常压下为无色液体,而且密度大于水的是〔〕①一氯甲烷②硝基苯③溴苯④四氯化碳⑤溴乙烷⑥乙酸乙酯A.①⑥B.②③④⑥C.②③④⑤D.①④⑤5.右图是氯化钠晶体的结构示意图,其中,与每个Na+距离最近且等距离的几个Cl-所围成的空间的构形为〔〕A、正四面体形B、正六面体形C、正八面体形D、三角锥形6.以下实验装置图正确的选项是()A、实验室制备及收集乙烯B、石油分馏C.实验室制硝基苯D.实验室制乙炔7.在pH=1的无色溶液中,以下离子能大量共存的是 〔〕A 、NH 4+、Ba 2+、NO 3—、CO 32—B 、Fe 2+、OH —、SO 42—、MnO 4— C 、K +、Mg 2+、NO 3-、SO 42— D 、Na +、Fe 3+、Cl —、AlO 2—8.以下表达中正确的选项是〔〕A 、金属的熔点和沸点都特别高B 、H 2O 2、PCl 3基本上含有极性键的非极性分子C 、HF 、HCl 、HBr 、HI 的酸性依次增强D 、H 2O 是一种特别稳定的化合物,这是由于氢键所致9.选择适当的试剂鉴别、、己炔、乙酸四种物质〔〕A 、水B 、溴水C 、NaOH 溶液D 、酸性高锰酸钾溶液10.在差不多处于化学平衡状态的体系中,假如以下量发生变化,其中一定能说明化学平衡移动的是〔〕A.反应混合物的浓度B.反应体系的压强C.正、逆反应的速率D.反应物的转化率11.某元素的原子最外电子层排布是5s 25p 1,该元素或其化合物不可能具有的性质是〔〕18.该元素单质是导体B 、该元素单质在一定条件下能与盐酸反应C 、该元素的氧化物的水合物显碱性D 、该元素的最高化合价呈+5价12.以下说法不正确的选项是〔〕A.定溴乙烷中存在溴元素:加入NaOH 溶液加热,冷却后加入稀硝酸酸化,然后加入AgNO 3溶液B 、分子中羟基的活性:>>CH 3OHC 、常温常压下各物质的密度:>> H 2O>CH 3COOCH 2CH 3D 、物质在水中的溶解性:HOCH 2—CH 2OH>CH 3CH 2OH>CH 3CH 313.水的电离方程式:H 2O H ++OH -。
河北省2018_2019学年高二化学寒假作业15(无答案)
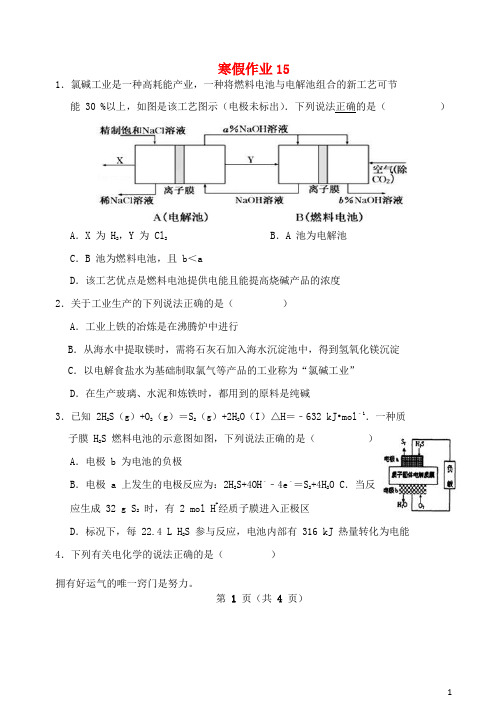
寒假作业151.氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能 30 %以上,如图是该工艺图示(电极未标出).下列说法正确的是()A.X 为 H2,Y 为 Cl2B.A 池为电解池C.B 池为燃料电池,且 b<aD.该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度2.关于工业生产的下列说法正确的是()A.工业上铁的冶炼是在沸腾炉中进行B.从海水中提取镁时,需将石灰石加入海水沉淀池中,得到氢氧化镁沉淀C.以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”D.在生产玻璃、水泥和炼铁时,都用到的原料是纯碱3.已知 2H2S(g)+O2(g)=S2(g)+2H2O(I)△H=﹣632 kJ•mol﹣1.一种质子膜 H2S 燃料电池的示意图如图,下列说法正确的是()A.电极 b 为电池的负极B.电极 a 上发生的电极反应为:2H2S+4OH﹣﹣4e﹣=S2+4H2O C.当反应生成 32 g S2时,有 2 mol H+经质子膜进入正极区D.标况下,每 22.4 L H2S 参与反应,电池内部有 316 kJ 热量转化为电能4.下列有关电化学的说法正确的是()拥有好运气的唯一窍门是努力。
第1页(共4页)钢闸门容易被腐a、b 均惰性电极,电池工作一段时间阴、阳两极生成的蚀 a 极电极反应为:后,乙池溶液的总气体的物质的量之H2﹣2e﹣=2H+ 质量增加比是 1:15.锂(Li)﹣空气电池的工作原理如图所示下列说法不正确的是()A.金属锂作负极,发生氧化反应B.Li+通过有机电解质向水溶液移动C.正极的电极反应:O2+4e﹣═2O2﹣D.电池总反应:4Li+O2+2H2O═4LiOH第 5 题第 6 题6.为了验证 Fe2+与 Cu2+氧化性强弱,选用如图装置,若构建原电池时两个电极的质量相等,当导线中通过 0.05 mol 电子时,两个电极的质量差为A.3 g B.1.4 g C.1.6 g D.0 g7.科学家研发出了一种新材料,其工作原理如图所示。
河北省2018_2019学年高二化学寒假作业11(无答案)

寒假作业11一.选择题(共 10 小题)1.下列离子方程式中,属于水解反应的是()A.CH3COOH+H2O CH3COO﹣+H3O+B.CO2+H2O HCO3﹣+H+C.HCO3﹣+H2O H2CO3+OH﹣D.HS﹣+H2O S2﹣+H3O+2.下列关于电解质溶液的叙述正确的是()A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中 c(NH4+)①<②<③B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离C.中和 pH 与体积均相同的盐酸和醋酸溶液,消耗 NaOH 的物质的量相同D.常温下,同浓度的 Na2S 与 NaHS 溶液相比,Na2S 溶液的 pH 大3.为了使 K2S 溶液中 c(K+)/c(S2﹣)的比值变小,可加入的物质是()①适量的 HCl;②适量的 NaOH;③适量的 KOH;④适量的 NaHS.A.②③B.①②C.③④D.②④4.Na2CO3溶液存在水解平衡:CO32﹣+H2O HCO3+OH﹣.下列说法正确的是()A.稀释溶液,水解平衡常数增大B.加入少量 NH4Cl 固体,平衡向正反应方向移动C.升高温度,减小立志宜思真品格,读书须尽苦功夫。
第1页(共4页)D.加入 NaOH 固体,溶液 pH 减小5.已知 K2HPO4溶液水解程度大于电离程度,对于平衡 HPO42﹣+H2O H3O++PO43﹣,欲使溶液中 c(HPO42﹣)、c(PO43﹣)、c(H3O+)三种离子浓度均减少,可采用的方法是 (已知:常见磷酸盐中只有钾盐、钠盐、铵盐易溶于水) ()A.加水B.加热C.加消石灰D.加 AgNO36.浅绿色的 Fe(NO3)2溶液中,存在水解平衡:Fe2++2H2O Fe(OH)2+2H+.若在此溶液中加入盐酸,则溶液颜色()A.浅绿色略变深B.颜色基本不变C.变为红褐色D.变黄7.把下列溶液蒸干并灼烧最后能得到原溶液中溶质的是()A.氯化铁溶液B.碳酸钠溶液C.亚硫酸钠溶液D.高锰酸钾溶液8.20 ℃时,两种一元弱酸的钠盐 NaX 和 NaY,已知,往 NaX 溶液中通入 CO2 只能生成HX 和 NaHCO3;往 NaY 溶液中通入 CO2能生成 HY 和 Na2CO3,下列说法正确的是()A.酸性 HY>HX B.结合 H+的能力 Y﹣>CO32->X﹣>HCO3-C.溶液的碱性:NaX>Na2CO3>NaY>NaHCO3D.HX 和 HY 酸性相同但比 H2CO3弱9.下列应用与盐类的水解无关的是()A.明矾用于净水B.次氯酸钠常用作消毒剂C.FeCl3溶液滴入沸水中制 Fe(OH)3胶体D.用碳酸氢钠和硫酸铝两种溶液可制成泡沫灭火剂10.下列浓度关系正确的是()A.0.1 mol/L 的 NH4HSO4溶液中滴加0.1 mol/L 的 Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH﹣)>c(SO42﹣)>c(H +)B.若将 CO2通入 0.1 mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32﹣)+c(HCO3﹣)=0.1 mol/L C.0.1 mol/L 的 NaOH 溶液与 0.2 mol/L 的HCN 溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN﹣)>c(HCN)>c(OH﹣)>c(H+)D.向 1 L 1 mol/L 的 KOH 热溶液中通入一定量的 Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液:c(K +)+c(H +)=6c(ClO3﹣)+2c(ClO﹣)+c(HClO)+c(OH﹣)二.填空题(共 2 小题)11.从 Na2CO3、NaCl、CH3COOH、Al2(SO4)3、NH3五种物质中:(1)选取溶于水中会促进水电离,且溶液显碱性的物质,用离子方程式表示溶液其显碱性的原因:;(2)选取溶于水会抑制水电离,且溶液显酸性的物质,用化学用语表示其显酸性的原因:;(3)选取溶于水会促进水电离,且溶液显酸性的物质,用离子方程式表示其溶液显酸性的原因:.12.CuSO4的水溶液呈(填“酸”、“中”、“碱”)性,常温时的 pH7 (填“>”或“=”或“<”),实验室在配制 CuSO4的溶液时,常将 CuSO4固体先溶于硫酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解.三.实验题(共 1 小题)13.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4 在分析试剂、医药、电子工业中用途广泛,请回答下列问题:(1)相同条件下,pH 相同的 NH4Al(SO4)2中 c(NH4+)(填“=”、“>”或“<”)NH4HSO4中 c(NH4+).(2)如图 1 是0.1 mol•L﹣1电解质溶液的 pH 随温度变化的图象.①其中符合0.1 mol•L﹣1NH4Al(SO4)2的 pH 随温度变化的曲线是(填写字母);②20 ℃时,0.1 mol•L﹣1 NH4Al(SO4)2中 2c(SO42﹣)﹣c(NH4 +)﹣3c(Al3+)=mol•L﹣1(填数值)(3)室温时,向100 mL 0.1 mol•L﹣1NH4HSO4溶液中滴加0.1 mol•L﹣1NaOH 溶液,得到的溶液 pH 与 NaOH 溶液体积的关系曲线如图 2 所示.试分析图中 a、b、c、d 四个点,水的电离程度最大的是;在 c 点,溶液中各离子浓度由大到小的排列顺序是.立志宜思真品格,读书须尽苦功夫。
河北省2018_2019学年高二化学寒假作业10(无答案)

1寒假作业10一.选择题(共 10 小题)1.25°C 时,水的电离达到平衡:H 2OH ++OH ﹣,下列叙述正确的是( )A .将纯水加热到 95 0C 时,Kw 变大,pH 不变,水仍呈中性B .向纯水中加入稀氨水,平衡逆向移动,c (OH ﹣)增大,Kw 变小C .向水中加入少量固体硫酸氢钠,c (H +)增大,平衡逆向移动,K W 不变D .向水中通入 HCl 气体,平衡逆向移动,溶液导电能力减弱2.下列说法正确的是( )A .电解精炼铜时,阳极泥中含有 Zn 、Fe 、Ag 、Au 等金属B .在硫酸钡悬浊液中加入足量饱和 Na 2CO 3 溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明 Ksp (BaSO 4)>Ksp (BaCO 3)C .恒温时,向水中加入少量固体硫酸氢钠,c (H +)增大,水的离子积常数K w 不变D .2CO (g )+2NO (g )═N 2(g )+2CO 2(g )在 298 K 时能自发进行,则它的△H>0,△S>03.下列离子在稳定人体血液的 pH 中起作用的是( )A .Fe2+B .Na+C .HCO 3﹣D .Cl﹣4.测定下列溶液的 pH 测定结果错误的是( )A .柑橘汁 pH :3~4B .食盐溶液 pH =7C .醋酸溶液 pH =4D .纯碱溶液 pH =75.将 1 mol•L ﹣1的下列物质的水溶液,从常温加热至 100 ℃,溶液的 pH 保持 不变的是( )A .氯化钠B .氢氧化钾C .硫酸铵D .硫酸 天道酬勤。
第 1 页(共 4 页)6.稀盐酸标准溶液滴定未知浓度的 NaOH 溶液时,造成 NaOH 溶液浓度测定值偏低的原因是()A.滴定管用蒸馏水洗净后,直接装入盐酸标准溶液B.锥形瓶用水洗净后直接装入待测溶液C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失D.滴定过程中,摇动锥形瓶时有溶液溅出7.某学生用0.2000 mol•L﹣1的标准 NaOH 溶液滴定未知浓度的盐酸,下列操作会引起实验结果偏大的是()A.在锥形瓶装液前,留有少量蒸馏水B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗D.用酸式滴定管量取液体时,读数,之前俯视,之后平视8.用 0.100 mol/L标准盐酸溶液滴定 20 mL 未知浓度的氢氧化钠溶液,下列操作会造成测定结果偏低的是()A.装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸B.滴加盐酸时滴到锥形瓶外C.滴定过程中,振荡时待测液溅出锥形瓶D.滴定前装盐酸的滴定管有气泡,滴定后气泡消失9.常温下,下列叙述正确的是()A.pH<7 的溶液是酸的溶液B.pH>7 的溶液是碱的溶液C.pH>7 的溶液有可能是盐的溶液,这是因为盐可能电离出 H+D.pH>7 的溶液有可能是盐的溶液,这是盐类水解造成的10.常温下,下列溶液肯定呈碱性的是()A.溶液中含有 OH﹣B.与氯化铵溶液反应放出氨气天道酬勤。
2018-2019学年度第一学期高二化学试题及答案(K12教育文档)

2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改) 2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018-2019学年度第一学期高二化学试题及答案(word版可编辑修改)的全部内容。
第1页共16 页2018-2019学年度第一学期高二化学试题及答案本试卷分第Ⅰ卷选择题和第Ⅱ卷非选择题,共100分,考试时间70分钟。
第I卷(选择题)一、选择题(本题共20道小题,每小题3分,共60分)1.下列说法不正确的是( )A. 人类在远古时代就通过燃烧植物的方式开始利用生物质能B。
氢能是理想的绿色能源,但人们只能将氢气的化学能转化为热能C。
煤中含有硫元素,大量的直接燃烧煤会引起酸兩等环境问题D。
太阳能以光和热的形式传送到地面,人们可以直接利用这些光和热2.据报道,科学家开发出了利用太阳能分解水的新型催化剂.下列有关水分解过程的能量变化示意图正确的是()A.B.C.D .3.常温下,1mol化学键分解成气态原子所需要的能量用E表示.根据表中信息判断下列说法不正确的是()共价键H﹣H F﹣F H﹣F H﹣ClH﹣I E(kJ•mol﹣1)436157568432298 A.432 kJ•mol﹣1>E(H﹣Br)>298 kJ•mol﹣1B.表中最稳定的共价键是H﹣F键C.H2(g)→2H (g)△H=+436 kJ•mol﹣1第2页共16 页D.H2(g)+F2(g)=2HF(g )△H=﹣25 kJ•mol﹣14.下列热化学方程式,正确..的是()A。
河北省2018_2019学年高二化学寒假作业18(无答案)

寒假作业18一.选择题(共 12 小题)1.下列正确的是()A.碳酸电离:H2CO3H++HCO3﹣B.Na2S 水解:S2﹣+2H2O H2S↑+2OH﹣C.Na2CO3溶液:c(HCO3﹣)>c(OH﹣) D.NH4Cl 溶液中,c(NH4+)>c(Cl﹣) 2.盐酸与氢氧化钠溶液相互滴定的滴定曲线如图,下列叙述正确的()A.酚酞不能用作本实验的指示剂B.盐酸的物质的量浓度为 1 mol・L﹣1C.P 点时恰好完全中和,溶液呈中性D.曲线 a 是盐酸滴定氢氧化钠溶液的滴定曲线3.下列电离方程式中正确的是()A.HF 溶于少量水中:HF+H2O F﹣+H3O+B.H2S 溶于水:H2S 2H++S2﹣C.Na2HPO4溶于水:Na2HPO4═2Na++H++PO43﹣D.NaHSO4熔融:NaHSO4═Na++H++SO42﹣4.常温下,c(OH﹣)最小的是()A.pH=0 的溶液B.0.05 mol/L H2SO4C.0.5 mol/L HCl D.0.05 mol/L Ba(OH)25.下列属于弱电解质的是()A.CO2 B.BaSO4 C.HClO D.Cl26.室温下,pH 均为 2 的两种一元酸 HA 和 HB 各 1 mL,分别加水稀释,pH 随溶液体积的变化曲线如图。
正确的是()有些事情不是看到希望才去坚持,而是坚持了才看得到希望。
第1页(共4页)A.HA 为弱酸,HB 为强酸B.a 点溶液的导电性比 c 点溶液的导电性弱C.若两溶液加水稀释,则所有离子的浓度都减小D.对 a、b 两点溶液同时升高温度,则减小7.由重水 D2O 组成的水,D2O 的离子积为1.6×10﹣15,可用 pH 一样定义规定PD=﹣lg{c(D+)},下列关于 PD 的叙述,正确的是()A.D2O 呈中性,PD=7B.1LD2O 溶液中含 0.01 mol NaOD,PD=12C.用 D2O 溶解 0.1 mol DCl 成 1L 溶液,PD=2D.在 100 ml 0.25 mol/L DCl 溶液中加入 50 ml 0.2 mol/L 的 NaOD 的 D2O溶液,PD=1 8.下列说法正确的是()A.25 ℃与100 ℃时,水的 pH 相等B.在25 ℃时,0.1 mol/L 的硫酸中,K w值为1×10﹣14C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的 n(NaOH)不相等D.H2(g)+O2(g)═H2O(g)和 2H2(g)+O2(g)═2H2O(g)的△H 相等二.填空题(共 2 小题)9.已知0.1 mol•L﹣1的 NaHSO4溶液中 H+的浓度为0.1 mol•L﹣1,请回答下列问题:(1)写出 NaHSO4在水溶解中的电离方程式:;写出 NaHSO4 在熔融状态下的电离方程式:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
寒假作业6
一.选择题(共 10 小题)
1.下列数据不一定随温度升高而增大的是()
A.活化分子百分数
B.化学平衡常数
C.弱酸或弱碱的电离平衡常数
D.水的离子积常数
2.下列说法正确的是()
A.人们把能够发生有效碰撞的分子叫做活化分子,同时把活化分子具有的能量叫活化能
B.化学反应不一定都有能量变化
C.活化能接近于零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率几乎没有什么影响
D.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量变化产生影响
3.下列说法正确的是()
A.能够发生化学反应的碰撞是有效碰撞
B.活化分子之间的碰撞一定是有效碰撞
C.反应物分子的每次碰撞都能发生化学反应
D.增大反应物浓度时,活化分子百分数增大
4.化工生产中未使用催化剂的是()
A.联合制碱B.合成氨气C.乙烯水化D.生产硫酸5.2007 年诺贝尔化学奖得主﹣﹣德国科学家格哈德•埃特尔通过对有关一氧化
拥有好运气的唯一窍门是努力。
第1页(共4页)
碳在金属铂表面的氧化过程的研究,发明了汽车尾气净化装置.净化装置中的催化转化器,可将 CO、NO、NO2和碳氢化合物等转化为无害的物质,有效降低尾气对环境的危害.下列有关说法不正确的是()
A.催化转化器中的铂催化剂可加快 CO 的氧化
B.铂表面做成蜂窝状更有利于提高催化效果
C.在铂催化下,NO、NO2可被 CO 还原成 N2
D.碳氢化合物在铂催化下,被 CO 直接氧化成 CO2和 H2O
6.比较 MnO2和 CuO 对 H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在 0.1 g,6%的 H2O2溶液均取 5 mL,可选择的实验装置是()
A. B.
C. D. 7.下列说法正确的
是()
①增加水的量或温度,都可以加快镁跟水的反应速率。
②增加硫酸的浓度,一定可以加快锌与硫酸反应制取氢气的速率。
③对反应 3H2(g)+N2(g)2NH3(g),在一密闭容器中进行,充入氦气,则
化学反应速率一定不改变。
④对于反应 3KSCN(aq)+FeCl3(aq)Fe(SCN)3(aq)+3KCl(aq),加入 KCl
固体,逆反应速率瞬时增大,随后正反应速率增大。
A.①②B.①④C.②④D.无
拥有好运气的唯一窍门是努力。
第2页(共4页)
8.控制变量是科学研究的重要方法。
向 2 mL H2O2溶液中滴入 2 滴 1 mol/L CuSO4 溶液,下列条件下分解速率最快的是()
A.A B.B C.C D.D 9.下列化学实验事实及其解释都正确的是()
A.过量的铜屑与稀硝酸作用,反应停止后,再加入 1 mol/L 稀硫酸,铜屑又逐渐溶解是因为铜可直接与 1 mol/L 稀硫酸反应
B.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入 CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.工业制玻璃的主要反应之一:Na2CO3+SiO2Na2SiO3+CO2↑,该反应
原理可用“强酸 H2CO3制弱酸 H2SiO3”来解释
10.等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t 产生氢气体积 V 的数据,根据数据绘制得如图,则曲线 a、b、c、d 所对
应的实验组别可能是组别可能是()
拥有好运气的唯一窍门是努力。
第3页(共4页)
5
A .4﹣3﹣2﹣1
B .1﹣2﹣3﹣4
C .3﹣4﹣2﹣1
D .1﹣2﹣4﹣3
二.填空题(共 2 小题)
11.某反应在催化剂的作用下按以下两步进行:第一步为 X+Y =Z ;第二步为 Y+Z
=M+N+X .此反应的总化学方程式为 ,反应的催化剂为 .
12.已知 2KMnO 4 + 5H 2C 2O 4 + 3H 2SO 4═K 2SO 4 + 2MnSO 4 + 8H 2O + 10CO 2↑,在开始
一段时间内,反应速率较小,溶液褪色不明显;但不久反应速率明显增大,
溶液很快褪色.针对上述现象,某同学认为该反应放热,导致溶液温度上升,
反应速率增大.从影响化学反应速率的因素看,你猜想还可能是 的
影响.若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以选
择在反应开始前是否加入 (填字母序号)做对比实验.
A .硫酸钾
B .硫酸锰
C .氯化锰
D .水.
拥有好运气的唯一窍门是努力。
第 4 页(共 4 页)。
