化学环烷烃
环烷烃的概念

环烷烃的概念环烷烃是一类有机化合物,也被称为脂环烷烃或脂肪环烷烃。
它的分子结构由碳(C)和氢(H)原子组成,其中碳原子形成一个或多个环状结构,每个碳原子上连接着两个氢原子。
环烷烃的普遍化学式为CnH2n,其中n代表碳原子的数量。
环烷烃根据碳原子的环状结构可以分为多个类别,最简单的是环己烷(C6H12),它由六个碳原子组成一个环。
其他常见的环烷烃有环戊烷、环丙烷等。
环烷烃的特点是分子结构中含有一个或多个环状结构,这种环状结构使得环烷烃相对于直链烷烃具有一些特殊的性质。
首先,由于环烷烃分子内部有较大的空间限制,环烷烃的分子难以与其他分子进行反应,使得环烷烃的化学稳定性较高。
此外,环烷烃还具有较高的沸点和熔点,比直链烷烃的物理性质要高。
环烷烃可以通过多种方法合成,最常见的方法是通过烷烃的脱氢反应得到。
例如,环己烷可以由己烷经过加热脱氢反应制得。
此外,环烷烃还可以通过环状化合物之间的反应合成,如环戊烷可以由乙烯和乙烯二聚反应得到。
环烷烃在生活中有广泛的应用。
最典型的例子是石油和天然气中的环烷烃,它们是石油和天然气中最常见的组分之一。
石油和天然气中的环烷烃可以用于生产燃料、润滑剂和化工原料。
此外,环烷烃还可用作溶剂、塑料、橡胶等领域的原料。
但是,环烷烃也存在一些环境和健康方面的问题。
环烷烃是一类挥发性有机物,它们在大气中的存在会对空气质量产生负面影响,形成臭氧、光化学烟雾等污染物。
此外,环烷烃还可能引发健康问题,如呼吸道疾病和神经系统损伤。
总之,环烷烃是一类有机化合物,具有稳定性高、物理性质特殊的特点。
它们在能源、化工和其他领域有着广泛的应用,但也带来环境和健康方面的问题。
对环烷烃的深入研究和合理利用,有助于提高环境质量,推动可持续发展。
环烷烃

• 环烷烃的化学性质
加氢
与卤素反应
+ Cl2
hv
+ Br2 300 ℃
Cl + HCl
Br + HBr
与氢卤酸反应
+HI +HI CH3 +HI
CH3CH2CH2I
CH3CH2CH2CH2I I
CH3CHCH2CH3
反应活性次序 :
• 第三章习题 • 1-1,2,4,5,6 • 3-1,2,5 •5 • 6-1,2,4,5 • 10-1
CH3 CH3
CH3 CH3
优势构象
多取代环己烷有不同取代基时,体积较大 的取代基在e键为优势构象
CH3
CH3
(CH3)2CH
CH(CH3)2
(CH3)2CH
CH3
优势构象
(CH3)2CH
CH3
CH3
(CH3)2CH
优势构象
(CH3)2CH CH3
• 思考题: 写出反-1-甲基-3-叔丁基环己烷的优势构象。
4
315
2
6
a键和e键:
6个a键
6个e键
• a键和e键的转换
H 5H 4H 3
H
H6 1 H2
4 5
3
6
2 1
• 取代环己烷的稳定构象
单取代环己烷一般以取代基在e键的 构象为优势构象
H
5H
4
3
HH
C
H
61
室温
2
4
3
5
2
6
CH3
1
CH3
H
多取代环己烷一般以取代基在e键较多者为 优势构象
CH3 CH3
环烷烃

1–甲基–2–乙基环己烷
CH(CH3)2
CH3
1–甲基环丁烯
5–异丙基– 1,3–环戊二烯
二、环烷烃的化学性质
卤代反应
光照 + Br2 Br + HBr
CH3 +
光照 Br2
Br CH3 + HBr
1-甲基-1 –溴环已烷
开环加成反应 (1)加H2
C 2 H H2C H2C H2C CH2 CH CH Ni / 80。 C H2 Ni H2
氧化反应 常温下环烷烃与氧化剂不反 应,不使KMnO4溶液褪色。
三、环烷烃的稳定性
与张力能有关
环丙烷 总张力能(KJ.mol-1) 115.5
环丁烷
110.4
环戊烷 环己烷
27.0 0
结论:环烷烃的张力能越大,越不稳定。 (稳定性:环己烷 > 环戊烷 > 环丁烷 > 环丙烷)
四、环已烷的构象
环已烷的构象
(1)优势构象:椅式构象
椅式 (2)a,e键和构象的翻转
Hale Waihona Puke 船式环烷烃内容提要
环烷烃的命名 环烷烃的化学性质 环烷烃的稳定性 环已烷的构象
环烷烃
脂环烃是指性质类似脂肪烃的碳环化合
物。饱和的脂环烃又称环烷烃,通式为
CnH2n(n≥3)。
一、环烷烃的命名
1.常见环烷烃
环丙烷
环丁烷
环戊烷
环已烷
2. 复杂结构的环烷烃命名
CH3 CH3
CH3 CH2CH3
1,2–二甲基环丙烷
CH3CH2CH3
H2C H2C CH2
H2
CH2 Ni / 200 C
。 CH3CH2CH2CH3
有机化学第五章环烷烃

使用分子轨道模型可以解释环烷烃的电子结构和性质,例如键的 性质和稳定性。
07 结论与展望
环烷烃的重要性和应用前景
环烷烃作为有机化学中的重要组成部分,具有广 泛的应用前景。在能源、材料、医药等领域,环 烷烃都发挥着重要的作用。随着科技的不断发展 ,环烷烃的应用领域还将进一步拓展。
在材料领域,环烷烃可用于合成高分子材料、功 能性材料等。例如,环烷烃基聚合物具有良好的 热稳定性、电绝缘性和化学稳定性,广泛应用于 电子、航空航天、汽车等领域。
位置异构。
碳环异构是指由于碳环的形状和 大小不同引起的异构,例如正烷
烃和异烷烃。
位置异构是指由于取代基在碳环 上的位置不同引起的异构,例如 1-甲基环己烯和2-甲基环己烯。
顺反异构体
顺反异构体是指由于碳-碳双键上的 取代基的相对位置不同引起的异构, 例如顺式-2-丁烯和反式-2-丁烯。
在顺反异构体中,由于双键两侧的基 团不同,导致双键上的电子分布不均 匀,从而产生不同的化学性质。
脂环烃
定义
脂环烃是一类具有闭合环状结构的烃类化合物,其碳原子之间通 过单键或双键连接形成环状结构。
分类
脂环烃可以分为饱和脂环烃和不饱和脂环烃,其中饱和脂环烃又可 以分为链状脂环烃和环状脂环烃。
命名
脂环烃的命名通常采用“环”字开头,后接表示环上碳原子数目的 数字和环的名称。
芳香烃
定义
芳香烃是指具有闭合环状结构的碳氢化合物,其 特点是具有芳香性。
3
命名
桥环烃的命名通常采用“桥”字开头,后接表示 桥上碳原子数目的数字和桥的名称。
03 环烷烃的结构与性质
环烷烃的键合特点
环烷烃的碳原子之间通过单键连接,形成闭合的环状结构。
立体化学 第5章 环烷烃
1,2,4-三甲基环己烷
C. 必要时须注明立体构型;
D. 复杂化合物也可将环的部分当作取代基。
顺-1,2-二甲基环丙烷 反-1,3-二甲基环丁烷
4-环戊基庚烷
(2) 多环化合物的命名:
(命名较为复杂, 以二环化合物为例). A. 参加成环的总碳原子数作为母体烃; 如有8个碳原子,则称为辛烷 B. 简单桥环可用“二环”、“三环”等作词头; C. 二环“连接”处的碳原子为桥头碳原子; D. 从桥头碳原子处,由大环开始编号;将各“桥”所含的碳原子 数写入方括号中(注意:桥头C原子都不可计入)。
2) 环戊烷的构象
环戊烷的结构是以拆叠的形式存在,四个C原子基本在一 平面上,另一个C则在平面之外,这种构象称为信封式构象。 环戊烷由于以“信封式”构象存在,使分子张力较小,化学性 质较稳定。
3) 环己烷的构象及构象分析
i) 椅式和船式构象
椅式
船式
船式构象相对能量较高, 不稳定,通过C-C键扭曲, 使其成为扭曲式(或称为扭 船型)。这种构象相对于船 式能量低。
角张力---由于键角偏离正常键角 而产生的张力。
环丙烷的三个C在同一平而上,相邻两个C上的C-H键都是重叠式构象, 相互拥挤,产生排斥,也具有较高的能量。
扭转张力---由于重叠式构象而产生的张力。
4. 环烷烃的构象和构象分析
1) 环丁烷的构象
环丁烷的四个C不在同一平面上,形如蝴蝶。即通过C-C键的扭转而以 一个拆叠的碳环存在。 环丁烷的三个C原子分布在同一平面,另一个C取于平面之外。 环丁烷的这种存在形式可使环的张力降低,但仍然是一个不稳定分子。
(1)分子中有两个平行的平面,C1、C3、C5和C2、C4、C6;
(2)12个氢原子分成两类:一类与分子对称轴平行,即垂直于环平面,称为
有机化学第三章环烷烃

※ 在不同的环烃中键角大于或小于 109o28’,而正常的 SP3 杂化轨道之间的夹角为 109°28′ 即 C - C 之间的电子云 没有达到最大程度的重叠。
1 (109° 28′-60° )= 24° 64′ 2 1 (109° 28′-90° )= 9° 44′ 2 1 (109° 28′-108° )= 0° 44′ 2 1 (109° 28′-120° )= -5° 16′ 2
两个环共用两个或两个以上碳原子的化合物称桥环化合物。
3、环戊烷的结构
C:sp3杂化,轨道夹角109.5o,五边形内角为108o角张力: 109.5-108=1.5o 可见,环戊烷分子中几乎没有什么角张力,故五元 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
事实上,环戊烷分子中的五个碳原子亦不共 平面,而主要是以“信封式”构象存在,使 五元环的环张力可进一步得到缓解。
二、化学性质
结构分析:C-C, C-H σ键牢固,化性稳定,似烷烃;
但C3—C4环易破,环可以加成,似烯烃。
1、取代反应
+ Cl2 光照 + HCl Cl Cl + HCl
+ Cl2
加热 300oC
反应条件加强, 反应程度减弱。
2、加成反应
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应条 件也愈苛刻)
7 6 5 4 3
9 1 2 8
10
1 2 5
7
6
5 4
3 2 1 CH3
7 CH3
6
4
3
8
9
螺[2, 4]庚烷
7-甲基螺[4, 5]癸烷
1-甲基螺[3,5]-5-壬烯
环烷烃的命名
环烷烃的命名环烷烃的命名环烷烃,属于有机化合物,因为仅由氢(H)和碳(C)元素组成,故又属于烃类。
又因为其仅由单键连接,构成如环状,故得名。
环烷烃的化学通式为 CH,n为碳原子n2(n+1-g)数,g为环的数量。
只有单环的环烷烃的命名与其同碳原子数的链状烯烃相似,如:环丙烷、环丁烷、环戊烷、环己烷等,超过20个碳的一般被称为“环石蜡”。
按环的大小,环烷烃可被分为小、中、大三类。
环丙烷、环丁烷视作小的。
常见的环戊烷、环己烷、环庚烷以及环辛烷至环十三烷是中等大小的,更大的则被视为大的环烷烃。
首先确定其为环烷烃,并观察其有几个碳原子,则命名为环几烃。
此后再加上卤素、甲基等取代基进行命名。
多环环烷烃的命名法:除非有俗名,否则多环环烷烃如桥环烷烃、螺环烷烃的命名较为复杂。
名字包括表示环数量的前缀(如“二环”)、各环内碳原子总数的后缀以及表示各端点之间碳原子数的数字前缀,表示于中括号内。
多个环公用的碳原子,即桥头碳不计入内。
例一:二环[3.2.0]庚烷该环烷烃总碳数为七,由一个五元环及一个四元环,共两个环组成,故词尾为“庚烷”,词头为“二环”。
两个被共用的碳原子间有三个连接路线:一为五元环的部分,共三个碳(两个桥头碳不计入内,下同);二为四元环的部分,共二个碳;三为两环之间共用的边线,该物质由两桥头碳直接连结,中间没有碳。
由此得出中括号内的数字(以降序表示数字之间用点分隔)。
故上图的环烷烃为二环[3.2.0]庚烷,而数字的个数总比环数多一个(在此有两个环及三个数字)。
“[3.2.0]二环庚烷”亦可,但环上有取代基时“二环[3.2.0]庚烷”有保留前面的位置的好处,方便加上“2,3-二氯”或“3,3-二甲基”等含数字的前缀,以符合IUPAC命名常规。
例二:二环[2.2. 1]庚烷(俗名降冰片烷)上图环烷烃总碳数为七,全为单键,词尾为庚烷;两共用碳间一个碳原子连接着,故词尾之前的数字前缀为[2.2.1](共用碳不计入内);该环烷烃由两个环组成,故前缀为“二环”,最后得出“二环[2.2.1]庚烷”。
有机化学-环烷烃
CH3
CH3
H
H
H3C H
CH3 H
H3C
CH3
顺-1,3-二甲基环戊烷 (cis-1, 3-dimethylcyclopentane)
CH3 H H3C
H
镜
H
面
CH3
CH3
CH3
H3C
CH3
顺反异构体
H CH3
➢ 顺反异构用“顺” 或“反”注明基团相 对位置。 英文用 “cis”和“trans”表示。
萘 naphthalene
O
莰烷
2-莰酮(樟脑)
camphane camphor
§3.2 环烷烃的物理性质和化学反应
一、物理性质
环烷烃的bp. mp.和相对密度比同碳原子数的直链烷烃高。 例题:将下列化合物按沸点降低的顺序排列: (1)丁烷(2)己烷(3)3-甲基戊烷 (4)2-甲基丁烷(5)2,3-二甲基丁烷(6)环己烷
解:(6)(2)(3)(5)(4)(1)
二、化学性质 饱和环烷烃对强酸、强碱、强氧化剂稳定
自由基取代反应(普通脂环烃具有开链烃的通性 )
Br2
30 0 ℃
CH3
光
Cl2
Br HBr
CH3
Cl
HCl
小环化合物的特殊性质 —— 易开环加成
➢ 小环化合物的催化加氢
H2 / Pt, 50oC or Ni, 80oC
环烷烃:碳干为环状而性质与开链烷烃相似的烃类。
§3.1 环烷烃的异构和命名
一、分类 环烷烃的类型
(单)环烷烃
通式:CnH2n
(与烯烃通式相同)
桥环烃(稠环) 桥环烃
螺环烃
小 环 ( C3、 C4)
有机化学:第五章 环烷烃
? CH3 C CH3 CHC3H3
CH3 H3C CHC3H3
e, a构象
e, a构象
33
1,3-二取代环己烷的构象
CH3
CH3
CH3 CH3
CH3 CH3
e, a构象
CH3 CH3
H3C
CH3
a, a构象
e, e构象,优势
34
小结:
1°环己烷有两种极限构象(椅式和船式),椅式为优势构象。 2°一元取代基主要以e键和环相连。 3°多元取代环己烷最稳定的构象是e键上取代基最多的构象。 4°环上有不同取代基时,大的取代基在e键上构象最稳定。
1885年,Baeyer提出了张力学说(strain theory):
a. 形成环的C原子都在同一平面上,并排成正多 边形; b. 在不同环中C-C键之间的夹角小于或大于正四 面体所要求的角度:109°28′; c. 环中C-C键键角的变形会产生张力,键角变形 的程度越大,张力越大,环的稳定性低,反应活 性越大。
+
Cl2
+
Cl2
+
Cl2
+
Br2
+
Cl2
hv hv 300 oC hv hv
Cl Cl
Cl Br
Cl
10
氧化反应
KMnO4
O + CO2H
O3
( Z)
Zn/H2O
OHC
CHO
11
中小环的加成反应
加氢反应
+
H2
+
H2
+
H2
Ni 80 oC
Ni 100 oC
Pt 300 oC
有机化学:第四章 环烷烃
环烷烃
单环烷烃----只含一个环的环烷烃
桥环烷烃----共用两个或两个以上碳原子 的多环烷烃
螺环烷烃----单环之间共用一个碳原子 的多环烷烃
集合环烷烃----环与环之间以单键直接相 连的多环烷烃
3
Xiamen University of China
4.2 环烷烃的异构和命名
• 碳架异构、顺反异构、旋光异构、构象异构
23
构象转换体
两个椅式构象之间的能垒为44.3 kJ/mol
19
Xiamen University of China
2.取代环己烷的构象
优势构象:大的取代基处于平伏键(e键)
H CH3
95%
H
CH3
C CH3
CH3
99.99%
H
5% CH3
CH3
H CH3 C CH3
H
H
20
Xiamen University of China
H2 Pt / C, 50 C
CH3CH2CH3
H2 Pt / C, 200 C
CH3CH2CH2CH3
11
Xiamen University of China
加卤素
12
Xiamen University of China
加卤化氢
HBr HI HBr
CH3CH2CH2Br I
CH3 CH3
Br
烷基取代环丙烷开环规律:环断裂发生在与氢连接 最多及最少的两个成环碳上,且符合马氏规律
Cl
CH3
H
H
H
CH3
CH3 H
反-1,2-环已二醇
顺-1-甲基-4-氯环已烷
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
小环易发生加成反应。
11
① . 加 H2
+ H2 + H2 + H2
Ni 40℃
Ni 100℃
CH3CH2CH3
CH3CH2CH2CH3
Pt 300℃
CH3CH2CH2CH2CH3
由上面反应条件可以看出,小环发生加成反应活性大。 ②. 加 X2
+ Br2
室温
BrCH2CH2CH2Br
12
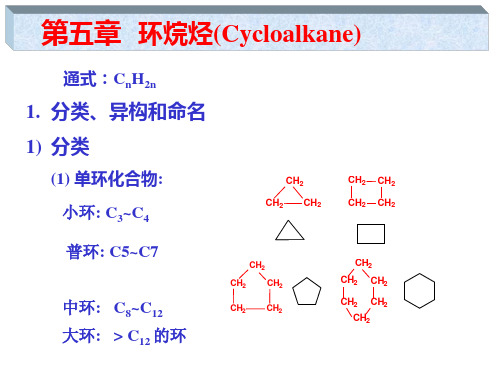
+ Br2
小环:3~4个碳原子。 普通环:5~7个碳原子。 中环:8~11个碳原子。 大环:12个以上碳原子。 螺环:两个环公用一个碳原子,公用的碳叫螺碳。
桥环:两个环公用两个或两个以上碳原子。
螺碳 桥头碳
2
单环体系
多环体系
2. 异构 包括:
构造异构
顺反异构:构造式相同,分子中原子在空间的 排列方式不同。由于环的存在,使 C-C键不能旋转而引起的。
a 为 小 环 中 的 , 为 大 环 中 的 。பைடு நூலகம்b
7
5 6
4
3
1 2
8
7 6 4 3
1 2
7
5
螺[2 . 4]庚烷
1,6-二甲基螺[3 . 4]辛烷
桥环烃: ①. 确定母体:几环某烷(由桥环中总碳数确定)。 ②. 环数的确定:把桥环烃变为链烃,打开几次,就 是几元环。
③. 编号:先编大桥后编小桥,从桥头碳开始编,使
例:C5H10的环烷烃异构
3
CH3 CH3 H H
H CH3
CH3 H
3. 命名 1). 单环环烷烃 规则:①. 确定母体:环某烷(由环中总碳数确定)。 ②. 编号:若环上有取代基,编号尽可能小。若有 不同取代基,要用较小的数字,表示较小取代 基的位置。 ③. 书写同烷烃。
4
④. 对于顺反异构体: 顺式(cis):相同基团在平面的同侧。 反式(trans):相同基团在平面的两侧。 例:
第三章
环 烷 烃 (Cycloalkanes)
一. 环烷烃的分类、命名和异构 二. 环烷烃的物理性质和化学反应 三. 环烷烃的稳定性
四. 环烷烃的构象
五. 多环烃的构象
六. 环烷烃的合成
1
一. 环烷烃的分类、命名和异构 (Classification, Nomenclature, Isomerism of Cycloalkanes) 概述: 单环环烷烃通式:CnH2n , 与烯烃互为异构体。 环烷烃的性质与烷烃相似。 1. 分类
由拜尔张力学说,比六元环大的环都有偏转角,并且环越
大,偏转角越大,张力越大。这一推论不正确。这是由于 张力学说前提不合理,即环中碳原子在同一平面内不合理。 拜尔张力学说存在于小环中。 2. 燃烧热与环烷烃的稳定性 燃烧热—纯粹的化合物完全燃烧所放出的热。 化合物的燃烧热越大,化合物越不稳定。
18
从《有机化学》高等教育出版社(第二版)胡宏纹 主编 上册 P50 表 3.2 单环环烷烃(CH2)n的燃烧热kJ mol-1(298K) 可看出:小环:三元、四元环张力很大。 普通环:五、六、七环张力很小。 中环:8~11环,张力较普通环大。 大环:n>12,几乎无张力。
5
6
Cl
10
二. 环烷烃的物理性质和化学反应 (Physical Properties,Chemical Reactions of Cycloalkanes) 1. 物理性质(自学) 2. 化学反应 1). 取代反应
+ Br2
hν
Br
+ HBr
机理:自由基机理 取代反应一般在五、六元环上易发生。 2). 加成反应
1 (109o28/-60o)=24o44/ 2
90o
1 (109o28/-90o)=9o44/ 2
1 (109o28/-108o)=0o44/ 2
108
o
120
o
1 (109o28/-120o)=-5o16/ 2
由上面计算可知:a. 环戊烷、环己烷偏转角度最小,也最稳定。
17
b. 环丙烷的键角偏转大于环丁烷,因此环丙烷反应活性大于 环丁烷。 拜尔张力学说的不足之处:
邻的碳开始编号,使取代基位次最小。
③.写法:
6
螺[a . b]某烷
( 半 取代基位置 字 线 用 ) 阿 拉 伯 数 字 , 数 字 间 用 逗 号 隔 开 位次 取代基名称
相 同 的 取 代 基 合 并 起 来 , 用 一 、 二 、 三 表 示
除 螺 碳 外 每 个 环 中 的 碳 原 子 数 。
1-甲基-2-乙基环戊烷
1-甲基-4-异丙基环己烷
CH3 CH3
顺-1,2-二甲基环丙烷
H H
5
H CH3
CH3
反- 1,3-二甲基环戊烷
H
CH3CH2
CH(CH3)2
反-1-乙基-3-异丙基环戊烷 2). 多环烃 螺环烃: ①. 确定母体:螺某烷(由螺环中总碳数确定)。 ②. 编号:先编小环后编大环。从小环中和螺碳相
14
3). 氧化反应 环丙烷与烯烃既类似又有区别,它有抗氧化能力,不使 KMnO4水溶液褪色,可用此区别: 环丙烷 不饱和烃
O
O2
O
+
O
15
三. 环烷烃的稳定性 (Stability of Cycloalkanes)
为什么三元环不稳定易发生加成?
为什么五元环、六元环较稳定不易发生开环加成,而易
发生取代? 1. 拜尔(Baeyer )张力学说要点
①. 形成环的碳原子都在同一平面上,并排成正多边形。
②. 正常C-C键之间夹角为109.5°,环中C-C键之间夹角
为了保持109.5°,环中的键角要扩张或压缩,从而产
生张力。
16
③. 键角变形程度越大,张力越大。
④. 张力使环的稳定性降低,张力越大,环的反应性越大。 例:
环内键之间夹角
60 o
偏转角度
室温
不发生加成反应
+ Br2
Br
Br
③. 加 HX
+ HI
ICH2CH2CH3
+ HI
CH3CHCH 2CH3 I (主)
13
不对称环丙烷加 HX 的规律:
①. 开环位置:在含氢最多与含氢最少的两个碳之间。 ②. 氢加在含氢较多的碳原子上。
+ HBr
CH3 CH3C CHCH3 Br CH3
(主)
取代基位次最小。 ④. 写法:
8
几环[a . b . c]某烷
( 半 取代基位置 字 线 用 ) 阿 拉 伯 数 字 , 数 字 间 用 逗 号 隔 开 位次 取代基名称
相 同 的 取 代 基 合 并 起 来 , 用 一 、 二 、 三 表 示
除 桥 头 碳 外 每 个 桥 中 的 碳 原 子 数 。
由 大 桥 到 小 桥 。
9
H3C 8 1 2 CH2 C CH2
9 CH(CH ) 3
3
CHCH 2CH3
4
CH2
5
1,9-二甲基-3-乙基二环[4.2.1]壬烷
CH2
7 7 6 5 4 2 3 4
CH
6
CH2
1
2 3
2,7,7-三甲基二环[2.2.1]庚烷
1
Cl
7
7,7-二氯二环[4.1.0]庚烷
