硫酸盐_溶解度
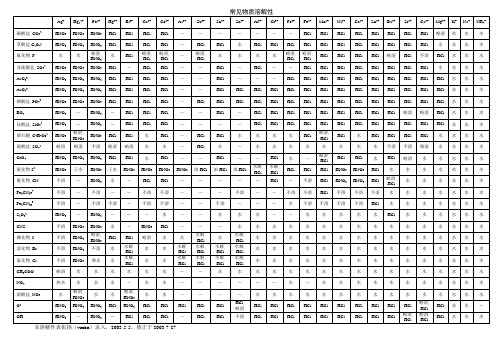
常见物质溶解性溶度积
39.5
37.4
46.4
56.7
82.5
118
173
氟硅酸铵
(NH4)2SiF6
18.6
甲酸铵
NH4HCO2
102
143
204
311
533
磷酸一氢铵
(NH4)2HPO4
42.9
62.9
68.9
75.1
81.8
97.2
硫酸氢铵
NH4HSO4
100
酒石酸氢铵
NH4HC4H4O6
1.88
2.7
碘酸铵
BaCl2
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
铬酸钡
BaCrO4
2.775×10-4
氰化钡
Ba(CN)2
80
亚铁氰化钡
Ba2Fe(CN)6
9.732×10-3
氟化钡
BaF2
0.159
0.16
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
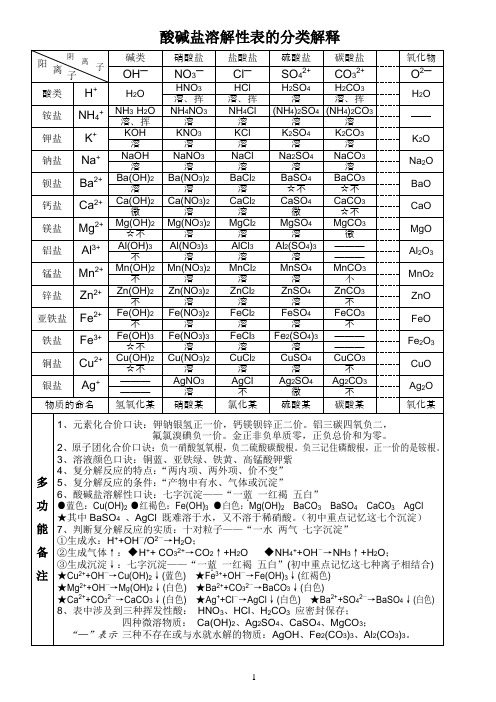
酸碱盐溶解性表的分类解释
CuCO3
CuO
☆不
溶
溶
溶
不
银盐
Ag+
———
AgNO3
AgCl
Ag2SO4
Ag2CO3
Ag2O
———
溶
不
微
不
物质的命名
氢氧化某
硝酸某
氯化某
硫酸某
碳酸某
氧化某
多
功
能
备
注
1、元素化合价口诀:钾钠银氢正一价,钙镁钡锌正二价。铝三碳四氧负二,
氟氯溴碘负一价。金正非负单质零,正负总价和为零。
2、原子团化合价口诀:负一硝酸氢氧根,负二硫酸碳酸根。负三记住磷酸根,正一价的是铵根。
SO32-
S2-
SiO32-
PO43-
HCO3-
H+
溶、挥
溶、挥
溶
溶、挥
溶、挥
溶、挥
溶、挥
溶、挥
微
溶
溶、挥
NH4+
溶、挥
溶
溶
溶
溶
溶
溶
溶
溶
水解
溶
溶
Li+
溶
溶
溶
溶
溶
溶
微
溶
溶
溶
不
溶
Rb+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶
微
溶
K+
溶
溶
溶
溶
溶
溶
溶
溶
溶
溶Байду номын сангаас
溶
溶
Cs+
溶
硫酸盐检测方法详解

硫酸盐检测方法详解硫酸盐在地壳中是一种丰富的组份,由于石膏、硫酸钠及某些页岩的溶出,使水中含量甚高。
硫化矿经氧化使矿山排水含硫酸盐很高,含硫有机物及排放工业废水均为硫酸盐的来源,天然水中的浓度可由数mg/L至数千mg/L。
水中的亚硫酸盐可氧化为硫酸盐,而硫酸盐在缺氧的条件下可还原为硫化物。
饮用水中硫酸盐浓度过高,易使锅炉和热水器结垢,产生不良的水味。
当硫酸盐浓度为300-400mg/L时,多数饮用者开始察觉有味。
在有镁离子或钠离子存在时,硫酸盐超过250mg/L时有轻泻作用。
根据饮用者味觉的敏感度,味觉阈为300~1000mg/L。
WHO基于味觉的考虑,饮水中硫酸盐控制浓度为400mg/L。
测定硫酸盐的方法有称量法、EDTA容量法、硫酸钡比浊法、硫酸苯肼法、亚甲蓝比色法、络合比色法、甲基麝香草酚蓝自动比色法、难溶性钡盐比色法、原子吸收间接法及离子色谱法等。
称量法为经典方法,手续繁琐且不能测定浓度低于lOmg/L的硫酸盐,目前在常规分析中已较少应用。
硫酸钡比浊法可测40mg/L以下的硫酸盐,但反应条件苛刻,近年来对加入试剂的方式加以改进,获得较好精密度。
离子色谱法是目前测定硫酸盐较好的方法,但设备较昂贵,尚不能在基层水质分析室推广使用。
难溶性钡盐比色法,属于这类方法的有铬酸钡比色法、钼酸钡法、二羟甲苯醌(DHTQ)钡比色法及四氯化醌酸钡比色法。
我国幅员辽阔,各地天然水中所含硫酸盐浓度差别很大,可由数mg/L至数百mg/L,因此所选用的分析方法应能满足多种情况的需要。
水样保存:ISO规定,硫酸盐水样在冷藏条件下可稳定7~28天。
北京市卫生防疫站把自来水及清洁地面水在4℃及30℃下保存37天,硫酸盐浓度并无明显变化,在冷藏条件所得结果与ISO基本一致,见表17.1。
1.5.2过滤:在水质分析中,常用滤纸、玻璃砂芯滤器、古氏坩埚等过滤水样。
(1)滤纸分为定性滤纸与定量滤纸,用棉花等纤维制成。
常用的有直径为5.5,7,9,12.5 及15cm等规格。
溶解度表

溶解度表篇一:物质溶解度表溴化铊TlBr TlCl Tl2SO425°C 25°C 25°C 25°C;4×10–6 ×10–4 ×10–4 ×10–4氯化铊硫酸铊硫氰化铊TlSCN物质水溶液溶解度表以化学品中特征元素的拼音顺序排列。
所有数据都为1atm下水溶液溶解度的数据,单位为g/100cm31. 锕、氨、铵 (2)2. 钯、钡、铋、铂、钚……………………………………………………………………………… 33. 氮、镝…………………………………………………………………………………………… 44. 铒……………………………………………………………………………………………….4 5. 钒………………………………….……………………………………………………………4 6. 钆、钙、锆、镉、铬、汞、钴、硅…………………………………………………………….4 7. 铪、氦、钬……………………………………………………………………………………..7 8. 镓、钾、金………………………………………………………………………………………7 9. 钪…………………………………………………………………..………….…………………8 10. 镧、锂、硫、镥、铝………………………………………………………………………………9 11. 镁、锰…………………………………………………………………………………………9 12. 钠、镍、钕…………………………………………………………………………………….10 13. 硼、铍、钋、镨…………………………………………………………………………………12 14. 氢、铅………………………………………………………………………………………..12 15. 铷…………………………………………………………………………………………….13 16. 铯、钐、砷、铈、锶………………………………………………………………………….14 17. 铊、碳、铽、锑、铁、铜、钍………………………………………………………………..15 18. 锡、氙、锌、溴…………………………………………………………………………………17 19. 氩、氧、铟、钇、镱、银、铀、铕………………………………………………………….19 20. 有机化合物………………………………………………………………………………….22 21. 酸碱盐溶解性表…………………………………………………………………………231.锕、氨、铵2.钯、钡、铋、铂、钚3. 氮、镝4.铒5.钒6.钆、钙、锆、镉、铬、汞、钴、硅篇二:溶解性表溶解性表钾、钠、铵盐、硝酸盐;(钾盐、钠盐、铵盐、硝酸盐均可溶于水)氯化物除银、亚汞;(氯化物除氯化银、氯化亚汞外均可溶于水)硫酸盐除钡钙铅;(硫酸盐除硫酸钡、硫酸铅外均可溶于水)碳酸、磷酸盐,只溶钾、钠、铵。
水质中硫酸盐标准限值

水质中硫酸盐标准限值水质中硫酸盐的标准限值是控制水中溶解的硫酸盐含量,以保障公共健康和水生态环境的可持续发展。
不同国家和地区的水质标准中硫酸盐的限值可能存在差异,但一般来说,都有一定的限制。
首先,让我们了解一下硫酸盐是什么。
硫酸盐是指溶解在水中或存在于土壤中的含硫化合物,包括硫酸钠、硫酸镁、硫酸钙等。
这些化合物主要来源于自然过程和人类活动。
在水中,硫酸盐可以与水中的钙离子、镁离子等结合,形成不易溶于水的硫酸钙、硫酸镁等沉淀物,从而降低水中的硬度,但过高的硫酸盐含量也会对水生生物和人体健康产生负面影响。
那么,水质中硫酸盐的标准限值是多少呢?实际上,各国的水质标准中硫酸盐的限值存在一定的差异。
在中国,根据《生活饮用水卫生标准》(GB 5749-2006),饮用水中硫酸盐的限值是250毫克/升(以质量计)。
而在一些欧洲国家,如德国和荷兰,硫酸盐的限值通常为300毫克/升左右。
这些限值是基于对公共健康和水生态环境的影响而制定的。
为什么要限制水质中的硫酸盐含量呢?首先,过高的硫酸盐含量会影响水的味道和气味,降低水的质量。
其次,硫酸盐在一些情况下可以与水中的有机物发生反应,产生有害的副产物,如甲醛等致癌物质。
此外,过高的硫酸盐含量也会对水生生物产生负面影响,破坏水生态环境的平衡。
最重要的是,高硫酸盐含量可能对人体健康产生不良影响。
研究表明,长期饮用高硫酸盐含量的水可能导致心血管疾病、胃肠道疾病等健康问题。
然而,在实际应用中,控制水质中的硫酸盐含量并不是一件容易的事情。
首先,水中硫酸盐的来源比较复杂,既包括自然过程,也有人类活动的影响。
其次,硫酸盐的控制技术目前还不够成熟,难以实现经济、高效的处理。
此外,在一些地区,由于地质条件等因素的影响,水中天然存在的硫酸盐含量就比较高,难以通过常规处理方法降低至标准限值以下。
针对这些问题,我们可以采取一些措施来降低水质中的硫酸盐含量。
首先,加强水源地的保护和管理,减少人类活动对水源的污染。
溶解性表
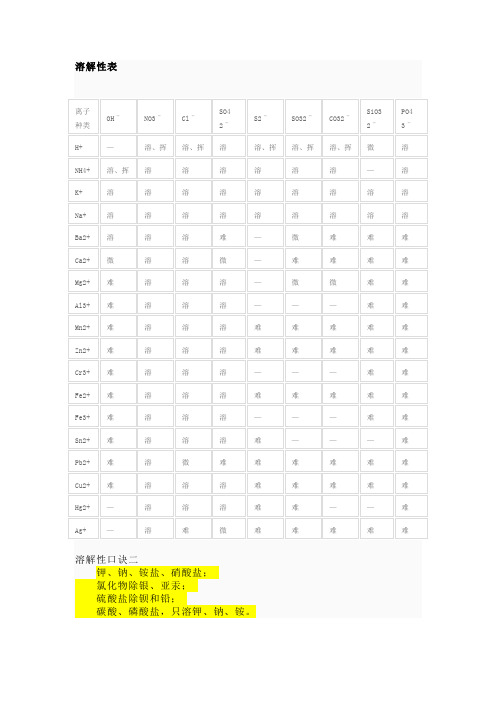
图例溶:该物质可溶于水难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀白色:BaSO4BaCO3CaCO3AgCl Ag2CO3Mg(OH)2Fe(OH)2Al(OH)3 CuCO3 ZnCO3 MnCO3 Zn(OH)2蓝色:Cu(OH)2浅黄色:AgBr红褐色:Fe(OH)3浅绿色:Fe(OH)2常见化合物沉淀Cu(OH)2蓝色沉淀Fe(OH)3红褐色沉淀AgBr淡黄色沉淀AgI ,Ag3PO4黄色沉淀CuO 黑色沉淀Cu2O 红色沉淀Fe2O3 红棕色沉淀FeO 黑色沉淀FeS2 黄色沉淀PbS 黑色沉淀FeCO3 灰色沉淀Ag2CO3 黄色沉淀AgBr 浅黄色沉淀AgCl 白色沉淀Cu2(OH)2CO3 暗绿色沉淀BaCO3白色沉淀(且有CO2生成)CaCO3白色沉淀(且有CO2生成)BaSO4白色沉淀不溶的碳酸盐白色沉淀(且有CO2生成)不溶的碱、金属氧化物白色沉淀(且有CO2生成)Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀不建议死记硬背,只需记住每个阴离子里哪个不溶即可,钾钠铵硝都溶溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡银铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③氢氧根多溶一个钡④口诀中未有皆下沉。
⑤注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅不溶(硫酸钙硫酸银微溶也是沉淀);③硝酸盐都溶于水;④碱性物质中除了钾离子钠离子铵离子锂离子还有钡离子也可溶⑤口诀中没有涉及的盐类都不溶于水;说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
常见物质溶解性及溶度积
31.2
33.5
35.8
38.1
40.8
46.2
52.5
55.8
59.4
氯酸钡
Ba(ClO2)2
43.9
44.6
45.4
47.9
53.8
66.6
80.8
铬酸钡
BaCrO4
2.775×10-4
氰化钡
Ba(CN)2
80
亚铁氰化钡
Ba2Fe(CN)6
9.732×10-3
氟化钡
BaF2
0.159
0.16
HNO3
-
HNO3
-
-
-
水
-
-
水
水
水
-
-
水
水
水
水
水
HCl
水
水
水
水
水
水
CNS-
不溶
HNO3
HNO3
水
-
HNO3
HCl
-
-
-
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
碘化物, I-
不溶
HNO3
略溶,
HNO3
HCl
HCl
略溶
水
水
水解,
HCl
水
水解,
HCl
水
水
水
水
水
水
水
水
水
水
水
水
水
水
水
溴化物, Br-
不溶
HNO3
不溶
HCl
物质的溶解性规律是什么 有什么记忆口诀
1物质的溶解性规律是什么有什么记忆口诀物质的溶解性规律记忆口诀铵钾钠钡氢氧溶;碳酸只溶铵钾钠;全部硝酸都能溶;盐酸只有银不溶;硫酸只有钡不溶。
溶解性是物质在形成溶液时的一种物理性质。
它是指物质在一种特定溶剂里溶解力量大小的一种属性。
溶解度是指达到(化学)平衡的溶液便不能容纳更多的溶质,是指物质在特定溶剂里溶解的最大限度。
在特别条件下,溶液中溶解的溶质会比正常状况多,这时它便成为过饱和溶液。
物质溶解性的影响因素一,影响固体溶解度的因素1,内因:溶质和溶剂本身的性质。
2,外因:只与温度有关。
二,气体物质的溶解度1,概念:气体的溶解度是指某气体在压强为101.3kPa(一个大气压)和肯定温度时溶解在1体积溶剂中达到饱和状态时的体积。
2,影响因素(1)内因:气体溶质和溶剂本身的性质。
1(2)外因:气体的溶解度受压强和温度影响。
压强越大,气体的溶解度越大,比如:加大压强可以使更多的二氧化碳溶于水中。
温度越高,气体的溶解度越小,比如:水在加热时,水中就有气泡冒出,由于溶解在水中的气体如氧气溶解度会减小而溢出。
物质溶解性的口诀溶解性口诀一钾钠铵盐溶水快,硫酸沉钡银铅钙。
氯盐不溶氯化银,硝盐溶液都透亮。
碱溶锂钾钠钡氨,口诀未提皆下沉。
溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶酸碱盐溶解性口诀酸类多数都易溶,硅酸微溶是独种。
碱类钾钠钡铵溶,钙是微溶余不溶。
硫酸铅钡沉水中,微溶钙银与亚汞。
盐类溶有钾钠铵,外加易溶硝酸盐。
碳酸能溶钾钠铵,其余俱沉水中间。
盐酸沉淀银亚汞,还有微溶氯化铅。
化学试剂硫酸盐标准-概述说明以及解释
化学试剂硫酸盐标准-概述说明以及解释1.引言1.1 概述概述部分内容:硫酸盐标准是化学试剂中的一种重要标准,它在化学实验、工业生产以及环境监测等领域中起着至关重要的作用。
硫酸盐是一类化合物,它们由硫酸根离子(SO4^2-)和阳离子组成,具有广泛的应用价值。
硫酸盐标准主要是指硫酸盐化合物的纯度、浓度和质量等方面的标准,用于确保化学试剂的质量和性能的稳定性。
在化学实验中,硫酸盐标准广泛应用于定量分析、反应物的测定以及溶液的配制等方面。
通过使用硫酸盐标准,我们可以准确测量化学实验中的各种试剂和物质的含量,并对其进行定量分析,从而得到准确的实验结果。
此外,硫酸盐标准还可以用于标定实验仪器和设备,确保实验过程的准确性和可重复性。
在工业生产中,硫酸盐标准被广泛应用于各种生产工艺中。
例如,在纺织、造纸、玻璃等行业中,硫酸盐用作催化剂和反应物,在合成、脱色和清洗等过程中起着重要作用。
通过确保硫酸盐标准的质量和浓度,可以有效控制生产过程中化学反应的条件,提高生产效率和产品质量。
此外,硫酸盐标准还在环境监测中具有重要意义。
硫酸盐是大气和水体中的一种主要污染物,其浓度和含量的监测对于评估环境质量和控制环境污染具有重要意义。
通过建立硫酸盐标准,并进行准确的测量和监测,可以及时发现和处理环境中的硫酸盐污染问题,保护生态环境和人类健康。
综上所述,硫酸盐标准在化学试剂领域中具有重要地位和应用价值。
它不仅对于化学实验的准确性和可靠性起着关键作用,同时也在工业生产和环境监测中发挥着重要作用。
随着科学技术的不断发展,相信硫酸盐标准在未来会有更广泛的应用和进一步的发展。
1.2 文章结构文章结构部分介绍了全文的组织结构和各个章节的内容安排。
在这篇长文中,我们将会从以下几个方面来探讨化学试剂硫酸盐标准的重要性和应用:1. 引言部分:在引言中,我们将简要概述硫酸盐标准的背景和相关的问题,介绍硫酸盐在化学领域中的广泛应用,并阐明本文的研究目的和意义。
硫酸钠与硫酸钙沉淀
硫酸钠(Na₂SO₄)和硫酸钙(CaSO₄)都是硫酸盐,它们在水溶液中的溶解度相对较高,因此一般不会形成沉淀。
硫酸钠是一种无色结晶或白色粉末,溶于水,其水溶液呈中性。
硫酸钙也是一种白色结晶或粉末,微溶于水,其水溶液也呈中性。
在一般情况下,硫酸钠和硫酸钙不会发生化学反应,因为它们的离子组合已经在各自的分子中稳定存在。
硫酸钠中的钠离子(Na⁺)和硫酸根离子(SO₄²⁻)以及硫酸钙中的钙离子(Ca²⁺)和硫酸根离子(SO₄²⁻)都已经形成了稳定的化合物,不会在水中发生交换反应形成新的沉淀。
然而,在某些特定条件下,例如在高温或高浓度的溶液中,硫酸钠和硫酸钙的溶解度可能会发生变化,导致它们在某些情况下可能会形成沉淀。
但这并不是由于它们之间发生了化学反应,而是由于溶液条件的改变导致溶解度降低。
总的来说,硫酸钠和硫酸钙在一般情况下不会形成沉淀,因为它们的离子组合已经稳定存在。
只有在特定条件下,如高温或高浓度溶液中,它们的溶解度可能会发生变化,导致形成沉淀。
但在这些情况下,也不是由于它们之间发生了化学反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫酸钡溶解度 2.38*10-4g 求ksp?
溶解度为 2.38*10-4 g,那么用物质的量表示,就是
(2.38*10-4g/233g·mol^-1)/0.1L = 1.0215*10^-5 mol/L。
硫酸钡完全电离,且阴、阳离子均不发生水解,所以[Ba2+] = [SO4 2-] = 1.0215*10^-5 mol/L。
Ksp = [Ba2+]· [SO4 2-] = 1.043*10^-10
硫酸钡沉淀加入硝酸钾,为什么影响他的沉淀溶解度
在硫酸钡沉淀中加入硝酸钾,会使硫酸钡溶解度增加。
这是因为加入了强电解质KNO3,使溶液中离子数增加,由于带有不同电荷的离子相互吸引,Ba2+和SO42-的活动性有所降低促使
BaSO4==Ba2+ + SO42-
平衡向右移动。
从而增加溶解度直到达到新的平衡,这种加入不含相同离子的电解质而使溶解度增大的效应叫“盐效应”。
浓硫酸溶解硫酸钡的反应原理
在有硫酸钡存在的溶液中有以下平衡:
BaSO4(S)==BaSO4(aq)==Ba^2+ + SO4^2-
当溶液中有极浓的硫酸时:SO4^2- + H+ =HSO4^-
这样就使得溶液里的SO4^2-离子减少.以上的平衡就向右移动.这样就能看到硫酸钡溶解了.由于硫酸钡的离子积常数很小,所以需要极浓的酸才能使它溶解.
硫酸铅在浓硫酸中的溶解也是同样的道理.
硫酸钡:理化特性
主要成分:纯品
外观与性状:白色斜方晶体。
熔点(℃):1580
相对密度:4.50(15℃)
溶解性:不溶于水,不溶于酸。
在水中的溶解度只有0.0024g/100g水。
溶于热的浓硫酸。
主要用途:用作白色颜料、纸和橡胶等的填充剂、X光透视肠胃时的药物等。
DTPA 可以溶解硫酸钡,可以购买DTPA。
硫酸钙的溶解度:。
