铝及其化合物图像问题专题复习
2014年高三复习《铝的图像题》

将一定质量的Mg、Al合金投入100mL 一定物质的量浓度的盐酸溶液中,合金全部 溶解,向所得溶液中滴加5mol· L-1的NaOH 溶液至过量,生成沉淀的质量与加入NaOH 溶液的体积关系如图所示: 求:(1)原合金中Mg、 Al质量各是多少? (2)盐酸的物质的量 浓度为多少?
图像应用题(练习题:12T)
加入物质
通入过量CO2 通入过量CO2 滴入稀盐酸 滴加NaOH浓溶液至过量 滴加AlCl3溶液至过量 滴加氨水至过量
图像序号
三、铝盐的应用: (1)明矾净水原理______________ 【思考】 向含1molKAl(SO4)2的溶液中滴加Ba(OH)2溶液, A、若让SO42-恰好沉淀,离子方程式为_______ 生成Al(OH)3沉淀的物质的量为________ B、若让Al3+恰好沉淀,反应的离子方程式为: _____________________________________ (2)将氯化铝溶液加热蒸干灼烧,得到什么物质 (3)将硫酸铝溶液加热蒸干灼烧,得到什么物质?
【拓展练习】 1、从下列制备Al(OH)3的方案中,选出最佳方 案,并说明理由。
方案一:2Al+3H2SO4=Al2(SO)3+3H2↑
Al2(SO)3+6NaOH=2Al(OH)3↓+3Na2SO4 方案二:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
2 Na[Al(OH)4] +H2SO4=2Al(OH)3↓+Na2SO4
方案三:2Al+3H2SO4=Al2(SO)4+3H2↑ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑ Al2(SO)3+6 Na[Al(OH)4]=8Al(OH)3↓+3Na2SO4
导学案-铝及其化合物图像专题

导学案——Al 3+、AlO 2-和Al(OH)3间转化的图像专题 1、向AlCl 3溶液中逐滴加入NaOH 溶液至过量现象是 ,反应的离子方程式依次是,。
2、向NaAlO 2溶液中逐滴加入稀盐酸至过量现象是 ,反应的离子方程式依次是,。
例题:将一定量氧化镁、氧化铝的混合物完全溶于200 mL 盐酸中,而后逐滴加入1 mol·L -1 NaOH 溶液.溶液中生成沉淀的物质的量随加入NaOH 溶液的体积的变化趋势如图所示.(1)求所用盐酸的物质的量浓度 。
(2)求原混合物中氧化镁、氧化铝的物质的量之比 。
练习:1、在AlCl 3和MgCl 2的混合溶液中,逐滴加入NaOH 溶液直至过量,经测定,加入NaOH 的体积和所得沉淀的物质的量的关系如下图所示(b 处NaOH 的体积为1L),则下列判断错误的是A .NaOH 的浓度为0.6 mol·L -1 B .在a 点处溶液中的溶质为NaClC .混合溶液中n(Al 3+)∶n(Mg 2+)=1∶1D .图中线段oa : ab =4∶12、将一定量的镁、铝合金溶于100 mL 2 mol/LH 2SO 4溶液中,然后再滴加1 mol/L NaOH 溶液,沉淀质量m 随加入NaOH 溶液的体积V 变化如右图所示。
下列说法中错误的是A .V 2 = 400mLB .0≤V 1<280mLC .加入NaOH 溶液的过程中,产生沉淀的最大量可能为0.18molD .当V 1=160mL 时,n(Mg) = 0.04mol1 2 3 43、现有AlCl 3和MgSO 4混合溶液,向其中不断加入NaOH 溶液,得到沉淀的量与加入NaOH 溶液的体积如下图所示。
原溶液中Cl -与SO 2-4的物质的量之比为( )A.1∶3B.2∶3C.6∶1D.3∶14、选出正确的图像。
(1)向NaOH 、Ca(OH)2溶液中(假设各1 mol),通入CO 2气体,对应图象是 。
铝的重要化合物-图像专题

1 2 3 4 n(HCl)
(4)将NaAlO2溶液滴入到HCl溶液中至过量
原理:4HCl+NaAlO2 = AlCl3+NaCl +2H2O 3NaAlO2+ AlCl3 + 6H2O = 4Al(OH)3 ↓+3NaCl
现象:先无现象,后产生白色沉淀,沉淀不溶解 图象: 沉淀
原理:AlCl3 + 4NaOH == NaAlO2+3NaCl +2H2O 3NaAlO2+AlCl3+6H2O=4Al(OH)3↓+3NaCl
现象:先无明显现象,后产生白色沉淀 图象: 沉淀
1 2 3 4 n(AlCl3)
(3)将HCl溶液滴入到NaAlO2溶液中至过量
原理:HCl+NaAlO2 + H2O = Al(OH)3 ↓+NaCl Al(OH)3 +3HCl = AlCl3 + 3H2O
铝将NaOH溶液滴入AlCl3溶液中加至过量 原理:AlCl3 + 3NaOH = Al(OH)3↓+3NaCl Al(OH)3 + NaOH = NaAlO2 + 2H2O 现象:先有白色沉淀,后沉淀溶解
沉淀
1 2 3 4 n(NaOH)
(2)将AlCl3溶液滴入NaOH溶液中加至过量
现象:先有白色沉淀,后沉淀部分溶解 图象: 沉淀
c
1 2 3 4 5 6 n(NaOH)
1 2 3 4 n(NaAlO2)
(5)将CO2通入偏铝酸盐溶液中 原理: CO2(少量)+2NaAlO2+ 3H2O = 2Al(OH)3 ↓+Na2CO3 CO2(过量)+NaAlO2+ 2H2O = Al(OH)3 ↓+NaHCO3 现象:产生白色沉淀,沉淀不溶解。
铝的化合物及图像讲解

Al2(SO4)3 +6NaOH=2Al(OH)3↓ +3Na2SO4
Al(OH)3+NaOH=Na[Al(OH)4]
Al2(SO4)3 +6NH3· H2O= 2Al(OH)3↓+3(NH4) 2SO4
Al2(SO4)3与NaOH、NH3· H2O均可反应生成Al(OH)3↓,
Al(OH)3溶于强碱而不溶于弱碱,所以应该用氨水 制取。
3[Al(OH)4]- + Al3+ == 4Al(OH)3
小结:Al3+与碱、 [Al(OH)4]-与酸的反应
AlCl3中逐滴加入NaOH?
AlCl3中逐滴加入氨水?
Al3++3NH3.H2O=Al(OH)3 ↓+3NH4+ 故:用Al3+制取Al(OH)3用弱碱更合适
Na [Al(OH)4]中逐滴加入盐酸? Na [Al(OH)4]中缓慢通入CO2?
练习2
1989年世界卫生组织把铝确定为食品污染源 之一,应加以控制使用。铝在下列应用时应 加以控制的是: ①制铝合金 ②制电线 ③制炊具 ④ 用氢氧化铝凝胶胃舒平药品 ⑤ 银色漆颜料 ⑥ 易拉罐 ⑦ 包装糖果和小食品 ( D) A、全部 B、③ ④ ⑦ C、③⑤ ⑥ D、③ ④ ⑥ ⑦
(4)氢氧化铝实验室制法
3
1
1
2
3
4
n(HCl)
6.往AlCl3溶液中加入Na [Al(OH)4]溶液 Al3+ + 3 [Al(OH)4]- = 4Al(OH)3↓
4
n[Al(OH) ] ↓
3
1
2
3
4
n(Na [Al(OH)4] )
7.往Na[Al(OH)4]溶液中加入AlCl3溶液 Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓
金属及其 化合物 铝三角及图像

第三章 金属元素及其化合物 第6课时 “铝三角” 和铝的图像
复习重点: 1、铝三角。 2、有关铝的图像问题。 复习难点:有关铝的图像问题。
华美实验学校
曾维玲
一、铝三角的相互转化 Al
12
13
Al2O3
⑦
Al(OH)3
Al3+
⑥ ⑤
AlO2—
写出上图铝三角中转化的离子反应方程式:
13
F2>O2>Cl2 > Br2 >Fe3+> I2 > S
AlO2-、Al(OH)3、OH-、 CO32- OH-、AlO2-、CO32- 、HCO3- 、 Al(OH)3 B.在含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:
I-、Br-、Fe2+ I-、Fe2+ 、Br-
C.在含等物质的量的Ba(OH)2、KOH的溶液中缓慢通入CO2:
KOH、Ba(OH)2、BaCO3 Ba(OH)2、KOH、 K2CO3、 BaCO3
D.在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉: Ag+、Cu2+、H+、Fe2+
K Ca Na Mg Al Zn Fe SnPb(H)Cu Hg Ag Pt Au 单质还原性越来越弱
K +Ca2+ Na +Mg2+ Al3+ Zn2+ Fe2+ Sn2+Pb2+(H+)Cu 2+ Fe3+ Hg2+ Ag+ 离子氧化性越来越强
当堂训练
1.向AlCl3溶液中滴加NaOH溶液,加入的NaOH溶液的体积与沉 淀的质量之间的关系如右图所示: (1)图中A点表示的意义是
金属铝及其化合物的图像问题-老师
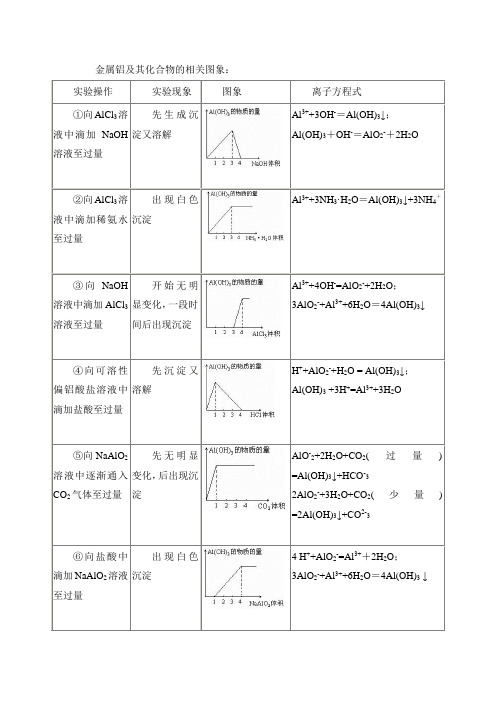
金属铝及其化合物的相关图象:实验操作实验现象图象离子方程式①向AlCl3溶液中滴加NaOH 溶液至过量先生成沉淀又溶解Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-=AlO2-+2H2O②向AlCl3溶液中滴加稀氨水至过量出现白色沉淀Al3++3NH3·H2O=Al(OH)3↓+3NH4+③向NaOH 溶液中滴加AlCl3溶液至过量开始无明显变化,一段时间后出现沉淀Al3++4OH-=AlO2-+2H2O;3AlO2-+Al3++6H2O=4Al(OH)3↓④向可溶性偏铝酸盐溶液中滴加盐酸至过量先沉淀又溶解H++AlO2-+H2O = Al(OH)3↓;Al(OH)3 +3H+=Al3++3H2O⑤向NaAlO2溶液中逐渐通入CO2气体至过量先无明显变化,后出现沉淀AlO-2+2H2O+CO2(过量)=Al(OH)3↓+HCO-32AlO2-+3H2O+CO2(少量)=2Al(OH)3↓+CO2-3⑥向盐酸中滴加NaAlO2溶液至过量出现白色沉淀4 H++AlO2-=Al3++2H2O;3AlO2-+Al3++6H2O=4Al(OH)3↓金属铝及其化合物的相关图象问题求解:1.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。
下列表示氢氧化钠加入量(x)与溶液中沉淀的物质的量(y)的关系示意图,正确的是()答案 C解析Al(NO3)3+3NaOH===Al(OH)3↓+3NaNO3、Mg(NO3)2+2NaOH===Mg(OH)2↓+2NaNO3、Al(OH)3+NaOH===NaAlO2+H2O,所以开始沉淀逐渐增多,达最大值后Al(OH)3开始溶解,沉淀又逐渐减少,因Mg(OH)2不溶于NaOH溶液,所以最后沉淀量不为0。
2.将NaOH溶液逐滴加入用盐酸酸化的AlCl3溶液中,若用y轴表示Al(OH)3沉淀的量,x轴表示NaOH溶液的体积,下列图像正确的是()答案D解析:当溶液中有H+、Al3+时,加入的OH-先与H+反应,后与Al3+反应:H++OH-===H2O,Al3++3OH-===Al(OH)3↓,故开始加入NaOH溶液时,无沉淀产生,随着NaOH量的增加,沉淀的量也逐渐增加,当NaOH溶液加入到一定量时,沉淀量达到最大值,再加入NaOH溶液,沉淀开始溶解:Al(OH)3+OH -===AlO-2+2H2O。
铝及其化合物铝三角图像问题教师版有复习资料
铝及其化合物、铝三角图像问题1、铝(1)物理性质:密度小熔点较低,硬度较小银白色金属。
(3)化学性质:①跟O 2及其它非金属反应:常温下,在空气中因生成氧化膜,具有抗腐蚀能力。
4Al+3O 2−−−→点燃2Al 2O 3 2Al+3S −−−→点燃Al 2S 3 ②跟某些氧化物:2Al+Fe 2O 3−→−∆2Fe+Al 2O 3 (铝热反应) ③跟水反应:2Al+6H 2O → 2Al(OH)3+3H 2↑ (一般不反应,只有氧化膜被破坏后反应)④跟酸的反应:2Al+6H +→ 3Al 3+ + 3H 2↑(常温下,在浓H 2SO 4、浓HNO 3中钝化)⑤跟强碱溶液反应:2Al+2NaOH+2H 2O → 2NaAlO 2+3H 2↑2、Al 2O 3(两性氧化物):白色固体、熔点高(1)跟酸反应:Al 2O 3+6H + →2Al 3++3H 2O (2)跟碱反应:Al 2O 3+2OH -→AlO 2—+2H 2O3、Al(OH)3 (两性氢氧化物)Al(OH)3的两性:Al(OH)3 + 3H + → Al 3+ + 3H 2O Al(OH)3 + OH - → AlO 2- + 2H 2OAl(OH)3显两性的内在本质是:H 2O + H + + AlO 2-Al(OH)3Al 3+ + 3OH - (1)物理性质:白色胶状物质,难溶于水 (2)受热分解:2Al(OH)3−→−∆Al 2O 3+3H 2O (3)Al(OH)3实验室制法:①可溶性铝盐加氨水:Al 3++3NH 3·H 2O →Al(OH)3↓+3NH 4+②可溶性偏铝酸盐与弱酸:AlO 2—+ H 2CO 3 +H 2O → Al(OH)3↓+ HCO 3—③ 3AlO 2- +Al 3++6H 2O →4Al(OH)3↓4、铝盐(1)Al 3+与碱溶液反应:Al 3++3OH -→Al(OH)3↓(碱不足)Al 3++4OH -→AlO 2-↓+2H 2O (碱过量)(2)Al 3+水解:Al 3++3H 2O Al(OH)3+3H + (3)明矾:Kal(SO 4)2•12H 2O 是一种复盐。
铝及铝的化合物一轮复习
(2)当 n[KAl(SO4)2]∶n[Ba(OH)2]=1∶2 时,铝元素的 存在形式是什么?
提示 铝元素的存在形式是AlO-2:KAl(SO4)2
+2Ba(OH)2===KAlO2+2BaSO4↓+2H2O。
考点精讲
考点一 铝与强酸、强碱的反应 1.等质量的两份铝分别与足量的盐酸、 氢氧化钠溶液反应,所得 H2 的体积之比是多 少?为什么?
4.8,2.7 8mol/L
应用Ⅱ
铝元素在溶液中的存在形式的判断
观察方程式可知:找到恰好完全反应的两个点
①Al3++3OH-=Al(OH)3 ②Al3++4OH-= AlO2-+2H2O
a mol b mol
Al(OH)3 AlO2-
Al(OH)3 和Al3+ ○
Al(OH)3 和AlO2
○
AlO2-
铝及其化合物
思考 4
学案部分
向明矾溶液中逐滴加入 Ba(OH)2 溶液,
(1)当 n[KAl(SO4)2]:n[Ba(OH)2]=2∶3 时,铝元 素的存在形式是什么? 提示 铝元素的存在形式是Al(OH)3:
2KAl(SO4)2+3Ba(OH)2===2Al(OH)3↓+ 3BaSO4↓+K2SO4。
⑵铝的特性——与碱的反应
化学方程式: 2Al+2NaOH+2H2O===2NaAlO2+3H2↑ 离子方程式: 2Al+2OH-+2H2O===2AlO2-+3H2↑
反应的实质分析: 该反应的氧化剂是什么?
2Al +6H2O=== 2Al(OH)3+3H2 ↑ Al(OH)3+OH-===AlO2-+2H2O
4Al+3O2
2Al2O3
问题:铝是活泼金属,为什 么铝制品却有非常广泛的用途?
高中化学一轮复习讲义(解析版):铝及其化合物
铝及其化合物【学习目标】1.铝及其化合物的性质及用途2.铝三角及图像问题3.铝热反应◆感知高考1. [2020·江苏]下列有关物质的性质与用途具有对应关系的是A. 铝的金属活泼性强,可用于制作铝金属制品B. 氧化铝熔点高,可用作电解冶炼铝的原料C. 氢氧化铝受热分解,可用于中和过多的胃酸D. 明矾溶于水并水解形成胶体,可用于净水【答案】D【解析】A.铝在空气中可以与氧气反应生成致密氧化铝,致密氧化铝包覆在铝表面阻止铝进一步反应,铝具有延展性,故铝可用于制作铝金属制品,A错误;B.氧化铝为离子化合物,可用作电解冶炼铝的原料,B错误;C.氢氧化铝为两性氢氧化物,可以用于中和过多的胃酸,C错误;D.明矾溶于水后电离出的铝离子水解生成氢氧化铝胶体,氢氧化铝胶体能吸附水中的悬浮物,用于净水,D正确;故选D。
2.[2020·浙江1月选考,12]下列关于铝及其化合物说法,不正确的是()A. 明矾可用作净水剂和消毒剂B. 利用铝热反应可冶炼高熔点金属C. 铝可用作包装材料和建筑材料D. 氢氧化铝可用作治疗胃酸过多的药物【答案】A【解析】A.明矾溶于水可生成具有吸附性的氢氧化铝胶体,可以净水但不能消毒,故A错误;B.铝热反应是金属铝和沸点较高的金属氧化物之间反应冶炼高熔点金属的过程,故B正确。
C.铝具有良好的延展性,铝箔可以做包装材料,铝合金硬度大密度小常用做建筑材料,故C正确;D.胃酸主要成分为HCl,氢氧化铝具有弱碱性可中和过多胃酸,故D正确;故答案为A。
◆核心知识1.铝的结构和存在铝位于元素周期表,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
【答案】第3周期ⅢA族,。
2.金属铝及其化合物的化学性质(1)转化关系①理清知识主线Al→Al2O3←Al(OH)3→⎩⎪⎨⎪⎧NaAlO2AlCl3Al2(SO4)3KAl(SO4)2·12H2O②形成网络构建(2)重要反应方程式(用方程式回答下列问题)①用化学方程式表示除去铁粉中的铝粉。
铝及其化合物的图像题
铝及其化合物的图像题1、在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOHAl2(SO4)3则原混合液中溶液的体积关系如图所示,) (D与MgSO4的物质的量浓度之比1 ∶.3B.6∶1A2 ∶.1 D2∶1 C.)((2011·桂林摸底)下列图象正确的是2、3-+-++错;DH与AlO能反应,当Al(OH)最多时,AlO解析:H与Al最少,不反应,A错;223333-++-Al最少时,Al(OH)最多,当Al(OH)最少时,AlOOH能与Al反应,当Al最多,且233-+不符合.B符合上述量值特点而C、Al(OH)、AlO的物质的量的最大值相等,23B答案:1-再往溶液待合金完全溶解后,盐酸中,(2011·青岛一模)把一块镁铝合金投入到1 mol·L3、1-溶液体积变化的关系如图NaOH NaOH溶液,生成沉淀的物质的量随加入里加入1 mol·L)所示.下列说法中错误的是(80 mL A.盐酸的体积为<50 0<a B.a的取值范围为2+)<0.025 molC.n(Mg0.01b值为a值为30时,D.当2++2Al、H↑解析:从开始到沉淀量最大的过程中,涉及的反应有Mg+2H===Mg+2323-+-++++-3OH、、H+OH===HOMg、+2OH===Mg(OH)↓Al+↑+6H===2Al +3H222的~90 mLHCl的总量,A正确;80 mL,此时消耗的===Al(OH)↓NaOH的物质的量等于3--沉淀消耗,故形成Al(OH)OAl(OH)NaOH溶液用于溶解Al(OH):+OH===AlO+2H323232+的最大值是0,则Mg=,30 mLNaOH的体积是,所以a<50B项正确;从题图来看,若a沉淀的物质的量均、Al(OH)时,得到正确;当0,故C a为30Mg(OH)≠,而0.025 mol a32项不正确.D0.02 mol0.01 mol为,共,D答案:.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液至过量,表示氢氧化钠加入4.量(x)与溶液中沉淀物的量(y)的关系示意图正确的是()此过程中发生的反应:解析:+3NaOH===Al(OH)↓)Al(NO+333+Mg(NO)3NaNO,233开始时沉淀逐渐增多,2HO.Al(OH)+NaOH===NaAlO+2NaOH===Mg(OH)↓+2NaNO,23322溶液,所以最后沉不溶于NaOHAl(OH)溶解,沉淀又逐渐减少,因Mg(OH)达最大值后,23淀量保持不变.C 答案:的物质的量关系如图所示,生成沉淀的量与加入X或通入)Y溶液中,5.将物质X逐渐加入() 符合图示情况的是(D B C A HCl AlClCOX NaOH 32 NaOHAlClNaAlO Ca(OH) Y322项沉淀生成与溶解消耗BCO的物质的量相等;项生成沉淀和溶解沉淀消耗的解析:A2项开始无沉淀,后来才产生沉淀.,D盐酸量的比例为1∶3C答案:.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象6) (的效果.下列表达不正确的是.高温反应的气体产物:和CA.密闭容器中CuOCl中的燃烧产物:B.Fe在2NaOH后铝的存在形式:C.AlCl溶液中滴加3SO反应后溶液中的铵盐:D.氨水与2△△↑,2CuO+C=====2Cu+CO+解析:CuOC=====Cu+CO↑,2?CuO?CuO?n?n?CuO?n,CO 和CO;CO1<2,产物为2产物≤1,C;≥,产物为22??n?C n?C?n?C33+-+4OH错.,FeCl中燃烧只有一种产物在正确.AFeClBAl++Al3OH===Al(OH),↓332.n?NaOH?n?NaOH?3+--和Al(OH)的形式存在;Al=3,则===AlO+2HO,<3,铝元素以322??AlClAlCl?nn?33n?NaOH?n?NaOH?-<4,以AlO和Al(OH)的形式存在;≥4.只以Al(OH)的形式存在;3<332??n?AlCl?AlCl n33-以AlO的形式存在,C正确.NH·HO+SO===NHHSO,2NH·HO+SO===(NH)SO322242223433n?NH·HO?n?NH·HO?2233+HO,≤1,生成NHHSO;1<<2,产物为NHHSO与(NH)SO32244343?SO?nn?SO?22n?NH·HO?23的混合物;≥2,只生成(NH)SO,D正确.342?SO n?2答案:B23++++-等离子的溶液中,Cl、200 mL含MgH、Al、、NH在7.(2011·徐州第二次质量调研)41-的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量逐滴加入5 mol·L(mol)关系如下图所示:) (下列叙述正确的是0.01 mol 的差值为与y A.x1--L=0.75 mol·(ClB.原溶液中c)1pH=C.原溶液的32++2)=(Mg5)∶n(Al∶n D.原溶液中+段求得,依4由横坐标0~剖析图象容易求得:原解析:200 mL 溶液中含20 mmol H(3+-++Al(OH)(只能由横坐标33~35O)据是H+OH===H;含10 mmol Al段求得,依据是3232++段~[在Al30已求得的基础上,联合横坐标NaOH===NaAlO+2HO);含50 mmol Mg42223+--++15 mmol NH];含↓以及Mg↓由===Al(OH)2OH===Mg(OH)(+求得,依据是Al+3OH432-+-结合上述已(;含165 mmol ClO)33段求得,依据是NH+OH===NH↑+H横坐标30~234-L0.825mol·错误,C正确.B c(Cl)=)经推得的各种数据,由溶液电中性原则求得.因此,A、1-1. 5∶.D错误,所求的比值应为AC答案:33+-+,与AlO物质的量变化的曲线,实线表示Al)8.(2011·石家庄质检一下列图象表示Al2-)虚线表示AlO,其中正确的是(23--+-中的+、Al(OH)+OH===AlO2HO↓解析:据离子方程式:Al+3OH===Al(OH)2332+-Al(OH)O===Al(OH)↓及H+正确,对应关系可知BA错误.由离子方程式:AlOH+32233++可知O===Al+3H+3HC均错误.、D2B答案:32+++的混合液中并微热,产生沉淀和气体的物质、O逐渐加入到含有AlNH、Mg9.将Na42232+++的物质的、O的物质的量的关系如图所示,则原混合液中Al、MgNH的量与加入Na422量分别是()8 mol 、3 mol、2 mol、8 mol B.A.2 mol、3 mol4 mol、3 mol4 mol 2 mol、3 mol、、2 molD.C.,生成的Al(OH)反应中生成的沉淀有Mg(OH)、解析:322+=)沉淀)可知:n(Mg.气体有NH和O由纵坐标及曲线n(233+mol=8 n(NaO)mol]=2 ,产物中n(气体)]n[Mg(OH)=3 mol,n(Al在加入)=n[Al(OH)2232的混合气,NHO和mol NaO前放出气体为前、后是两条斜率不同的直线.所以加入8 32224 mol8 mol-n(NH)=8 mol NaO与HO 反应可放出4 mol O可知放出O之后仅放出,由322222+.=n(NH)=4 mol4C答案:1-Al(OH)NaOH溶液时,得到mL某物质的量浓度的AlCl溶液中滴入2 mol·L10.向20 33 (mL)关系如下图所示,试回答下列问题:的质量与所滴加NaOH溶液的体积是的意义点(1)图中A表示________________________________________________,是的意义图中B点表示(2) _________________________________________________,_________________________________ (3)上述两步反应用总的离子方程式可表示为________________________________________________________________________,________.沉淀0.39 g,则此时用去NaOH溶液的体积为Al(OH)(4)若溶液中有33-+AlO→Al(OH)―溶液中发生解析:由图可知:随着NaOH溶液的加入,AlClAl→―233完全溶解,涉及的离子Al(OH)Al(OH)点表示得到沉淀的最大值,B点表示的转化.故A333--+-+OH===AlO+2HO总的离子反应方程式为:反应为:Al;+3OH===Al(OH)↓Al(OH)23323-+-O+4OH===AlO+2HAl22要生成0.39 g Al(OH)沉淀时有两种情况:31-,即:(OH]=n)过量,此时①AlCl n[Al(OH)33310.39 g131---2 mol·10V×=L·mL×L×1-3mol78 g·7.5 mL=V解得3+此时又使沉淀部分溶解,使NaOH相对过量时,NaOHAlAl(OH)全部生成后,当②33+-)n[Al(OH)(Al n4=]3.-,(OH)n0.78 g0.39 g113---2 mol·×-=L×V′×104L·mL即:11--molmol78 g·78 g·17.5 mL.′=解得V Al(OH)沉淀的最大值答案:(1)生成3 (2)Al(OH)沉淀完全溶解33-+-O+(3)Al2H+4OH===AlO22(4)7.5 mL或17.5 mL11.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:混合物,的质量为______________(1)混合物中NaOH中合物为________________,混质中AlCl3的量______________.MgCl2的质量为________.(2)P点表示盐酸的体积是)n(Cl-沉淀量最大处,溶液中的溶质只有NaCl,由钠、氯元素原子守恒可知:n(NaOH)=0.045 =3×0.005 mol2L×0.5 mol/L+×0.01 mol+(AlCl3)(MgCl2)(HCl)=n+2n+3n=0.021.8 g.×40 g/mol=0.045 molmol,故m(NaOH)=的量不变,、AlCl3MgCl2、AlCl3,整个过程前后MgCl2NaCl(2)P点时溶液中的溶质为、0.09 L÷0.5 mol/L==,可看作加入的盐酸中和了原混合物中的NaOH故有V(HCl)0.045 mol90 mL.=(2)90 mL 0.95 g0.6675 g(1)1.8 g][答案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题6 几种重要的金属(2)
2012级高三化学组
课前预习案
【目标引领】
掌握铝的重要化合物的相互转化及其图像分析
【自主探究】
①向1L1mol/L氯化铝溶液中滴加1mol/L的氢氧化钠溶液,以氢氧化钠溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
②向1L 1mol/L氯化铝溶液中滴加1mol/L的氨水,以氨水的体积为横坐标,沉淀的物质的量为纵坐标作图。
(试剂反加时图像如何?)
③向1L 含1mol/L氯化铝、1mol/L盐酸的混合溶液中滴加1mol/L的氢氧化钠溶液,以氢氧化钠溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
④向1L 含1mol/L氯化铝、1mol/L氯化镁的混合溶液中滴加1mol/L的氢氧化钠溶液,以氢氧化钠溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
⑤向1L1mol/L氢氧化钠溶液中滴加1mol/L的氯化铝溶液,以氯化铝溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
⑥向1L1mol/L四羟基合铝酸钠溶液中滴加1mol/L的氯化铝溶液,以氯化铝溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
⑦向1L1mol/L氯化铝溶液中滴加1mol/L的四羟基合铝酸钠溶液,以四羟基合铝酸钠溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
⑧向1L1mol/L四羟基合铝酸钠溶液中滴加1mol/L的盐酸溶液,以盐酸溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
⑨向1L1mol/L盐酸溶液中滴加1mol/L的四羟基合铝酸钠溶液,以四羟基合铝酸钠溶液的体积为横坐标,沉淀的物质的量为纵坐标作图。
⑩向1L1mol/L四羟基合铝酸钠溶液中通入二氧化碳气体,以标况下二氧化碳气体的体积为横坐标,沉淀的物质的量为纵坐标作图。
【练习】1. 向30毫升1 mol/L的AlCl3溶液中逐渐加入浓度为4 mol/L的NaOH溶液,若产生0.78克白色沉淀,则加入的NaOH溶液的体积可能为()
A. 3mL
B. 7.5mL
C. 15mL
D. 27.5mL
2. 向含有a mol AlCl3的溶液中加入含b mol KOH的溶液,生成沉淀的物质的量可能是()(1)a mol (2)b mol (3)a/3mol(4)b/3mol(5)0 mol (6)(4a-b)mol
A.(1)(3)(4)(5)(6)
B. (1)(4)(5)(6)
C.(1)(2)(3)(5)(6)
D. (1)(3)(5)
3. 等体积的AlCl3和KOH两溶液混合后,沉淀中铝元素的质量与溶液中铝元素的质量相等,则AlCl3和KOH 两种溶液的物质的量浓度之比是()
(1)1:3(2)2:3(3)1:4(4)2:7
A.(1)和(2)
B.(1)和(3)
C.(2)和(4)
D.(3)和(4)
4. 下列各组溶液,不用其他试剂即能鉴别开的是()
A. MgCl2和NaOH
B. NaCl和AgNO3
C. Na2CO3和HCl
D. AlCl3和KOH
5. 现有200 mL MgCl2和AlCl3的混合溶液,其中 c(Mg2+)=0.2 mol/L,c(Cl-)=1.3 mol/L,要使Mg2+转化为Mg(OH)2,并使Mg2+与Al3+分离开,至少需要4 mol/L的NaOH溶液的体积为()
A. 140mL
B. 120mL
C. 100mL
D. 80mL
6. 将3 mol/L NaOH溶液滴入到25 mL一定浓度的AlCl3溶液中。
如图是整个过程的数学分析曲线。
其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀物质的量。
据图示回答下列问题:
B
(1)图中A点表示的意义是____________。
B点表示的意义是____________。
(2)当C点从O点向A点运动时,表示随OH-的不断加入,沉淀量逐渐_______。
OA曲线表示的离子方程式______________,由此可得A点的坐标为________;当C点从A点向B点运动时,表示____________________________________。
AB曲线表示的离子方程式为
____________________________________,由此可得B点的坐标为:_____________。
(3)由上述求得AlCl3溶液中Al3+离子的浓度为_________________。
