2020年高考化学计算题专题复习(带答案)
2020年高考化学微专题复习《滴定及计算(中和滴定、氧化还原滴定、沉淀滴定)》

滴定的拓展(氧化还原滴定、沉淀滴定)1.实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。
②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.101 0mol·L-1(NH4)2Ce(NO3)6溶液。
③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.050 0 mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00 mL。
测定过程的反应方程式为2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______________。
解析:50.00 mL 0.101 0 mol·L-1(NH4)2Ce(NO3)6溶液中n[(NH4)2Ce(NO3)6]=0.101 0 mol·L-1×50.00×10-3 L=5.050×10-3 mol,参与第二步反应的量n[(NH4)2Fe(SO4)2]=0.050 0 mol·L-1×29.00×10-3 L=1.450×10-3 mol,与NaN3反应的n[(NH4)2Ce(NO3)6]=5.050×10-3mol-1.450×10-3 mol=3.600×10-3 mol,试样中NaN3的质量分数为(3.600×10-3 mol×10×65 g/mol)/2.500 g ×100%=93.60%。
答案:93.60%(0.9360)2.(2019·全国卷Ⅱ节选)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。
2020版(2020年4月)浙江选考高考化学:特训4第29题化学计算题专练 Word版含答案
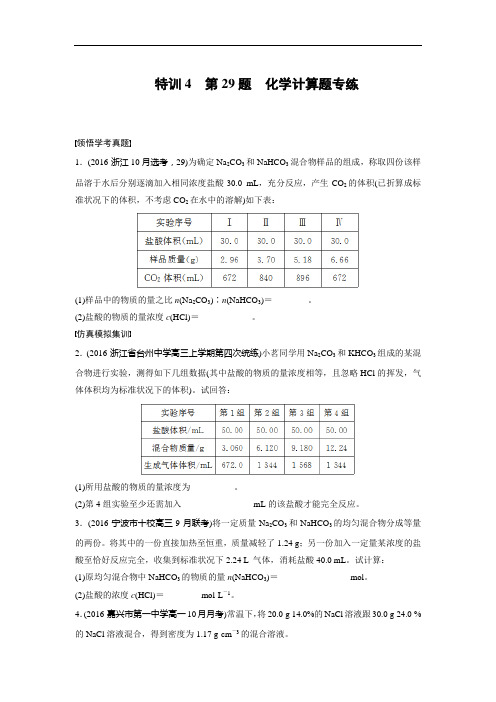
特训4第29题化学计算题专练领悟学考真题1.(2016·浙江10月选考,29)为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=____________。
仿真模拟集训2.(2016·浙江省台州中学高三上学期第四次统练)小茗同学用Na2CO3和KHCO3组成的某混合物进行实验,测得如下几组数据(其中盐酸的物质的量浓度相等,且忽略HCl的挥发,气体体积均为标准状况下的体积)。
试回答:(1)所用盐酸的物质的量浓度为__________。
(2)第4组实验至少还需加入________________ mL的该盐酸才能完全反应。
3.(2016·宁波市十校高三9月联考)将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。
将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。
试计算:(1)原均匀混合物中NaHCO3的物质的量n(NaHCO3)=________________ mol。
(2)盐酸的浓度c(HCl)=________ mol·L-1。
4.(2016·嘉兴市第一中学高一10月月考)常温下,将20.0 g 14.0%的NaCl溶液跟30.0 g 24.0 %的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。
(1)该混合溶液的质量分数为__________。
(2)该混合溶液的物质的量浓度是_______mol·L -1。
(3)在1 000 g 水中溶解__________ mol NaCl 才能使其浓度与上述混合溶液的浓度相等。
高中化学计算题学霸总结(含答案)

高中化学计算题学霸总结(含答案)高中化学计算题学霸总结(含答案)阳光老师:祝你学业有成一、计算题(本大题共30小题,共240.0分)1.把铁、铝混合物溶于盐酸中,反应后盐酸的浓度变为,溶液体积变化忽略不计。
求反应中消耗HCl的物质的量和该混合物中铝、铁的物质的量。
答案】消耗HCl的物质的量:设Al、Fe的物质的量分别为x、y。
2Al + 6HCl → 2AlCl3 + 3H2↑Fe + 2HCl → FeCl2 + H2↑根据反应方程式,消耗HCl的物质的量为2x + y。
该混合物中铝、铁的物质的量:根据题意,铝、铁混合物中铝、铁的质量比为2:3,设铝、铁的质量分别为m1、m2,则有:m1/m2 = 2/3m1 + m2 = 100g解得m1 = 40g,m2 = 60g铝、铁的相对原子质量分别为27和56,所以它们的物质的量分别为x = 1.48mol,y = 1.07mol。
解析】本题考查物质的量的计算,难度不大,解题的关键是对物质的量公式的熟练应用。
2.在由Na2CO3和NaHCO3组成的混合物中加入足量盐酸充分反应后,收集CO2的质量分数。
不考虑溶解,试计算原混合物中Na2CO3的质量分数。
答案】原混合物中Na2CO3的质量分数为。
设Na2CO3的物质的量为x,NaHCO3的物质的量为y。
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2ONaHCO3 + HCl → NaCl + CO2↑ + H2O根据反应方程式,CO2的物质的量为x + y。
CO2的质量分数为:答:原混合物中Na2CO3的质量分数为。
解析】本题考查质量分数的计算,掌握物质的性质和质量分数的计算方法是解答该题的关键,试题较容易。
3.计算质量比为51:32:34的C6H5OH、CH3OH、C2H5OH,其物质的量之比为______,它们所含氢原子数之比为______,所含质子数之比为______。
有含为,则C6H5OH 的摩尔质量为______,R的相对原子质量为______。
2020高考化学三轮复习《化学实验基础》专项测试题(含答案)

《化学实验基础》专项测试题一、单选题(每小题只有一个正确答案)1.进行实验时,应高度重视实验安全。
下列操作不符合安全要求的是()A.点燃CH4前必须验纯B.把蒸馏水加入浓硫酸中进行稀释C.实验室制备NH3时,用盐酸吸收尾气D.做蒸馏实验时,在蒸馏烧瓶中加入少许碎瓷片2.甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。
则甲、乙、丙、丁四种溶液依次是A.BaCl2、Na2CO3、AgNO3、盐酸B.BaCl2、Na2CO3、盐酸、AgNO3C.Na2CO3、盐酸、AgNO3、BaCl2D.AgNO3、盐酸、BaCl2、Na2CO33.下列区分物质的方法不正确的是A.用燃烧的方法可以区分甲烷和乙烯B.用酸性KMnO4溶液区分苯和CCl4 C.用新制的Cu(OH)2区分蔗糖和葡萄糖D.用KI溶液区分淀粉溶液和鸡蛋白溶液4.实验是化学学科的基本特征,下列有关实验事故处理不正确的是()A.水银温度计打破以后,尽量收集,然后撒上硫粉处理残余的水银B.实验室中若煤油着火可以直接用水浇灭C.在蒸馏实验中忘记加沸石,要停止加热,等液体冷却后再加沸石D.配制一定物质的量浓度溶液的实验中,定容时滴加蒸馏水超过刻度线,必须重新配制5.用下列实验装置进行相应实验,能达到实验目的的是A.用图1装置蒸发CuCl2溶液获得无水CuCl2B.用图2装置可证明非金属强弱:Cl>C>SiC.用图3装置制备少量白色的Fe(OH)2沉淀D.用图4装置进行已知浓度的NaOH溶液测定未知浓度的盐酸6.除去下列括号内杂质能达到目的的是()A.NaCl溶液(K2SO4):BaCl2溶液B.CO 2气体(SO2):NaOH溶液C.Fe2(SO4)3溶液(FeSO4):氯水D.MgO固体(Al2O3):NaOH溶液7.下列实验能达到目的的是A.在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸B.溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离C.用玻璃棒搅拌漏斗中的液体以加快过滤速度D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质8.下列有关离子检验的方法及结论均正确的是A.取待测液于试管中,依次加入盐酸、Ba(NO3)2溶液,产生白色沉淀,则原溶液含有SO42-B.取待测液于试管中,通入氯气,滴加KSCN溶液后呈血红色,则原溶液含有Fe2+ C.取固体于试管中加热,用湿润的红色石蕊试纸靠近试管口变蓝,则可证明固体为铵盐D.取待测液于试管中,加入硝酸酸化硝酸银,产生白色沉淀,则原溶液含有Cl-9.下列物质中,不能由金属跟非金属单质直接化合得到的是A.Na2O2B.NaCl C.FeCl2D.Fe3O410.关于下列各实验装置的叙述中,正确的是A.装置①常用于分离互不相溶的液体B.装置②可用于吸收NH3C.装置③可用于除去甲烷中混有的少量乙烯D.装置④可用于收集SO2、Cl2等气体11.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶内有少量水;④酸式滴定管用蒸馏水洗后,未用标准液润洗;⑤读取滴定管终点读数时,仰视刻度线。
高考化学计算专题试题集(含答案)

Ⅰ.有关物质的量的计算一、选择题1.质量相等的两份气体样品,一份是CO ,另一份是CO 2,这两份气体样品中,CO 与CO 2所含氧原子的原子个数之比是 ( )A .1:2B .1:4C .11:14D .1l :282.下列各组中两种气体的分子数一定相等的是 ( )A .温度相同、体积相同的O 2和N 2B .质量相等、密度不等的N 2和C 2H 4C .体积相同、密度相等的CO 和C 2H 4D .压强相同、体积相同的O 2和H 23.由钾和氧组成的某种离子晶体含钾的质量分数是78/126,其阴离子只有过氧离子(O 22-)和超氧离子(O 2-)两种。
在此晶体中,过氧离子和超氧离子的物质的量之比为 ( )A .2:lB .1:lC .1:2D .1:34.由CO 2、H 2和CO 组成的混合气在同温同压下与氮气的密度相同。
则该混合气体中CO 2、H 2和CO 的体积比为 ( )A .29:8:13B .22:l :14C .13:8:29D .26:16:575.由X 、Y 两元素组成的气态化合物XY 4,在一定条件下完全分解为A 、B 两种气体物质,己知标准状况下20mLXY 4分解可产生标准状况下30mL A 气体(化学式为Y 2)和10mL B气体,则B 的化学式为 ( )A .X 2B .Y 2X 2C .XY 2D .X 2Y 46.将N02、NH 3、O 2混合气22.4L 通过稀硫酸后,溶液质量增加了26.7g ,气体体积缩小为4.48L .(气体体积均在标况下测定)剩余气体能使带火星的木条着火,则混合气体的平均分子量为 ( )A .28.1B .30.2C .33.1D .34.07.为方便某些化学计算,有人将98%浓硫酸表示成下列形式,其中合理的是 ( )A .H 2SO 4·19B .H 2SO 4 ·H 2OC .H 2SO 4·SO 3D .SO 3· 109H 2O 8.两种气态烃组成的混合气体0.1mol ,完全燃烧得O.16molCO 2 T3.6g 水。
2020年高考化学二轮专题复习综合训练:(七) 化学计算 Word版含答案

分别为( )
A.a=10,b=9.2
B.a<10,b>9.2
C.a>10,b<9.2
D.a>10,b=9.2
5.设 NA 为阿伏加德罗常数的值。下列说法正确的是 A.1.6 g 由氧气和臭氧组成的混合物中含有氧原子的数目为 0.1NA B.0.1 mol 丙烯酸中含有双键的数目为 0.1NA C.标准状况下,11.2 L 苯中含有分子的数目为 0.5NA D.在过氧化钠与水的反应中,每生成 0.1 mol 氧气,转移电子的数目为 0.4NA
3.设 NA 表示阿伏加德罗常数的值,下列说法正确的是
( )
A.标准状况下,22.4 L C2H2、C2H6 的混合气体与 22.4 L C2H4 中所含原子总数均为 6NA
B.标准状况下,11.2 L12C16O 和 14N2 的混合气体中所含中子数和原子数的差值为 6NA
C.常温下,1 L pH=14 的 NaOH 溶液中由水电离出的 OH-数为 NA
A.0.08 mol·L-1
B.0.04 mol·L-1
C.0.02 mol·L-1
D.0.01 mol·L-1
8.下列指定微粒的数目相等的是( )
A.等物质的量的水与重水含有的中子数
B.等质量的乙烯和丙烯中含有的共用电子对数
C.同温、同压、同体积的 CO 气体和 NO 气体含有的质子数
D.等物质的量的铁和铝分别与足量盐酸完全反应时转移的电子数
酸溶液来说,浓度越大,密度越大,故 <1,因此 b<9.2。
5.A O2 和 O3 都只由氧元素组成,1.6 g O2 和 O3 的混合物中氧原子质量为 1.6 g,物
质的量为 0.1 mol,A 正确;丙烯酸(
2020年高考化学为专题复习热重曲线图像分析及其计算
(1)设晶体为1 mol 。
(2)失重一般是先失水,再失非金属氧化物。
(3)计算每步的m 剩余,m 剩余m (1 mol 晶体质量)×100%=固体残留率。
(4)晶体中金属质量不减少,仍在m 剩余中。
(5)失重最后一般为金属氧化物,由质量守恒得m (O),由n (金属)∶n (O),即可求出失重后物质的化学式。
1.[2019·全国卷Ⅰ,27(5)]采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。
硫酸铁铵晶体的化学式为_____________。
答案 NH 4Fe(SO 4)2·12H 2O解析 失重 5.6%是质量分数,设结晶水合物的化学式为NH 4Fe(SO 4)2·x H 2O ,由题意知1.5×18266+18x =5.6100,解得x ≈12。
2.[2014·新课标全国卷Ⅱ,27(4)]PbO 2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a 点为样品失重4.0%(即样品起始质量-a 点固体质量样品起始质量×100%)的残留固体。
若a 点固体组成表示为PbO x 或m PbO 2·n PbO ,列式计算x 值和m ∶n 值。
答案 根据PbO 2=====△PbO x +2-x 2O 2↑,有2-x 2×32=239×4.0%,解得x =2-239×4.0%16≈1.4,根据m PbO 2·n PbO ,有2m +n m +n=1.4,得m n =0.40.6=23。
1.25.35 g MnSO 4·H 2O 样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示:(1)300 ℃时,所得固体的化学式为________。
(2)1 150 ℃时,反应的化学方程式为___________________________。
2020年高考化学微专题复习《草酸的性质和制备》
②能证明草酸晶体分解产物中有CO的现象是------------------------
H中黑色粉末变为红色,其后的D中澄清石灰水变浑浊 。
(3)设计实验证明:草酸的酸性比碳酸的强
+2HCO3﹣→
+2H2O+2CO2↑
D.用高锰酸钾标准溶液滴定草酸:
A
2MnO4﹣+16H++5C2O42﹣═2Mn2++10CO2↑+8H2O
【分析】A.盐类水解是可逆反应; B.Al和NaOH溶液反应生成偏铝酸钠和氢气, Mg不反应; C.羧基能和碳酸氢钠反应,但酚羟基和碳酸氢 钠不反应; D.弱电解质写化学式.
②
少量NaHCO3溶液 产生气泡
③
酸性KMnO4溶液
紫色溶液褪色
④
C2H5OH和浓硫酸
加热后产生有香味物质
由上述实验所得草酸性质所对应的方程式不正确的是
C
A.H2C2O4有酸性,Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性:H2C2O4>H2CO3,NaHCO3+H2C2O4=NaHC2O4+CO2↑+H2O
A . pH=2.5 的 溶 液 中 : c ( H2C2O4 ) +c ( C2O42 ﹣ ) > c (HC2O4﹣) B.c(Na+)=0.100 mol•L﹣1的溶液中:
c(H+)+c(H2C2O4)=c(OH﹣)+c(C2O42﹣) C.c(HC2O4﹣)=c(C2O42﹣)的溶液中:c(Na+)> 0.100 mol•L﹣1+c(HC2O4﹣) D.pH=7的溶液中:c(Na+)>2c(C2O42﹣)
2020届高考化学三轮复习《常见物质的制备》专项测试题(含答案)
(4)仪器D中盛有冰水混合物,其作用为________________。
(5)操作1的名称为________,操作2的名称为________。
(6)若省略步骤Ⅱ会导致的后果是________。
24.水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂,利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+ N2H4·H2O +NaCl
(1)为尽量少引入杂质,试剂①应选用______________(填标号)。
a.HCl溶液b.H2SO4溶液c.氨水d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为_________________________。
(3)沉淀B的化学式为______________________
II.毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
《常见物质的制备》专项测试题
一、单选题(每小题只有一个正确答案)
1.下列说法正确的是()
A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B.欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶
C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
D.实验室用MnO2和稀HCl加热法制取Cl2时,若有14.6gHCl参加反应,则可制得3.55gCl2
A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
2020高考化学小专题复习选修3物质结构与性质晶体密度计算及参考答案
高考化学小专题复习——晶体密度计算1、Ge单晶具有金刚石型结构,已知Ge单晶的晶胞参数a=565.76 pm,其密度为_________________________g·cm−3(列出计算式即可)。
2CuNi某镍白铜合金的立方晶胞结构如图所示。
①晶胞中铜原子与镍原子的数量比为_______________________。
②若合金的密度为d g·cm–3,晶胞参数a=_____________________nm。
3、GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。
该晶体的类型为___________,Ga与As以________键键合。
Ga 和As的摩尔质量分别为M Ga g•mol−1和M As g•mol−1,原子半径分别为r Ga pm和r As pm,阿伏加德罗常数值为N A,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
4YMY(Cu)与M(Cl)形成的一种化合物的立方晶胞如图所示。
①该化合物的化学式为______________________,已知晶胞参数a=0.542 nm,此晶体的密度为______________________g·cm–3。
(写出计算式,不要求计算结果。
阿伏加德罗常数为N A)5、(O)和B(Na)能够形成化合物F,其晶胞结构如图所示,晶胞参数,a=0.566nm,F的化学式为____________;晶胞中A原子的配位数为____________;列式计算晶体F的密度(g·c m¯3)___________________________________。
6、Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_________,列式表示Al单质的密度为________________________g·cm¯3(不必计算出结果)7、金刚石晶胞含有_______个碳原子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020年高考化学计算题专题复习(精选高考真题+详细教案讲义,值得下载)1.(2019·唐山一模)阿伏加德罗常数的值用N A表示,下列叙述正确的是() A.室温时,1 L pH=2的NH4Cl溶液中所含H+的数目为1×10-12N AB.1 mol LiAlH4在125 ℃时完全分解生成LiH、H2、Al,转移电子数为3N A C.1.7 g氨气中含有共价键的数目为0.4N AD.标准状况下,22.4 L NO2含有的原子数小于3N A解析:选B A项,室温时,1 L pH=2的NH4Cl溶液中所含H+的数目为0.01N A;B项,1 mol LiAlH4在125 ℃时完全分解生成LiH、H2、Al,反应中Al元素的化合价从+3价降低到0价,因此转移电子数为3N A;C项,1.7 g氨气的物质的量是0.1 mol,其中含有共价键的数目为0.3N A;D项,标准状况下,NO2不是气体。
2.设N A为阿伏加德罗常数的值,下列叙述不正确的是()A.常温常压下,30.0 g氟化氢中含有氟原子的数目为 1.5N AB.标准状况下,33.6 L乙烯与乙炔的混合物中含有碳原子的数目为3N AL-1的Na2CO3溶液中含有氧原子的数目为3N AC.1 L 1 mol·D.某密闭容器中0.1 mol Na2O2和0.1 mol CO2充分反应,转移电子的数目为0.1N Amol-1=1.5 mol,含有20 g·解析:选C30.0 g氟化氢的物质的量为30.0 g÷氟原子的数目为 1.5N A,故A正确;标准状况下,33.6 L乙烯与乙炔的混合气体的物质的量为 1.5 mol,它们分子中均含有2个碳原子,则混合物中含有碳原子的数目为3N A,故B正确;在Na2CO3溶液中,除Na2CO3含氧原子外,H2O也含有氧原子,该溶液中含有氧原子的数目大于3N A,故C错误;根据化学反应2Na2O2+2CO2===2Na2CO3+O2,0.1 mol Na2O2和0.1 mol CO2充分反应,转移电子的数目为0.1N A,故D正确。
3.(2019·福州一模)设阿伏加德罗常数的值为N A,下列说法正确的是() A.0.01 mol乙烯气体被浓溴水完全吸收,反应伴随0.02N A个碳碳共价键断裂B.实验室用电解熔融NaOH制取金属钠,制得 2.3 g钠时,电路中至少转移0.1N A个电子C.标准状况下,44.8 L HCl气体溶于 1.0 L水中,所得溶液每毫升中含2×10-3N A个H+D.含4 mol HCl的浓盐酸与足量的MnO2混合后充分加热,可产生N A个Cl2分子解析:选B A项,0.01 mol乙烯气体被浓溴水完全吸收生成1,2-二溴乙烷,反应伴随0.01N A个碳碳共价键断裂;B项,实验室用电解熔融NaOH制取金属钠,钠由+1价变为0价,所以制得 2.3 g钠时,电路中至少转移0.1N A个电子;C项,标准状况下,44.8 L HCl气体溶于 1.0 L水中,所得溶液体积不是 1.0 L;D项,稀盐酸与MnO2不能反应产生Cl2,含4 mol HCl的浓盐酸与足量的MnO2混合后充分加热,产生的Cl2分子数小于N A个。
4.(2019·巴东三中模拟)用N A表示阿伏加德罗常数的值。
下列叙述不正确的是()A.电解饱和食盐水,阳极产生22.4 L气体时,电路中通过的电子数目为2N A B.4.4 g由CO2和N2O组成的混合气体中的电子数目为 2.2N AC.含有氢原子数为0.4N A的CH3OH分子中含有的共价键数目为0.5N AD.常温下,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1N A解析:选A未指明是否在标准状况下,无法计算阳极生成的22.4 L气体的物质的量,A错误;CO2和N2O的摩尔质量均为44 g·m ol-1,且两者1个分子中均含22个电子,故 4.4 g(0.1 mol)CO2和N2O的混合气体中含有 2.2N A个电子,B正确;含有氢原子数为0.4N A的CH3OH的物质的量为0.1 mol,每个CH3OH 分子中含有5个共价键,所以0.1 mol CH3OH分子中含0.5N A个共价键,C正确;常温下,pH=13的Ba(OH)2溶液中OH-浓度为0.1 mol·L-1,1.0 L该溶液中含有0.1 mol OH-,含有的OH-数目为0.1N A,D正确。
5.(2018·广西二模)设N A为阿伏加德罗常数的值。
下列说法正确的是() A.7.8 g Na2O2与足量水反应,转移的电子数为0.1N AB.36 g由35Cl和37Cl组成的氯气中所含质子数一定为17N AC.25 ℃时,pH=12的氨水中所含OH-的数目为0.01N AD.30 g由甲醛(HCHO)与乙酸组成的混合物中所含C—H键的数目为2N A解析:选A A项,7.8 g Na2O2的物质的量为7.8 g78 g·m ol-1=0.1 mol,与足量水反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑,0.1 mol过氧化钠反应转移0.1 mol电子,因此转移的电子数为0.1N A;B项,由35Cl和37Cl组成的氯气的相对分子质量在70~74之间,无法计算36 g由35Cl和37Cl组成的氯气的物质的量;C项,溶液的体积未知,无法计算25 ℃时pH=12的氨水中所含OH-的数目;D项,甲醛(HCHO)与乙酸的最简式相同,但1个HCHO分子中含2个C —H 键,1个CH 3COOH 分子中含3个C —H 键,故无法计算30 g 由甲醛(HCHO)与乙酸组成的混合物中所含C —H 键的数目。
6.用N A 表示阿伏加德罗常数的值。
俗名为“臭碱”的硫化钠可用于冶金、燃料、皮革、电镀等工业,硫化钠的一种制备方法是Na 2SO 4+2C=====高温Na 2S +2CO 2↑。
下列说法正确的是() A .1 mol ·L -1Na 2SO 4溶液中含氧原子的数目一定大于4N AB .1 L 0.1 mol ·L -1Na 2S 溶液中含阴离子的数目小于0.1N A C .生成1 mol 氧化产物时转移电子数为4N A D .通常状况下,11.2 L CO 2中含质子的数目为11N A解析:选C 未注明溶液的体积,无法计算Na 2SO 4的物质的量和溶液中水的物质的量,因此也无法计算所含氧原子的数目,A 错误;1 L 0.1 mol ·L -1Na 2S 溶液中含有0.1 mol Na 2S ,S 2-水解生成HS -和OH -,阴离子的数目大于0.1N A ,B 错误;题给反应的氧化产物为CO 2,C 元素化合价由0价升高到+4价,生成1 mol CO 2时转移电子数为4N A ,C 正确;通常状况下,气体摩尔体积不是22.4 L ·mol -1,故11.2 L CO 2的物质的量不是0.5 mol ,所含质子的数目不是11N A ,D 错误。
7.(2019·南昌一模)设N A 为阿伏加德罗常数的值。
下列有关叙述正确的是()A .1 mol 甲醇中含有的共价键数为4N AB .1 mol 氯气分别与铁和铝完全反应时转移的电子数均为3N A C .电解精炼铜,当电路中通过的电子数目为0.2N A 时,阳极质量减少 6.4 gD .1 mol CH 3COONa 和少量CH 3COOH 溶于水所得中性溶液中,CH 3COO-的数目为N A解析:选D A 项,1 mol 甲醇中含有的共价键数为5N A ;B 项,1 mol 氯气分别与铁和铝完全反应时,氯元素化合价由0变为-1,所以转移的电子数均为2N A ;C 项,粗铜中含有杂质铁、锌等,所以电路中通过的电子数为0.2N A 时,阳极质量不一定减少 6.4 g ;D 项,根据电荷守恒,n(CH 3COO -)+n(OH -)=n(Na +)+n(H +),溶液呈中性,则n(OH -)=n(H +),所以n(CH 3COO -)=n(Na +)=1 mol 。
8.N A 代表阿伏加德罗常数的值。
下列说法正确的是()A .在0 ℃、101 kPa 条件下,11.2 L 丁烷中含极性共价键数目为5N AB .含23 g 钠元素的Na 2O 和Na 2O 2混合物中阴离子数目介于0.5N A 和N A 之间C .5NH 4NO 3=====△4N 2↑+2HNO 3+9H 2O 中当氧化产物比还原产物每多14 g 时,转移电子数为15N AD .用惰性电极电解饱和碳酸钠溶液时,电路上通过2 mol 电子时产生气体分子总数为N A解析:选A 在0 ℃、101 kPa 条件下,11.2 L 丁烷的物质的量为0.5 mol ,其中含极性共价键(C —H)的物质的量为0.5 mol ×10=5 mol ,故A 正确;根据钠原子守恒,含23 g 钠元素的Na 2O 和Na 2O 2混合物的物质的量为0.5 mol ,而Na 2O 和Na 2O 2均由2个钠离子和1个阴离子构成,故其中阴离子数目为0.5N A ,故B错误;5NH 4NO 3=====△4N 2↑+2HNO 3+9H 2O 中氧化产物和还原产物均为氮气,其中氧化产物与还原产物的物质的量之比为5∶3,当氧化产物比还原产物每多14 g 时,共生成氮气 2 mol ,转移电子数为7.5N A ,故C 错误;用惰性电极电解饱和碳酸钠溶液,相当于电解水,当电路上通过 2 mol 电子时产生 1 mol H 2、0.5mol O 2,分子总数为 1.5N A ,故D 错误。
9.设阿伏加德罗常数的值为N A 。
已知:在无氧条件下,葡萄糖发生反应C 6H 12O 6――→催化剂2CH 3CH 2OH +2CO 2↑。
下列说法正确的是() A .0.1 mol 葡萄糖(C 6H 12O 6)含羟基(—OH)数目为0.6N AB .10.0 g 质量分数为46%的酒精与足量的钠反应产生氢分子数为0.05N A C .常温常压下,4.48 L CO 2和NO 2的混合气体含原子总数为0.6N A D .4.8 g Mg 在足量的CO 2中完全燃烧,转移电子数目为0.4N A 解析:选D A 项,葡萄糖的结构简式为HOCH 2(CHOH)4CHO,1个葡萄糖分子含5个羟基,错误;B 项,酒精中含有水,水与钠也反应生成H 2,错误;C 项,常温常压下,4.48 L 气体的物质的量小于0.2 mol ,错误;D 项,2Mg +CO 2=====点燃2MgO +C ,n(Mg)=0.2 mol ,转移电子为0.4 mol ,正确。
