过氧化氢的性质及漂白原理
双氧水介绍
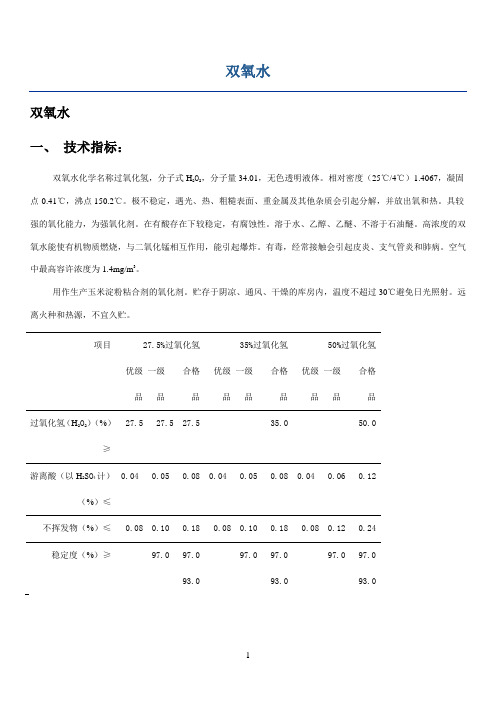
项目 27.5%过氧化氢优级 一级 合格 品 品 品35%过氧化氢 优级 一级 合格 品 品 品 50%过氧化氢 优级一级 合格 品 品 品 过氧化氢(H 2O 2)(%)≥27.5 27.5 27.5 35.0 50.0 游离酸(以H 2SO 4计)(%)≤0.04 0.05 0.08 0.04 0.05 0.08 0.04 0.06 0.12不挥发物(%)≤0.08 0.10 0.18 0.08 0.10 0.18 0.08 0.12 0.24 稳定度(%)≥ 97.0 97.0 93.0 97.0 97.0 93.097.0 97.093.0二、相关新闻:【1】双氧水的广泛用途——防腐、保鲜、杀菌、消毒在国外,食品级双氧水在食品行业中早已得到普遍应用。
在乳品及饮料等食品的无菌包装及啤酒、饮用水、水产保鲜、瓜果蔬菜等食品的生产加工过程都广泛使用食品级双氧水。
我国以前一直没有食品级双氧水,国内食品行业对食品组成双氧的需要也越来越多,尤其是乳品行业,无菌包装的纯牛奶、酸牛奶,其无菌包装的消毒必须要使用食品级双氧水。
由于食品级双氧水的生产具有一定的技术难度,国内一直没有食品级双氧水生产厂家,食品行业要使用食品级双氧水,只有两个途径:一是从国外进口食品级双氧水,二是使用工业级双氧水代替。
双氧水理化性质及食品级双氧水的特点1.双氧水的理化性质双氧水学名过氧化氢,系无色透明液体,溶于水、醇及醚,高浓度时有腐蚀性,敞口放置时,会渐渐分解为氧及水,30%的双氧水的密度为1.1g/cm3,熔点-0.89℃,沸点151.4℃,分子式为H2O2,分子量为34.01。
本品具有强烈的杀菌作用,在碱性条件下,效果更加明显。
2.食品级双氧水的特点食品级双氧水具有纯度高、杂质少、稳定性好,无有毒有害杂质。
工业级双氧水中含有大量的蒽醌类有机杂质以及铅、砷等金属离子、机械杂质等。
这些有毒有害杂质中,像蒽醌、铅砷是致癌物质,因此不能用于食品行业。
过氧化氢溶液的用法

过氧化氢溶液的用法
过氧化氢溶液也称为氧水,其化学式为H2O2。
它具有较强的氧化性质,在医疗、卫生、化工等领域有多种用途,以下是一些常见的用法:
1. 消毒杀菌:过氧化氢溶液可以有效杀灭细菌、病毒和其他微生物,常用于清洁创口、消毒工具、器械等。
在卫生领域,它可以用于清洁家居、厨房、卫生间等环境。
2. 漂白剂:过氧化氢溶液可以用作漂白剂,可用于漂白纸张、织物、毛发等。
它能去除污渍、烟斑等,还可用于牙齿美白。
3. 水处理:过氧化氢溶液可以用于水处理过程中的氧化反应,去除水中的有机物、重金属和其他污染物。
4. 化学合成:过氧化氢溶液在有机合成中常用作氧化剂,可以氧化苯、乙醇和醛等有机物。
5. 伤口清洁:适量稀释的过氧化氢溶液可用于清洁浅表伤口,有助于杀灭细菌和促进伤口愈合。
需要注意的是,过氧化氢溶液是一种强氧化剂,具有腐蚀性和刺激性,使用时需要注意安全。
在使用过程中,可以适量稀释过氧化氢溶液,严格按照说明书进行操作。
双氧水产品

双氧水一、双氧水的理化性质:双氧水,化学名称为过氧化氢,分子式H2O2,是除水外的另一种氢的氧化物。
粘性比水稍微高,化学性质不稳定,一般以30%或60%的水溶液形式存放。
过氧化氢有很强的氧化性,且具弱酸性。
英文名称:hydrogenperoxide水溶液名称:双氧水分子式:H2O2分子结构:O原子以sp3杂化轨道成键、分子为极性分子。
分子量:34.01主要成分:工业级分为27.5%、35%和50%。
外观与性状:水溶液为无色透明液体,有微弱的特殊气味。
纯过氧化氢是淡蓝色的油状液体。
熔点(℃):-2(无水)沸点(℃):158(无水)折射率:1.4067(25℃)相对密度(水=1):1.46(无水)饱和蒸气压(kPa):0.13(15.3℃)溶解性:能与水、乙醇或乙醚以任何比例混合。
不溶于苯、石油醚。
结构:H-O-O-H没有手性,由于-O-O-中O不是最低氧化态,故不稳定,容易断开。
溶液中含有氢离子,而过氧根在氢离子的作用下会生成氢氧根离子,其中氢离子浓度大于氢氧根离子浓度。
过氧化氢既是一种氧化剂,又是一种还原剂。
在酸性介质中,可将碘化钾氧化为碘。
但与强氧化剂(如高锰酸钾)作用时,则起还原作用。
二、双氧水的用途1、消毒剂双氧水是无色有刺激性气味的液体。
医疗上常用3%的双氧水进行伤口或中耳炎消毒。
当它与皮肤、口腔和黏膜的伤口、脓液或污物相遇时,立即分解生成氧。
这种尚未结合成氧分子的氧原子,具有很强的氧化能力,与细菌接触时,能破坏细菌菌体,杀死细菌。
杀灭细菌后剩余的物质是无任何毒害、无任何刺激作用的水。
不会形成二次污染。
因此,双氧水是伤口消毒理想的消毒剂。
但不能用浓度大的双氧水进行伤口消毒,以防灼伤皮肤及患处。
2、工业应用1)双氧水(过氧化氢)是重要的氧化剂、漂白剂、消毒剂和脱氯剂。
能用于棉织物及其它织物、草、藤、竹、木制品的漂白、纸浆的漂白及脱墨、三废(特别是废水)处理等。
2)有机及高分子合成(用作氧化剂、催化剂、引发剂、环氧化剂、交联剂等)。
双氧水的性质

双氧水的性质双氧水的性质不稳定,在放置过程中会逐渐分解,放出氧:H2O2→ H2O + 1/2O2受热和日光照射分解更快,H2O2是一种弱二元酸,可在水溶液中可按下式电离:H2O2↔ H+ + HOO- K1=1.55⨯10-12HOO-↔ H+ + O22- K2=1.0⨯10-25但HOO-是不稳定的,按下式分解:HOO-↔ OH- + (O)HOO-又是一种亲核试剂,具有引发双氧水形成游离基的作用:HOO-+H2O2↔ HOO•+HO•+OH-双氧水也能发生下列分解:HOOH →2HO•+ O2在双氧水溶液中加入碱,能中和其中的H+,这样便会增加HOO-存在,所以溶-的浓度,当pH>11.5时,过氧化氢分子大部分以H2O液的稳定性很差。
H2O2的分解能因催化作用而加速,除了某些金属如Cu、Fe、Mn和Ni离子等金属有催化作用外,其他如酶和极细小的有棱角的固体物质、容器器壁、乃至纤维和胶体等固体表面(特别是表面比较粗糙的物体)都具有加速H2O2分解的作用。
在有亚铁、高铁离子或其他金属离子存在时,可以使H2O2迅速而复杂的分解,形成HO•、HOO•、HOO-、O2等。
亚铁离子对双氧水的催化分解反应可表示如下:Fe2+ + H2O2→ Fe3+ + HO• +OH-Fe2+ + HO•→ Fe3+ + HO• +OH-H2O2+ HO•→ HOO•+H2OFe2+ + HOO•→ Fe3+ + HOO-Fe3+ + HOO•→ Fe2+ + H+ + O2有高铁离子存在时,则可被还原成亚铁离子:Fe3+ + HOO-→ Fe2+ + HOO•铜和其他的重金属离子也能发生类似的反应。
2、双氧水的氧化漂白机理关于双氧水漂白过程中起作用的物质究竟是什么,有如下几种说法。
(1)最早的说法认为是双氧水分解产生的初生态氧:H2O2→ H2O +(O)现在确认(O)特别在强碱、高温下能氧化纤维素造成织物损伤,但对漂白有多大作用并无确凿证据。
过氧化氢的性质及漂白原理

过氧化氢的性质及漂白原理过氧化氢是一种化学物质,化学式为H2O2、它是一种无色液体,具有特殊气味,可以溶于水。
过氧化氢是一种非常强力的氧化剂,具有许多重要的性质和应用。
首先,过氧化氢是一种强氧化剂。
它高度易于分解,释放出氧气并释放活性自由基,这些自由基会与其他物质发生反应。
因此,过氧化氢可以用作消毒剂和漂白剂。
在漂白过程中,过氧化氢的氧化能力可以去除物质表面的颜色,使其变得洁白。
其次,过氧化氢是一种储氧剂。
在一些特殊的场合,需要在没有氧气的环境下进行反应。
过氧化氢可以在这些情况下作为一种可供替代的氧供体。
当过氧化氢分解时,会释放出氧气,从而维持反应的进行。
再次,过氧化氢具有较强的杀菌能力。
它能够破坏细胞的膜结构,破坏细胞内的代谢功能,从而杀死微生物。
这种杀菌作用使过氧化氢广泛用于医疗、卫生和消毒领域。
此外,过氧化氢还具有一定的漂白能力。
在一些有机染料上,过氧化氢可以氧化这些染料,使其变成无色物质,从而达到漂白的效果。
这是因为过氧化氢可以在染料分子中引入氧原子,改变其电子结构,进而改变其颜色。
那么,过氧化氢漂白的原理是怎样的呢?过氧化氢漂白原理主要涉及到两个方面:氧化和降解。
首先,过氧化氢漂白是通过氧化染料颜色分子来实现的。
过氧化氢的氧化能力使其能够引入氧原子到染料分子中,改变其电子结构,从而改变其颜色。
染料颜色分子中的双键或芳香环会被过氧化氢氧化,产生一种新的化合物,这种化合物不再具有原始染料的吸光性,从而实现了漂白。
其次,过氧化氢漂白还涉及到染料降解的过程。
过氧化氢在分解时会产生活性自由基,这些自由基可以攻击染料分子中的结构,将其分解成小分子化合物,从而达到去除颜色的效果。
总结起来,过氧化氢是一种强氧化剂,具有漂白、杀菌、储氧等性质。
过氧化氢漂白是通过其氧化和降解的作用实现的。
通过氧化能力,过氧化氢可以引入氧原子到染料颜色分子中,改变其电子结构,从而改变颜色。
同时,过氧化氢的分解产生活性自由基,可以攻击染料分子中的结构,将其分解为更小的分子,从而去除颜色。
次氯酸钠与双氧水溶液的性质及漂白原理

次氯酸钠与双氧水溶液的性质及漂白原理次氯酸钠与双氧水溶液的性质及漂白原理?答:次氯酸钠与双氧水溶液的性质及漂白原理如下:(1)氯水、NaClO(次氯酸钠)的漂白性:干燥的氯气不能使红布条褪色,而能使湿润的红布条褪色,证明起漂白作用的不是Cl2,而是HClO。
氯气也能使品红溶液褪色,但加热不能复原,其实质为氧化还原反应。
NaClO(次氯酸钠)在水中极易发生水解,或与CO2反应生成HClO,从而表现出漂白性:。
利用它们的强氧化性,HClO常用作自来水消毒,水反应生成HClO而呈漂白性,常用于衣服、织物的漂白。
(2)H2O2(双氧水)、Na2O2的漂白性:过氧化氢在常温下能自动分解:2H2O2(双氧水)=2H2O+O2↑,因此它是一种强氧化剂,纺织工业常用它作漂白剂,就是利用它的氧化性。
Na2O2是一种淡黄色晶体,与水或者稀酸作用时,生成过氧化氢,并猛烈放热。
生成的H2O2(双氧水)在受热情况下立即分解放出氧气,表现出强氧化性:2Na2O2+2H2O=4NaOH+O2↑。
因此,Na2O2是一种重要的工业漂白剂。
(3)SO2的漂白性在品红溶液中通入SO2,溶液褪色。
加热,溶液又变为红色。
SO2漂白性的实质,是SO2与水反应生成的H2SO3跟有机色素结合成了不稳定的无色化合物,该化合物见光、遇热或长久放置又能恢复为原来的颜色。
用二氧化硫漂白过的草帽日久又渐渐变成黄色,就是这个缘故。
SO2漂白原理属于非氧化—还原反应。
次氯酸钠和过氧化氢的漂白原理相同,都是氧化性,过程不可逆。
SO2漂白原理是跟有机色素结合成了不稳定的无色化合物。
过程可逆,两者不同。
双氧水原理

双氧水原理
双氧水,化学名为过氧化氢,是一种常见的氧化剂和消毒剂。
它的分子式为
H2O2,结构上可以看作是水分子(H2O)中的一个氧原子被另一个氧原子替代而成的。
双氧水在化学和生物领域都有着广泛的应用,其原理也是备受关注的话题。
首先,我们来看看双氧水的化学结构。
双氧水是一种不稳定的化合物,因为氧原子之间的键结构较为松散,容易发生分解反应。
当双氧水暴露在光线、高温或金属离子等条件下时,就会发生分解反应,分解成水和氧气。
这也是为什么双氧水在储存和使用时需要避免光照和高温的原因。
双氧水的化学性质使其成为一种优秀的氧化剂。
在许多化学反应中,双氧水可以将其他物质氧化成较高价态的化合物。
这是因为双氧水本身含有较高的氧化性,能够释放氧气分子,与其他物质发生氧化反应。
这也是双氧水被广泛用作漂白剂和消毒剂的原因之一。
另外,双氧水还具有杀菌消毒的作用。
在生物体内,双氧水可以通过氧化细胞膜上的脂质和蛋白质,破坏细胞结构,从而杀死细菌、病毒和真菌等微生物。
这也是为什么双氧水被广泛用于医疗和卫生领域的原因。
除此之外,双氧水还可以用来处理水质。
它可以氧化水中的有机物和重金属离子,从而净化水质。
在工业生产中,双氧水也常用于废水处理和环境保护。
总的来说,双氧水作为一种重要的化学品,在化学、生物、医疗和环保领域都有着广泛的应用。
它的化学结构和性质使其成为一种重要的氧化剂和消毒剂,对人类社会的发展起着重要的作用。
因此,我们需要深入了解双氧水的原理,合理使用和储存双氧水,以充分发挥其作用,同时避免潜在的危险。
双氧水的漂白原理及其稳定剂的进展

双氧水的漂白原理及其稳定剂的进展摘要:本文主要介绍了双氧水漂白的原理以及稳定剂的进展。
双氧水是一种常见的漂白剂,在很多领域都有广泛的应用。
通过对双氧水的化学性质、漂白机理以及稳定剂的研究进展的综述,可以更好地理解双氧水在漂白过程中的应用和优势,为相关领域的研究和应用提供参考。
关键词:双氧水;漂白;稳定剂;化学性质;漂白机理双氧水,化学式为H2O2,是一种无色、无臭并具有强氧化性的液体。
它在自然界中广泛存在于空气、地球表面和生物体内。
双氧水以其独特的化学性质,在医学、工业、家居等领域发挥着重要的作用。
其中,双氧水的漂白作用是其最常见的应用之一。
一、双氧水的漂白原理双氧水(H2O2),是一种无色的液体。
它的分子结构类似于水(H2O),但多了一个氧原子。
漂白,指的是将物体表面的颜色去除或淡化的过程。
在这个过程中,漂白剂能够破坏杂质的分子结构,使其失去颜色。
而双氧水正是通过其强大的氧化能力,实现了漂白的效果[1]。
双氧水分子中的额外氧原子具有一种不稳定的性质。
在化学反应中,它很容易释放出这个氧原子,从而与其他物质发生反应。
当双氧水与某些物质接触时,其中的氧原子会与物质中的分子结构发生反应。
在这个反应过程中,氧原子会抽取物质中的电子,使其发生氧化。
这种氧化反应,可以破坏物质分子中的双键或共轭体系,从而改变了物质的化学结构,使其失去颜色。
以衣物漂白为例,双氧水可以有效地去除衣物上的污渍和色素。
当双氧水与染料分子接触时,其中的氧原子会与染料分子中的双键或共轭体系发生反应,破坏了染料的分子结构。
在这个过程中,染料分子上的双键会断裂,共轭体系会解离,使染料的颜色消失。
双氧水的漂白效果不仅仅局限于衣物,它还可以用于漂白纸张、木材、食品等。
在这些应用中,双氧水同样能够通过氧化作用,去除物体表面的杂质和色素,使其焕然一新。
当然,双氧水的漂白原理并不仅限于氧化作用。
在某些情况下,它还可以通过还原作用实现漂白效果。
例如,当双氧水与含有还原性物质的漂白剂混合时,它可以发挥还原剂的作用,降低某些物质分子的氧化状态,从而消除颜色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2、工艺条件 • • • • • • •
2)非硅稳定剂 无机磷酸盐 无机磷酸盐 非硅稳定剂 有机多元膦酸盐 其它有机化合物 注意事项: ① 生物可降解性; ② 毒性; ③ 水体富营养化;
三、H2O2漂白工艺
• 1、工艺流程 、 • 目前H2O2漂白大多采用平幅连续汽蒸漂白 工艺,其流程为: • 浸轧漂液 → 汽蒸 → 水洗
二、H2O2漂白工艺条件分析
• 1、pH值 、 值 • 漂白条件:H2O2浓度: 3克/升 • 温度:850C 、浸漂 时间:60分钟
2、温度 、
• H2O2漂白时,温度控制在:90-100℃。
• • • •
3、H2O2浓度 、 一般控制在3克/升左右。 4、时间 、 一般控制在60-90分钟左右。
5、稳定剂的作用 、
H2O2漂白时,为了有效地控制H2O2的分解速率,漂液中必须 要加入稳定剂。
• (1)硅酸钠 • 稳定原理:可能是漂液中的硅酸钠胶体, 能吸附对H2O2分解具有催化作用的金属离 子所致。 • 缺陷:如硅垢形成沉积在设备上后难以洗 除,会使织物手感发硬,同时还会造成染 色等疵病。
特别需要注意事项:
H2O2的分解能因催化作用而加速,如Cu、Fe、Mn、Ni等金属子以及有棱角的固 体、容器器壁等都会加速H2O2的分解。某些金属对H2O2的分解速率影响如所示:
• 2、H2O2漂白原理 、 • H2O2漂白时,通常认为HO2-离子是漂白 的主要成分,破坏了色素的共轭双键,达 到消色漂白的目的。 • 值得注意的是:H2O2在漂白过程中除了对 天然色素有破坏作用外,同时也会使纤维 素氧化而受损,因此在漂白过程中要有效 地控制双氧水的分解速率,通常在漂液中 要加入一定量的稳定剂如硅酸钠等。
• 1、H2O2溶液的性质 、 • H2O2为无色透明水溶液,工业用H2O2浓度 一般为30-35%,也有高达90%的,但容 易引起爆炸。H2O2在弱酸性条件下比较稳 定,在碱性条件下极易分解;在放置过程 中会逐渐分解放出氧气: • H2O2 → H2O + 1/2 O2
H2O2是一种弱的二元酸,在水溶液 中可按下式电离:
过氧化氢的性质及漂白原理
组长:阮杨锋 组员:金熠 干敏毅 赵斌 张佳伟 设计者;金熠 第7组
一、漂白的目的 漂白的目的是去除天然色素, 赋予棉布以必要的白度,同时棉布 上残留的其它杂质也可以进一步被 去除,使棉布的润湿性能有所提高。
• H2O2漂白的特点: • 1、是一种较温和的氧化性漂白剂,且 漂白产品白度稳定; • 2、是一种对环境友好的漂白剂,对人 体及环境无污染; • 3、可用于棉、蛋白质纤维、合成纤维 等的漂白,其适用面宽; • 因此,目前织物的漂白以H2O2漂白工艺 为主。
