2021高考化学压轴精选专项卷(一)
2021年高考化学压轴卷(江苏卷)(解析版)

2021年高考压轴卷(江苏卷)化学一、单项选择题:共13题,每题3分,共39分.每题只有一个选项最符合题意.1.下列说法不正确...的是()A.二氧化硫可以抑制酒中细菌生长,可在葡萄酒中微量添加B.碳酸钡可用于医疗上作检查肠胃的内服药剂,即“钡餐”C.高纯度的二氧化硅广泛用于制作光导纤维,其遇强碱会反应D.纯碱在造纸、玻璃、食品等工业中有着重要的应用【答案】B【解析】A.二氧化硫可以抑制葡萄酒中的细菌生长,利用二氧化硫的还原性还可以作抗氧化剂,A正确;B. 硫酸钡可用于医疗上作检查肠胃的内服药剂,即“钡餐”,原因为硫酸钡不溶于胃酸,B错误;C. 二氧化硅为制作光导纤维的原材料,其为酸性氧化物遇强碱会反应,C正确;D.纯碱为碳酸钠,纯碱在造纸中的制浆流程、玻璃的成分及食品的制作中应用,D正确;答案为B2.反应PH3 + HCl + 4HCHO = [P(CH2OH)4]Cl的产物常被用作棉织物的防火剂。
下列表示反应中相关微粒的化学用语正确的是()Cl B.HCHO结构式:H-C-O-HA.中子数为20的氯原子:3720C.O2-的结构示意图:D.PH3的电子式:【答案】D【解析】A.中子数为20的氯原子的质量数为20+17=37,原子符号左下角为质子数,左上角为质量数,Cl,故A错误;所以符号为3717B.HCHO中含碳氧双键,结构式为,故B错误;C.O元素为8号元素,O原子得到两个电子形成氧离子,结构示意图为,故C错误;D.PH3中P原子和每个H原子共用一对电子,还含有一对孤电子对,电子式为,故D正确;故答案为D。
3.三氯化氮(NCl3)易与水反应:2NCl3+3H2O=3HCl+N2↑+3HClO。
若N A代表阿伏加德罗常数的值。
下列说法正确的是()A.0.1 mol NCl3中质子数为6.5N AB.每生成36.5 g HCl转移电子数为2N AC.标准状况下,2.24 LN2中含σ键数为0.2N AD.100 mL1 mol/LHClO溶液中阴、阳离子总数为0.2N A【答案】B【解析】A.NCl3分子中含有的质子数是58,则0.1 mol NCl3中含有的质子数为5.8N A,A错误;B.在反应2NCl3+3H2O=3HCl+N2↑+3HClO中,每反应产生3 mol HCl,转移6 mol电子,反应生成36.5 g HCl的物质的量是1 mol,则转移电子数为2N A,B正确;C.N2中2个N原子形成共价三键,其中1个σ键,2个π键,标准状况下,2.24 LN2的物质的量是0.1 mol,因此其中含σ键数为0.1N A,C错误;D.100 mL1 mol/LHClO中含有溶质的物质的量是n(HClO)=1 mol/L×0.1 L=0.1 mol,由于HClO是一元弱酸,主要以电解质分子存在,因此该溶液中离子数目远小于0.2N A,D错误;故答案为B。
2021届高考化学压轴题精选专项卷(一)含答案与解析
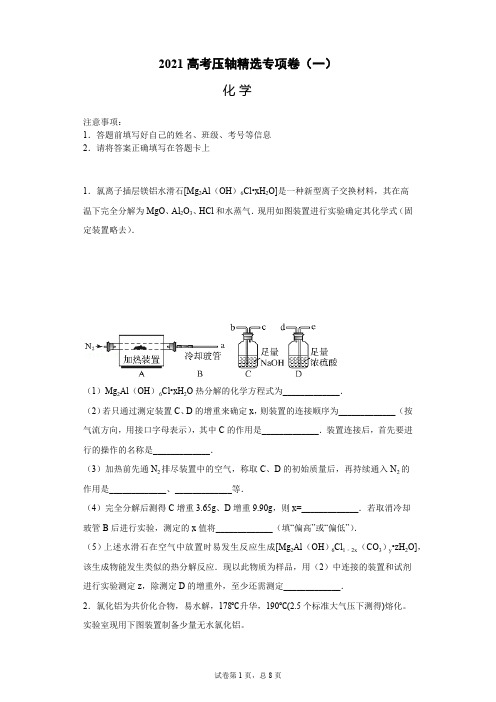
2021高考压轴精选专项卷(一)注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上1.氯离子插层镁铝水滑石[Mg 2Al (OH )6Cl•xH 2O]是一种新型离子交换材料,其在高温下完全分解为MgO 、Al 2O 3、HCl 和水蒸气.现用如图装置进行实验确定其化学式(固定装置略去).(1)Mg 2Al (OH )6Cl•xH 2O 热分解的化学方程式为_____________.(2)若只通过测定装置C 、D 的增重来确定x ,则装置的连接顺序为_____________(按气流方向,用接口字母表示),其中C 的作用是_____________.装置连接后,首先要进行的操作的名称是_____________.(3)加热前先通N 2排尽装置中的空气,称取C 、D 的初始质量后,再持续通入N 2的作用是_____________、_____________等.(4)完全分解后测得C 增重3.65g 、D 增重9.90g ,则x=_____________.若取消冷却玻管B 后进行实验,测定的x 值将_____________(填“偏高”或“偏低”).(5)上述水滑石在空气中放置时易发生反应生成[Mg 2Al (OH )6Cl 1﹣2x (CO 3)y •zH 2O],该生成物能发生类似的热分解反应.现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z ,除测定D 的增重外,至少还需测定_____________.2.氯化铝为共价化合物,易水解,178℃升华,190℃(2.5个标准大气压下测得)熔化。
实验室现用下图装置制备少量无水氯化铝。
化 学化 学请回答下列问题:(1)装置A为氯气发生装置,化学反应方程式为_________________________________。
若用足量MnO2与50mL12mol/L的盐酸充分反应,则所得氯气可制取无水AlCl3的质量应_________13.35g(填“大于”、“等于”或“小于”)。
2021届河北省高考压轴卷 化学(解析版)

2021河北省高考压轴卷化学可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Fe-56 Cu-64 Zn-65一、选择题(本题包括10小题,每小题2分,共20分。
每小题只有一个选项符合题意)1.古诗词、谚语等都是我国传统文化的瑰宝。
下列有关解读错误的是A.A B.B C.C D.D2.随着科学的发展,学科间的交叉和综合越来越多,学科之间的界限越来越不明显,“边缘科学”即代表了一个新名词,说明了学科间的相互联系。
但目前的科学研究,学科间的分工依然存在,各自的研究领域仍有所不同。
下列变化不属于化学研究范畴的是()A.COVID-19(新冠肺炎)病毒疫苗的研制B.近期出现雾霾的原因探究C.朝鲜的原子弹爆炸实验D.湖南华菱钢铁集团冶炼特种钢3.下列化学用语表示正确的是A.羟基的电子式:B.钠离子的结构示意图:C.氯仿分子的球棍模型:D.对硝基甲苯的结构简式:4.用N A表示阿伏加德罗常数的值。
下列说法正确的是A .1molNaHSO 4晶体中阴阳离子总数目为2N AB .1molSiO 2中含有Si —O 极性共价键的数目为2N AC .78g 苯与足量H 2发生加成反应时破坏π键数目为3N AD .16gCH 4与足量氯气在光照下反应生成CH 3Cl 分子数目为N A5.利用Cu ZSM 5--分子筛催化剂,3NH 可脱除燃煤烟气中的NO 和2NO ,生成两种无毒物质,其反应历程如图所示,下列说法正确的是A .上述总反应为:32222NH NO NO 2N 3H O ++=+B .X 是HNO 3、Y 是2NC .阶段②④中都是氧化还原反应D .3NH 、4NH +中的化学键形成方式完全相同6.茚地那韦被用于新型冠状病毒肺炎的治疗,其结构简式如图所示,下列说法正确的是A .茚地那韦分子中含有羟基和酮羰基B .lmol 茚地那韦最多与llmol 氢气发生加成反应C .虚线框内的所有碳、氧原子可能处于同一平面D .茚地那韦可以使酸性高锰酸钾溶液褪色,不与FeCl 3溶液显色7.绿原酸具有抗病毒、降血压、延缓衰老等保健作用。
2021年高考化学之精选真题模拟练习卷(一)含答案解析

2021年高考化学精选真题重组卷01注意事项:1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其它答案标号。
回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 P 31 S 32 Cl 35.5 Fe 56一、选择题:本题共14个小题,每小题3分。
共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.【2020浙江】下列说法不正确...的是( )A.天然气是不可再生能源B.用水煤气可合成液态碳氢化合物和含氧有机物C.煤的液化属于物理变化D.火棉是含氮量高的硝化纤维【答案】C【解析】A.天然气是由远古时代的动植物遗体经过漫长的时间变化而形成的,储量有限,是不可再生能源,正确;B.水煤气为CO和H2,在催化剂的作用下,可以合成液态碳氢化合物和含氧有机物(如甲醇),正确;C.煤的液化是把煤转化为液体燃料,属于化学变化,错误;D.火棉是名为纤维素硝酸酯,是一种含氮量较高的硝化纤维,正确;答案选C。
2.[2019新课标Ⅱ] 已知N A是阿伏加德罗常数的值,下列说法错误的是A.3 g 3He含有的中子数为1N AB.1 L 0.1 mol·L−1磷酸钠溶液含有的34PO-数目为0.1N AC.1 mol K2Cr2O7被还原为Cr3+转移的电子数为6N AD.48 g正丁烷和10 g异丁烷的混合物中共价键数目为13N A【答案】B【解析】A.3He的中子数为3-2=1,则3g3He的中子数为3g3g/mol AN⨯=N A,正确;B.磷酸钠为强碱弱酸盐,磷酸根离子在水溶液中会发生水解,则1L 0.1mol/L的磷酸钠溶液中磷酸根离子的个数小于1L×0.1mol/L×N A mol -1 =0.1N A ,错误;C .重铬酸钾被还原为铬离子时,铬元素从+6降低到+3,1mol 重铬酸钾转移的电子数为3mol×2×N A mol -1 =6N A ,正确;D .正丁烷与异丁烷的分子式相同,1个分子内所含共价键数目均为13个,则48g 正丁烷与10g 异丁烷所得的混合物中共价键数目为48g+10g 58g/mol×13×N A mol -1 =13N A ,正确;答案选B 。
2021年高考化学压轴题汇总及答案解析

2021年高考化学压轴题汇总及答案解析1.亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。
某学习小组针对亚硝酸钠设计了如下实验:【实验Ⅰ】制备NaNO2制备装置如图所示(夹持装置略去):(1)装置D可将剩余的NO氧化成NO-3,发生反应的离子方程式为____________。
(2)如果没有B装置,C中发生的副反应有_____________、____________。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。
于是进行了适当的改进,改进后提高了NaNO2的纯度,则其改进措施是________________________________。
【实验Ⅱ】测定制取的样品中NaNO2的含量步骤:试管编号①②③④⑤b.称量0.10 g制得的样品,溶于水配成500 mL溶液。
取5 mL待测液,加入1 mL M溶液,再加蒸馏水至10 mL并振荡,与标准色阶比较。
(4)步骤b中比较结果是:待测液颜色与③标准色阶相同,则甲同学制得的样品中NaNO2的质量分数是________。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。
设计并完成下列实验报告。
答案(1)5NO+3MnO-4+4H+===5NO-3+3Mn2++2H2O(2)2Na2O2+2H2O===4NaOH+O2↑2NO+O2===2NO22NO2+Na2O2===2NaNO3(3)在A、B之间增加装有水的洗气瓶(4)40%(5)维生素C 加入蒸馏水至总体积为10 mL 紫红色比③标准色阶浅解析(1)酸性KMnO4溶液具有强氧化性,能将NO氧化为NO-3,反应的离子方程式为5NO+3MnO-4+4H+===5NO-3+3Mn2++2H2O。
(2)铜和稀硝酸反应制得的NO中含有杂质水蒸气。
(3)制得的NaNO2中混有较多的NaNO3杂质,说明制得的NO中混有NO2,故应在装置A、B之间增加装有水的洗气瓶,以除去杂质NO2。
2021届全国卷Ⅰ高考压轴卷 理综化学(解析版)

2021新课标Ⅰ高考压轴卷化学注意事项:1.本试卷分选择题和非选择题两部分。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在本试卷上无效。
3.回答非选择题时,将答案写在答题卡上。
写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Ge:73 Ba:137一、选择题:本题共7小题,每小题6分,共42分。
每小题只有一个选项符合题意。
1.三星堆遗址被誉为20世纪人类最伟大的考古发现之一。
下列叙述错误的是A.A B.B C.C D.D2.茚地那韦被用于新型冠状病毒肺炎的治疗,其结构简式如图所示,下列说法正确的是A.茚地那韦分子中含有羟基和酮羰基B.lmol茚地那韦最多与llmol氢气发生加成反应C.虚线框内的所有碳、氧原子可能处于同一平面D.茚地那韦可以使酸性高锰酸钾溶液褪色,不与FeCl3溶液显色3.下列实验能达到目的的是A .AB .BC .CD .D4.科研工作者研究出一种新型的醇催化氧化途径,可以避免生成有毒物质,其部分反应机理如图所示.下列说法错误的是A .避免生成有毒物质符合绿色化学的理念B .在该反应中作催化剂C .反应过程中N 和S 元素的成键数目均保持不变D .总反应方程式为→++HCl5.一种矿石()2252Z X Y W Y ⋅的组成元素W 、X 、Y 、Z 为原子序数依次增大的短周期元素,Z 单质燃烧发出耀眼的白光,X 原子L 层比K 层多一个电子,2W Y 分子中含有10个电子。
下列说法正确的是 A .原子半径:Z Y X W >>> B .常温常压下单质沸点:W Y X >> C .Z 与Y 可形成共价化合物ZY D .X 的最高价氧化物的水化物是弱酸 6.环己酮()在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。
2021届高考押题样卷新高考版-化学(含答案解析)

绝密 ★ 启用前2021年普通高等学校招生全国统一考试 化 学注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5 Cu 64一、选择题:本题共14小题,每小题3分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.中华优秀传统文化博大精深、源远流长,王翰《凉州词》中写道“葡萄美酒夜光杯,欲饮琵琶马上催···”。
夜光杯的主要成分为3MgO·4SiO 2·H 2O ,古代制作琵琶的主要原料为木料或竹料、丝线等,下列说法错误的是A .由蚕丝搓纺而成的丝线的主要成分为蛋白质B .葡萄酒中通常含有微量SO 2,SO 2既可以杀菌又能防止营养成分被氧化C .夜光杯属硅酸盐产品,难溶于水,不耐酸碱侵蚀D .制作琵琶的竹料放入饱和Na 2SiO 3溶液中充分浸透后沥干可起到防火的作用【答案】C【解析】A .蚕丝主要成分是蛋白质,因此由蚕丝搓纺而成的丝线的主要成分也是蛋白质,故A 正确;B .二氧化硫能杀菌,还有较强的还原性,添加在葡萄酒中既能杀菌又能防止葡萄酒被氧化,故B 正确;C .夜光杯的主要成分为3MgO·4SiO 2·H 2O ,属硅酸盐产品,不溶于水,具有耐酸碱侵蚀、抗氧化等优点,故C 错误;D .Na 2SiO 3具有防火的作用,因此制作琵琶的竹料放入饱和Na 2SiO 3溶液中充分浸透后沥干可起到防火的作用,故D 正确。
综上所述,答案为B 。
(新高考)2021年最新高考冲刺压轴卷 化学(含答案解析)

(新高考)2021年最新高考冲刺压轴卷化学注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
答题前,考生务必将自己的姓名、考生号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在试卷上无效。
3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。
4.考试结束,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 S 32 Cl 35.5Cu 64Ge 73一、单选题(共10小题,每小题2分)1.苏颂《本草图经》有关不灰木(火浣布)有如下描述:“不灰木,出上党,今泽、潞山中皆有之,盖石类也。
其色青白如烂木,烧之不燃,以此得名。
或云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有”。
“不灰木”成分可能是A.纤维素B.硅酸盐C.氧化铁D.动物毛皮【答案】B【解析】不灰木,盖石类也,云滑石之根也,出滑石[Mg3(Si4O10)(OH)2]处皆有,则与滑石同类,都属于硅酸盐,故选B。
2.下列化学用语中,正确的是A.H2O2的电子式:B.海水中Br-的电子式为:C.海水中通入氯气时发生反应的离子方程式为:2NaBr+Cl2=Br2+2NaClD.Ca2+的结构示意图:【答案】B【解析】A.H2O2是共价化合物,电子式的书写不需要标方框和电荷符号,正确的是,A 项错误;B .溴原子最外层有7个电子,能得一个电子形成溴离子,电子式为,故B 正确;C .海水中通入氯气时发生反应的离子方程式为:2Br −+Cl 2=Br 2+2Cl −,故C 错误;D .Ca 的原子序数为20,故D 错误;综上所述,答案为B 。
3.下列指定反应的离子方程式正确的是A .酸性K 2Cr 2O 7溶液与酒精反应:3CH 3CH 2OH+2Cr 2O 2−7+16H +=4Cr 3++3CH 3COOH+11H 2OB .向CuSO 4溶液中加入Ba(OH)2溶液:Ba 2++SO 2−4=BaSO 4↓C .用足量氨水吸收CO 2气体:2OH −+CO 2=CO 2−3+H 2OD .电解NaCl 溶液:2NaCl=====通电2Na+Cl 2↑【答案】A【解析】酸性K 2Cr 2O 7溶液与酒精反应,乙醇被氧化为乙酸:3CH 3CH 2OH+2Cr 2O 2−7+16H +=4Cr 3++3CH 3COOH+11H 2O ,A 正确;B.向CuSO 4溶液中加入Ba(OH)2溶液,生成氢氧化铜和硫酸钡两种沉淀:2OH −+Ba 2++Cu 2++SO 2−4=BaSO 4↓+Cu(OH)2↓,B 错误;C .一水合氨难电离,用足量氨水吸收CO 2气体:2NH 3·H 2O+CO 2=2NH +4+CO 2−3+H 2O ,C 错误;D .惰性电极电解NaCl 溶液生成氢氧化钠、氢气和氯气:2Cl −+2H 2O=====电解2OH −+H 2↑+Cl 2↑,D 错误;答案选A 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意事项:1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上1.氯离子插层镁铝水滑石[Mg 2Al (OH )6Cl•xH 2O]是一种新型离子交换材料,其在高温下完全分解为MgO 、Al 2O 3、HCl 和水蒸气.现用如图装置进行实验确定其化学式(固定装置略去).(1)Mg 2Al (OH )6Cl•xH 2O 热分解的化学方程式为_____________.(2)若只通过测定装置C 、D 的增重来确定x ,则装置的连接顺序为_____________(按气流方向,用接口字母表示),其中C 的作用是_____________.装置连接后,首先要进行的操作的名称是_____________.(3)加热前先通N 2排尽装置中的空气,称取C 、D 的初始质量后,再持续通入N 2的作用是_____________、_____________等.(4)完全分解后测得C 增重3.65g 、D 增重9.90g ,则x=_____________.若取消冷却玻管B 后进行实验,测定的x 值将_____________(填“偏高”或“偏低”).(5)上述水滑石在空气中放置时易发生反应生成[Mg 2Al (OH )6Cl 1﹣2x (CO 3)y •zH 2O],该生成物能发生类似的热分解反应.现以此物质为样品,用(2)中连接的装置和试剂进行实验测定z ,除测定D 的增重外,至少还需测定_____________.2.氯化铝为共价化合物,易水解,178℃升华,190℃(2.5个标准大气压下测得)熔化。
实验室现用下图装置制备少量无水氯化铝。
2021高考化学压轴精选专项卷(一)绝密★启用前请回答下列问题:(1)装置A为氯气发生装置,化学反应方程式为_________________________________。
若用足量MnO2与50mL12mol/L的盐酸充分反应,则所得氯气可制取无水AlCl3的质量应_________13.35g(填“大于”、“等于”或“小于”)。
(2)装置B中所盛试剂为_________________,其作用是__________________________。
(3)有人认为若无装置B,其余装置、试剂保持不变,也能制备无水AlCl3,事实证明这样做非常危险,请简述理由___________________________________________________________。
(4)仪器a的名称是__________________,装置C和F的作用是____________________。
(5)实验开始时应先点燃A处的酒精灯,待装置内充满黄绿色气体后,再点燃D处的酒精灯,理由是_______。
(6)氯化铝是共价化合物,请设计实验证明。
___________________。
3.为测定Na2CO3·10H2O、NaHCO3的混合物中NaHCO3的含量,设计如下实验:取一定质量的混合物,通过测量反应前后③装置质量的变化,测定该混合物中NaHCO3的质量分数。
完成下列问题:(1)U型管①②③盛装的均为固态物质,可选试剂依次为___________、___________、___________(选填编号)。
U型管③吸收的气体为___________。
a.碱石灰 b.无水氯化钙 c.无水硫酸铜(2)干燥管中无水硫酸铜的作用是___________。
实验装置最后的干燥管中碱石灰的作用___________。
(3)实验停止加热后,继续通入空气一段时间的原因是___________。
(4)再设计一种测定上述混合物中NaHCO3含量的方案,并注明需要测定的物理量___________。
4.高铁酸钾(K2FeO4)是一种绿色高效的水处理剂。
某实验小组用如图装置(夹持仪器已省略)制备KClO溶液,再与Fe(NO3)3溶液反应制备K2FeO4。
已知K2FeO4的部分性质:①可溶于水、微溶于浓KOH溶液、难溶于无水乙醇②在强碱性溶液中比较稳定③在Fe3+或Fe(OH)3催化作用下发生分解。
请回答:(1)装置B的作用是除去氯气中的HCl气体、降低氯气的溶解度和____。
(2)Fe(NO3)3溶液(Ⅰ)与含KOH的KClO溶液(Ⅱ)混合时,溶液Ⅰ、Ⅱ滴加的顺序是____。
(3)已知K2FeO4理论产率与合成条件相应曲面投影的关系如图(虚线上的数据表示K2FeO4理论产率),制备K2FeO4的最佳条件是____。
(4)制得的K2FeO4粗产品中含有Fe(OH)3、KCl等杂质。
①有关提纯过程的正确操作为(选出合理的操作并按序排列):将粗产品溶于冷的KOH 溶液→____→____→____→____→真空干燥箱中干燥。
A.过滤B.将滤液蒸发浓缩、冷却结晶C.用蒸馏水洗涤晶体2~3次D.往滤液中加入冷的饱和KOH溶液,静置E.用适量乙醇洗涤晶体2~3次②过滤时应选用的漏斗是____。
③洗涤时选择相应操作的原因是____。
5.某学习小组开展下列实验探究活动证明亚硫酸的酸性强于次氯酸:(1)图一装置A中反应的化学方程式为_____________________ 。
(2)如果利用图一装置A 中产生的气体去证明+4价硫具有氧化性,可将气体通入________ (填序号)来证明。
M .H 2S 溶液 N .Na 2S 溶液 O .NaOH 溶液 P .品红溶液(3)选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱:装置连接顺序为A 、C 、___________、__________、D 、F ,其中装置 C 的作用是_______,通过_________________现象即可证明亚硫酸的酸性强于次氯酸。
6.长期放置的 FeSO 4溶液易被氧化而变质,某兴趣小组进行了如下实验:(1)设计实验检验 FeSO 4溶液的变质程度实验方案实验现象实验结论步骤1取待检测液于试管中,向其中滴加 KSCN 溶液_____步骤2__________FeSO 4溶液部分变质①将上述方案补充完整②若要使部分变质的 FeSO 4复原,方法是_____。
(写离子反应方程式)(2)利用部分变质的 FeSO 4溶液制备 Fe 2O 3①请在( )内填写所需试剂或条件,在□内填写含铁物质的化学式____、____、___;(以离子形式存在的可写离子符号)。
②若100mL 该变质溶液制得1.6gFe 2O 3,则变质前FeSO 4溶液的浓度为_____。
(3)FeSO 4 可用作补铁剂,使用时建议与维生素C 同服,同学甲猜测维生素 C 可将Fe 3+转化为 Fe 2+,以利于人体吸收。
为了验证这一猜想,设计了如下实验:实验方案实验现象取适量Fe2(SO4)3溶液于试管中,加入维生素C 片,紫色褪去振荡溶解后,滴加酸性高锰酸钾溶液。
由上述实验能否得出“维生素C 可将Fe3+转化为Fe2+”的结论?请说明理由_____。
7.某化学兴趣小组设计装置,进行实验探究KMnO4与浓盐酸的反应。
[实验1]设计如图1所示装置,并验证氯气的漂白性。
(1)高锰酸钾与浓盐酸的反应中,浓盐酸表现出的性质是_________;若实验中产生2.24 L(标准状况)Cl2,设N A为阿伏加德罗常数的值,则转移的电子数为___________。
(2)利用装置C验证氯气是否具有漂白性,则装置中I、II、III处依次放入的物质可能是__________________。
[实验2]设计如图2所示装置,左侧烧杯中加入100 mL由2.00 mol·L-1 KMnO4和6 mol·L-1 H2SO4组成的混合溶液,右侧烧杯中加入100 mL 5.00 mol·L-1 BaCl2溶液,盐桥选择KNO3琼脂。
(3)若用98%的浓硫酸(密度为1.84 g·cm-3)配制500 mL 6 mol·L-1的稀硫酸时,除了需用到玻璃棒、烧杯、量筒之外,还必须用到的玻璃仪器为____________;下列操作会导致所配溶液浓度偏小的是____________(填字母)。
A.容量瓶内壁附有水珠却未干燥处理B.加水定容时俯视刻度线C.颠倒摇匀后发现凹液面低于刻度线又加水补足D.稀释过程中有少量液体溅出烧杯外(4)左侧烧杯中石墨电极上的电极反应式为________________________________;盐桥中的K+移向____________ (填“左”或“右”)侧烧杯的溶液中。
(5)实验发现,其他条件不变,改用10.0 mol·L-1 H2SO4时,生成氯气的速率比使用6 mol·L-1 H2SO4时快且产生的气体体积更大,其可能的原因是______________________________。
8.某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。
提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在_________中(填写仪器名称).(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关______、打开开关_________就可观察到氢氧化亚铁的颜色。
试分析实验开始时排尽装置中空气的理由____________。
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是_______________。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇),用如图所示的装置抽滤,与普通漏斗过滤相比,抽滤的优点是_____________________________。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是____。
A.用冷水洗B.先用冷水洗,后用无水乙醇洗C.用30%的乙醇溶液洗D.用90%的乙醇溶液洗②测定摩尔盐中铁的含量。
称取ag产品于锥形瓶中,溶解后加稀硫酸酸化,用c mol·L-1的酸性KMnO4溶液滴定至终点,滴定终点的现象是_______________。
到达终点消耗KMnO4的体积为VmL,则该晶体中铁的质量分数的表达式为_______________________(用字母a,c,V 表示)。
③实验室可用______( 填试剂名称)检验Fe2+存在,出现特征蓝色沉淀的离子方程式为_________________。
9.某化学兴趣小组对硫酸亚铁的一些性质进行探究。
回答下列问题:(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。
