江苏省2019届高三模拟考试(四)·化学
2021年高考化学总复习:过氧化钠性质的考查
2021年高考化学总复习:过氧化钠性质的考查1.[2019江苏] 下列有关化学反应的叙述正确的是A.Fe在稀硝酸中发生钝化B.MnO2和稀盐酸反应制取Cl2C.SO2与过量氨水反应生成(NH4)2SO3D.室温下Na与空气中O2反应制取Na2O2明确过氧化钠的生成条件,掌握过氧化钠的电子式、过氧化钠与水及二氧化碳反应的实质,反应中的氧化剂、还原剂及转移电子数目。
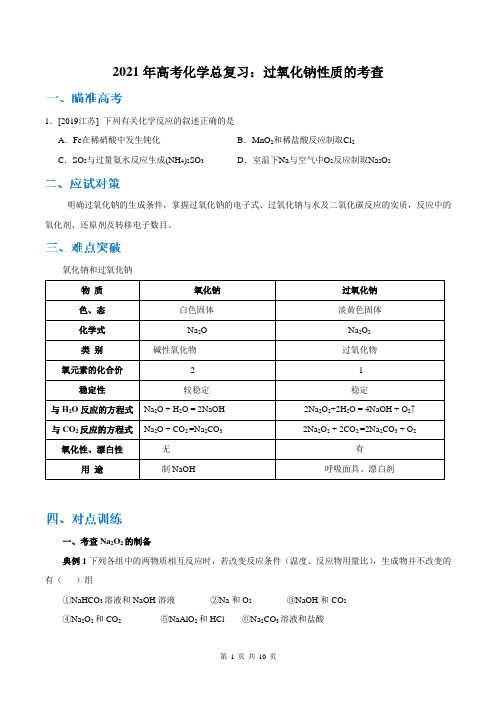
氧化钠和过氧化钠物质氧化钠过氧化钠色、态白色固体淡黄色固体化学式Na2O Na2O2类别碱性氧化物过氧化物氧元素的化合价-2 -1稳定性较稳定稳定与H2O反应的方程式Na2O + H2O = 2NaOH 2Na2O2+2H2O = 4NaOH + O2↑与CO2反应的方程式Na2O + CO2 =Na2CO32Na2O2 + 2CO2 =2Na2CO3 + O2氧化性、漂白性无有用途制NaOH 呼吸面具、漂白剂一、考查Na2O2的制备典例1下列各组中的两物质相互反应时,若改变反应条件(温度、反应物用量比),生成物并不改变的有()组①NaHCO3溶液和NaOH溶液②Na和O2③NaOH和CO2④Na2O2和CO2⑤NaAlO2和HCl ⑥Na2CO3溶液和盐酸A.1组B.2组C.3组D.4组二、考查Na2O2的结构典例2(广西钦州市2019届高三4月综合能力测试三模)下列关于钠及其化合物的说法正确的是A.过氧化钠的电子式:B.金属钠可用来除去苯中的少量水分C.常温下Na与O2反应生成Na2O,随温度升高生成Na2O的速率加快D.测Na2CO3和Na2SiO3溶液的pH,可确定碳和硅两元素的非金属性强弱三、Na2O2在阿伏加德罗常数中的考查典例3(2018届辽宁省重点高中协作校高三第三次模拟考试)设N A为阿伏加德罗常数的数值。
下列说法不正确的是A.23gCH3CH2OH与30gCH3COOH反应,生成CH3COOCH2CH3的分子数为0.5N AB.15.6g由Na2S和Na2O2组成的混合物中,含有的阴离子数目为0.2N AC.32.5g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.5N AD.过量MnO2与浓盐酸反应产生1molCl2,转移的电子数目为2N A四、Na2O2与CO2、H2O反应的考查典例4(湖南省长沙市长郡中学2019届高三上学期第五次调研考试)如图装置中,容器甲内充入0.1 mol NO气体。
高中化学:江苏省南京、盐城2023-2024学年度第一学期高三化学第一次模拟考试试题(含参考答案)

南京市、盐城市2024届高三年级第一次模拟考试化学试题可能用到的相对原子质量:H1C12N14O16S32Cl35.5一、单项选择题:共13题,每题3分,共39分.每题只有一个选项最符合题意.1.2023年9月23日,第19届中国亚运会开幕式主火炬首次使用零碳甲醇()3CH OH 作燃料.下列关于甲醇的说法不.正确的是( ) A .甲醇是电解质 B .甲醇属于可再生清洁能源 C .甲醇属于烃的衍生物 D .甲醇与乙醇互为同系物 2.工业合成尿素的反应原理为()23222CO 2NH CO NH H O ++高温高压催化剂.下列说法正确的是( )A .氧原子()8O 基态核外电子排布式为2241s 2s 2p B .3NH 的电子式为HH :H:H C .()22CO NH 中N 的化合价为3+ D .2H O 的空间构型为直线形3.实验室以3CaCO 为原料,制备2CO 并获得22CaCl 6H O ⋅晶体.下列图示装置和原理能达到实验目的是( )A .用装置甲制取2COB .用装置乙除去2CO 中的HClC .用装置丙干燥并收集2COD .用装置丁蒸干溶液获得22CaCl 6H O ⋅4.工业上可用NaClO 处理水体中的氨氮()34NH NH +、生成2N .下列说法正确的是( ) A .原子半径:r(O)r(Na)r(Cl)<< B .电负性:χ(Na)χ(N)χ(O)<< C .4NH Cl 属于分子晶体 D .第一电离能:111I (H)I (?N)I (O)<< 阅读下列资料,完成5~7题:氧元素是地球上存在最广泛的元素,也是与生命活动息息相关的主要元素,其单质及化合物在多方面具有重要应用.氧元素存在多种核素,游离态的氧主要有2O 、3O .工业上用分离液态空气、光催化分解水等方法制取2O .氢氧燃料电池是最早实用化的燃料电池,具有结构简单、能量转化效率高等优点;25℃和101kPa 下,2H 的燃烧热为1H 285.8kJ mol −∆=−⋅.氧能与大部分元素形成氧化物如222223234H O CO SO SiO Al O Cu O Fe O 、、、、、、等;过氧化物如2222Na O H O 、等可以作为优秀的氧化剂.5.下列说法正确的是( )A .161718O O O 、、互为同素异形体B .分子中键角大小:23SO SO >C .2CO 分子中σ键和π键数目比为2:1D .右图所示2Cu O 晶胞中有4个铜原子 6.下列化学反应表示正确的是( ) A .2H 燃烧的热化学方程式:12222H (g)O (g)2H O(g)H 285.8kJ mol −+∆=−⋅B .22Na O 吸收2222242SO :2Na O 2SO 2Na SO O ++C .Fe 和2H O(g)反应化学方程式:22322Fe 3H O(g)Fe O 3H ++高温D .碱性氢氧燃料电池正极反应:22O 4e 2H O 4OH −−++7.下列物质性质与用途具有对应关系的是( ) A .纳米34Fe O 能与酸反应,可用作磁性材料B .2SO 能与某些有色物质化合,可用于漂白纸张、草帽等C .23Al O 是两性氧化物,可用作耐火材料D .2SiO 是酸性氧化物,能用氢氟酸(HF)雕刻玻璃8.短周期主族元素X 、Y 、Z 、W 的原子序数依次增大,X 的一种核素没有中子,基态Y 原子的p 轨道为半充满,Z 单质是植物光合作用的产物之一,W 与Z 同族.下列说法正确的是( ) A .X 位于周期表中第二周期ⅣA 族B .共价键的极性:X Y X Z X W −<−<−C .简单气态氢化物的稳定性:W Y Z <<D .X 、Y 、Z 三种元素形成化合物的水溶液一定呈酸性 9.化合物Z 是抗肿瘤活性药物中间体,其合成路线如下:下列说法不.正确的是( ) A .X 中含有醛基和醚键 B .X 、Y 可用3FeCl 溶液或2%银氨溶液进行鉴别 C .Z 分子存在手性碳原子 D .该转化过程中包含加成、消去、取代反应类型10.利用铜-铈氧化物(2xCuO yCeO ,Ce −是活泼金属)催化氧化除去2H 中少量CO ,总反应为222CO(g)O (g)2CO (g)H +∆,反应机理如下图所示.下列说法正确的是( )A .该总反应的平衡常数()()22c CO K c(CO)c O =⋅ B .步骤(i )中有两种元素化合价发生变化C .步骤(i )、(iii )生成2CO 的机理相同D .步骤(iii )中存在共价键的断裂和共价键的生成11.室温下,探究130.1mol L NaHCO −⋅溶液的性质.下列实验方案能达到探究目的的是( ) 选项 探究目的实验方案A3HCO −是否发生电离 向132mL0.1mol L NaHCO −⋅溶液中加入一小块钠,观察溶液中是否有气泡产生B3HCO −是否发生水解 用干燥洁净玻璃棒蘸取130.1mol L NaHCO −⋅溶液,点在干燥的pH 试纸上,测出溶液的pHC溶液中是否存在Na +取一支洁净的铂丝,蘸取130.1mol L NaHCO −⋅溶液后在煤气灯上灼烧,透过蓝色钴玻璃观察火焰颜色D溶液中是否存在23CO − 向132mL0.1mol L NaHCO −⋅溶液中滴入几滴澄清石灰水,观察溶液是否变浑浊A .AB .BC .CD .D12.室温下,用含少量32Fe Mg ++、的粗4NiSO 溶液制备42NiSO 6H O ⋅晶体的流程如下图所示.已知()[]41111a sp 2sp 2K (HF) 6.310,K MgF 5.210,K Mg(OH) 1.310−−−=×=×=×.下列说法正确的是( )A .粗4NiSO 溶液中:()()()()232242c Ni 3c Fe 2c Mg 2c SO +++−++B .“沉铁”反应为:()32434623Fe Na 2SO 6OH NaFe SO (OH)++−−+++↓C .10.1mol L NaF −⋅溶液中:()()c OH c(HF)c H −++D .“沉镁”后的滤液中:()()c F 2c OH −−< 13.乙醇-水催化重整可获得2H .其主要反应为25222C H OH(g)3H O(g)2CO (g)6H (g)++1ΔH 173.3kJ mol −=⋅ 222CO (g)H (g)CO(g)H O(g)++ 1H 41.2kJ mol −∆=⋅ 2242CO (g)4H (g)CH (g)2H O(g)++ 1H 164.7kJ mol −∆=−⋅在密闭容器中,51.0110Pa ×、起始()()252n C H OH 1:3n H O =时,若仅考虑上述反应,平衡时242CO CO CH H 、、、的体积分数随温度的变化如题图所示.下列说法正确的是( )A .一定温度下,增大()()252n C H OH n H O 可提高乙醇平衡转化率B .反应242CO(g)3H (g)CH (g)H O(g)++的1ΔH 123.5kJ mol −=−⋅ C .研发高效催化剂可提高2H 的平衡产率 D .控制反应的最佳温度约为800℃二、非选择题:共4题,共61分.14.(15分)2532V O WO /TiO −催化剂可以催化3NH 脱除烟气中的NO . 反应为:132224NO(g)4NH (g)O (g)4N (g)6H O(g)H 1632.4kJ mol −+++∆=−⋅己知:①()3sp 43K NH VO 1.710−=×;②草酸()224H C O 能与含钒粒子形成易溶于水的配合物.(1)催化剂的制备.称取一定量的43NH VO 和24Na WO ,加入草酸溶液完全溶解.取一定量的2TiO 粉末浸渍于上述混合溶液中,在60℃水浴中搅拌、静置、过滤、焙烧、研磨后得到2532V O WO/TiO −催化剂.①焙烧时43NH VO 分解产生25V O 的化学方程式为______________. ②224H C O 的作用是______________.(2)催化剂的应用.将模拟烟气以一定流速通过装有2532V O WO /TiO −催化剂的反应管,反应相同时间,测得NO 的转化率随温度的变化如题图1所示.①反应温度高于350℃,NO 转化率下降的原因可能是______________. ②若烟气中含有2SO ,则会导致催化剂失活,原因可能是______________.图1 图2 (3)25V O 的回收.回收25V O 的过程可表示为:①酸浸时,投料完成后提高原料浸出率的措施有______________.②酸浸过程中,25V O 转化成2VO +,该反应的离子方程式为______________. ③水溶液中2VO +以()225VO H O +形式存在,如题图2所示给出了该离子部分结构,在答题卡的相应位置........补充完整该配离子的结构______________.15.(15分)匹唑派(G )是一种新型精神类药品,其合成路线之一如下:已知:Boc −结构简式为()33O ||CH C O C −——. 回答下列问题:(1)C 分子中采取3sp 杂化的碳原子数目是______________.(2)D E →过程中______________(填“能”或者“不能”)用KOH 替换23K CO .(3)E F →过程中还生成一种分子式为363C H O 的酯类产物,该产物的结构简式为______________. (4)C 的一种同分异构体同时满足下列条件,该同分异构体的结构简式为______________. ①分子中含有两个苯环和一个硝基;②分子中不同化学环境的氢原子个数比是1:2:2:1.(5)已知:写出以苯为原料制备的合成路线流程图(无机试剂和流程中的有机试剂任用,合成路线流程图示例见本题题干).16.(15分)实验室以菱锰矿(含3MnCO 及少量Fe Si 、的氧化物等)为原料制备高纯3MnCO 和34Mn O 的流程如下图所示.已知:室温下[]1313sp sp 22K (MnS) 2.610K Mn(OH) 2.010H S −−=×=×、、电离常数713a1a 2K 1.110K 1.310−−=×=×、.(1)该流程中可循环使用的物质有______________.(2)“沉铁”过程需加氨水调节溶液pH ,使溶液中3+Fe 转化为()3Fe OH 沉淀同时得到4MnSO 溶液.检验4MnSO 溶液中是否含有3+Fe 的实验方法是______________.(3)沉铁过程中也会产生少量2Mn(OH)沉淀.2Mn(OH)在工业上可用于去除溶液中HS −,反应为:22Mn(OH)HS MnS OH H O −−+++,其平衡常数K=______________.(4)制取3MnCO .在题图1所示的实验装置中,搅拌下使一定量的4MnSO 溶液与氨水43NH HCO −混合溶液充分反应.①滴液漏斗中添加的药品是______________. ②混合溶液中氨水的作用是______________.图1(5)制取34Mn O .固定其他条件不变,反应物物质的量浓度比值、温度、空气流量对4MnSO 溶液制取34Mn O 纯度的影响如题图2、题图3、题图4所示.图2 图3 图4补充完整制取纯净34Mn O 的实验方案:取150mL0.7mol L −⋅的4MnSO 溶液,______________,控制搅拌速率1500r min −⋅反应8h ,______________,110℃干燥2h ,得到纯净的34Mn O (须使用的试剂:11.4mol L NaOH −⋅溶液、121.0mol L BaCl −⋅溶液). 17.(16分)“碳中和”目标如期实现的关键技术之一是2CO 的再资源化利用. (1)氨的饱和食盐水捕获2CO 是其利用的方法之一,反应原理为:32234NaCl(aq)NH (g)CO (g)H O(l)NaHCO (s)NH Cl(aq)++++.该反应常温下能自发进行的原因是______________.(2)XO 基掺杂23Na CO 形成23XO Na CO −(X Mg Ca Cd =、、等),能用于捕获2CO ,原理如下图所示.已知阳离子电荷数越高、半径越小,阴离子越易受其影响而分解.①X=Ca 时,再生的化学方程式为______________. ②X=Mg 相比X=Ca ,其优点有______________.(3)催化电解吸收2CO 的KOH 溶液可将2CO 转化为有机物. ①3HCO −在阴极放电生成3CH COO −的电极反应式为______________.②碱性溶液有利于抑制阴极上副产物的产生,该副产物的化学式为______________. (4)在催化剂作用下,以2CO 和2H 为原料合成3CH OH ,主要反应为: 反应Ⅰ:122321CO (g)3H (g)CH OH(g)H O(g)H 49kJ mol −++∆=−⋅反应Ⅱ:12222CO (g)H (g)CO(g)H O(g)H 41kJ mol −++∆=+⋅保持压强3MPa ,将起始()()22n CO :n H 1:3=的混合气体匀速通过装有催化剂的反应管,测得出口处2CO 的转化率和甲醇的选择性()()32n CH OH 100%n CO×应生成反与温度的关系如题图1、题图2所示.图1 图2 ①随着温度的升高,2CO 转化率增大、但甲醇选择性降低的原因是______________. ②假设定义催化剂催化效率()()32n CH OH η100%n CO ×投入生成,计算340℃时三种催化剂的催化效率之比()()()232323ηIn O :ηMg /In O :ηMn /In O =______________(写出计算过程).南京市、盐城市2024届高三年级第一次模拟考试化学试题参考答案阅卷说明:1.本试卷中每个化学方程式、离子方程式2分,反应物、生成物书写均正确得1分,未配平、未注明或写错反应条件、未注明或写错符号等共扣1分2.本卷中所有合理答案均参照给分一、单项选择题:共13题,每题3分,共39分1.A 2.A 3.C 4.B 5.D 6.D 7.B 8.C 9.C 10.D 11.B 12.C13.D二、非选择题:共4题,共61分14.(15分)(1)①4325322NH VO V O 2NH H O +↑+焙烧 (2分)②与3VO −形成易溶于水的配合物,促进43NH VO 的溶解 (2分)(2)①催化剂活性下降,反应速率减慢;3NH 与2O 发生反应生成NO (2分)(答对一点得1分,答对两点得2分)②2SO 会被()25V O 催化氧化为33SO ,SO 与3NH 作用生成44NH HSO 或()442NH SO ,覆盖(沉积)在催化剂的表面,大大降低了催化剂和反应物的接触面积[或2SO 与3NH 作用生成43NH HSO 或()432NH SO ,最终被氧化为44NH HSO 或()442NH SO ,覆盖(沉积)在催化剂的表面,大大降低了催化剂和反应物的接触面积] (3分)(答对一点得1分,答对两点得3分)(3)①适当升温,适当加快搅拌速度,延长浸泡时间(写出一条即可) (2分) ②22225342V O SO 4H 2VO SO 2H O −++−++++ (2分)③(V 与2H O 中H 相连不得分;2H O 写成2O H 不得分)(2分)15.(15分)(1)3(2分) (2)不能(其他答案都不得分) (2分)(3)33O ||CH O H C OC ——或()32CO OCH (3分) (4)或 (3分)(5)(5分)16.(15分)(1)3NH 或氨水、()442NH SO (2分) (2)取少量4MnSO 溶液于试管中,向其中滴加KSCN 溶液{或[]46K Fe(CN)溶液},若溶液不变红(或没有蓝色沉淀),则溶液中无3Fe + (2分)(其他答案合理也给分)(3)10 (3分)(4)①(三颈烧瓶中盛有4MnSO 溶液)(缓慢滴加)氨水43NH HCO −混合溶液 (2分) ②调节溶液pH ,增大()23c CO −,使2Mn +尽可能沉淀完全 (2分)(5)边搅拌边向其中加入150mL1.4mol L NaOH −⋅溶液,并保持75℃水浴加热,同时以117L min −⋅的流量向溶液中通入空气 (2分)静置过滤,用水洗涤,取最后一次洗涤滤液,向其中滴加121.0mol L BaCl −⋅溶液,无沉淀生成 (2分)17.(16分)(1)反应ΔH 0< (2分)(2)①()232322Na Ca CO CaO Na CO CO ∆−+↑(或()232322Na Ca CO CaO Na CO CO ∆++↑)(2分) ②等质量的MgO 和CaO 相比,MgO 吸收的2CO 的量多;2Ca +和2Mg +电荷数相等、2Mg +半径小,再生时3MgCO 分解温度低,更节能 (3分)(3)①2333211HCO 8e CH COO 9CO 4H O −−−−+++ (2分) ②2H (2分)(4)①随着温度升高,反应Ⅰ和反应Ⅱ速率加快,消耗的2CO 增多.反应Ⅰ的H 0∆<,反应Ⅱ的ΔH 0>,随着温度升高,反应Ⅰ正向进行程度小,反应Ⅱ正向进行程度大,2CO 转化率升高、但3CH OH 选择性降低 (3分)②()()()232323ηIn O :ηMg /ln O :ηMn /ln O (12%15%):(10%20%):(5%30%)18:20:15=×××=(2分)。
江苏省扬州市2023-2024学年高三上学期期初模拟考试化学试题及答案
扬州市2024届高三上学期期初考试模拟试题化学学科可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16 Mg-24 S-32 Cl-35.5一、单项选择题:共13题,每题3分,共39分。
每题只有一个选项最符合题意。
原子结构示意图为的电子式为中既含有离子键又含有共价键.实验室制备和收集氨气时,下列装置能达到相应实验目的的是A.制备氨气B.干燥氨气C.收集氨气D.吸收尾气B.B C.C D.DGe—GaAs、ZnGeAs2和碳化硅都是重要的半导体化合物,下列说法错误的是.基态铬原子的价电子排布式为3d54s1Ge—GaAs中元素Ge、Ga、As中元素Zn、Ge、As的电负性由大到小的顺序为5.卤族元素单质及其化合物应用广泛。
具有与卤素单质相似的化学性质。
在常温下能与Cu 反应()2CN 2F 生成致密的氟化物薄膜,还能与熔融的反应生成硫酰氟()。
与浓硫酸反应可制得HF ,24Na SO 22SO F 2CaF 常温下,测得氟化氢的相对分子质量约为37.通入酸性溶液中可制得黄绿色气体,该气体常2SO 3KClO 2ClO 用作自来水消毒剂。
工业用制备的热化学方程式为2Cl 4TiCl ()()()()224TiO s 2Cl g 2C s TiCl g +++ƒ 。
下列说法不正确的是()2CO g 149kJ mol H -∆=-⋅A .是由极性键构成的极性分子B .、中心原子的杂化方式均为()2CN 3ClO -24SO -3sp C .常温下,氟化氢可能以分子的形式存在 ()2HF D .与熔融反应时一定有氧元素化合价升高2F 24Na SO 6.化学方程式是化学转化过程的符号语言描述,不仅表示物质的转化,有的还揭示转化的本质,有的还表示出物质转化过程中的能量变化,下列叙述正确的是A .碳酸氢铵溶液中滴加足量NaOH 溶液:2433232NH HCO 2OH NH H O CO H O +---++=⋅++B .一种绿色氧化剂,但遇到酸性高锰酸钾时,只能表现出还原性,其反应的方程式: 22H O22244244223H O 3H SO 2KMnO K SO 2Mn =SO 4O 6H O ++++↑+C .通入漂白粉溶液中产生白色浑浊:2SO 2223SO Ca 2ClO H O CaSO 2HClO +-+++=↓+D .的标准燃烧热是,其燃烧的热化学方程式可以表示为2H 1285.8kJ mol -⋅2222H (g)O (g)2H O(g)+=。
2021年高考化学总复习:盖斯定律的应用

2021年高考化学总复习:盖斯定律的应用1.[2019新课标Ⅲ节选]近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。
因此,将氯化氢转化为氯气的技术成为科学研究的热点。
回答下列问题:(2)Deacon直接氧化法可按下列催化过程进行:CuCl2(s)=CuCl(s)+12Cl2(g) ΔH1=83 kJ·mol− 1CuCl(s)+12O2(g)=CuO(s)+12Cl2(g) ΔH2=− 20 kJ·mol− 1CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=− 121 kJ·mol− 1则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol− 1。
2.[2017江苏]通过以下反应可获得新型能源二甲醚(CH3OCH3)。
下列说法不正确的是①C(s) + H2O(g)CO(g) + H2 (g) ΔH1 = a kJ·mol−1②CO(g) + H2O(g)CO2 (g) + H2 (g) ΔH 2 = b kJ·mol−1③CO2 (g) + 3H2 (g)CH3OH(g) + H2O(g) ΔH 3 = c kJ·mol−1④2CH3OH(g)CH3OCH3 (g) + H2O(g) ΔH 4 = d kJ·mol−1A.反应①、②为反应③提供原料气B.反应③也是CO2资源化利用的方法之一C.反应CH3OH(g)12CH3OCH3 (g) +12H2O(l)的ΔH =2dkJ·mol−1D.反应2CO(g) + 4H2 (g)CH3OCH3 (g) + H2O(g)的ΔH = ( 2b + 2c + d ) kJ·mol−16.[2017·11月浙江选考]根据Ca(OH)2/CaO 体系的能量循环图:下列说法正确的是A.ΔH5>0 B.ΔH1+ΔH2=0C.ΔH3=ΔH4+ΔH5D.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5=03.[2019新课标Ⅱ节选]环戊二烯()是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。
2020年高考化学一轮必刷好题专题25:氨气含答案

2020年高考化学一轮必刷好题专题25:氨气1.(2019江苏)下列有关化学反应的叙述正确的是A .Fe 在稀硝酸中发生钝化B .MnO 2和稀盐酸反应制取Cl 2C .SO 2与过量氨水反应生成(NH 4)2SO 3D .室温下Na 与空气中O 2反应制取Na 2O 2 【答案】C【解析】A .常温下,Fe 在与浓硝酸发生钝化反应,故A 错误;B .二氧化锰与浓盐酸在加热条件下反应制取氯气,故B 错误;C .二氧化硫与过量氨水反应生成硫酸铵,故C 正确;D .常温下,Na 与空气中的氧气反应生成Na 2O ;加热条件下,钠与氧气反应生成Na 2O 2,故D 错误。
2.(2019江苏)在给定条件下,下列选项所示的物质间转化均能实现的是A .Fe 2Cl −−−→点燃FeCl 2NaOH(aq)−−−−−→Fe(OH)2 B .S 2O −−−→点燃SO 3H O2−−−→H 2SO 4 C .CaCO 3−−−→高温CaO 2SiO −−−→高温CaSiO 3 D .NH 32O −−−−−→催化剂,△NO 2H O−−−→HNO 3 【答案】C【解析】A .铁与氯气反应只能生成氯化铁,A 错误;B .硫在空气或氧气中燃烧只能生成二氧化硫,B 错误;C .两步均能实现,C 正确;D .NO 不与H 2O 反应,D 错误。
锁定考点基础练习1.(北京市东城区2019届高三一摸)下列物质的应用中,利用了该物质氧化性的是A .氨——作制冷剂B .漂粉精——作游泳池消毒剂C .甘油——作护肤保湿剂D .明矾——我国古时用于除铜锈【答案】B【解析】A. 氨作制冷剂利用了易液化的性质,没有元素化合价发生变化,故A 不选;B.漂粉精中Cl 元素的化合价降低,作氧化剂,故选B;C.甘油作护肤保湿剂,利用吸水性,没有元素的化合价变化,故C 不选;D.铜锈的主要成分是碱式碳酸铜,明矾水解使溶液呈酸性, 用于除铜锈,没有元素的化合价变化,故D 不选。
【最新】江苏省南京市2019届高三学情调研(化学)Word版

南京市2019届高三学情调研卷本试卷分选择题和非选择题两部分。
共120分。
考试时间100分钟。
注意事项:答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。
选择题答案要求填涂在答题纸...上,非选择题的答案写在答题纸上对应题目的答案空格内,答案不写在试卷上。
考试结束后,交同答题纸。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P31 S 32 Ca 40 Cu 64选择题单项选择题:本题包括7小题,每小题2分,共计14分。
每小题只有一个....选项符合题意。
1.以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。
下列做法违背发展低碳经济的是()A.尽量用纯液态有机物代替水作溶剂B.限制塑料制品的使用C.提高原子利用率,发展绿色化学D.发展氢能和太阳能2.下列化学用语或命名正确的是()A.Cl-的结构示意图:B.NH4Cl的电子式:C.丙烯的实验式(最简式):CH2D.的名称:2-乙基丙烷3.下列离子方程式式书写正确的是()A.明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42++2Ba2++4OH-=2BaSO4↓+AlO2-+2H2OB.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-C.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-D.硝酸亚铁溶液和稀盐酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑4.下列有关说法错误的是()A.利用铝热反应可以冶炼熔点较高的金属B.用作“钡餐”的物质主要成分是硫酸钡C.常温下,可以用铁制容器来盛装冷的浓硫酸D.人造刚玉熔点很高,可用作高级耐火材料,其主要成分是二氧化硅5.设nA为阿伏加德罗常数的值,下列叙述正确的是()。
高三试卷化学-江苏省盐城市、南京市2024届高三下学期3月第一次模拟考试化学试卷及参考答案
南京市、盐城市2024届高三年级第一次模拟考试化学2024.03本试卷分选择题和非选择题两部分,共100分。
考试用时75分钟。
注意事项:答题前,考生务必将自己的学校、姓名写在答题卡上。
考试结束后,交回答题卡。
可能用到的相对原子质量:H1C12N14O16Na23Cu64Zn65一、单项选择题:共13题,每题3分,共39分。
每题只有一个选项最符合题意。
1.2024年1月,从邮轮首航到电动飞机首飞再到航天首发,我国一批科技创新实现新的突破。
下列说法不.正确的是()A .“天目一号”气象星座卫星的光伏发电系统工作时可将化学能转化为电能B .“快舟一号甲”运载火箭利用燃料与氧化剂反应放热并产生大量气体实现助推C .“爱达·魔都号”邮轮使用的镁铝合金具有密度低、抗腐蚀性强的特点D .“AG60E”电动飞机使用的动力型锂电池具有质量轻、比能量高的特点2.反应2242NaCl+2NH Cl+NaNO H O+N Δ↑可用于制备少量氮气。
下列说法正确的是()A .基态Cl 原子的电子排布式:253s 3pB .2H O 的VSEPR 模型:V 形C .4NH Cl 的电子式:- H H:N:H Cl H +⎡⎤⎢⎥⎢⎥⎣⎦D .固态2N 的晶体类型:分子晶体3.下列由废铁屑制取()()44222NH Fe SO 6H O ⋅的实验装置与操作能达到实验目的的是()A .用装置甲称取一定质量的()442NH SO 固体B .用装置乙除去废铁屑表面的油污C .用装置丙将废铁屑充分溶解D .用装置丁蒸干溶液得到()()44222NH Fe SO 6H O ⋅晶体4.十二烷基磺酸钠()12253C H SO Na 常用作轻纺工业的乳化剂。
下列说法正确的是()A .12253C H SO Na 为离子化合物B .离子半径:()()2-+r O <r Na C .电离能:()()()111I C <I N <I O D .热稳定性:22H O H S<阅读下列材料,完成57~题:碳元素在自然界分布很广。
江苏省四校(姜堰中学、前中、淮阴中学、溧阳中学)2019届高三下学期第二学期联考化学试题(原卷版)
高三化学试卷可能用到的相对原子质虽:H1 C12 N 14 0 16 Mg 24 Al27 S 32 K 39选择题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个选项符合题意。
1.2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”B. 我国发射“嫦娥三号”卫星所使用的碳纤维,是一种非金属材料C. 用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用D. 碳纳米管表面积大,可用作新型储氢材料2.下列有关化学用语表示正确的是A. 中子数力79、质子数为55的铯(CsB. 氮气分子的电子式:C. HOCH2COOH缩聚物的结构简式:D. 氯离子的结构示意图:3.下列有关物质性质与用途具有对应关系的是A. Si02熔点很高,可用于制造坩埚B. NaOH能与盐酸反应,可用作制胃酸中和剂C. Al(OH)3是两性氢氧化物,氢氧化铝胶体可用于净水D. HCHO可以使蛋白质变性,可用于人体皮肤伤口消毒4.室温下,下列各组离子在指定溶液中能大量共存的是( )A. 0.1mol·L -1KHSO 3溶液:Na +、NH 4+、H +、SO 42- B. 0.1mol·L -1H 2SO 4溶液:Mg 2+、K +、Cl -、NO 3- C. 0.1mol·L -1Na 2SO 3溶液:Ba 2+、K +、ClO -、OH - D. 0.1mol·L -1Ba (OH )2溶液:NH 4+、Na +、Cl -、HCO 3- 5.炼油厂的废碱液含有废油、苯酚钠、碳酸钠等,实验室通过以下两个步骤处理废碱液获取氢氧化钠固体。
下列说法正确的是A. 用装置甲制取CO 2并通入废碱液B. 用装置乙从下口放出分液后上层的有机相C. 用装置丙分离水相中加入Ca(OH)2产生的CaCO 3D. 用装置丁将滤液蒸发结晶得到NaOH 固体6.下列指定反应离子方程式正确的是( )A. 澄清石灰水与过量苏打溶液混合:Ca 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2OB. 少量SO 2通入饱和的漂白粉溶液中:C1O -+SO 2+H 2O=SO 42-+2H ++Cl -C. 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H ++O 22Cu 2++2H 2OD. 向酸性高锰酸钾溶液中滴加少量双氧水:7H 2O 2+2MnO 4-+6H +=2Mn 2++6O 2↑+10H 2O7.Na 2FeO 4只在强碱性条件下稳定,易被 H 2还原。
江苏省南通市2023届高三下学期第四次模拟考试化学试题(无答案)
江苏省南通市2023届高三下学期第四次模拟考试化学试题学校:___________姓名:___________班级:___________考号:___________一、未知1.化学与生产、生活密切相关。
下列说法不正确的是A .氨气与氯化氢反应生成氯化铵的过程属于氮的固定B .煤的气化、煤的液化和煤的干馏均属于化学变化C .淀粉在稀硫酸催化作用下转化为葡萄糖的过程属于多糖水解D .将钢铁闸门与电源负极相连的防腐措施属于外加电流保护法2.CsCl 是一种分析试剂,制备方法2322Cs CO 2HCl=2CsCl H O CO +++↑。
下列说法正确的是A .CsCl 的电子式:B .基态2O -的核外电子排布式:2261s 2s 2pC .23CO -的空间构型:三角锥形D .中子数为18的Cl 原子:1817Cl3.X 、Y 、Z 、W 是原子序数依次增大的短周期元素。
X 和Y 基态原子的s 能级电子总数均等于其p 能级电子总数,Z 的原子最外层电子数是Y 原子最外层电子数的2倍,W 和X 位于同一主族。
下列说法正确的是A .第一电离能:()()11X W I I <B .最高价氧化物对应水化物的酸性:Z>W C .原子半径:()()()W Y X r r r >>D .简单气态氢化物的热稳定性:X>Z4.242N H H O ⋅是一种重要的精细化工原料,易溶于水,沸点较低,具有强还原性,其制备原理为32NH +242NaClO=N H H O NaCl ⋅+。
下列实验装置和操作不能达到实验目的的是A .用甲装置制备3NH B .用乙装置制备氨水C .用丙装置制备242N H H O⋅D .用丁装置提纯242N H H O⋅5.化合物Z 是一种抗衰老药物,可由图示方法制备,下列说法正确的是A .当容器内气体总压不变时,反应已知:()22CoS 1.810-=⨯K ,()21NiS 1.010K -=⨯,()17FeS 4.010K -=⨯,(5)利用该纳米铁制成的改性15.化合物G是一种抗焦虑药物的中间体,其合成路线如下:写出以、为原料制备的合成路线流16.硫代硫酸钠(223Na S O )可用作分析试剂及鞣革的还原剂,遇酸易分解,有单质硫生成。
江苏省盐城中学2023届高三第二次模拟考试(4月)化学试题
江苏省盐城中学2023届高三第二次模拟考试(4月)化学试题学校:___________姓名:___________班级:___________考号:___________一、单选题1.化学与科技、生活有密切的关系。
下列叙述错误的是 A .航空航天工业中采用化学镀镍,电镀时镀件作阴极,镍作阳极B .我国力争2060年前实现碳中和,用脱硫煤代替原煤作燃料有利于实现碳中和C .“肾功能衰竭”的病人需要做“血液透析”,其原理与胶体的提纯有关D .卡塔尔世界杯旗帜来自中国制造,其主要材质是透风性好、不易损坏的涤纶 2.化学与生活密切相关。
下列化学用语或描述表达正确的是 A .基态硫原子的轨道表示式: B .H 2S 的电子式:C .SO 2的VSEPR 模型:D .中子数为9的氮原子97N3.亚硝酸钠(2NaNO )是一种肉制品生产中常见的食品添加剂,实验室通过以下反应制备2NaNO :2222NO Na O =2NaNO +。
下列实验装置不能达到实验目的的是A .用装置甲制备NOB .用装置乙干燥NOC .用装置丙合成2NaNOD .用装置丁处理尾气4.X 、Y 、Z 、W 的原子序数依次增大,X 的价电子排布式为n n 1ns np -,Y 的简单氢化物分子呈三角锥形,Z 的单质及其化合物灼烧时火焰呈黄色,W 位于元素周期表中第四周期,基态原子有1个电子未成对且内层电子全满。
下列说法正确的是A .同周期元素中第一电离能比Y 高的元素只有一种B .简单离子半径:Y Z <C .将X 的最高价氧化物的水化物溶于水,能促进水的电离D .1molW 的正二价阳离子与Y 的简单氢化物形成的配离子中含有的σ键数目为A 12N5.下列有关物质的性质与用途的对应关系正确的是 A .N 2性质不活泼,可作为粮食保护气 B .NH 3具有还原性,可用作制冷剂C .N 2H 4的熔沸点较低,可用作火箭推进剂D .NH 4Cl 受热易分解,可用作铁的除锈剂6.黑磷具有与石墨相似的层状结构,其结构如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
江苏省2019届高三教学情况调研(四)化学试题可能用到的相对原子质量:H 1 C 12N 14O 16Na 23Al 27P 31S 32Cl 35.5K 39Ca 40Cr 52Fe 56Cu 64选择题单项选择题:本题包括10小题,每小题2分,共计20分。
每小题只有一个....选项符合题意。
1.中国古代著作中有许多涉及化学的叙述,是中华民族智慧的结晶。
下列解读正确的是(▲)A.《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。
”文中涉及的操作方法是蒸馏B.文房四宝“笔、墨、纸、砚”中,宣纸主要由合成纤维制造C.《汉书》中“高奴县有洧水可燃”,洧水指汽油D.《天工开物》中“凡石灰,经火焚炼为用”,“石灰”指碳酸钙2.下列化学用语表示正确的是(▲)A.3517Cl与3717Cl得电子能力不相同B.用电子式表示CO2的形成过程:C.HClO的结构简式:H-Cl-OD.铬(2452Cr)原子的结构示意图:3.下列物质性质与相应结果或应用的对应关系正确的是(▲)A.某地雨水经过一段时间,其pH由4.68降为4.28,因为水中溶解了较多的CO2B.乙醇和水都可与金属钠反应产生可燃性气体,所以乙醇分子中的氢与水分子中的氢具有相同的活性C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸D.锌的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀4.用下列实验装置进行相应实验,能达到实验目的的是(▲)甲乙丙A.图甲:实验室中进行合成氨操作B.图乙:比较Na2CO3、NaHCO3的稳定性C.图丙:实验室中进行石油的分馏操作D.为观察Mg 条在CO 2气体中的燃烧,在一个底部铺有少量玻璃棉的集气瓶中收集满CO 2气体,取一小段除去表面氧化膜的Mg 条用坩埚钳夹持,点燃后迅速投入上述集气瓶底部 5. 短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 的简单氢化物可用作制冷剂,Y 的原子半径是所有短周期主族元素中最大的,由X 、Y 和Z 三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产出。
下列说法不正确的是 (▲)A.X 的简单氢化物的热稳定性比W 的强 B.的简单离子与X 的具有相同的电子层结构C.Y 与Z 形成的化合物的水溶液可使蓝色石蕊试纸变红 D.Z 与X 属于同一主族,与Y 属于同一周期6. 设N A 为阿伏加德罗常数的值。
下列有关叙述正确的是 (▲)A.30 g SiO 2中含有硅氧键个数为1 N A B.1L0.1 mol ·L-1的Na 2CO 3溶液中所含氧原子数目为0.3 N AC.常温常压下,1 mol CO 2与SO 2的混合气体中含氧原子数为2 N AD.向FeI 2溶液中通入适量Cl 2,当有1 mol Fe 2+被氧化时,共转移的电子的数目为N A 7. 下列指定反应的离子方程式正确的是(▲)A.酸性溶液中KIO 3与KI 反应生成I 2:IO -3+I -+6H +=I 2+3H 2OB.Na 2S 2O 3溶液中加入稀硫酸:2S 2O 2-3+4H +=SO 2-4+3S ↓+2H 2O C.向Na 2SiO 3溶液中通入过量SO 2:SiO 2-3+SO 2+H 2O =H 2SiO 3↓+SO 2-3D.用过量氨水吸收工业尾气中的SO 2:2NH 3·H 2O +SO 2=2NH +4+SO 2-3+H 2O8. 一定条件下,在水溶液中1 mol Cl -、ClO -x (x =1,2,3,4)的能量(kJ )相对大小如图所示,下列有关说法正确的是 (▲)A.e 是ClO -3B.b→a +c 反应的活化能为60 kJ ·mol -1C.a 、b 、c 、d 、e 中c 最稳定D.b→a +d 反应的热化学方程式为:3ClO -(aq )=ClO -3(aq )+2Cl -(aq ) ΔH =-116 kJ ·mol -19. 在给定条件下,下列选项所示的物质间转化均能一步实现的是 (▲)A.SiO 2―――→HCl (aq )SiCl 4――→H 2高温SiB.CuCl 2(aq )――――→NaOH (aq )Cu (OH )2―――→蔗糖(aq )△Cu 2O C.Al ――→NaOHAl (OH )3――→NaOHNaAlO 2D.CH 4――→O 2CO ――→O 2CO 210. 微生物燃料电池(如右图所示)是指在微生物的作用下将化学能转化为电能的装置。
下列说法正确的是(▲) A.该电池能在高温条件下持续工作B.负极反应式为HS -+9OH --8e -=SO 2-4+5H 2OC.若维持该微生物电池中两种细菌的存在,则电池可以持续供电D.电池中HS -、SO 2-4离子浓度会发生变化不定项选择题:本题包括5小题,每小题4分,共计20分。
每小题只有一个或两个.....选项符合题意。
若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 下列说法正确的是 (▲)A.由油脂得到甘油和由淀粉得到葡萄糖均发生了水解反应 B.乙醛和丙烯醛()虽不是同系物,但它们均可发生加成反应、氧化反应、还原反应和加聚反应C.“夺命快递”事件中的有毒物质为氟乙酸甲酯CH 2FCOOCH 3(),能发生加成、水解、氧化反应D.乳酸薄荷醇酯()仅能发生水解、氧化、消去反应12. 常温下,下列各组离子一定在指定溶液中能大量共存的是(▲)A.溶液中通入CO 2气体:Ca 2+、Cl -、K +、H +B.常温下,pH =12的溶液:K +、Cl -、SO 2-3、SiO 2-3、Ca 2+C.常温下c (H +)c (OH -)=1×10-12的溶液:K +、AlO -2、CO 2-3、Na + D.含有大量AlO -2的溶液中:Na +、K +、HCO -3、NO -3 13. 由下列实验及现象不能推出相应结论的是(▲)14. 常温下,配制0.10 mol ·L-NaHCO 3溶液,测其pH 为8.4;取少量该溶液滴加CaCl 2溶液至pH =7,滴加过程中产生白色沉淀,但无气体放出。
下列说法不正确的是 (▲)A.NaHCO 3溶液呈碱性的原因是HCO -3的水解程度大于电离程度 B.加入CaCl 2促进了HCO -3的水解C.反应的离子方程式是2HCO -3+Ca 2+=CaCO 3↓+H 2CO 3D.反应后的溶液中存在:c (Na +)+2c (Ca 2+)=c (HCO -3)+2c (CO 2-3)+c (Cl -)15. 在20L的密闭容器中按物质的量之比1∶2充入CO 和H 2,发生:CO (g )+2H 2(g ) ⥫=⥬CH 3OH (g ) ΔH 。
测得CO 的转化率随温度的变化及不同压强下CO 的变化、p 2和195℃时n (H 2)随时间的变化结果如图表所示。
下列说法正确的是(▲)A.0~3 min ,平均速率v (CH 3OH )=0.8mol ·L-1·min -1B.p 1<p 2,ΔH >0C.在p 2及195℃时,该反应的平衡常数为25 D.在B 点时,v 正<v 逆非选择题16. (12分)Li 4Ti 5O 12和LiFePO 4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe 、TiO 3,还含有少量MgO 、SiO 2等杂质)来制备,工艺流程如下:回答下列问题:(1)“酸浸”实验中,铁的浸出率结果如右图所示。
由图可知,当铁的净出率为70%时,所采用的实验条件为 ▲ 。
(2)“酸浸”后,钛主要以TiOCl 42-形式存在,写出相应反应的离子方程式 ▲ 。
(3)TiO 2·x H 2O 沉淀与双氧水、氨水反应40 min 所得实验结果如下表所示:分析40℃时TiO 2·x H 2O 转化率最高的原因: ▲ 。
(4)Li 2Ti5O 15中Ti 的化合价为+4,其中过氧键的数目为 ▲ 。
(5)若“滤液○2”中c (Mg 2+)=0.02 mol ·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe 3+恰好沉淀完全即溶液中c (Fe 3+)=1.0×10-5 mol ·L-1,此时是否有Mg 3(PO 4)2沉淀生成?(写出计算过程,FePO 4、Mg 3(PO 4)2的K sp 分别为1.3×10-22、1.0×10-24。
)▲(6)写出“高温煅烧○2”中由FePO 4制备LiFePO 4的化学方程式: ▲ 。
17. (15分)橙皮素具有抗氧化、降血脂、保护心血管和抗肿瘤等多种功效。
它的合成路线如下:(1)化合物A 中的含氧官能团有 ▲ 、 ▲ (填官能团名称)。
(2)已知:B ―→C 为取代反应,其另一产物为HCl ,写出X 的结构简式: ▲ 。
(3)反应D ―→E 的反应类型是 ▲ 。
(4)写出同时满足下列条件的B 的同分异构体的结构简式: ▲ 。
○1 属于芳香族化合物 ○2 分子中有4种不同化学环境的氢 ○3 不能与FeCl 3溶液发生显色反应,但能发生水解反应 (5)已知:,结合流程信息,写出以对甲基苯酚和上述流程中的“X ”为原料,制备的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:CH 3CH 2OH ――→浓硫酸170 ℃CH 2=CH 2――→ Br 2CH 2Br —CH 2Br▲ ▲ ▲18. (12分)工业上用铝土矿(主要成分为Al 2O 3,含有Fe 2O 3、SiO 2等杂质)制取无水氯化铝的一种工艺流程示意如下:已知:(1)步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是:▲。
(任写一条)(2)步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是▲。
(3)结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是▲。
(4)称取含Fe2O3和Al2O3的试样0.2000 g,将其溶解在pH=2.0的热溶液中(50℃左右),以磺基水杨酸为指示剂,用0.02000 mol·L-1 EDTA标准溶液滴定试样中的Fe3+,用去18.00 mL。
然后将试样调至pH=3.5,加入上述EDTA标准溶液25.00 mL,并加热煮沸,使Al3+与EDTA 完全反应。
再调试液pH=4.5,以PAN[1-(2-吡啶偶氮)-2-苯酚]为指示剂,趁热用CuSO4标准溶液(每毫升含CuSO4·5H2O 0.005000 g)返滴定,用去8.00 mL。
