水解
水解反应的机理探索

水解反应的机理探索水解反应是一种常见的化学反应过程,它在许多领域都有重要的应用,包括工业生产、环境保护以及生物化学等。
本文将探索水解反应的机理,并对其应用进行简要介绍。
一、水解反应概述水解反应是指在水的存在下,化学物质与水分子之间发生的化学反应。
在水解反应中,化学物质(被称为底物)可被水分子加水分解成更小的分子或离子。
通常情况下,水解反应是一个可逆的过程,因此反应既可以向前进行,也可以向后进行。
二、水解反应的机理水解反应的机理可以分为酸碱催化和酶催化两种情况。
1.酸碱催化机理在酸碱催化的水解反应中,水分子在被底物攻击后,它首先变成一个负离子,然后再与负离子结合生成新的化学物质。
酸性条件下,酸性物质(如硫酸、盐酸)可以捕获水分子中的氢离子,从而使水分子成为一个带负电的氧阴离子。
而在碱性条件下,碱性物质(如氢氧化钠、碳酸钠)可以捕获水分子中的氢氧根离子,使其成为一个带负电的氧阴离子。
这些负离子与底物结合后,形成新的化学物质。
2.酶催化机理在酶催化的水解反应中,酶是充当催化剂的生物大分子。
酶能够降低反应活化能,同时提高反应速率。
当底物与酶结合时,酶能够改变底物的构象,使其与水分子相互作用,进而发生水解反应。
酶催化的水解反应在生物体内广泛存在,常见的例子包括消化系统中的食物分解和药物代谢等。
三、水解反应的应用1.工业生产中的应用水解反应在工业生产中有着广泛的应用。
例如,纸浆和纸张生产中的木质素水解反应可以将木质素转化为有机酸和酚类物质,从而提高纸张的亲水性能。
此外,聚合物合成和药物生产等领域也常涉及水解反应的应用。
2.环境保护中的应用水解反应在环境保护中起着重要作用。
例如,废水处理中的水解反应可以将有机污染物转化为无害的分子或离子,从而减少对自然环境的污染。
此外,水解反应还可以用于处理有机溶剂和化学废物,以实现资源的回收利用。
3.生物化学中的应用水解反应在生物化学领域有着广泛的应用。
例如,酶催化的水解反应在蛋白质降解和代谢物转化等生物过程中起着关键作用。
化学反应的水解

化学反应的水解水解是一种化学反应,指的是将化合物分解为其组成离子或原子的过程。
在水解反应中,水作为一个反应物参与进来,将化合物分解成离子或原子。
水解反应广泛存在于化学、生物和环境领域中,具有重要的意义和应用。
一、水解的定义和分类水解是指通过水的存在和作用,使物质发生分解或转化的化学反应过程。
根据反应物和生成物的类型,水解可以分为酸性水解、碱性水解和中性水解。
1. 酸性水解:在酸性环境下,酸性物质作为催化剂或反应物,使化合物发生水解反应。
例如,酸性下的酯水解会生成酸和醇。
2. 碱性水解:在碱性环境下,碱性物质作为催化剂或反应物,使化合物发生水解反应。
例如,碱性下的酰胺水解会生成胺和酸。
3. 中性水解:在中性环境下,通常是通过酶催化下的生物体内水解反应。
例如,蛋白质的水解是通过酶在生物体内发生的。
二、水解的机制水解反应的机制与反应物的性质有关。
下面以酸性水解和碱性水解为例进行介绍。
1. 酸性水解的机制:首先,酸性环境下的酸性物质(如HCl)会提供H+离子。
然后,该H+离子与水形成H3O+,即酸性溶液。
接着,酸性溶液中的H3O+和酯反应,酯中的可水解基团(如酯基)被负离子攻击断裂,生成酸和醇。
2. 碱性水解的机制:首先,碱性环境下的碱性物质(如NaOH)会提供OH-离子。
然后,该OH-离子与水形成OH-,即碱性溶液。
接着,碱性溶液中的OH-和酰胺反应,酰胺中的可水解基团(如酰基)被负离子攻击断裂,生成胺和酸。
三、水解的应用1. 生物化学:水解反应在生物体内广泛存在,与生物代谢、消化和分解有关。
例如,胃液中的酸性水解使食物中的蛋白质分解为氨基酸,从而被人体吸收利用。
2. 垃圾处理:水解反应在垃圾处理、废水处理和土壤污染修复等方面具有重要的应用。
通过水解反应,有机废物可以分解为无害物质,从而减少对环境的污染。
3. 化学合成:水解反应在化学合成中也有重要应用。
例如,在某些有机合成中,通过水解反应可以将化合物分解为更简单的产物,从而制得目标化合物。
水解反应_精品文档

水解反应水解反应是化学中一种常见的反应类型,指的是分子或离子与水发生化学反应,产生新的物质。
水解反应在生活中和工业中都具有重要的意义,不仅能够产生有用的产物,还能够帮助我们理解化学反应的原理。
水解反应的概述水解反应是指物质与水作用,使其分解成更简单的物质。
水解反应可以发生在离子、分子、化合物等不同的化学物质上。
通常情况下,水解反应是通过在分子或离子中添加水分子来实现的。
这些水解反应可以是酸碱中和反应、酯水解反应、碳酸酯水解反应等。
水解反应可以分为完全水解和不完全水解两种情况。
完全水解指的是反应物与水反应产生的产物完全溶解在水中形成离子。
而不完全水解则是指只有一部分反应物与水反应产生离子,另一部分仍然以分子形式存在。
水解反应的类型酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的过程。
在这种反应中,酸质子和碱的氢氧根离子结合形成水,同时产生一个化学反应的产物 - 盐。
例如,硫酸与氢氧化钠反应的水解反应可以表示为:H2SO4 + 2NaOH → Na2SO4 + 2H2O酯水解反应酯水解反应是指酯与水反应,将酯分解成醇和羧酸的过程。
这种反应是通过水进攻酯的羰基碳而发生的。
例如,酯乙酸乙酯与水反应的水解反应可以表示为:CH3COOC2H5 + H2O → CH3COOH + C2H5OH碳酸酯水解反应碳酸酯水解反应是碳酸酯与水反应,产生相应的醇和碳酸盐。
碳酸酯在水中分解成酸和醇的过程。
例如,二甲基碳酸酯与水发生的水解反应可以表示为:CH3OCO2CH3 + H2O → CH3CO2H + CH3OH水解反应的意义水解反应在生活中和工业上具有重要的应用价值。
在生活中,水解反应发生在我们日常饮食中的食物消化过程中。
例如,淀粉在体内经过水解反应形成葡萄糖,为我们提供能量。
在工业上,水解反应广泛应用于合成和分解化学物质。
例如,酯水解反应可以用于生产肥皂和香精。
水解反应还可以用于环境保护领域,例如处理废水中的有机物。
高中化学常见的水解反应
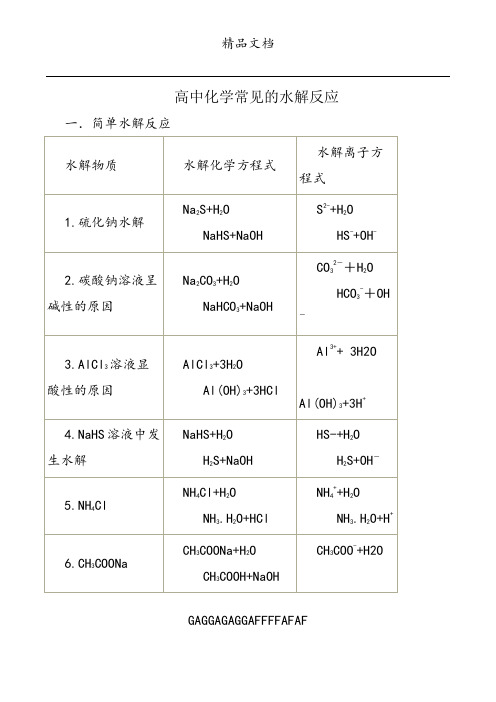
高中化学常见的水解反应一.简单水解反应GAGGAGAGGAFFFFAFAFGAGGAGAGGAFFFFAFAFGAGGAGAGGAFFFFAFAF二.双水解GAGGAGAGGAFFFFAFAF(一)不是彻底水解,比单一离子水解要强,用表示,例:1.(NH4)2CO3水解离子方程式为:NH4++CO32- +H2OHCO3-+NH3.H2O2.CH3COONH4水解离子方程式为:CH3COO-+NH4++H2OCH3COOH+NH3.H2O3.NH4HCO3水解离子方程式为:NH4++HCO3- +H2OH2CO3+NH3.H2O(二)彻底水解, 用“=”,例:1.泡沫灭火器原理:(药品为Al2(SO4)3和NaHCO3)水解化学方程式为:Al2(SO4)3+6NaHCO3=2Al(OH)3↓+3Na2SO4+6CO2↑水解离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑2.Al3+与S2-[如AlCl3、Al2(SO4)3、Al(NO3)3与Na2S、K2S溶液混合。
]水解离子方程式为:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑3.Al3+与CO32-[如AlCl3、Al2(SO4)3、Al(NO3)3与Na2CO3、K2CO3溶液混合。
]水解离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑4.Al3+与AlO2-[如AlCl3、Al2(SO4)3、Al(NO3)3与NaAlO2、KAlO2溶液混合。
]GAGGAGAGGAFFFFAFAFAl3++3AlO2-+6H2O=4Al(OH)3↓5.Fe3+与ClO-[如FeCl3、Fe2(SO4)3、Fe(NO3)3与NaClO溶液混合。
] Fe3++3ClO-+3H2O= Fe(OH)3↓+3HClO6.FeGAGGAGAGGAFFFFAFAFGAGGAGAGGAFFFFAFAF3+与HCO 3-[如FeCl 3、Fe 2(SO 4)3、Fe (NO 3)3与NaHCO 3 溶液混合。
水解的定义

水解的定义
水解的定义
水解(Hydrolysis)是一种化学变化,是指向特定的有机物质中加入水从而使其分解的过程。
它是一种分子重组的过程,通常由酶催化,高能水或低pH水参与。
水解过程对于生物有着重要意义,因为它在很多方面发挥着作用,比如糖、蛋白质和核酸的代谢,以及激素、神经传导物质和细胞旁路的合成。
水解的定义可以总结为:水解是指一种化学变化,即将某种物质与水结合产生新的分子,从而分解物质的过程。
水解反应有着广泛的应用,是许多生物反应的基础。
它可以分解多种物质,比如糖、蛋白质和核酸等,也可以用来合成激素、神经传导物质和细胞旁路。
水解反应是一种分子重组的过程,通常是由酶催化剂、高能水或低pH水参与的。
当反应结束时,会产生新物质,这些新物质可能是原物质的组合物、细胞内的小分子物质,或者是细胞外的大分子物质。
水解反应发生的条件不一定相同,可以是特定的温度、pH值和酶活性。
水解反应可以分为两种:酶催化水解和非酶催化水解。
酶催化水解是一种特殊的水解反应,它只能通过酶催
化剂来发生。
而非酶催化水解可以在没有酶的情况下发生,通常是由高能水或低pH水参与的。
水解反应的过程可以概括如下:在某种特定的条件下,例如高能水或低pH水,将水和有机物质混合,当水解反应发生时,有机物质会被水分解,产生新的分子。
最后,水解是一种重要的化学变化,它可以被用来分解和合成多种物质,这对于生物有着重要意义。
它是许多生物反应的基础,可以用来解析有机物质的结构,也可以用来将多种物质分解成小分子物质,从而有助于生命的正常代谢等等。
水解过程的三个阶段

水解过程的三个阶段水解过程是一种将大分子物质分解成小分子物质的化学反应。
这种反应对于生物体的生命活动很重要,例如消化食物、释放能量和合成生物分子等。
水解反应通常涉及到水分子的加入,从而在反应中将化学键断裂。
根据反应速度和反应物浓度的变化,水解过程可以分为三个阶段:起始阶段、中间阶段和末端阶段。
第一个阶段是起始阶段。
在这个阶段,水解反应的速度是最快的,因为反应物的浓度最高。
当反应物与水分子接触时,它们之间的化学键开始断裂,产生小分子物质和离子。
一个常见的例子是碳酸酯的水解反应。
碳酸酯是一类含有碳、氧和羟基的化合物,它们可以通过与水反应分解成碳酸和醇。
在碳酸酯的水解反应中,起始阶段的速度主要受到反应物浓度和温度的影响。
第二个阶段是中间阶段。
在起始阶段,反应物浓度不断减少,而水和产物的浓度则增加。
由于浓度差异,反应速度逐渐减慢。
在这个阶段,反应物的水解速度大致恒定,直到达到一个平衡状态。
在平衡状态下,反应物的浓度和产物的浓度保持不变,即反应和逆反应以相同的速率进行。
这意味着平衡阶段的水解反应不会进一步发展,除非有其他因素干扰。
中间阶段的长度取决于反应物的浓度、化学键的强度和反应条件等因素。
第三个阶段是末端阶段。
在这个阶段,反应物的浓度非常低,几乎已经接近于零。
由于反应物浓度的不足,水解反应速度进一步减慢,并最终停止。
在末端阶段,反应物的浓度基本没有变化,而产物的浓度达到最大值。
这意味着水解反应已经达到了最终的平衡状态。
末端阶段的长度可能会很长,可能需要很长时间才能达到平衡。
总之,水解过程可以分为起始阶段、中间阶段和末端阶段。
起始阶段是水解反应速度最快的阶段,中间阶段是反应速度逐渐减慢并达到平衡的阶段,而末端阶段是反应速度基本停止并达到最终平衡的阶段。
不同阶段的长度和速度取决于反应物浓度、化学键强度和反应条件等因素。
理解水解过程的三个阶段有助于我们更好地解释和控制这些化学反应在生物和化学领域中的应用。
水解和电离
水解
水解是一种化学反应,它指的是物质在水的作用下分解成其他物质。
水解反应是一种常见的化学反应,它可以将复杂的物质分解成简单的
物质,如水解糖分解成糖类和水,水解蛋白质分解成氨基酸等。
水解
反应可以分为酸性水解和碱性水解。
酸性水解是指在酸性条件下,物
质在水的作用下分解成其他物质,如糖在酸性条件下分解成糖类和水;碱性水解是指在碱性条件下,物质在水的作用下分解成其他物质,如
蛋白质在碱性条件下分解成氨基酸等。
电离
电离是一种物理反应,它指的是原子或分子在电场的作用下分解成其
他物质。
电离反应是一种常见的物理反应,它可以将复杂的物质分解
成简单的物质,如气体电离分解成气体离子,液体电离分解成液体离
子等。
电离反应可以分为单电离和多电离。
单电离是指原子或分子在
电场的作用下分解成一个离子,如气体电离分解成气体离子;多电离
是指原子或分子在电场的作用下分解成多个离子,如液体电离分解成
液体离子等。
化学水解知识点总结
化学水解知识点总结
水解反应的机理一般分为酸催化和碱催化两种方式。
在酸催化下,水解反应的过程中水分子首先失去一个质子变成了一个羟基离子。
这个羟基
离子会攻击化合物的一个原子核,从而打开其分子结构并将之分为两部分。
举个例子,如
果我们以酯类化合物和水进行水解反应,就可以得到相应的醇和羧酸。
若考虑碱催化的水解反应,一方面硫酸铵等金属离子所引起的酸碱中立化过程,另一方面
羟氢根离子的活性作用,使得单子化物分子发生活化。
在这种情况下,水分子的一个质子
和羟基离子中的一个质子结合成水,使得其活性增加,从而导致水解反应。
水解反应可以发生在各种不同的化合物之间,尤其是在有机化合物领域有着广泛的应用。
例如,在生物体内,消化酶通过水解的方式将蛋白质、碳水化合物和脂肪等分解为小分子
物质,以供生物体发挥功能。
此外,在工业上,水解反应也常常用于制备各种化合物,例
如在制糖、纺织品、医药等领域都有着广泛的应用。
在化学反应工程领域,水解反应的研究也起着非常重要的作用。
如何控制水解反应的速率,同时保持反应系统的稳定性,是一个非常重要的问题,涉及到反应条件的优化、催化剂的
选择和反应温度的控制等方面。
此外,水解反应也常常用于环境保护领域,例如通过水解反应将一些有毒化合物转化为无
毒的产物,或者将一些难降解的有机物转化为易降解的产品,以减少对环境的污染和破坏。
总的来说,水解反应在化学领域中具有非常广泛的应用,既体现了基础化学的研究价值,
也具有非常重要的应用价值。
水解反应的研究不仅可以帮助我们理解化合物的结构和性质,还可以为生产制备更加绿色化合物提供理论基础和技术支持。
高中化学水解知识点总结
高中化学水解知识点总结
高中化学水解知识点总结
一、水解概念
水解,又称水溶性分解或水分解,是指溶解在水溶剂中的一些化合物,经水攻击,分解成小分子物质的一种反应,简称水解。
二、水解反应分类
1、水解反应分为三类:
(1)电解:指在水溶液中加入对离子有作用力的电子极,使离子发生水解的反应。
(2)碱解:指在水溶液中加入强碱,使其发生水解的反应。
(3)酸解:指在水溶液中加入酸,使其发生水解的反应。
2、根据水解反应的分子结构,可以将水解反应分为物理水解和化学水解两类。
(1)物理水解:指由外力作用,使物质分子受到力的作用,而分子分裂解体的反应,即一种物理反应。
(2)化学水解:指水解反应的物质分子受到外力作用而分裂解体时发生的反应,即一种化学反应。
三、水解反应的特点
1、水解反应是一种物质分解的反应,是一种分子分解为小分子物质的反应。
2、水解反应的最终产物是小分子物质,通常是非电解质形式的物质。
3、水解反应的速率与水分子的活性有关,水解反应受到温度、pH、浓度、加入的盐类的影响。
4、水解反应可以分为物理水解和化学水解两类。
四、水解反应的应用
1、用于制备活性剂:水解反应可用于制备某些活性剂,如尿素、盐酸等。
2、用于医药制剂:水分解可用于制备药物,如尿素、铵、苯酐等。
3、用于食品工业:水解可以用于制备饮料、熟食类食物,还可以用于制备乳制品、调味品等。
4、用于化学反应:水解可以用于制备有机物质和无机物质,如硫酸铵等。
水解的作用
水解的作用
水解是指将一个化合物加入水中,使其分解成更小的分子或离子的化学反应。
水解是一种常见的化学反应,它在生物体内和化学工业中都有广泛的应用。
在生物体内,水解是许多生化反应的重要组成部分。
例如,消化过程中,人体能够将食物中的蛋白质、碳水化合物和脂类分解成更小的分子,以供身体吸收和利用。
这些反应涉及许多不同的酶,它们能够催化水解反应,从而将食物分解成更小的分子。
在化学工业中,水解也被广泛应用。
例如,许多合成化学反应需要加入水来促进反应。
此外,许多化学物质需要经过水解才能被有效地处理和处理掉,以避免对环境和健康造成负面影响。
总之,水解是一种重要的化学反应,在生物体内和化学工业中都有广泛的应用。
它能够将复杂的化合物分解成更小的分子或离子,从而使它们更易于处理和利用。
- 1 -。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水解目录[隐藏]定义正盐用例碳酸根离子分步水解[编辑本段]定义水解是一种化工单元过程,是利用水将物质分解形成新的物质的过程。
盐电离出的离子结合了水电离出的H+和OH-生成弱电解质分子的反应物质与水发生的导致物质发生分解的反应(不一定是复分解反应)(也可以说是物质是否与水中的氢离子或者是氢氧根离子发生反应)由弱酸根或弱碱离子组成的盐类的水解有两种情况:①弱酸根与水中的H+结合成弱酸,溶液呈碱性,如乙酸钠的水溶液:CH3COO- + H2O ←═→ CH3COOH + OH-②弱碱离子与水中的OH-结合,溶液呈酸性,如氯化铵水溶液:NH4+ + H2O ←═→ NH3·H2O + H+生成弱酸(或碱)的酸(或碱)性愈弱,则弱酸根(或弱碱离子)的水解倾向愈强。
例如,硼酸钠的水解倾向强于乙酸钠,溶液浓度相同时,前者的pH值更大。
弱酸弱碱盐溶液的酸碱性取决于弱酸根[1]和弱碱离子水解倾向的强弱。
例如,碳酸氢铵中弱酸根的水解倾向比弱碱离子强,溶液呈碱性;氟化铵中弱碱离子的水解倾向强,溶液呈酸性;若两者的水解倾向相同,则溶液呈中性,这是个别情况,如乙酸铵。
弱酸弱碱盐的水解与相应强酸弱碱盐或强碱弱酸盐的水解相比,弱酸弱碱盐的水解度大,溶液的pH更接近7(常温下)。
如0.10 mol/L的Na2CO3的水解度为4.2%,pH为11.6,而同一浓度的(NH4)2CO3的水解度为92%,pH为9.3。
酯、多糖、蛋白质等与水作用生成较简单的物质,也是水解:CH3COOC2H5 + H2O ─→ CH3COOH + C2H5OH(C6H10O5)n + nH2O ─→ nC6H12O6某些能水解的盐被当作酸(如硫酸铝)或碱(如碳酸钠)来使用。
[编辑本段]正盐正盐分四类:一、强酸强碱盐不发生水解,因为它们电离出来的阴、阳离子不能破坏水的电离平衡,所以呈中性。
二、强酸弱碱盐,我们把弱碱部分叫弱阳,弱碱离子能把持着从水中电离出来的氢氧根离子,破坏了水的电离平衡,使得水的电离正向移动,结果溶液中的氢离子浓度大于氢氧根离子浓度,使水溶液呈酸性。
三、强碱弱酸盐,我们把弱酸部分叫弱阴,同理弱阴把持着从水中电离出来的氢离子,使得溶液中氢氧根离子浓度大于氢离子浓度,使溶液呈碱性。
四、弱酸弱碱盐,弱酸部分把持氢,弱碱部分把持氢氧根,生成两种弱电解质,再比较它们的电离常数Ka、Kb值的大小(而不是水解度的大小),在一温度下,弱电解质的电离常数(又叫电离平衡常数)是一个定值,这一比较就可得出此盐呈什么性了,谁强呈谁性,电离常数是以10为底的负对数,谁负得少谁就大。
总之一句话,盐溶液中的阴、阳离子把持着从水中电离出来的氢离子或氢氧根离子能生成弱电解质的反应叫盐类的水解。
还有有机物类中的水解,例如酯类的水解,是酯和水反应(在无机酸或碱的条件下)生成对应羧酸和醇的反应叫酯的水解,还有卤代烃的碱性水解,溴乙烷和氢氧化钠水溶液反应生成乙醇和溴化钠叫卤烷的水解,还有蛋白质的水解,最终产物为氨基酸等等。
[编辑本段]用例水解反应(1)含弱酸阴离子、弱碱阳离子的盐的水解,例如:Fe3++3H2O=Fe(OH)3+3H+,CO3 2-+H2O=HCO3-+OH-(2)金属氮化物的水解,例如:Mg3N2+6H2O=3Mg(OH)2+2NH3(3)金属硫化物的水解,例如:Al2S3+6H2O=2Al(OH)3+3H2S(4)金属碳化物的水解,例如:CaC2+2H2O=Ca(OH)2+C2H2(5)非金属卤化物的水解,例如:PCl3+3H2O=H3PO3+3HCl此类反应多为水分子攻击卤原子,但也有例外,如NCl3水解:NCl3+3H2O=NH3+3HClO该反应为水分子攻击氮原子取代反应(水解反应)(有机反应)1.卤代烃在强碱水溶液中水解,例如:CH3CH2-Cl+H-OH—△→NaOHCH3CH2OH+HCl2.醇钠的水解,例如:CH3CH2ONa+H2O=CH3CH2OH+NaOH3.酯在酸、碱水溶液中水解,例如:CH3COOCH2CH3+H2O—△H+orOH-→CH3C OOH +CH3CH2OH4.二糖、多糖的水解,例如淀粉的水解:(C6H10O5)n+nH2O→nC6H12O6(葡萄糖)5.二肽、多肽的水解,例如H2NCH2CONHCH2COOH+H2O→2H2NCH2COOH6.亚胺的水解ArCH=N-Ph—H20 H+ →ArCHO+PhNH2注意:上述反应中“=”均为可逆符号,水解产物量很小,不必标明沉淀或气体。
水解反应目录[隐藏]名词解释典型类型名词解释典型类型聚丙烯酰胺的水解反应[编辑本段]名词解释水解反应又是取代反应。
盐类水解反应的定义:在溶液中盐电离出的离子与水电离出的氢离子和氢氧根结合生成弱电解质的反应。
无机物在水中分解通常是双分解过程,水分子也被分解,和被水解的物质残片结合形成新物质,如氯气在水中分解,一个氯原子和一个水被分解的氢原子结合成盐酸,水分子的另一个氢原子和氧原子与另一个氯原子结合成次氯酸;碳酸钠水解会产生碳酸氢钠和氢氧化钠;氯化铵水解会产生盐酸和氨水等。
有机物的分子一般都比较大,水解时需要酸或碱作为催化剂,有时也用生物活性酶作为催化剂。
在酸性水溶液中脂肪会水解成甘油和脂肪酸;淀粉会水解成麦芽糖、葡萄糖等;蛋白质会水解成氨基酸等分子量比较小的物质。
在碱性水溶液中,脂肪会分解成甘油和固体脂肪酸盐,即肥皂,因此这种水解也叫作皂化反应。
水与另一化合物反应,该化合物分解为两部分,水中氢原子加到其中的一部分,而羟基加到另一部分,因而得到两种或两种以上新的化合物的反应过程。
工业上应用较多的是有机物的水解,主要生产醇和酚。
水解反应是中和或酯化反应的逆反应。
大多数有机化合物的水解,仅用水是很难顺利进行的。
根据被水解物的性质,水解剂可以用氢氧化钠水溶液、稀酸或浓酸,有时还可用氢氧化钾、氢氧化钙、亚硫酸氢钠等的水溶液。
这就是所谓的加碱水解和加酸水解。
水解可以采用间歇或连续式操作,前者常在釜式反应器中进行,后者则多用塔式反应器。
[编辑本段]典型类型①卤化物的水解通常用氢氧化钠水溶液作水解剂,反应通式如下:R—X+NaOH-─→R—OH+NaX-Ar—X+2NaOH─→Ar—ONa+NaX+H2O式中R、Ar、X分别表示烷基、芳基、卤素。
脂链上的卤素一般比较活泼,可在较温和的条件下水解,如从氯苄制苯甲醇;芳环上的卤素被邻位或对位硝基活化时,水解较易进行,如从对硝基氯苯制对硝基酚钠。
②芳磺酸盐的水解通常不易进行,须先经碱熔,即以熔融的氢氧化钠在高温下与芳磺酸钠作用生成酚钠,后者可通过加酸水解生成酚。
如萘-2-磺酸钠在300~340℃常压碱熔后水解而得2-萘酚。
某些芳磺酸盐还需用氢氧化钠和氢氧化钾的混合碱作为碱熔的反应剂。
芳磺酸盐较活泼时可用氢氧化钠水溶液在较低温度下进行碱熔。
③胺的水解脂胺和芳胺一般不易水解。
芳伯胺通常要先在稀硫酸中重氮化生成重氮盐,再加热使重氮盐水解。
反应通式如下:Ar—NH2+NaNO2+2H2SO4─→Ar—N+2HSO-4+NaHSO4+2H2OAr—N+2HSO4+H2O─→ArOH+H2SO4+N2如从邻氨基苯甲醚制邻羟基苯甲醚(愈创木酚)。
芳环上的氨基直接水解,主要用于制备1-萘酚衍生物,因它们有时不易用其他合成路线制得。
根据芳伯胺的结构可用加碱水解、加酸水解或亚硫酸氢钠水溶液水解。
如从1-萘胺-5-磺酸制1-萘酚-5-磺酸便是用亚硫酸氢钠水解。
④酯的水解油脂经加碱水解可得高碳脂肪酸钠(肥皂)和甘油;制脂肪酸要用加酸乳化水解。
低碳烯烃与浓硫酸作用所得烷基硫酸酯,经加酸水解可得低碳醇。
⑤淀粉水解C12H22O11(麦芽糖)+H2O→C6H12O6淀粉水解淀粉为高分子化合物,一定条件下可以水解方程式:(C6H10O5)n+nH2O————nC6H1 2O6条件:稀硫酸,加热淀粉是一种重要的多糖,是一种相对分子量很大的天然高分子化合物。
虽属糖类,但本身没有甜味,是一种白色粉末,不溶于冷水。
在热水里淀粉颗粒会膨胀,有一部分淀粉溶解在水里,另一部分悬浮在水里,形成胶状淀粉糊。
淀粉进入人体后,一部分淀粉收唾液所和淀粉酶的催化作用,发生水解反应,生成麦芽糖;余下的淀粉在小肠里胰脏分泌出的淀粉酶的作用下,继续进行水解,生成麦芽糖。
麦芽糖在肠液中麦芽糖酶的催化下,水解为人体可吸收的葡萄糖,供人体组织的营养需要。
科学探究:设计实验方案,实验淀粉能不能水解,水解的条件和产物是什么?怎样判断淀粉是否水解了?实验用品:淀粉、水、碘溶液、2 0%的硫酸、10%氢氧化钠、2%的硫酸铜、酒精灯、试管夹、试管等。
实验方法:1、在试管1中加入0.5g淀粉和4ml水,在试管2中加入0.5g淀粉和4ml 20%的硫酸溶液。
分别加热试管3~4min。
2、把试管2中的一部分溶液倒入试管3中,留作下一步实验用。
3、向试管1和试管2中加入几滴碘溶液,观察现象。
发现试管1的溶液呈蓝色(淀粉遇碘变成蓝色),试管2无明显现象。
不同现象的原因是:淀粉在酸性条件并加热的条件下发生了水解反应。
4、向试管3中滴入10%的钜海 泻腿芤褐械牧蛩幔 讶芤旱鞒嗜跫钚裕 谷芤旱腜H值约为9~1 0。
5、另取一只试管4加入3ml氢氧化钠溶液,并向其中滴入4滴2%的硫酸铜溶液,立即有蓝色的氢氧化铜沉淀生成。
再取试管3中的水解液1ml滴入,振荡混合均匀后,用酒精灯加热煮沸,溶液颜色常有蓝色——黄色——绿色(黄蓝两色混合)——红色等一系列变化。
最终有红色沉淀生成。
原因是氢氧化铜被还原生成红色难溶于水的氧化亚铜。
实验结论:淀粉在酸的催化作用下,能发生水解;淀粉的水解过程:先生成分子量较小的糊精(淀粉不完全水解的产物),糊精继续水解生成麦芽糖,最终水解产物是葡萄糖。
注意事项:淀粉水解的中间产物糊精(有分子量较大的红糊精和分子量较小的白糊精),对碘反应的颜色变化是:紫色—棕色—黄色,若淀粉水解不彻底,也会有不同的颜色出现。
问题思考:1、试管1为什么变成了蓝色?试管2为什么无明显现象?为什么?(试管1中的淀粉未水解,淀粉遇碘变成蓝色;试管2中淀粉在酸的催化作用下水解了,所以无明显现象;不同现象的原因是:淀粉在酸性条件并加热的条件下发生了水解反应。
)2、如何验证淀粉没有还原性?(提示:不能发生银镜反应或者不能还原氢氧化铜)3、实验延伸设计:如何验证唾液酶对淀粉水解的催化作用?(注意事项:用唾液作催化剂水解淀粉时,温度不得超过45℃,因为温度过高,唾液酶易失去活性,最适宜的温度是37—40℃。
)某些细菌能够分泌淀粉酶(胞外酶),将淀粉水解为麦芽糖和葡萄糖,再被细菌吸收利用。
淀粉被水解后遇碘不再变蓝色。
(1)将装有淀粉培养基的锥形瓶置于沸水浴中融化,然后取出冷却至50℃左右,即倾入培养皿中,待凝固后制成平板。
