有机化学第12章活泼亚甲基反应
有机化学徐寿昌第二版第12章醛和酮核磁共振

◆醛酮的红外光谱
羰基化合物在1680~1850cm-1处有一个强的羰基伸 缩振动吸收峰。醛基C-H在2720cm-1处有尖锐的特征 吸收峰。
乙醛的红外光谱
1
2
羰基若与邻近基团发生共轭,则羰基吸收频率降低: 苯乙酮的红外光谱
12.4.1 亲核加成反应 ◆烯烃的加成一般为亲电加成. ◆醛、酮的加成为亲核加成,易与HCN、NaHSO3、
R1 R2
例如:
C=C
R1 R2
+Ph3P=O
=O + Ph3P=CH2
=CH2
CH3CH=CHCHO+ Ph3P=C(CH3)2
CH3CH=CHC=C(CH3)2
该反应1945年由德国化学家Wittig发现,对有机合成特别是 维生素类的合成做出了巨大贡献。1979年Wittig 在82岁时获得了 Nobel化学奖.
◆反应历程(亚硫酸氢根离子为亲核试剂):
O
◆ -羟基磺酸钠与等摩尔的NaCN作用,则磺酸基可 被氰基取代,生成 -羟基腈,避免用有毒的氰化氢, 产率也比较高。
PhCHONaHSO3PhCHSO3NaNaCNPhCHCNHCl/△ PhCHCOOH
OH
OH
OH
பைடு நூலகம்
◆醛酮与NaHSO3的加成反应活性: 甲醛>乙醛>苯甲醛>丙酮>环戊酮>苯乙酮(不反应).
◆希夫碱还原可得仲胺。在有机合成上常利用芳醛与 伯胺作用生成希夫碱,再还原来制备仲胺。
⑦醛酮与Wittig试剂的加成:
Wittig试剂为磷的内蓊盐,即磷叶立德.由三苯基磷 与卤代烷反应得到磷盐.磷盐与碱作用得到Wittig试 剂: Ph3P+—C-R1(R2). 反应通式为:
常见有机化学反应及机理
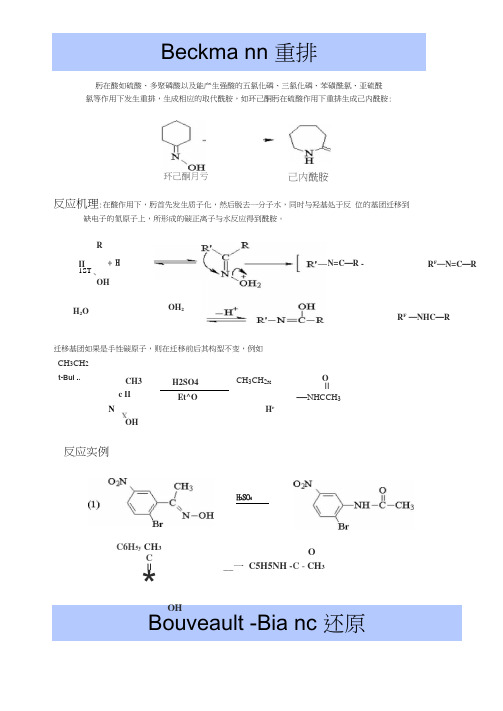
Beckma nn 重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰 氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:环己酮月亏己内酰胺Bouveault -Bia nc 还原反应机理:在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反 位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
R II 1ST、OH + H H 2O N=C —R -OH 2 R F —N=C —RR F —NHC —R迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如 CH 3CH 2t-Bui .. CH3 H2SO4 CH 3CH 2XOIIc IIEt^O—NHCCH 3N H rX OH反应实例 H 2SO 4C6H 5y CH 3CII*OHO__一 C5H5NH -C - CH 3脂肪族竣酸酯可用金属钠和醇圧原得一级醇。
氏不饱和竣酸酯 还原得相应的饱和醇°芳香酸酯也可进行本反应,但收率较低,本法 在氢化锂铝还原酯的方法发现以前,广泛地被使用,非共辄的双键可 不受影响9OEtOHR —C —OR 1 + 皿■ RCH 3OH + RQH反应机理首先酯从金属钠获得一个电子还原为自由基负离子,然后从醇中 夺取一个质子转变为自由基,再从钠得到一个电子生成负离子,泊除 烷细基成为醛,醛再经过相同的步骤还原咸醇钠,再酸化得到相应的 醇。
□O-EtCHR —C —OR' + Na ------------------------- — R^C —OR 1 _— R —C —OR 1_R —CH —OR* ------------ R —CH-OR ---------------------- R —C —H■ R —C —HiEtCHR —G —H ----------------Na +FCH 2OH反应实例醛酮也可以用本法还賦 得到相应的醇;Claisen- Schmidt 反应一个无:一氢原子的醛与一个带有:一氢原子的脂肪族醛或酮在稀氢氧化钠水溶液或醇 溶液存在下发生缩合反应,并失水得到:汀;不饱和醛或酮:反应机理NaR —CH 3(CHi )10CO^tNa EtOHCH/CH^KCHaOH 75%EtO 2C(CH^CO^t ——_■ EtOH HOCH XCH 抚CH 例畑CHgH^CHOC 哄⑴沖・叭如皿0HCH=CH-CHO 亠 H 2OClaise n 酯缩合反应含有僅-氢的酯在酚钠等碱性缩合剂作用下发生缩合作用,失去一分子 醇得到E 番同酸it 如2分子乙酸乙酯在金属钠和少量乙醇作用下发生缩合 得到乙麻乙酸乙酯。
华中科技大学有机化学第十二章 羧酸及其衍生物

Kochi反应便宜,对一级,二级,三级卤化烷的产率均好。
10.3 羧酸的合成反应
1. 烯或炔烃的氧化。
2. 醇或醛的氧化。 3. 烷基苯的侧链氧化。 4. 甲基酮的氧化(卤仿反应)。 5. 腈化合物的水解。 6. 格氏试剂与二氧化碳反应。 7. 苯酚钠盐与二氧化碳反应。
9.4 羧酸衍生物的结构与命名 1.羧酸衍生物的结构 羧酸衍生物的结构通式为RCOL (L= OR , NH2, NHR , NR2, X, OCOR等).这些化合物都具有酰基(RCO),因此又称酰基化合物.它们的 结构与羧酸相似,都具有羰基的键。并与L的一对未共用电子共扼.其电 子共轭与共振式如下:
丁二酸和戊二酸在单独加热或与乙酐共热时脱水生成环酐己二酸和庚二酸受热时同时发生脱水和脱羧生成较为稳定的失羧卤化将羧酸与ago反应得羧酸的银盐然后加等摩尔的溴或碘在无水四氯化碳中回流即可失羧得到溴代或碘代烷hunsdiecker反应
第十二章 羧酸及其衍生物
分子中含有羧基(-COOH,carboxyI group)的化合物叫做羧酸 (carboxyIic acid)。羧基是羧酸的官能团,除甲酸(HCOOH)外,羧酸 可看作是烃分子中的氢原子被羧基取代的产物。
生成酸酐的反应机理是一分子羧酸对另一分子羧酸的亲核加成-消去反应
3.生成酯 羧酸和醇或在强酸(硫酸,对甲苯磺酸等)催化下分子间脱水生成酯, 这个反应叫做酯化反应(esterification)。 酯化反应是可逆反应。为了提高产率,一般采用的方法是增加某 一种反应物的用量,或不断从体系中移去某一种产物。 实验证明,羧酸酯化时生成的水分子中的氧原子一般是来自羧酸 的羟基。例如,用同位素标记的醇与羧酸反应,其结果是同位素标记 的氧原子留在酯分子中。
六、二元羧酸受热的反应 二元羧酸受热易脱水、脱羧,生成产物的结构取决于两个 羧基的相对位置。无水草酸在加热时脱羧生成甲酸。
醛酮反应

第12章 活泼亚甲基反应在醛、酮、羧酸及其衍生物中,与羰基相邻的α-亚甲基(1)也受羰基拉电子效应的影响,因此α-碳上的氢也表现出一定的酸性,并可离解出一个质子形成碳负离子(2)。
(2)经过共振成为烯醇负离子(3),得到一个质子形成烯醇式(4)。
(1)式和(4)式之间的互变称为烯醇互变异构。
(1)式称为酮式(keto form ),(4)式称为烯醇式(enol form )。
H+C C O-H+34(酮式)(烯醇式)醛、酮、酸酸及其衍生物的α-亚甲基上的氢受到邻位羰基的活化而呈一定的酸性,因此常称为活泼亚甲基化合物。
活泼亚甲基化合物烯醇化程度越高,α-氢酸性越大,亚甲基越活泼。
而烯醇化程度与分子结构有关,例如,丙酮在液态时含有1.5×10-4%的烯醇(pK a 20),而乙酰丙酮则由于其烯醇式可形成分子内氢键以及共轭效应,在己烷中的烯醇含量高达92%,酸性较丙酮大得多(pK a 9),与苯酚相近(pK a 9.98)。
C H 2C C O C H 3O CH 3H 3(8%) (92%)与羧酸相比(pK a 4.76),烯醇是较弱的酸。
一些活泼亚甲基化合物的酸性见表12.1。
除了含羰基化合物外,其它带有吸电子基团(如硝基、亚硝基、烷氧基等)的化合物均有不同程度的烯醇化作用。
表12.1 一些活泼亚甲基化合物的酸性 化合物 pK a 化合物pK a HCOCH 2CHO CH 3COCH 2COCH 3 RCH 2NO 2 CH 3COCH 2CO 2R NCCH 2CN 5 910 11 11CH 3SO 2CH 2SO 2CH 3EtO 2CH 2CO 2Et RCH 2CHO RCOCH 2R’ RO 2CCH 2R’ RCH 2CN 12.5 13 16 19-29 24.5 25醛、酮、羧酸及其衍生物的羰基活化α-氢的能力有以下次序: -CHO > -COCO 2R > -COPh > -COR > -CN > -COX > -CO 2R > -CO 2H 这些羰基化合物的许多重要反应与它们的α-活泼亚甲基有关。
有机化学 第12章 含氮化合物

NH2 对氨基苯磺酸
4.命名芳胺时,当氮上同时连有芳基和脂肪烃基时, 应在芳胺名称前冠以N– ,明确取代基位置。
NHCH3 N(CH3)2 CH3 NCH2CH3
N-甲基苯胺
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
5.氨基连在侧链上的芳胺,一般以脂肪胺为母体来 命名
CH2CH2NH2 2-苯乙胺
(二)氨与醇或酚反应
Al2O3 350~400℃,0.5MPa
CH3OH + NH3
CH3NH2 + (CH3)2NH + (CH3)3N + H2O
OH
+ NH3
(NH4)2SO3 150℃,0.6MPa
NH2
+ H2O
二、由还原反应制胺
(一)硝基化合物的还原 这是制备芳胺常用的方法。 (二)醛和酮的还原氨化 醛和酮与氨或胺反应后,再进行催化氢化,称为醛 和酮的还原氨化。
NH2 MnO2,H2SO4 ~10℃ O O
§12—4 季铵盐和季铵碱
一、季铵盐 叔胺与卤代烷反应,生成季铵盐。 季铵盐是无色晶体,溶于水,不溶于非极性
有机溶剂。 季铵盐的最重要用途是用作阳离子表面活性 剂和相转移催化剂
二、相转移催化剂
(一)含义ຫໍສະໝຸດ 当两种反应物互不相溶时,就 构成了两相。由于反应物之间不容易接触, 反应较难进行,甚至不发生反应。若加入一 种催化剂使反应物之一由原来所在的一相, 穿过两相之间的界面,转移到另一相中,使 两种反应物在均相中反应,则反应较易进行。 这种催化剂叫做相转移催化剂。
(三)与叔胺反应 脂肪族叔胺在强酸性条件下,与亚硝酸形成盐。芳 香族叔胺与亚硝酸反应,生成氨基对位取代的亚硝 基化合物(芳环上的亲电取代反应)。
有机化学:第12章 含氮化合物

R4N+X22:46:50
R4N+OH- + X-
Br CO2H + NH3 (1 mol)
NH2 CO2H OH-
NH3+ CO2-
65-70%
PhNH2 + PhCH2Cl
PhNHCH2Ph 96%
Et3N + PhCH2Cl
Et3N+CH2PhClTEBA Triethybenzylammonium chloridel
——3o胺、叔胺
22:46:50
胺的命名
四、芳香族仲胺、叔胺,基前以N-示区 别苯环的取代(P223)
22:46:50
[胺的分类之二:芳香胺、脂肪胺(P222)]
胺的命名
五、结构比较复杂的胺,将氨基为取代 基(P223)
22:46:50
六、二元胺的命名
——[胺的分类之三:一元胺、二元胺等(P222)]
H2NCH2CH2CH2CH2NH2: 1,4-丁二胺
(腐胺)
H2NCH2CH2CH2CH2CH2NH2:1,5-戊二胺
(尸胺) 腐胺、尸胺是肉腐烂时产生的,极臭、剧毒
(P224)
22:46:50
七、季铵类化合物的命名
——胺、铵(P222)
(季铵碱,碱性与KOH相当)
22:46:50 (俗名: 1227——杀菌剂)
22:46:50
胺的命名
原则:
一、简单胺按所含烃基命名(P223)
22:46:50
胺的命名
二、多个烃基时表示出烃基个数(P223)
[胺的分类之一:伯、仲、叔(P222)]
22:46:50
胺的命名
三、烃基不同时先列简单的(P223)
有机化学:第十二章 醛和酮

分子量
58
58
58
60
沸点
-0.5
48.8
56.1
97.2
共四十八页
第三节 醛酮的化学性质(huàxuéxìngzhì)
δ δO CC
H
R (H )
酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳
涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应
卤代反应
醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。
机理(jī lǐ):
共四十八页
氨的衍生物能与醛、酮起加成反应,用于鉴别羰基的存在,称为羰基 试剂。
常用试剂:2,4-二硝基苯肼
R C
R'
O + H2NNH
NO 2
NO 2
R
-H2O
C
NNH
R'
NO 2
NO 2
黄色(huángsè)结 晶
反应产物用稀酸水解(shuǐjiě),可生成原来的醛、酮。用与分离和提纯醛或酮。
羰基是醛、酮的官能团。
O
R1
R
CO
CO
R2
H
O
羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质(wùzhì),如甘油
醛
(HOCH2CHOHCHO)和丙酮酸 (HOOCCOCH3)是细胞代谢作用的基本成分,
又是有机合成的重要原料和中间体。
共四十八页
第一节 醛和酮的分类(fēn lèi)和命名
共四十八页
一 、亲核加成反应(jiā chénɡ fǎn yīnɡ)
亲核加成反应是羰基(tānɡ jī)的特征反应,亲核试剂NuA与羰基C=O反应。
有机化合物的基本反应

—N+(CH3)3、—NO2、—CN、—SO3H、 与苯环直接相连的原子上有
—CHO、—COCH3、—COOH
重键(重键另一端是电负性
(钝化能力由强到弱)
大的元素)或带正电荷
3.2 稠环芳烃
(1)萘的反应
有机化学
(2)一取代萘的定位效应
①取代基为邻对位定位基时,使萘环活化(卤素除外),新取代主要进入同环α 位。 ②取代基为间位取代基时,使萘环钝化,新取代基主要进入异环α位(5.8 位)。
(2)丙二酸二乙酯
框线部分来自乙酰乙酸乙酯。
有机化学
丙二酸二乙酯亚甲基烃基化产物碱性水解后酸化加热脱羧,可得到取代乙酸。 框线部分来自于丙二酸二乙酯。
NOTE:
有机化学
9.3 其他涉及碳负离子的反应
(1)普尔金(Perking)反应 芳香醛和酸酐在相应羧酸盐存在下发生的类似羟醛缩合的反应,最终得到α, β-不饱和酸:
4.卤代烃
有机化学
(1)亲核取代反应
亲核取代反应分为 SN1 反应和 SN2 反应,其特点及影响因素如下:
项目
SN1
SN2
两
种 反应机理
反
应 反应动力学
单分子反应 v=k[RX]
双分子反应 v=k[RX][Nu-]
的 活性中间体
碳正离子
无
机 重排情况
可能有
无
理 定速步骤 及
形成碳正离子的一步,即取决于碳 过渡态的稳定性,即反应中心碳
LiAlH4、NaBH4、 KBH4、 异丙醇铝/异丙醇
主要还原羰基为醇
低温时主要还原 C=C
Li/液 NH3
双烯 加成
共轭二烯
(2)乙烯酮的反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
O
C
加成
R CX3
HO
O
消除
O
R C CX3 OH
C
+ CX3
R OH
O
R
C
+ O-
HCX3
(I)
(II)
❖ 当使用次碘酸钠溶液为卤化试剂时,乙醛和甲基酮能够迅速转 化成羧酸和碘仿,其中碘仿以黄色沉淀析出,很容易观察到, 故碘仿反应被用于乙醛和甲基酮的鉴定
CH3CH2OH I2/KOH CH3CHO
O 2 CH3COC2H5
1. EtONa/EtOH 2. H3+O
OO CH3CCH2COC2H5
❖ 反应机理
O CH3COC2H5 + OC2H5
O
O
CH3COC2H5 + CH2COC2H5
O CH2COC2H5 + HOC2H5
1
O
O
CH3 C CH2COC2H5 OC2H5
2
O
O
CH3 C CH2COC2H5
溴发生加成 反应
12.2.2 迪克曼缩合反应
❖ 分子内的酯缩合称为迪克曼(Dieckmann)缩合。这个反应 特别适合于合成五元和六元环型-酮酸酯。
CO2C2H5 1. C2H5ONa
CO2C2H5
2.H3+O
CO2C2H5 O
CO2C2H5 1. C2H5ONa
CO2C2H5
2.H3+O
CO2C2H5 O
CO2H
12.1 羰基化合物的-卤化
❖ 12.1.1 醛和酮的卤化
-位含有活泼氢的酮在酸或碱催化下可与卤素作用, 发生-氢的卤代反应:
O X2
C R CH3 X=Cl, Br or I
O C R CH2 X
❖ 酸催化机理
O
H+
C R CH3
O+H
-H-
C
R CH2
H
+
OH
XX
OH X-
CCΒιβλιοθήκη R CH2HCOOH + CHI3 (黄色)
CH3CHO
O
R CH3
O CH3
NaOCl
CO2H
CH3 CH3C CHCOCH3
KOCl
88%
CH3 CH3C CHCO2H
53%
12.1.3 脂肪酸的卤化
❖ 羧酸的-H酸性比醛、酮小,故而羧酸的-H远比醛和酮的H难以卤化,而且只限于氯化和溴化。-碘代酸需要间接的方 法合成。与羧酸相反,酰氯和酸酐的-H都容易被卤化。
R CH2 X
O
C
+ HX
R CH2 X
O
C6H5
C
+ CH3
Br2
AcOH
O
C
+ HBr
C6H5 CH2 Br
66% 对于不对称的酮,-氢被卤素取代的优先次序是
CH CH2 CH3,
❖ 醛类直接进行卤化,常被氧化成酸。如将醛转化成缩醛后再卤 化,然后水解缩醛,也能得到-卤代醛
RCH2CHO
CH3OH HCl
❖ 活泼亚甲基化合物烯醇化程度越高,-氢酸性越大,亚甲基越 活泼
HO CC
1(酮式)
C
O C
H+
2
OC C H+
3
OH CC
4(烯醇式)
O
O
C
C
CH3
CH2 CH3
(8%)
H
O
O
C
C
CH3 CH
CH3
(92%)
❖ 醛、酮、羧酸及其衍生物的羰基活化-氢的能力有以下次序: -CHO -COCO2R -COPh -COR -CN -COX -CO2R -
酰卤的卤化也要通过烯醇式,反应在酸催化下进行。
O
H+
OH
Br OH
Br Br
RCH2CBr
RCH CBr
RCH CBr + HBr
-H+
RCHCOBr Br
12.2 酯缩合反应
12.2.1 克莱森缩合反应
含有-活性氢的酯在碱性条件下失去一分子醇生成-酮酸酯, 这个反应称为酯缩合反应,或者克莱森(Claisen)缩合反应。
OCH3 RCH2CH
OCH3
Br2
Br OCH3 RCHCH
H3+O
OCH3
Br RCHCHO
❖ 碱催化机理
O
OH-
C R CH3
O
XX
C
R CH2
O
OH-
C
R CH2 X
O
+
C
X-
R CH2
O XX
C R CHX
O C R CHX
O
OH-
C
R CHX2
+
X-
O C R CX2
O C R CX2
12.2.3 交叉的酯缩合反应
两种不同的酯亦可发生缩合反应,称为交叉的酯缩合反应
一种酯中没有-H,另一种酯中含有-H时,它们的 缩合反应还是相当有用的
O
O
HCOC2H5 + CH3COC2H5
1. C2H5ONa 2. H+3O
OO HCCH2COC2H5
79%
O
O
1. C2H5ONa
C6H5CH2COC2H5 + C2H5OCOC2H5 2. H+3O
C6H5
(CH3)2CHCO2CH3 MeONa
O (CH3)2CHCCHCO2CH3
CH3
❖ 乙酰乙酸乙酯是一个由酮型(5)和烯醇型(6)互变异构体组 成的混合物。在烯醇型异构体(6)中存在分子内氢键。
CH3 C
OC2H5 C
OO
酯 5
氨解形成
酮
酰胺
CH3 C
OC2H5 C
OO H
6
烯醇
醛酮试剂反应形成 肟、腙等
脂肪酸在催化量的三氯化磷或三溴化磷存在下可进行氯化 或溴化
2P + 3Br2 3RCH2CO2H + PBr3
2PBr3 3RCH2COBr + P(OH)3
RCH2COBr + Br2
RCHCOBr + RCH2CO2H Br
RCHCOBr + HBr Br
RCHCO2H + RCH2COBr Br
OC2H5
OO CH3CCH2COC2H5 + OC2H5
中间体(4)的生成是酯 缩合反应的驱动力
OO CH3CCH2COC2H5 + OC2H5
3
OO CH3CCHCOC2H5 + HOC2H5
H+
4
OO CH3CCH2COC2H5
C6H5CH2CO2CH3
MeONa
O C6H5CH2CCHCO2CH3
XX
O
C R CX3
+ X-
❖ 羰基的-碳上只有一个质子,碱催化的反应也可生成单卤代产 物
O C6H5CCHCH2CH3
CH3
Br2 NaOH/H2O
O C6H5CCBrCH2CH3
CH3
12.1.2 卤仿反应
由于-CX3强拉电子作用,生成的三卤代产物中的羰基很容易受 OH- 的 亲 核 进 攻 , OH- 加 成 到 羰 基 碳 上 , 形 成 四 面 体 过 度 态 (I);然后,(I)中的三卤甲基作为离去基团离去,生成羧 酸(II)和三卤甲基负离子,后者再获取一个质子后生成卤仿。 这个反应称为卤仿反应。
第12章 活泼亚甲基反应
本章内容
12.1 羰基化合物的-卤化 12.2 酯缩合反应 12.3 羟醛缩合反应 12.4与羟醛缩合相关的反应 12.5 烷基化反应 12.6 磷和硫叶立德与醛、酮的缩合反应
❖ 醛、酮、酸酸及其衍生物的-亚甲基上的氢受到邻位羰基的活 化而呈一定的酸性,因此常称为活泼亚甲基化合物
