Curtius重排有机化学
Curtius重排有机化学
then t-BuOH, reflux, 81% O
CbzN O
HN
O
H
O
N
N
OO
N H
N H
CO2H
H
Syringolin A
C. R. J. Stephenson et.al. Org. Lett., 2010, 12, 3453-3455
2.4 the synthesis of carbamates
3.2 Lossen Rearrangement
Mechanism of Lossen Rearrangement
3.2 Lossen Rearrangement
Recent applicationsLeabharlann OR1OH N
H
CDI MeCN
O
O O
R1 N
CDI: 羰基二咪唑
J. A. stafford. et.al. J. Org. Chem. 1998, 63, 10040
R1 N C O R2 NH2 Isocyanate
O
R1 N H
NHR2
Urea derivative
R2 OH
O
R1 N H
OR2
Carbamate
2.1 Mechanism
Thermal rearrangement
Photochemical rearrangement
注意:由于氮烯存在的证据很难找到,也有人认为 基团的迁移和N2的离去为一协同过程。
Curtius Rearrangment
Contents
1 Introduction 2 CurtiuCsliRckeatorrandgdeTmitelent 3 OtherCNliucckletoopahdidlicTritelearrangement 4 ConcClulsicioknto add Title
有机人名反应-反应机理5

26
Beckmann 重排 反应实例:
(3)
27
用已知试剂及其他常用试剂制备下列化合物并解释所用反应机理,请利用 Beckmann重排
H
N
Br
C
O
??? N
OH
29
N OH
N HO
30
H N OH H
acid heat
HO HN
acid heat
H
31
H N OH H
acid heat
HO HN
O
O
O
54
Claisen 缩合 反应式:
55
机理:
Claisen 缩合
pKa 24.5
pKa 15.9
pKa 10
56
Claisen 缩合
反应实例:
当只有一个a-H时:
pKa 33
57
Claisen 缩合
应用:
O
O
H
O
O
O
Ph O
O O
O
O Ph
Ph O
O O
O O
O
58
Claisen 缩合
Br
Zn
O
OZnBr
RO O
R
OR
R OH O
R
OR 72
Demjanov 重排 反应式:
73
机理:
Demjanov 重排
74
Demjanov 重排 反应实例:
75
76
Diels-Alder反应 反应式:
77
机理:
Diels-Alder反应
78
说明:
Diels-Alder反应
以吸电子与给电子来解释,吸 与给使双键两端出现正负,再 以正负相吸来解释。
库尔提斯重排反应

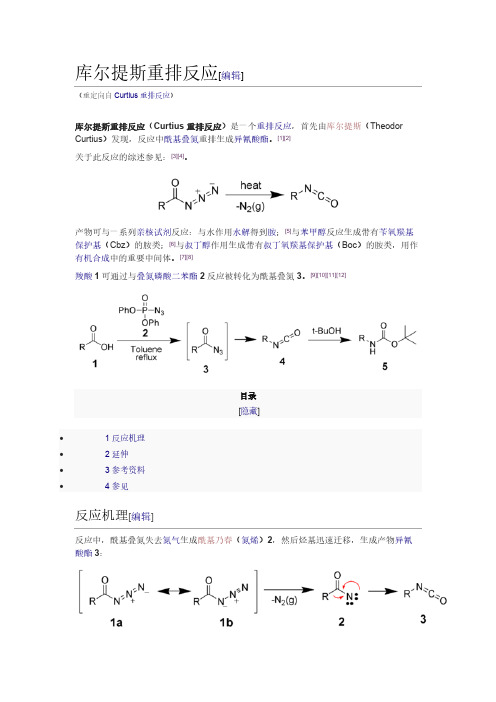
库尔提斯重排反应[编辑](重定向自Curtius重排反应)库尔提斯重排反应(Curtius重排反应)是一个重排反应,首先由库尔提斯(Theodor Curtius)发现,反应中酰基叠氮重排生成异氰酸酯。
[1][2]关于此反应的综述参见:[3][4]。
产物可与一系列亲核试剂反应:与水作用水解得到胺;[5]与苯甲醇反应生成带有苄氧羰基保护基(Cbz)的胺类;[6]与叔丁醇作用生成带有叔丁氧羰基保护基(Boc)的胺类,用作有机合成中的重要中间体。
[7][8]羧酸1可通过与叠氮磷酸二苯酯2反应被转化为酰基叠氮3。
[9][10][11][12]目录[隐藏]∙ 1 反应机理∙ 2 延伸∙ 3 参考资料∙ 4 参见反应机理[编辑]反应中,酰基叠氮失去氮气生成酰基乃春(氮烯)2,然后烃基迅速迁移,生成产物异氰酸酯3:延伸[编辑]在Curtius重排反应的基础上,Darapasky递降反应(A. Darapsky, 1936)以α-氰基酯为原料,通过重排反应生成氨基酸。
[13]参考资料[编辑]1. ^ Curtius, T. Ber.1890, 23, 3023.2. ^ Curtius, T. J. Prakt. Chem.1894, 50, 275.3. ^ Smith, P. A. S. Org. React.1946, 3, 337-449. (Review)4. ^ Scriven, E. F.; Turnbull, K.; Chem. Rev.1988, 88, 297-368. Review5. ^ Kaiser, C.; Weinstock, J. Organic Syntheses, Coll. Vol. 6, p.910 (1988); Vol. 51,p.48 (1971).Article6. ^ Ende, D. J. a.; DeVries, K. M.; Clifford, P. J.; Brenek, S. J. Org. Proc. Res.Dev.1998, 2, 382-392.7. ^ Lebel, H.; Leogane, O.; Org. Lett.2005, 7(19),4107-4110. doi:10.1021/ol051428b8. ^ Shioiri, T.; Yamada, S. Organic Syntheses, Coll. Vol. 7, p.206 (1990); Vol. 62,p.187 (1984).Article9. ^ Shioiri, T.; Ninomiya, K.; Yamada, S. J. Am. Chem. Soc.1972, 94,6203-6205.doi:10.1021/ja00772a05210. ^ Ninomiya, K.; Shioiri, T.; Yamada, S. Tetrahedron1974, 30, 2151-2157.11. ^ Wolff, O.; Waldvogel, S. R. Synthesis2004, 1303-1305.12. ^ Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E. Organic Syntheses, Coll.Vol. 6, p.95 (1988); Vol. 59, p.1 (1979). Article13. ^/reactions/RXN051.htm(重定向自贝克曼重排)贝克曼重排反应(Beckmann rearrangement)是一个由酸催化的重排反应,反应物肟在酸的催化作用下重排为酰胺。
有机重排反应总结

有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4.Hofmann-loffler-freytag反应:质子化N-卤化胺经热分解或光解形成六氢吡啶等的反应。
有机选论

各种异氰酸酯的非光气合成 异氰酸酯是重要的有机合成中间体,其反应活性高,能与亲核 试剂进行加成,能参加众多的精细有机合成反应,已被广泛应 用于农药和医药等精细有机合成行业和高分子工业。 在Curtius重排里,用亚硫酰氯(SOCl2)作为酰基氯化剂,从而 出现了一些异氰酸酯的非光气合成 例:合成异氰酸苯酯
芳胺在亚硝酸钠和氯化亚锡作用下生成苯肼 ,随后与丙酮酸反应,一锅法制得腙,它与二 苯叠氮磷酸在甲苯中反应,生成酰基叠氮化
物,随后发生Curtius重排,得到异氰酸酯,
最后关环生成三唑啉酮。在制备商品化除草
剂磺酰三唑酮和三唑酮草酯时,利用合成关
键中间体三唑啉酮。
相关文献:
1.绿色的Curtius重排及其新应用的研究 [期刊论文] 陈中元, 严剑峰, 陈玲英 - 《当代化工》 2006年5期 2.三唑啉酮衍生物合成方法研究进展 [期刊论文] 骆焱平- 《化学世界》 2011年9期 3.1-氨基-7-甲氧基-β-咔啉及其1-烷氧羰基氨基衍生物的合成和初 步抗肿瘤活性究 [期刊论文] 徐广宇, 周伊, 左高磊, 蒋勇军 - 《有机化学》 2009年10 期 4.酰基叠氮单体的合成、聚合反应及其聚合物的应用研究 [学位论文] 郑海庭, 2011 - 中国科学技术大学:高分子化学与物 理 5.合成芳香异氰酸酯最佳条件的探讨 [期刊论文] 冯桂荣, 张相平, 张会茹, 史春晖- 《唐山师范学院学报》 2005年5期 6.1-己胺甲酰基-5-氟尿嘧啶的新合成路线 [期刊论文] 古凤才, 史云梅, 王彦广, 王金明, 聂建明 - 《化学工业与 工程》 2001年5期
Curtius重排反应新应用
1.高收率地制备6-氮杂嘌呤衍生物 1,2,4-三嗪类化合物可以对某些肿瘤细胞产生抑制作用, 而6-氮杂嘌呤类衍生物则是制备1,2,4-三嗪类化合物的
有机重排反应详尽总结

有机重排反应详尽总结重排反应(rearrangement reaction)是分子的碳骨架发生重排生成结构异构体的化学反应,是有机反应中的一大类。
重排反应通常涉及取代基由一个原子转移到同一个分子中的另一个原子上的过程,现将有机重排反应进行一个详尽的总结。
(1)Amadori重排反应酸或碱催化下醛糖的N-糖苷(糖胺,glycosylamines)异构化生成1-胺基-1-脱氧酮糖的反应被称为Amadori重排反应。
此反应的底物和产物都称为“Amadori化合物”。
各种Lewis酸都已应用于此反应:CuCl2 , MgCl2 , HgBr2 , CdCl2 , AlCl3 , SnCl4 , etc。
此反应中只需催化量的酸就可以催化胺和醛糖反应,进而重排。
伯胺,仲胺,脂肪胺或芳香胺都可以发生此反应。
糖胺类化合物会发生复杂的美拉德反应(食物在烹饪或储藏过程中糖,胺,氨基酸和蛋白质等进行重排和降解)。
此反应中生成的黑色产物是由于发生了此类非酶褐变反应。
(2)Baker-Venkataraman重排贝克-文卡塔拉曼重排反应(Baker-Venkataraman重排)是2-乙酰氧基苯乙酮衍生物在碱作为催化剂之下生成1,3-二酮的反应。
这个反应常用于制造色酮和黄酮类化合物。
(3)Bamberger RearrangementN-芳基羟胺在强酸水溶液作用下重排为氨基苯酚的反应。
(4)Beckmann Rearrangement贝克曼重排反应(Beckman rearrangement)指醛肟或酮肟在酸催化下生成N-取代酰胺的亲核重排反应,反应中起催化作用的酸常用五氯化磷。
此反应是由德国化学家恩斯特·奥托·贝克曼发现并由此得名。
(5)Brook RearrangementC-Si→O-Si的离子性重排反应,从羟基硅烷到硅醚的转化。
Brook 重排反应的推动力是产物中键能较高的 Si-O 键的生成。
库尔提斯重排反应-推荐下载
在一个研究中[5],研究者使用电脑模拟丙酮肟在贝克曼溶剂中的重排反应,并考虑到了溶 剂分子和取代物的影响。模拟表明,有三个乙酸分子和一个质子(以氧鎓的形式存在)参 与了反应。形成亚胺中间体后(σ 配合物),甲基通过协同反应迁徙到氮上,并推走羟基。 羟基中氧原子受到三个乙酸分子的稳定。接下来,一分子水进攻亲电的碳原子,其中一个 氢原子被一个乙酸接收,生成的中间体为 N-甲基乙酰氨酸,其中氧原子为四配位。最后异 构化形成稳定的产物酰胺。
p.48 (1971).Article 6. ^ Ende, D. J. a.; DeVries, K. M.; Clifford, P. J.; Brenek, S. J. Org. Proc. Res.
Dev. 1998, 2, 382-392. 7. ^ Lebel, H.; Leogane, O.; Org. Lett. 2005, 7(19), 4107-
延伸[编辑]
在 Curtius 重排反应的基础上,Darapasky 递降反应(A. Darapsky, 1936)以 α-氰基酯 为原料,通过重排反应生成氨基酸。[13]
参考资料[编辑]
1. ^ Curtius, T. Ber. 1890, 23, 3023. 2. ^ Curtius, T. J. Prakt. Chem. 1894, 50, 275. 3. ^ Smith, P. A. S. Org. React. 1946, 3, 337-449. (Review) 4. ^ Scriven, E. F.; Turnbull, K.; Chem. Rev. 1988, 88, 297-368. Review 5. ^ Kaiser, C.; Weinstock, J. Organic Syntheses, Coll. Vol. 6, p.910 (1988); Vol. 51,
异氰酸酯中间态的重排反应

强酸(硫酸、聚磷酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及酰胺。
反应由卡尔· 弗里德里希· 施密特在1924年发现,一般采用质子酸(如硫酸、多聚磷 酸、三氯乙酸)或路易斯酸催化。如果原料在酸中稳定,则这个反应产率很高, 高于同类型的霍夫曼重排反应、Lossen重排反应及Curtius重排反应。使用的羧酸 可以是一元或二元直链脂肪羧酸、脂环族羧酸或芳香族羧酸。叠氮酸及酰基叠氮 均是易爆且有毒的化合物,使用时需注意安全。
生成异氰酸酯中间态的人名反应
目录
Curtius 反应 Hofmann 重排 Lossen 反应 Schmidt反应
Curtius 重排反应
Curtius重排反应是首先由库尔提斯(Theodor Curtius)于1890年发现,反应中 酰基叠氮在惰性溶剂中加热分解重排生成异氰酸酯。
产物可与一系列亲核试剂反应:与水作用水解得到胺;与苯甲醇反应生成带有
பைடு நூலகம்
苄氧羰基保护基(Cbz)的胺类;与叔丁醇作用生成带有叔丁氧羰基保护基
(Boc)的胺类,用作有机合成中的重要中间体。
Curtius 反应
羧酸可通过与叠氮磷酸二苯酯(DPPA)反应被转化为酰基叠氮加热重排成 异氰酸酯。
反应机理:
Curtius 反应
应用实例:
Hofmann 重排
霍夫曼重排反应又称霍夫曼降解反应(Hofmann降解),由奥古斯特· 威
Hofmann 重排
反应变化:
一些反应物可以用来代替溴,如N-溴代琥珀酰亚胺用1,8-二氮杂二环[5.4.0]十一碳7-烯(DBU)作为生物碱进行反应。
用甲醇钠和甲醇的混合液代替氢氧化钠,可以提高产率。此时中间产物异氰酸酯 会和甲醇反应生成易水解和分离的氨基甲酸甲酯。 参考文献:Org. Synth. 2002, 78, 234
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.3 Wolff Rearrangement
NHRN12
OR3
Rh2(OAc)4 2H2O, PhH, reflux.
R1 NO
Ar
S
OO
Ar S
CO2R3
K. Kim. et.al. Org. Lett. 2002, 4, 873.
N2 O
Br
OTIPS
HO
OTIPS
C
hν
O Br
Br
Me
DCE, rt; then 80oC
D. A. Evans. et.al. Org. Lett. 2001, 3, 3009-3012
D. ROmo. et.al. J. Am. Chem. Soc. 2003, 125, 6344
3.2 Lossen Rearrangement
W. Lossen (1872)
Lossen Rearrangement
First published in 1881:
Hofmann, A. W. Chem. Ber. 1881, 14, 2725. Shioiri, T. Comp. Org. Syn. 1991, 6, 800‐806. (Review)
MOR or M(OR)2 MOX or NaBrO2
H2O / 0oC then heat
Introduction
亲核重排(缺电子重排)
在缺电子重排反应中,基团Z带着一对电子从原子A迁移到另一个缺 少电子的原子B上,多数为1,2-重排,即基团的迁移在两个相邻原子 间发生:
常见的亲核重排类型
缺电子碳链的重排 Baeyer-Villiger oxidation rearrangement, Backman rearrangement, pinacol rearrangement 等.
3.1 Hofmann Rearrangement
Recent applications
O PhIX2
R NH2
J. W. Keillor et.al. J. Org. Chem. 1997, 62, 7495.
OX I
R N Ph H
1,2-shift
N RC
O
H2O
R NH2
O O PhIX2 S
+
71%
OTIPS
Me
Me
steps
O
O
Me Salvilenone
R. L. Danheiser. et.al. J. Am. Chem. Soc. 1994, 116, 9471.
3.2 Lossen Rearrangement
Mechanism of Lossen Rearrangement
3.2 Lossen Rearrangement
Recent applications
O
R1
OH N
H
CDI MeCN
O
O O
R1 N
CDI: 羰基二咪唑
J. A. stafford. et.al. J. Org. Chem. 1998, 63, 10040
2.4 the synthesis of carbamates
D. H. Appella. et.al. J. Am. Chem. Soc. 2004, 126, 15067-15073
Ph
N Ph 1) TFA, CH2Cl2
O 2) DPPA, Et3N, toluene
3) BnOH
Ot-Bu
2.2 the synthesis of amines
D. L. Boger et.al. J. Am. Chem. Soc. 2006, 128, 15683-15696. Olivier Baudoin et.al. Angew. Chem. Int. Ed. 2009, 48, 179 -182
2.2 the synthesis of amines
Nakahara, S.et.al. J. Am. Chem. Soc. 1993, 115, 10733-10741. F. M. Menger.et.al. Angew. Chem. Int. Ed. 2002, 41, 2581 -2584.
O O
NH
NH NH
1) LiOH, H2O, THF, H2O2 50oC, 12h, 92%
2) DIPEA, acetone, ClCO2Et, 0oC; NaN3, rt, 12h, 75%
O O
NH NH
NH NH
R. L. Funk et.al. Org. Lett., 2006, 8, 3995-3998
碳烯与氮烯的重排 Curtius rearrangement , Schmidt rearangement , Wolff rearrangement, Lossen rearangement , Hofmann rearrangement
Introduction
Julius Wilhelm Theodor Curtius (1957-1928), 德国化 学家,生于德国鲁尔区的Duisburng。先后师从Bensun和 Kolbe 。 1882 年 , 在 Leipzig 大 学 取 得 博 士 学 位 。 1884 年,在慕尼黑大学跟随Baeyer工作。在1890年到1894年 间,发现了酰基叠氮化物的重排反应,并以其名字命名。 除此之外,他还发现了叠氮醋酸乙酯(1883),联氨 (1887),叠氮化合物(1891),吡唑啉衍生物(1891) 四嗪衍生物(1906),多肽(1904)。
then t-BuOH, reflux, 81% O
CbzN O
HN
O
H
O
N
N
Hale Waihona Puke OON HN HCO2H
H
Syringolin A
C. R. J. Stephenson et.al. Org. Lett., 2010, 12, 3453-3455
2.4 the synthesis of carbamates
N2
O
O NuH (1 equiv), PhMe
O
μ W ( 300 W), 1- 30 mi n
n
-N2
n
R
29 examples
R
O Nu
n = 0, 1, 2
Y. Coquerel. et.al. J. Org. Chem. 2009, 74, 415.
H. Yang. et.al. Org. Lett. 2000, 2, 2177.
Carda, M., Marco, J. A. Tetrahedron: Asymmetry, 2002, 13, 1005-1010. M. Lautens. et.al. J. Am. Chem. Soc. 2005, 127, 15028-15029.
2.4 the synthesis of carbamates
M = Na, K, Ba, Ca
X = Cl, Br
LTA or PhI(OCOR)2 or PhI(OH)OTs or
PhIO pH = 1-3 / solvent / H2O
LTA: 四乙酸铅
3.1 Hofmann Rearrangement
Mechanism of Hofmann Rearrangement
55%
Ph N Ph
NH Cbz
1) H2, Pd(OH)2/C MeOH, HCl
2) o-anisaldehyde, NaBH(OAc)3, CH2Cl2
66%
H N Ph
NH OMe
2-Epi-CP-99,994
J. Szymoniak. et.al. Org. Lett., 2008, 10, 2473-2476
2.3 the synthesis of ureas
A Solid-Phase Synthesis of N,N′-Disubstituted Ureas
M. T. Migawa.et.al. Org. Lett., 2000, 2, 3309-3311
H. Lebel, et.al. Org. Lett., 2006, 8, 5717-5720
O R1 C
N
CO2
HNR2 R3 R 4OH
O
R1 N H
NR2R3
O
R1 N H
OR4
P. Dube. et.al. Org. Lett. 2009, 11, 5622.
3.2 Lossen Rearrangement
Recent applications
K. Ohmoto. et.al. Synlett. 2001, 299.
3.3 Wolff Rearrangement
Wolff (1902)
Lossen Rearrangement
3.3 Wolff Rearrangement
Mechanism of Wolff Rearrangement
3.3 Wolff Rearrangement
Recent applications
2.4 the synthesis of carbamates
O H
CbzN O
HO2C steps
Garnes's alde
K.Tomioka. et.al. Org. Lett., 2009, 11, 2007-2009
CbzN
DPPA, Et3N, 4A MS, toluene, rt
BocHN
R1 N C O R2 NH2 Isocyanate
O
R1 N H
NHR2
Urea derivative
