大气中污染物的转化
污染物的环境迁移和转化机制

污染物的环境迁移和转化机制随着现代工业化和城市化的快速发展,环境污染已经成为了我们面临的一个严峻问题。
产生污染物的源头往往是工业、农业、交通等各个方面,而这些污染物在环境中的迁移和转化机制则是我们需要探讨的一个重要话题。
在本文中,我们将从三个方面进行讨论:污染物在大气、土壤和水中的迁移和转化机制。
一、大气中的污染物迁移和转化机制大气污染是全球环境面临的一个共同挑战,其中主要污染物包括二氧化硫、氮氧化物、臭氧、颗粒物等。
这些污染物在大气中的迁移和转化机制主要有以下几方面。
1、物理迁移大气中的污染物往往通过物理迁移的方式,随着气流的传输而在大气中传播。
例如,风起时,二氧化硫、氮氧化物等污染物就会随着气流的传递而向周围传播,范围可以达到数十公里。
2、化学转化大气中的污染物也可以通过化学反应进行转化,这种化学反应可以是自催化反应,也可以是光催化反应。
例如,在光照下,氮氧化物会与挥发性有机物发生反应,生成臭氧等氧气化合物,这就是光化学反应。
3、降雨和沉积大气中的污染物在接近地面时,会被降雨和沉积作用所固定,从而减少它们对环境的影响。
在雨水中,大气中的污染物会形成酸雨,对土壤和水体的污染作用加剧。
二、土壤中的污染物迁移和转化机制土壤是生态系统的一个重要组成部分,土壤中的污染物对环境造成的威胁是不可忽视的。
在土壤中,污染物的迁移和转化机制主要有以下几方面。
1、扩散和渗透土壤中的污染物可以通过扩散和渗透的方式进行迁移,这种方式和大气中的物理迁移类似。
污染物在土壤中的扩散和渗透受到土壤质量和结构的影响,不同的土壤类型对污染物的扩散和渗透具有不同的影响。
2、吸附和解析物质在土壤中的吸附和解析的过程是污染物在土壤中的转化机制之一。
污染物在与土壤颗粒接触时,会被吸附在颗粒表面。
根据不同的污染物和土壤类型,吸附的程度和效果有所不同。
3、微生物降解微生物降解是土壤中污染物的重要转化机制之一。
有些污染物可以被土壤中的细菌和真菌等微生物进行降解,这样就可以减少其对环境的影响。
22大气中污染物的迁移和转化

22大气中污染物的迁移和转化大气污染是严重影响人类健康和环境质量的问题之一。
大气污染物的迁移和转化是大气环境中重要的过程,它们的行为对空气质量和生态系统的影响至关重要。
本文将介绍22种常见的大气污染物的迁移和转化机制,以加深对大气污染问题的理解。
首先,我们来讨论大气中颗粒物的迁移和转化。
颗粒物是大气污染的主要成分之一,由固体和液体颗粒组成。
颗粒物的迁移主要受到空气流动、重力沉降和湿沉降的影响。
在空气中,颗粒物会受到风力的作用,通过对流和湍流运动的扩散,以及吸附、沉积等机理来传播。
一些较大的颗粒物会因重力作用而沉降到地面,而较小的细颗粒物则更容易被气流携带,并通过湿沉降的方式降落到地表。
对于气态污染物,其迁移主要受到大气扩散、湍流混合和物理吸附的影响。
大气扩散是气态污染物迁移的主要机制之一,它是指气体在浓度差异的作用下发生的传输过程。
气态污染物的浓度差异造成了压力梯度,从而驱动了气体的扩散。
此外,气象因素如气温、风速和湍流运动也会对气态污染物的迁移和扩散起到重要的影响。
转化是大气污染物从一种形式转变为另一种形式的过程。
对于颗粒物而言,转化通常包括物理变化和化学变化两种形式。
物理变化主要是指颗粒物在大气中的扩散和沉降,以及颗粒物的粒径和表面化学性质的变化。
化学变化主要指的是颗粒物与大气中的气态污染物、水汽以及光等作用下发生的化学反应。
这些转化过程可以增加或减少颗粒物的大小、化学成分和毒性,从而对空气质量和人体健康产生重要影响。
气态污染物的转化主要通过化学反应进行。
光化学反应是大气中气态污染物转化的重要机制之一。
例如,大气中的一氧化氮和氧气反应生成二氧化氮,在太阳光的照射下,二氧化氮会进一步分解为氮氧化合物和臭氧。
此外,气态污染物还可以通过化学还原、氧化和水解等反应进行转化。
这些化学反应会引起大气中的各种复杂反应网络,对大气的化学结构和组成产生重要影响。
综上所述,大气污染物的迁移和转化是大气污染问题的核心。
第2章 大气环境化学-4-转化

NO2(aq) k=9.90×10-8mol.L-1.Pa-1 × )
+
K 2 NO 2 (g) + H 2 O ←1 → 2 H
+ NO
− 2
+ NO
− 3
K NO(g) + NO 2 (g) + H 2 O ← 2 → 2 H
+
+Leabharlann 2 NO− 2K 1 = 2 .4 × 10
−8
(mol.L
★ 3.3.3氮氧化物的气相转化 氮氧化物的气相转化
的氧化: (1)NO的氧化: ) 的氧化 O3为氧化剂: NO+O3 → NO2 + O2 为氧化剂: + RO2·具有氧化性,可将 具有氧化性, 氧化成NO 具有氧化性 可将NO氧化成 2: 氧化成 NO + RO2· →NO2+ RO· O2从RO·中靠近 的-CH2-摘除一个 ,生成 中靠近O·的 摘除一个H·,生成HO2·和相应醛。 和相应醛。 中靠近 摘除一个 和相应醛 RO· + O2 → R′CHO + HO2· HO2· + NO → HO· + NO2 式中R′比 少一个碳原子 少一个碳原子。 式中 比R少一个碳原子。 HO·和RO·也可与 直接反应生成亚硝酸和亚硝酸酯: 和 也可与NO直接反应生成亚硝酸和亚硝酸酯 直接反应生成亚硝酸和亚硝酸酯: 也可与 HO· + NO → HNO2 RO· + NO → RONO
3.3.6 氮氧化物污染的控制
3.3.6 氮氧化物污染的控制
通过改进燃烧方式来控制NOX的生成和排放量。降低 的生成和排放量。 通过改进燃烧方式来控制 燃烧温度; 降低O 分压; 减小烟气滞留时间; 燃烧温度 ; 降低 2 分压 ; 减小烟气滞留时间 ; 降低燃 料中的N含量和严格控制空气过剩系数。 料中的 含量和严格控制空气过剩系数。 含量和严格控制空气过剩系数 缺点:燃烧不完全,烃类化合物、烟尘、 缺点 : 燃烧不完全 , 烃类化合物 、 烟尘 、 CO的排放 的排放 有所增加。 有所增加。
大气污染物的迁移与转化过程及其对环境质量的影响分析

大气污染物的迁移与转化过程及其对环境质量的影响分析大气污染是当今社会所面临的一大环境问题,它对人类健康和生态系统造成巨大的威胁。
大气污染物的迁移与转化过程是影响环境质量的重要因素。
本文将从大气污染物的源、迁移与转化过程以及对环境质量的影响等方面进行分析。
一、大气污染物的源大气污染物的源可以分为自然源和人为源。
自然源包括火山喷发、沙尘暴等,但其排放量相对较低,对大气环境质量的影响有限。
相比之下,人为源是大气污染物的主要来源,主要包括工业排放、交通尾气、农业活动和生活废弃物等。
工业排放是大气污染物的重要来源之一。
随着工业的不断发展和城市化进程的加快,工业生产带来的废气排放量持续增加,包括二氧化硫、二氧化氮、颗粒物等污染物,严重影响了空气质量。
交通尾气也是大气污染物的重要来源之一。
机动车的增多使得尾气排放成为城市大气污染的主要原因之一,尤其是一氧化碳、氮氧化物和颗粒物的排放量高,对空气质量的影响不容忽视。
农业活动也会导致大气污染物的排放。
农业生产中使用的农药和化肥含有一些有害物质,这些物质在施用过程中会转化为大气污染物,如氨、二氧化碳等。
此外,农作物的露天焚烧和畜禽养殖等也会造成大量的污染物释放,对环境质量造成严重影响。
二、大气污染物的迁移与转化过程大气污染物的迁移与转化过程是指大气中各种污染物的传输与化学反应过程。
这一过程不仅决定了大气污染物的浓度分布,还直接影响到环境质量。
在大气传输过程中,扩散、对流和湍流等因素起着重要作用。
大气污染物会通过扩散作用在空气中传输,同时受到空气流动和混合的影响。
此外,大气层中的对流运动也会导致大气污染物在不同高度的传输差异。
大气污染物的化学反应过程也是大气质量变化的重要因素。
大气污染物之间会发生一系列化学反应,如氧化、还原、酸碱反应等,这些反应不仅影响着大气污染物的浓度分布,还会生成新的污染物。
三、大气污染物对环境质量的影响大气污染物的迁移与转化过程直接影响着环境质量,对人类健康和生态系统产生了重要影响。
环境化学:第二章大气环境化学 3
-4
λ < 120 nm
N2 + hν
N+N
120 160 200 240
λ (nm)
图2-29 O2吸收光谱(R. A. Bailey, 1978)
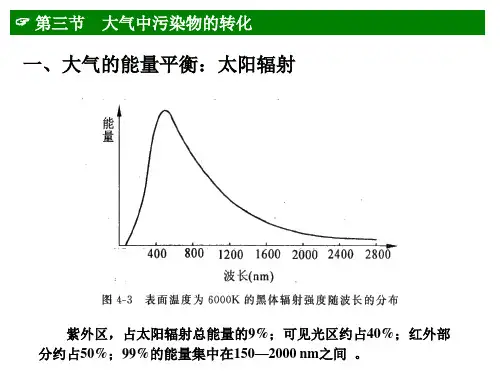
第三节 大气中污染物的转化
(2)臭氧的光离解
O + O2 + M 低碰于撞1反00应0 km的大气中,O3 + M
臭氧吸收1180 nm以下的光就可以离解,但主要 吸收290 nm以下的光,较长波长的光可以进入对流 层和地面。
A :B 能量 A+ + BA :B 能量 A·+B·
不对称裂解 对称裂解
自由基——由对称裂解生成的带单电子的原子或原子 团称为自由基。
第三节 大气中污染物的转化
2、自由基反应(free radical reaction)
凡是有自由基生成或由自由基诱发的反应都 叫做自由基反应。
CCl3F + hγ(175~220nm)
c. H2O2 + hν 2·OH
第三节 大气中污染物的转化
1、 HO 自由基的来源
HO最高含量出现在热带,因为那里温度高,太阳辐射强。
第三节 大气中污染物的转化
2、 HO2自由基的来源
a. 甲醛光解(主要来源):
HCHO + hν
H + HCO
H+O2 + M HCO+O2
HO2 + M HO2+CO
第三节 大气中污染物的转化
3、大气中重要吸光物质的光离解 4
(1) O2和N2的光离解
3
2
O2键能493.8KJ/mol。相
1
应波长为243nm。在紫外区 lgε
大气化学中的污染物迁移与转化

大气化学中的污染物迁移与转化污染物的迁移和转化是影响大气质量的重要因素。
在大气环境中,污染物会经历一系列的化学反应和物理过程,从而发生动态变化,对大气环境和人类健康产生一定的影响。
本文从大气化学的角度探讨污染物的迁移和转化过程,以及对环境和健康的影响。
一、污染物在大气中的迁移过程污染物在大气中能够进行迁移的原因是受到了气体运动的影响。
大气中的污染物可分为两类,一类是颗粒物,一类是气态污染物。
对于颗粒物来说,其迁移过程受到两种运动的影响,分别是大气中的水平输送和垂直扩散。
而对于气态污染物,则主要受空气的输送和扩散作用。
大气中的水平输送主要由风力所驱动,其方向与速度会发生变化。
当空气通过地形的障碍物时,也会受到地形的影响,产生不同的气流。
而大气中的垂直扩散影响来自气压的变化和导致的温度差异。
这种输送和扩散过程,不同的污染物会有不同的迁移特征和影响范围。
在此基础上,可以对不同的污染物采取不同的减排措施。
二、污染物在大气中的转化过程污染物在大气中变化的过程,一部分是受到自然的影响,比如光照、风速等因素的作用,另一部分则是受到人类活动的影响,比如机动车、电厂等的排放。
在大气中,氧气及其他气体的作用,与有机化合物和无机化合物反应,产生了大量的化学反应。
这些反应的产物有时比原始物质更为危险。
大气中的光化学反应是导致污染物转化的主要过程。
该过程可以分为两类,一类是直接光化学反应,一类是间接光化学反应。
直接光化学反应通常涉及有机化合物的氧化反应,如VOCs(挥发性有机物),产生臭氧和其他氧化产物。
间接光化学反应则通常涉及氮氧化物和其他化学物质的作用。
三、对健康和环境的影响空气污染对人类健康和环境产生负面影响。
大气化学在解释污染物对环境和健康的影响方面扮演着重要的角色。
空气污染物对人类健康的影响主要表现为呼吸系统疾病,如哮喘、支气管炎、肺癌等。
此外,空气污染还会造成眼睛病变、心脏病等疾病。
对于环境来说,空气污染造成的主要危害包括气候变化、酸雨、植物和动物的生长和繁殖等问题。
大气环境中有机污染物的迁移与转化
大气环境中有机污染物的迁移与转化大气环境中的有机污染物对人类健康和生态系统造成了巨大的影响。
它们广泛存在于空气中,随着大气运动和化学反应的影响,这些有机污染物不仅会迁移到不同的地区,还会发生一系列的转化过程。
了解有机污染物的迁移和转化机制,对于制定有效的监控和治理措施至关重要。
有机污染物的主要来源是人类活动,如汽车尾气、工业废气排放和农药使用。
这些有机化合物在大气中经历着几个重要的迁移方式:对流、扩散和沉降。
对流是大气中垂直气流的运动,它可将污染物快速地向高空迁移。
扩散是由于分子之间的碰撞而引起的无序运动,使得污染物在水平方向上扩散。
沉降是指污染物通过重力作用从大气中下降到地面。
然而,大气环境中的有机污染物并不是永远存在于原始形式。
它们会发生一系列的转化,包括氧化、光解和降解等。
氧化是指污染物与大气中的氧气发生反应,一种典型的氧化反应是光化学反应,即污染物在光的照射下与氧气和臭氧发生反应。
光解是指在光照下,有机污染物发生断裂,形成更简单的化合物。
降解是指有机污染物分子逐渐断裂,最终转化为非有机化合物。
近年来,对于有机污染物的迁移和转化机制进行了广泛的研究。
研究表明,大气运动是有机污染物迁移的主要驱动力。
例如,在季风影响下,大气中的污染物可以从一个地区迁移到另一个地区,并通过降雨等形式沉降到地面。
同时,大气中的光照和氧气含量也对有机污染物的转化起着至关重要的作用。
光照可以促使有机污染物发生光解反应,而氧气的存在则会引发氧化反应。
然而,尽管有机污染物的迁移和转化已被广泛研究,但仍存在许多挑战。
例如,有机污染物在大气中的迁移路径仍然不够清楚。
此外,有机污染物的转化速率受到许多因素的影响,包括温度、湿度和气候等。
因此,未来的研究需要更加系统地探索有机污染物的迁移和转化机制,以便更好地制定监控和治理策略。
综上所述,大气环境中的有机污染物不仅会迁移到不同的地区,还会发生一系列的转化。
了解有机污染物的迁移和转化机制对于制定有效的监控和治理措施至关重要。
大气污染物在环境中的迁移和转化规律
大气污染物在环境中的迁移和转化规律大气污染物的排放对环境和人类健康产生了严重影响,因此研究大气污染物的迁移和转化规律对于减少污染物的排放和保护环境具有重要意义。
本文将探讨大气污染物在环境中的迁移和转化规律。
首先,大气污染物的迁移主要通过空气传播进行。
大气污染物在源地产生后,受到大气风向的影响,通过空气中的颗粒物、气相物质等载体,迁移到远离源地的地区。
例如,来自工业生产、交通尾气和燃煤等活动产生的二氧化硫、氮氧化物等大气污染物会随着风的传播,被带到远离污染源的地区,造成大范围的污染。
其次,大气污染物在迁移过程中会发生转化反应。
大气中的光照、温度、湿度等因素会影响大气污染物的光解、氧化还原和降解反应。
例如,二氧化硫和氮氧化物会与大气中的氧气和水汽发生氧化反应,生成硫酸和硝酸,进而在大气中形成酸雨。
另外,大气中的光照会导致光解反应,产生一氧化碳等有害气体。
大气污染物的迁移和转化还受到大气气象条件的影响。
气象因素如大气湍流、温度逆温层和气压等对大气污染物的扩散和移动起着重要作用。
湍流可以搅拌和扩散大气中的污染物,减少其浓度和影响范围。
而逆温层和气压的变化会影响污染物在大气中的垂直运移。
这些气象因素的变化需要加以考虑和监测,以便更好地预测大气污染物的迁移和转化规律。
另外,大气污染物的迁移和转化还受到地理和人为因素的影响。
地理因素如地形、地貌和地表覆盖等会影响大气污染物的传输和沉降。
例如,山地地形的存在会限制大气污染物的扩散,导致山谷地区出现高浓度的污染物。
此外,人为活动也对大气污染物的排放和迁移产生了重要影响。
随着工业化和城市化的发展,人类活动排放的大气污染物数量不断增加,加剧了环境污染问题。
为了减少大气污染物的排放和保护环境,必须加强大气污染物的监测和控制。
通过监测大气污染物的浓度和变化趋势,可以评估污染物的传播和影响范围,为污染治理提供依据。
此外,还可以利用环境模型和监测数据,预测大气污染物的迁移和转化规律,规划和制定相应的治理措施。
大气环境化学大气中污染物的转化
大气环境是人类生存的基础,提供氧 气、调节气候等重要功能。
生态系统平衡的维护
大气环境是生态系统中不可或缺的一 部分,对维持生态平衡起着重要作用 。
大气污染物的来源和影响
工业排放
工业生产过程中产生的废气、烟尘 等是大气污染物的主要来源之一, 对环境和人体健康造成严重影响。
交通运输
汽车、飞机等交通工具排放的尾气 是大气污染物的重要来源,包括一 氧化碳、氮氧化物等有害物质。
限制机动车尾气排放
加强机动车尾气排放标准,推广新能源汽车,鼓励公共交通出行, 减少私家车使用。
控制生活污染源
提倡绿色生活方式,减少一次性塑料制品的使用,加强垃圾分类和 资源回收利用。
改善能源结构
增加清洁能源比重
大力发展太阳能、风能、水能等 可再生能源,逐步减少对化石能
源的依赖。
提高能源利用效率
推广节能技术和设备,加强能源管 理和监测,减少能源浪费。
包括水溶性离子、痕量元 素、碳元素等,这些组分 决定了颗粒物的物理和化 学性质。
PART 03
大气中污染物的转化过程
REPORTING
WENKU DESIGN
光化学转化
光化学转化是指大气中的污染物在阳 光的作用下,通过吸收光能发生化学 反应,从而改变其化学性质的过程。
光化学转化在大气污染物的转化中起着 重要的作用,特别是对于一些持久性有 机污染物,如多环芳烃和二噁英等。
PART 06
结论
REPORTING
WENKU DESIGN
大气环境化学的重要性和挑战
重要性
大气环境化学研究污染物在大气中的迁移、转化、归宿和影响,对于环境保护和 人类健康具有重要意义。
挑战
2.2大气中污染物的转化(1)
斯坦方程:
一个光子的能量为: E= h =
hc
(光子能量) (h为普朗克常数,
6.626×10-34Js/光子,c为光速3.0×108m/s,λ为光子波 长nm=10-9m)分子活化能为)。 如果一个分子吸收一个光量子,则1mol的分子吸收的光量子的总能量为: EN= h N=
N2+hv(<120nm)→N2*→N+N
2、臭氧分子的光解
O3:平流层中的臭氧层对地球生命起着重要的保护作用。臭氧光解对于维 持臭氧层的物质平衡具有重要作用,而且光解也存留了大量的太阳能量, 缓慢释放到大气中,成为上层大气的一个能量贮存库。
键能:是弯曲分子,E0=101.2KJ/mol,对应能够使其断裂的光子波长
例如: O3+hv→O2*+O* O2*+O3→2O2+O 3O3+hv→3O2+3OO*+O3Fra bibliotekO2+2O
3O+3O3→6O2 总反应:6O3+hv→9O2 所以对于O3消失的总量子产率为6,即吸收一个有效光子 能够导致6个O3消失。 一些比较复杂的光化学反应中的量子产率最大能够达到106。
二、大气中重要吸光物质的光解
和光化学过程均有发生,则∑φi=1,即所有初级过程的量子产率之和等于1。
表观量子产率:考虑到次级的光化学过程,一个光子可以引发 进一步的化学反应,这时的量子产率可能会远远大于1.0。例如 氯和氢的光化学合成链反应,表观量子产率105-106
Cl2+hv Cl +Cl
H2+ Cl HCl+H Cl2+ H HCl+Cl
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如此吸光后所产生的光物理或光化学过程的相对效率。 初级量子产率:表示单个初级过程的量子产率
i
i过程所产生的激发态分 子数目 (单位体积单位时间内 ) 吸收的光子总数 (单位体积单位时间内 )
所有初级过程(物理的化学的):∑φi= 1;
初级量子产率φi ≤1.0。 1、CH3COCH3 + hv (299 nm) → CO + 2CH3· (初级) 2、CH3COCH3 + hv (338 nm) → CH3CO·+ CH3·(初级) 若没有其它初级过程,φ1(CO) = φ2 (CH3CO·) = 1 因自由基测定较难,稳定产物又可能由次级反应产生,
被降水清除,寿命很长,达数年至数百年! 在O3层,在强紫外线作用下进行光解: CFXCl2 + hv = · CFXCl + · Cl · Cl + O3 = · ClO + O2
大气中有那些重要的温室 气体污染物? CO2、CH4、N2O、CFCs
· ClO + O = · Cl + O2
1个· Cl 可已发消耗10万个O3分子, 结果使臭氧层遭到破坏。
该反应是大气 中HO· 的重要 来源之一。
或:HNO2+ hv (200 - 400 nm) → NO2 + H·
RONO + hv (200 - 400 nm) → NO2 + R· HNO3及其烷基硝酸脂:
键能:EHO-NO2 = 199.4 kJ/mol
吸收: λ= 120 - 335 nm 光解:HNO3 + hv(120 – 335 nm) → NO2 + HO· RONO2 + hv → NO2 + RO·
波尔茨曼常数K = 1.38×10-23 J· K-1,T—开氏温度)。
解:根据爱因斯坦方程:
34 8 1 hc 6 . 626 10 Js 2 10 ms 19 E 6 . 626 10 (J ) 9 300 10 m 19 2 E 2 6 . 626 10 J 32000K T 由E=3KT/2: 3K 3 1.38 10 23 JK 1
多卤代烷光解至多断两个键,断键顺序:I→Br→Cl→H→F。
2.3.3 大气中重要自由基的来源
1、自由基
指带有不成对价电子的分子碎片(原子、原子团或离子)。自
由基性质很活泼,寿命很短,氧化性极强。 清洁大气中自由基浓度约为10 - 12 ppt,被污染的对流层中 更多,自由基对大气污染物的转化具有极为重要的作用。 自由基反应使分子中键能最小的部分断裂。 大气中的自由基主要有 HO· 、 HO2· 、 R· 、 RO· 、 RO2· 、 RCO· 、 RC(O)O· 、 RC(O)O2· 以 及 NO3· 。 其 中 以 HO· 和
8、卤代烃的光解
卤代烃介绍
卤代脂肪烃通式:CmHnFRClSBrT → n + R + S + T = 2m+2 制冷剂 (Freon, 氟利昂):CFC– Chloro-,Flro-,Carbon 代码:CFC-XYZ 规定:X= m-1,Y = n + 1,Z = F,Cl由通式计算出, 若X为0,则省略不写; 例如:CFC-113:C2F3Cl3; CFC-11: CFCl3;
断裂波长λ= 243 nm。 吸收: 紫外区< 243 nm, λm = 147 nm;
1
lgε 0
-1
-2 -3 -4 120 160 200 240
光解:
λ < 240 nm
O2 + hv (< 240 nm) → O + O
λ (nm)
O2吸收光谱
2、O3的光解
键能:E0 = 101.2 kJ/mol,
光化学次级过程 (1)初级过程中的反应物、生成物之间进一步发生的反应。 (2)一般光化学反应波长100-700 nm。 (3)次级过程通常是热化学反应。 举例:
大气中氯化氢的光化学过程
HCl + hv H + Cl (初级光化学分解) H + HCl H2 + Cl (次级热化学反应) Cl + Cl Cl2 (次级热化学反应) Cl2 + hv Cl + Cl (初级光化学分解) Cl + H HCl (光反应引发的热化学反应)
第三节
1.光化学反应
大气中污染物的转化
2.3.1 光化学反应基础
由吸收光子而发生的化学反应称光化学反应。 光化学的初级过程
指化学物质吸收光量子形成激发态物质及其初次转化。
(0) A + hv → A*(形成激发态) (1) A* → A + hv(辐射跃迁,光物理) (2) A* + M → A + M(无辐射跃迁,光物理) (3) A* → B1 + B2 + „„(光分解,光化学) (4) A* + C → D1 + D2 + „„(光合成,光化学)
O* + O3 → O2 + 2O
3O + 3O3 → 6O2
总反应:6O3 + hv → 9O2
吸收一个光子导致6个O3消失,ΦO3 = 6,
复杂光化学反应: Φ最大能够达到106。
2.3.2 大气中重要吸光物质的光解
1、O2的光解 键能:
4
3 2
R. A. Bailey, 1978
E0 = 493.8 kJ/mol,
纯NO2光解:
O + NO2 → NO + O2
总反应: 体系中存在O2: 2NO2 + hv → 2NO + O2 Φ = 2φ
NO2 + hv →NO + O
O2 + O → O 3 O3 + NO → O2 + NO2 Φ< φ
例:
O3 + hv → O2* + O*
O2* + O3→ 2O2 + O
CFC-22: CHF2Cl
灭火剂(Halon ,哈龙 ):Halon – XYZB 规定:X = C,Y = F,Z = Cl,B = Br
例如:Halon-1211:CF2ClBr
卤代烃光解反应
吸收: 远红外-微波 λ = 0.5 -1.25 mm 光解:
在对流层,CFCs稳定,不发生光解反应;且不溶于水,不易
R. A. Bailey, 1978
80
60
4、NO2的光解 键能: E0 =300.5 kJ/mol, λ键=420 nm 20 吸收: λ=290 - 500 nm;λm = 400 nm 光解:λ < 420 nm NO2 + hv(< 420 nm) → NO + O O + O2 → O3 (对流层O3唯一人为源)
若E0 = 170 kJ/mol,则λ≤ 704nm;
若E0 = 150 kJ/mol, 则λ≤ 798nm; 若E0 = 160 kJ/mol,则λ≤ 700nm。 注意:一般化学键的键能大于167.4 kJ/mol,故波长大于700 nm 的光不能引起光化学离解。
例题: 计算λ= 300 nm的光子能量,相当于物质分子在什么温度下的 平均动能?(提示:波尔茨曼温度与能量关系方程E = 3KT/2,
次级反应
由HO· 引发反应: HO· + NO → HNO2 HO· +HNO2→ H2O + NO2
HO· + NO2 → HNO3
若CO、 CH4存在: HO· + CO → CO2 + H HO· + CH4 → CH3 ·+ H2O 由H· 引发反应: H·+ O2 → HO2· 2HO2· → H2O2 + O2 次级反应导致
40
350
400
450
λ (nm) NO2吸收光谱
5、HNO2和HNO3及其烷基脂光解
HNO2及其烷基亚硝酸脂:
键能:EHO-NO = 201.1 kJ/mol,EH-ONO = 324.0 kJ/mol, 吸收:λ= 200 – 400 nm, 光解:HNO2+ hv (200 - 400nm)→NO + HO· RONO + hv (200 - 400nm) → NO + RO·
分子吸光过程是单光子过程,又称为光化学当量定律。 只适用于初级过程,且对高通量光子流(如激光),不能成立。
光子能量与化学键能(E0) 1mol分子吸收的光量子的总能量为:
E N 0 hc
N0 阿伏加得罗常数, 6.022×1023
若E0 = 300 kJ/mol,则λ≤ 399nm;
如CH3CO· 次级反应产生CO,故初级量子产率不易得到。
总量子产率(表观量子产率) 由整个光化学反应过程产生的光效率; 总量子产率可能会远远大于1.0。
光化学反应或其引发的 热反应形成分子数目( 单位体积单位时间内) 吸收的光子总数(单位 体积单位时间内)
举例:氯和氢的光化学合成链反应
-2
光解 :
O3 + hv(< 240 nm)→O2* + O* (高能)
200 300 400 500 600 700
λ (nm) O3吸收光谱
O3 + hv(450-700 nm)→O2 + O (低能)
(mPa-1·cm-1)
3、N2的光解 键能: E0 =939.4 kJ/mol, λ键=127 nm 吸收: λ< 120 nm;λm = 60 - 100 nm 光解(平流层以上): N2 + hv(<120 nm)→ N + N
