【天津大学】燃烧学 5-1 化学反应机理
天津市考研化学复习资料物理化学重要反应机理速记攻略

天津市考研化学复习资料物理化学重要反应机理速记攻略物理化学是考研化学科目中的一个重要部分,它涉及到很多的反应机理和速记技巧。
下面是对于天津市考研化学复习资料中物理化学重要反应机理的速记攻略。
这些反应机理的速记将帮助考生更好地理解和记忆物理化学中的知识点。
1. 酸碱中和反应机理速记酸碱中和反应是物理化学中的重要基础反应之一。
常见的酸碱中和反应有强酸与强碱中和、强酸与弱碱中和以及弱酸与弱碱中和等。
中和反应的机理可以总结为:酸中和碱时,酸的氢离子与碱的氢氧根离子结合形成水,中和反应的特点是产生中和盐及水。
2. 氧化还原反应机理速记氧化还原反应也是物理化学中的重要反应类型之一。
在氧化还原反应中,物质的电子转移会导致物质的氧化或还原。
常见的氧化还原反应有金属与非金属氧化反应、金属与酸的反应、金属与金属离子溶液的反应等。
在氧化还原反应中,电子的转移是关键,电子的转移方向决定了物质的氧化或还原。
3. 高分子化合物反应机理速记高分子化合物是考研化学中的重点内容之一。
在高分子化合物的反应机理中,常见的反应有聚合反应、加成反应、消除反应等。
在聚合反应中,单体分子通过共价键相连形成高分子分子。
在加成反应中,两个或多个分子中的一个或多个原子通过共价键相连形成新的分子。
在消除反应中,一个分子中的一个或多个原子通过共价键脱离形成两个或多个新的分子。
4. 光化学反应机理速记光化学反应是光学中的重要内容之一。
在光化学反应中,光的能量被物质吸收,然后引发物质的化学反应。
光化学反应机理可以总结为:光的能量通过吸收产生激发态的物质,激发态的物质经历各种反应路径最终回到基态。
5. 加速反应机理速记加速反应是化学反应中的一类特殊反应。
在加速反应机理中,反应速率受到外部条件(温度、压力等)的影响,反应速率可以通过改变外部条件来调节。
加速反应机理可以总结为:反应速率与反应物的浓度和反应温度成正比,反应速率常常服从指数函数的规律。
以上是对于天津市考研化学复习资料中物理化学重要反应机理的速记攻略。
乙炔燃烧的反应原理

乙炔燃烧的反应原理乙炔燃烧是一种重要的化学反应,在工业和日常生活中都得到广泛应用。
在乙炔燃烧过程中,乙炔与氧气发生反应,产生热量、光和水。
乙炔分子的化学式是C2H2,它由两个碳原子和两个氢原子组成。
乙炔是一种不稳定的分子,容易与氧气反应生成二氧化碳和水。
反应方程式如下:C2H2+2.5O2->2CO2+H2O1.起燃阶段:在起燃阶段,需要提供一定的活化能才能开始反应。
通常使用点火器或燃烧器提供火花或高温来提供活化能。
乙炔分子与氧气发生接触,发生自由基反应。
自由基反应指的是在反应中形成自由基,这些自由基能够持续参与反应并引发链式反应。
2.扩燃阶段:一旦起燃,乙炔的燃烧将进入扩燃阶段。
在乙炔分子与氧气分子接触的同时,会产生一系列自由基,如乙炔自由基(C2H•)和氧自由基(O•)。
这些自由基会不断反应,并产生新的自由基,形成一个自由基链反应。
乙炔自由基与氧自由基反应形成乙炔氧自由基(C2HO•):C2H•+O•->C2HO•乙炔氧自由基再次与氧气分子发生反应,产生乙炔醛(C2HO2•):C2HO•+O2->C2HO2•乙炔醛继续参与反应,并形成CO2和H2O:C2HO2•->CO2+H2O这些反应是连续进行的,不断释放出热量和光能。
乙炔燃烧产生的火焰有高温和明亮的特点,适用于许多应用,如焊接和切割金属。
3.熄灭阶段:当乙炔燃烧缺乏氧气或温度过低时,燃烧将变得不完全。
未燃烧的乙炔分子将进一步与氧气和已燃烧产物反应,生成一些副产物,如一氧化碳和碳。
这些副产物对环境和人体健康有害,因此需要在使用乙炔的过程中控制燃烧条件,以减少不完全燃烧的产生。
乙炔燃烧反应的原理可以总结为:乙炔分子与氧气分子反应,生成CO2和H2O。
在反应过程中,乙炔分子和氧气分子产生自由基,这些自由基不断反应并形成新的自由基,形成链式反应。
燃烧过程释放出大量的热量和光能,形成明亮且高温的火焰。
控制燃烧条件可以减少不完全燃烧的产生,提高乙炔燃烧的效率。
燃烧反应的基本原理与实例分析

燃烧反应的基本原理与实例分析燃烧反应是日常生活和工业生产中广泛存在的一种化学反应,它不仅是能量释放的重要途径,还对环境和人类生活产生着重要影响。
本文将重点探讨燃烧反应的基本原理,并通过实例分析来进一步加深对其理解。
一、燃烧反应的基本原理燃烧反应是指一种氧化还原反应,其基本原理包括燃料、氧气和点火源三个要素。
1. 燃料:燃料是引发燃烧反应的物质。
常见的燃料有木材、煤炭、石油等有机物,以及氢气、乙炔等无机物。
燃料的特点是能够与氧气发生反应,并释放出大量热能。
2. 氧气:氧气在燃烧反应中起到氧化剂的作用,它与燃料发生反应,将其氧化为二氧化碳和水等产物。
氧气的供应是燃烧反应能否进行的关键因素,在空气中氧气的浓度约为21%。
3. 点火源:点火源是引发燃烧反应的外部能量源,它能提供足够的能量使燃料发生燃烧。
点火源可以是明火、电火花或者高温等。
燃烧反应的进行包括三个过程:点火、燃烧和燃尽。
二、实例分析:蜡烛的燃烧反应蜡烛是我们日常生活中常见的燃烧反应实例。
下面以蜡烛的燃烧过程为例,通过分析来深入了解燃烧反应。
蜡烛的主要成分是石蜡,它是一种有机化合物。
当蜡烛点燃时,石蜡作为燃料与空气中的氧气发生反应,释放出大量的热能。
这是因为石蜡中的碳和氢与氧气结合形成水和二氧化碳。
燃烧过程中,蜡烛的螺纹芯提供了一个点火源,通过点燃火焰使石蜡发生燃烧。
随着燃烧的进行,火焰在蜡烛的顶端形成。
火焰分为三个区域:暗区、明区和烟区。
在火焰的底部是暗区,这个区域是石蜡的气体部分从蜡烛中释放出来后被加热并发生燃烧的地方。
在正上方是明区,明区的温度比暗区高,石蜡气体部分发生的燃烧相对更完全。
在火焰的顶部则是烟区,这个区域是不完全燃烧所产生的碳黑颗粒凝结形成的。
蜡烛的燃烧反应不仅释放出热能,还产生了光和可见烟雾。
石蜡的燃烧反应生成的火焰火苗发出了光线,产生了明亮的火光。
同时,石蜡不完全燃烧产生的碳黑颗粒凝结在空气中形成可见烟雾。
在蜡烛燃烧的过程中,燃料和氧气的供应是关键因素。
天津市考研化学复习资料有机化学重要反应机理解析

天津市考研化学复习资料有机化学重要反应机理解析有机化学是考研化学科目中的重要一部分,也是化学学科中的基础知识点之一。
在考研复习过程中,有机化学的反应机理解析是必须要掌握的内容之一。
本文将针对天津市考研化学复习资料中的有机化学重要反应机理进行解析和讲解,帮助考生更好地理解和掌握相关知识。
一、电荷密度效应和离域化程度的关系电荷密度效应和离域化程度是有机化学反应中的两个重要因素。
电荷密度效应指的是当有机分子中的共价键被断裂或形成时,电子密度会发生变化,从而导致分子发生变化的趋势。
而离域化程度则是指分子中的π电子的离域程度,也是分子稳定性的重要因素。
通过分析电荷密度效应和离域化程度,可以更好地理解有机反应的机理。
二、亲核试剂的选择与反应机理在有机化学中,亲核试剂的选择对于反应机理和反应产物的确定具有至关重要的作用。
不同的亲核试剂选择会导致不同的反应路径和不同的产物生成。
例如,卤代烷与氢氧化钠反应时,亲核试剂的选择是OH-,反应会生成相应的醇类产物。
而与氨反应时,亲核试剂的选择是NH3,反应生成相应的胺类产物。
因此,通过合理选择亲核试剂,可以有效地控制反应路径和产物生成。
三、亲电试剂的选择与反应机理亲电试剂在有机化学反应中起到了至关重要的作用。
亲电试剂是通常通过吸电子基团来实现的,如卤素等,它们能够提供亲电中心,从而参与反应。
通过选择合适的亲电试剂,可以实现不同的反应过程和产物生成。
例如,烯烃与溴水反应时,亲电试剂是Br+,反应会生成相应的溴代产物。
而与氢卤酸反应时,亲电试剂是H+,反应会生成相应的卤代烷产物。
因此,选择合适的亲电试剂是影响反应路径和产物生成的重要因素。
四、共轭体系和反应机理共轭体系是有机化学中一个重要的概念,它指的是分子中存在相互交替的单键和多键。
共轭体系的存在能够提高分子的稳定性,在一些反应过程中能够影响反应机理和产物生成。
共轭体系能够提供相应的反应中间体和反应路径,从而影响反应的进行。
燃烧气体动力学中的化学反应机理研究

燃烧气体动力学中的化学反应机理研究近年来,燃烧气体动力学中的化学反应机理研究成为了科技领域的重要研究方向。
化学反应机理是描述燃烧反应中吸热、放热以及化学反应速率等特征的一种重要的模型。
在燃烧领域如发动机、火箭等应用中,精确的化学反应机理能够为燃烧的优化提供准确的预测和解释,从而提高能源利用率并减少污染物的排放。
化学反应机理是由许多基本的反应步骤组成的。
这些步骤中包括了化学键的断裂、新键的形成、摩尔计量比例以及能量改变等重要的物理和化学参数。
要建立一个可靠的化学反应机理模型,需要对所有可能发生的反应进行严谨的分类研究。
当前,建立化学反应模型的主要方法包括实验验证和计算模拟。
其中,实验验证是建立合理机理的基础,而计算模拟则更多地用于在实验数据基础上对新理论进行检验与改进。
在实验研究中,化学反应机理的研究需要以混合气体的物理变化和化学反应等为基础。
一下涉及的实验主要是瞬态反应和稳态反应,这是两种不同形式的实验方法。
在瞬态反应中,实验研究关注于化学反应速率的瞬时变化;而在稳态反应中,实验则关注于反应达到平衡时的状态另一方面,计算模拟是化学反应研究的另一种重要手段。
普通计算机可以通过计算燃料和空气之间燃烧的化学反应过程来生成很多的燃料燃烧图像。
计算机使用燃烧数学模型,对各个化学步骤和能量转移进行计算,预测化学反应的过程和结果。
在计算模拟中,优秀的化学反应机理是保证计算结果的精确性的关键。
在实验和计算模拟的基础上,燃烧气体动力学中的化学反应机理研究包括以下几个关键领域。
第一,单子体反应机理的确定。
当存在单独分子质量糖元时,设计燃烧器并建立最合理的反应机理就是一项复杂的任务。
单体反应机理包括氧化、脱氢、脱硫和水合等反应,对于纯物质或复杂混合物都带有重要的指导意义。
第二,燃烧过程的机理研究。
在燃烧过程的气相反应中,燃料和氧化剂之间的反应会产生多个氧化远和热量释放。
燃料燃烧的机理用于设计燃烧器、评估环境影响以及诊断和优化火灾过程。
正庚烷甲苯混合物燃烧简化机理分析

力 学 的控制 , 以要 对 其进 行模 拟 计算 就需 要构 建 可 所 靠 的燃 料 氧 化 反 应 动 力 学 模 型 . 多维 模 型 与 简 化 将
收 稿 日期 : 201l 1 . 2. 一 2 0
基 金项 目: 国家 自然 科 学基 金资 助项 目 (07 0 8 ; 5 96 7) 国家杰 出青年 基金 资 助项 目(120 6 5 152 )
苯 参 比燃料 ( le e rfrn e fe, R ) t u n eee c u lT F 和基本 参 比 o
种 : 感 性分 析 法 、 化 反应 机 理 的软 件 自动 生 成法 敏 简 和 集 总法 . 文 采用 敏感 性 分析 法 进行 简 化 , 本 计算 采 用 美 国圣 地 亚 国家 实 验 室燃 烧 研 究 室开 发 的大 型气 相 化 学 和 等 离 子 体 动 力 学 的 化 学 动 力 学 分 析 软 件
( 7 , 一 步 氧 化 生 成 苯 甲醛 ( 6 C CH) 进 C H5 HO) 苯 甲 和 酰 基 ( 6 C ; 庚 烷 的 主 要 反 应 路 径 是 正 庚 烷 C H5 O) 正
实验都是在激波管或快速压缩机 中进行 , 在真实的柴 油 机缸 内的实验 却很 少. 实 际 上 , 油 包 括 芳 香 烃 , 环 芳 香 烃 (A 柴 J多 P H) 又是 生成 碳烟 的重 要前 驱物 , 以构 建正 庚烷 和典 型 所
雒 婧 1 ,尧命发 , 2
(. I 天津大学 内燃 机燃 烧学国家重点实验室 ,天津 3 0 7 ; 0 0 2 2 .河北工业大学能 源与环境 工程 学院 ,天津 3 0 0 ) 04 1 摘 要 :提 出了一个新 的包括多环芳 香烃 (AH 生成 的正庚 烷/ P ) 甲苯混合物 燃烧化学 动力学简 化机理.该 机理包括
天津大学高等教育出版社第五版《物理化学》课后习题答案第五章

化学平衡5.1 在某恒定的温度和压力下,取的A(g)进行如下化学反应若,试证明,当反应进度时,系统的吉布斯函数G值为最小,这时A, B 间达化学平衡。
5.2 已知四氧化二氮的分解反应在298.15 K 时,1•754=-mol kJ .G Δθm r 。
试判断在此温度及下列条件下,反应进行的方向。
(1) N 2O 4(100 kPa), NO 2(1000 kPa); (2) N 2O 4(1000 kPa), NO 2(100 kPa); (3) N 2O 4(300 kPa), NO 2(200 kPa); 解:由J p 进行判断14720=15298×314810×754=3.)...exp()RT G Δexp(K θm r --=5.3 1000 K 时,反应的1•39719=-mol kJ .G Δθm r 。
现有与碳反应的气体混合物,其组成为体积分数,,。
试问:(1)T = 1000 K ,p = 100 kPa 时,m r G Δ等于多少,甲烷能否形成? (2)在1000 K 下,压力需增加到若干,上述合成甲烷的反应才可能进行。
5.4 已知同一温度,两反应方程及其标准平衡常数如下:求下列反应的θK 。
解:所给反应 = (2)-(1),因此θm r θ.m r θm r G ΔG ΔG Δ12=,- θθθθθθ1212)ln (ln ln K K K K RT K RT K RT =---=-5.5 已知同一温度,两反应方程及其标准平衡常数如下:求下列反应的。
解:所给反应 = 2×(2)-(1),因此θm r θ.m r θm r G ΔG ΔG Δ122=,-θθθθθθ12212)()ln (ln 2ln K K K K RT K RT K RT =---=-注:平衡组成的计算关键是物料衡算。
5.6 在一个抽空的恒容容器中引入氯和二氧化硫,若它们之间没有发生反应,则在375.3 K 时的分压分别为47.836 kPa 和44.786 kPa 。
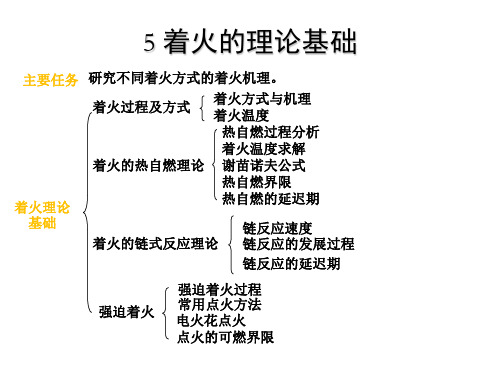
燃烧理论5着火的理论基础
环境温度T0
环境温度升高,相当于散热曲线右移,散热率 曲线与放热率曲线的交点 C降低,着火温度降 低,着火提前。
比表面积和散热系数
燃料粒径的大小 燃烧区周围的散热条件
燃料的比表面积越大,相当于散热面积越大,散热率增 加,燃料着火条件变差,着火温度上升,着火推迟;散 热系数越大,散热率越大,燃料着火条件变差,着火温 度上升,着火推迟。
着火过程是一种典型的受化学动力学控制的燃 烧现象。
5.1 着火过程及方式
一、着火的方式与机理
自然界中燃料的着火方式
自燃着火 预混可燃气体由于自身温度的升高而导致化学反应
(自燃) 速率自行加速引起的着火称为自然—— 整体加热。
强迫着火
(点燃或点火)
预混可燃气体由于外界能量的加入,如电火花等点 火源点致使预混可燃气体化学反应速度急剧加快引 起的着火——局部加热。
几种可燃气体的着火范围
名称
着火温度℃
氢 (H2) 一氧化碳 (CO)
甲烷 (CH4) 乙烷 (C2H6) 丙烯 (C3H6) 乙炔 (C2H2) 硫化氢 (H2S)
氨 (NH3) 高炉煤气
焦炉煤气
发生炉煤气
生活用煤气
天然煤气
571 609 632 472 504 305 290 651 700~800 650~750 700~800 560~750 530
TB
E 2R
1
1
4RT0
E
化简得:
TB
T0
R E
T02
得到着火的条件:
TB
TB
T0
R E
T02
物理意义:可燃混合气的温度如比容器壁过热时,即
TB
RT02 E
