浅谈苯环的亲电取代定位效应
苯环上亲电取代反应的定位规律
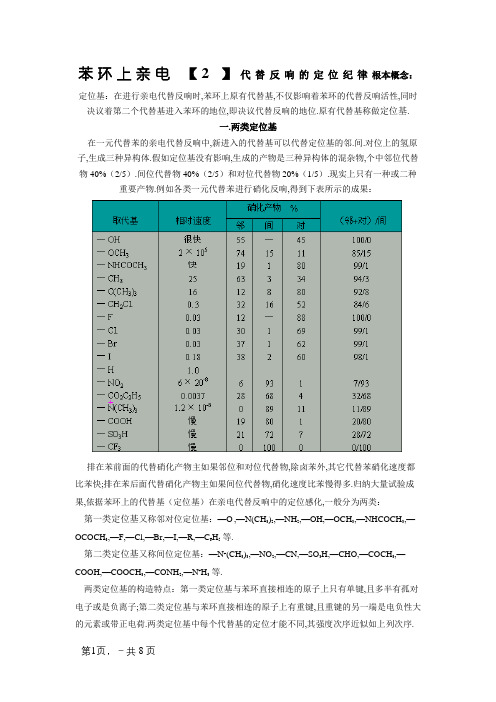
苯环上亲电【2】代替反响的定位纪律根本概念:定位基:在进行亲电代替反响时,苯环上原有代替基,不仅影响着苯环的代替反响活性,同时决议着第二个代替基进入苯环的地位,即决议代替反响的地位.原有代替基称做定位基.一.两类定位基在一元代替苯的亲电代替反响中,新进入的代替基可以代替定位基的邻.间.对位上的氢原子,生成三种异构体.假如定位基没有影响,生成的产物是三种异构体的混杂物,个中邻位代替物 40%(2/5).间位代替物 40%(2/5)和对位代替物 20%(1/5).现实上只有一种或二种重要产物.例如各类一元代替苯进行硝化反响,得到下表所示的成果:排在苯前面的代替硝化产物主如果邻位和对位代替物,除卤苯外,其它代替苯硝化速度都比苯快;排在苯后面代替硝化产物主如果间位代替物,硝化速度比苯慢得多.归纳大量试验成果,依据苯环上的代替基(定位基)在亲电代替反响中的定位感化,一般分为两类:第一类定位基又称邻对位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等.第二类定位基又称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等.两类定位基的构造特点:第一类定位基与苯环直接相连的原子上只有单键,且多半有孤对电子或是负离子;第二类定位基与苯环直接相连的原子上有重键,且重键的另一端是电负性大的元素或带正电荷.两类定位基中每个代替基的定位才能不同,其强度次序近似如上列次序.苯环上亲电代替反响的定位纪律二.定位纪律的电子理论解释在一代替苯中,因为代替基的电子效应沿着苯环共轭链传递,在环上消失了电子云密度较大和较小的瓜代散布现象,因而环上列地位进行亲电代替反响的难易程度不同,消失两种定位感化.也可以从一代替苯进行亲电代替反应生成的中央体σ络合物的相对稳固性的角度进行考核,当亲电试剂 E+进攻一代替苯时,生成三种σ络合物:Z 不同,生成的三种σ 络合物碳正离子的稳固性不同,消失了两种定位感化.1.第一类定位基对苯环的影响及其定位效应以甲基.氨基和卤素原子为例解释.甲基在甲苯中,甲基的碳为 sp3杂化,苯环碳为 sp2杂化,sp2杂化碳的电负性比 sp3杂化碳的大,是以,甲基表现出供电子的引诱效应(A).别的,甲基 C—H σ 键的轨道与苯环的π 轨道形成σ—π 超共轭系统(B).供电引诱效应和超共轭效应的成果,苯环上电子密度增长,尤其邻.对位增长得更多.是以,甲苯进行亲电代替反响比苯轻易,并且重要产生在邻.对位上.亲电试剂 E+进攻甲基的邻.间.对地位,形成三种σ 络合物中央体,三种σ 络合物碳正离子的稳固性可用共振杂化体表示:进攻邻位:进攻对位:进攻间位:亲电试剂进攻苯生成的σ 络合物的碳正离子也可以用共振杂化体表示:苯环上亲电代替反响的定位纪律的正电荷在有供电基的叔碳上,较疏散.而在显然,共振杂化体Ⅰ和Ⅱ比Ⅲ稳固,因为Ⅰc和ⅡbⅢ中,正电荷都散布在仲碳上,不稳固.所以甲基是邻对位定位基.共振杂化体Ⅲ比Ⅳ稳固,固然在Ⅲ和Ⅳ中的共振极限构造式都是正电荷散布在仲碳上,但甲基有供电性,使Ⅲ的正电荷可以疏散在环和甲基上,是以,甲基活化了苯环.从共轭效应和共振论两种不雅点剖析.考核甲苯的亲电代替反响,都得出甲基是第一类定位基.有活化苯环感化的一致结论.氨基在苯胺中,N—C 键为极性键,N有吸电子的引诱效应(C),使环上电子密度削减;但同时氮原子有孤对电子,与苯环形成供电的p—π共轭效应(D),使环上电子密度增长:在这里,共轭效应大于引诱效应,所以分解效应使是环上电子密度增长,尤其是氨基的邻位和对位增长更多.是以,苯胺进行亲电代替反响比苯更轻易,且重要产生在氨基的邻.对位上. 考核生成的中央体σ络合物碳正离子的稳固性也得到同样的结论.(3)卤原子卤原子比较特别,是一类使苯环钝化的第一类定位基.以氯苯为例,在氯苯中氯原子是强接收电子基,强的吸电子引诱效应使苯环电子密度下降,比苯难进行亲电代替反响.但氯原子与苯环又有弱的供电的 p-π 共轭效应(C的2p轨道与 Cl 的 3p 轨道形成 p-π 共轭系统,没有 C 的 2p 轨道与 N 的 2p 轨道形成的 p-π 共轭系统有用),使氯原子邻.对位上电子密度削减得不多,是以表现出邻对位定位基的性质.2.第二类定位基对苯环的影响及其定位效应以硝基苯为例解释.在硝基苯中,硝基消失着吸电子的引诱效应(E),还消失着吸电子的π-π共轭效应(F):这两种电子效应都使苯环上电子密度下降,亲电代替反响比苯难;共轭效应的成果,使硝基的间位上电子密度下降得少些,表现出间位定位基的感化.亲电试剂进攻硝基苯时,形成邻.间.对三种σ 络合物中央体:进攻邻位:进攻对位:进攻间位:共振杂化体Ⅲ比Ⅰ和Ⅱ稳固,因为在Ⅰ和Ⅱ中有正电荷散布在有强吸电子基团的叔碳上的极限构造式ⅠⅡb不稳固.是以,硝基是第二类定位基,代替反响产生在间位上.共振杂化c和体Ⅲ有强吸电子基团,与响应的苯的共振杂化体比拟,Ⅲ不稳固.是以,硝基表现出钝化苯环的感化.苯环上亲电代替反响的定位纪律三.对邻.对位产物比例的影响身分1.空间效应环上有邻对位定位基消失时,生成邻位和对位产物的比例与定位基和新进入基团的体积有关系.这两种基集团积越大,空间位阻越大,邻位产物越少.烷基苯的硝化反响跟着烷基的体积增大,邻位硝基苯的比例削减.烷基硝化反响时异构体散布苯环上原有定位基不变,跟着进入基集团积增大,邻位异构体的比例也削减.如表所示.甲基苯烷基化时异构散布2.反响温度的影响反响温度不同,邻.对位异构体的比例不同.如3.催化剂的影响运用现代催化技巧,可以掌握代替基的定位感化,如运用有择型催化感化的分子筛催化乙苯的乙基化,可以得到高选择性的对二乙苯.工业上就是用分子筛催化合成对二乙苯.后者催化脱氢,得到交联聚苯乙烯的共聚单体对二乙烯基苯:甲苯与丙烯烷基化反响,运用不同孔径的分子筛催化剂,分别得到间甲基异丙苯和对甲基异丙基苯.已运用于工业临盆装配上.间甲基异丙基苯和对甲基异丙基苯分别是制备间甲基苯酚和对甲基苯酚的原料.四.二元代替苯的定位纪律当苯环上有两个代替基时,第三个代替基进入苯环的地位,重要由本来的两个代替基的性质决议.大体上说,苯环上有两个代替基时,有三种定位情形.苯环上亲电代替反响的定位纪律1.苯环上原有两个代替基对引入第三个代替基的定位感化一致,第三个代替基进入苯环的地位就由它们配合定位.例如,下列化合物引入第三个代替基时,第三个代替基重要进入箭头所示的地位:2.苯环上原有两个代替基,对进入第三个代替基的定位感化不一致,两个代替基属统一类定位基,这时第三个代替基进入苯环的地位重要由定位感化强的代替基所决议.假如两个代替基定位感化强度较小时,得到两个定位基定位感化的混杂物:3.苯环上原有两个代替基对引入第三个代替基的定位感化不一致,两个代替基不同类定位基时,这时第三个代替基进入苯环的地位重要由第一类定位基定位:在斟酌第三个代替基进入苯环的地位时,除斟酌原有两个代替基的定位感化外,还应当斟酌空间位阻,如3-乙酰氨基苯甲酸的 2 位代替产物很少.五.定位纪律在有机合成上的运用运用定位纪律可以选择可行的合成路线,得到较高的产率和避免庞杂的分别进程.例如由甲苯合成间硝基苯甲酸,应采用先氧化后硝化的步骤:由对硝基甲苯合成2,4-二硝基苯甲酸,其合成路线有如下两条:显然第一条合成路线较合理,可以简化分别步骤,同时硝化一步反响较第二条路线的硝化一步—NO2)的定位感化是一致的. 反响易进行,因为两个代替基(—CH3,定位纪律只实用于动力学掌握的反响.例如,叔丁苯在FeCl3 催化下,与叔丁基氯反响生成对二叔丁基苯:苯环上亲电代替反响的定位纪律这与定位纪律一致,但用过量的AlCl3为催化剂,则生成1,3,5-三叔丁基苯:这是因为在过量强酸感化下,烷基化和脱烷基化达成均衡,邻.对位烷基化快,脱烷基化也轻易;间位烷基化慢,脱烷基化也较难,最后变成热力学上稳固的均三叔丁基苯.六.症结词定位基,定位纪律,两类定位基,定位纪律的性质解释,二元代替苯的定位纪律,定位纪律的运用。
苯环上的亲电子取代反应及定位效应与反应活性正文

苯环上的亲电子取代反应及定位效应与反应活性一、苯的亲电子取代反应1.简介苯环平面的上下有π电子云①,与σ键②相比,平行重叠的π电子云结合较疏松,因此在反应中苯环可充当一个电子源,与缺电子的亲电试剂③发生反应,类似于烯烃中π键④的性质。
但是苯环中π电子又有别于烯烃,π键共振形成的大π键⑤使苯环具有特殊的稳定性,反应中总是保持苯环的结构。
苯的结构特点决定苯的化学性质,它容易发生亲电子取代反应⑥。
π键σ键电子云2.卤代⑦苯与卤素作用,在三卤化铁(FeX3)的催化下,得到卤代苯,同时放出卤化氢。
(1)与Cl2反应FeCl3+Cl2+HCl反应2FeBr3+ Br2 +HBr(3)与I2反应:碘活性不够,只有与非常活泼的芳香化合物才能发生取代反应。
目前采用氧化剂将碘氧化为碘正离子后直接引入苯环。
HNO3I+I286%)铁屑与卤素反应产生三卤化铁,起到同样的作用。
3Br2+2Fe 2FeBr3苯与氯、溴的取代反应应用十分广泛。
其公认的反应历程是首先缺电子的FeX3与卤素络合,促进卤素之间σ键的极化、异裂。
FeX3+X2X++FeX4-带正电的卤素进攻苯环的π电子。
形成苯碳正离子中间体,类似于烯烃的亲电加成,这一步是速度决定步骤+二卤代烃+X-也可失去质子,恢复苯的骨架。
苯的稳定性起了决定作用,得到取代而不是加成产物。
-H++FeX3+HX3.硝化苯与浓硝酸和浓硫酸的混合物(称混酸)反应,生成硝基苯。
浓H2SO4+HNO3(浓)(98%)+H2O50℃其反应历程如下:浓硫酸的酸性比硝酸的强,它作为酸提供质子(H+),硝酸作为碱提供氢氧根(OH-),去掉一分子水,产生硝基正离子,硝基正离子具有很强的亲电子性,与苯发生亲电子取代反应。
若采用浓硝酸,则反应速度明显减慢,这是由于浓硝酸中仅存在少量的硝基正离子。
4.磺化不同浓度的硫酸与苯反应的速度不同,浓度越高反应越快。
含三氧化硫的发烟硫酸的反+H2SO4(7%SO3(52%)+H2O磺化反应也是亲电取代反应,通常认为亲电试剂是三氧化硫。
苯取代基的定位效应

苯取代基的定位效应
苯取代基的定位效应,指的是苯环上的取代基会对反应发生在苯上的位置产生一定的影响。
一、电子效应
苯环上的取代基会改变苯环的电子密度,这种改变就被称为电子效应。
电子效应可分为两种类型:电子给体效应和电子吸引效应。
1. 电子给体效应
取代基为电子给体时,它的存在会使得苯环上的电子云对它起较为弱的吸引作用,从而导致其周围苯环中的电子云较为密集。
这样,反应发生的位置往往会在给体基团的邻位或对位上。
例如,当苯环上有一个甲基(Me)取代的时候,甲基是一个电子给体,可以加强邻位或对位上的电子密度。
因此,向苯环中加入亲电试剂时,它们会在邻位或对位上进行反应。
2. 电子吸引效应
这是指苯环上的取代基为电子吸引体时,会使得周围的电子云相对稀薄。
在这种情况下,反应发生的位置通常是取代基所在的位置,即在本实例中为对位。
例如,在苯环上含有强电子吸引基硝基(NO2)时,它会强烈吸引邻位和对位上的电子云,从而使得苯环上其他位置的电子云相对稀薄。
因此,亲电试剂会选择在取代基的位置进行反应。
二、立体效应
苯环上的取代基还会影响苯上的反应位置,具体原因是取代基存在时,它们周围的空间有一定的障碍,绕过取代基需要消耗的能量会增加,因此会影响反应进展的位置。
例如,在β-溴苯乙酸甲酯的加成反应中,苯环上存在一个甲基时,它会在邻位和对位上形成立体障碍,使得反应发生在较远的对位上,从而形成β-溴苯乙酸甲酯。
总之,苯取代基的定位效应可以使得我们更加准确地设计和控制反应的位置,从而提高反应效率和成品产率。
请用共振论解释羟基对苯环上亲电取代反应定位作用的影响

请用共振论解释羟基对苯环上亲电取代反应
定位作用的影响
1 羟基对苯环上亲电取代反应定位作用
共振理论是一种电化学和化学反应的理论,它是由Friedel一家在20世纪50年代提出的,它解释了苯环芳香环中取代反应中定位作用的影响。
羟基可以在芳香环中影响取代反应的定位,从而使反应更有效地发生。
羟基对介导亲电取代反应的定位作用是通过共振效应发挥的。
羟基可以与亲电基的电子对形成共振来增强取代反应的机会。
因为羟基可以促进电子的移动,增加取代反应发生的机会,所以反应会变得更加有利。
共振效应是一种通过分子结构之间的电子色散来影响取代反应定位作用的情况。
羟基对于亲电取代反应的定位作用非常重要,它使取代反应变得更加高效。
然而,由于羟基存在大量电子,它也会使化合物稳定受到影响,所以反应位点的位置非常重要。
从这一点来看,羟基可以改变取代反应的定位和产物的稳定性。
总的来说,共振理论有助于解释羟基对苯环上亲电取代反应定位作用的影响。
由于它可以增加取代反应发生的机会,从而提高反应的效率。
但也有可能改变取代反应的定位和产物的稳定性,因此在应用这些反应时要特别注意。
苯环上的亲电子取代反应及定位效应与反应活性正文

苯环上的亲电子取代反应及定位效应与反应活性一、苯的亲电子取代反应1.简介苯环平面的上下有π电子云①,与σ键②相比,平行重叠的π电子云结合较疏松,因此在反应中苯环可充当一个电子源,与缺电子的亲电试剂③发生反应,类似于烯烃中π键④的性质。
但是苯环中π电子又有别于烯烃,π键共振形成的大π键⑤使苯环具有特殊的稳定性,反应中总是保持苯环的结构。
苯的结构特点决定苯的化学性质,它容易发生亲电子取代反应⑥。
π键σ键电子云2.卤代⑦苯与卤素作用,在三卤化铁(FeX3)的催化下,得到卤代苯,同时放出卤化氢。
(1)与Cl2反应FeCl3+Cl2+HCl反应2FeBr3+ Br2 +HBr(3)与I2反应:碘活性不够,只有与非常活泼的芳香化合物才能发生取代反应。
目前采用氧化剂将碘氧化为碘正离子后直接引入苯环。
HNO3I+I286%)铁屑与卤素反应产生三卤化铁,起到同样的作用。
3Br2+2Fe 2FeBr3苯与氯、溴的取代反应应用十分广泛。
其公认的反应历程是首先缺电子的FeX3与卤素络合,促进卤素之间σ键的极化、异裂。
FeX3+X2X++FeX4-带正电的卤素进攻苯环的π电子。
形成苯碳正离子中间体,类似于烯烃的亲电加成,这一步是速度决定步骤+二卤代烃+X-也可失去质子,恢复苯的骨架。
苯的稳定性起了决定作用,得到取代而不是加成产物。
-H++FeX3+HX3.硝化苯与浓硝酸和浓硫酸的混合物(称混酸)反应,生成硝基苯。
浓H2SO4+HNO3(浓)(98%)+H2O50℃其反应历程如下:浓硫酸的酸性比硝酸的强,它作为酸提供质子(H+),硝酸作为碱提供氢氧根(OH-),去掉一分子水,产生硝基正离子,硝基正离子具有很强的亲电子性,与苯发生亲电子取代反应。
若采用浓硝酸,则反应速度明显减慢,这是由于浓硝酸中仅存在少量的硝基正离子。
4.磺化不同浓度的硫酸与苯反应的速度不同,浓度越高反应越快。
含三氧化硫的发烟硫酸的反+H2SO4(7%SO3(52%)+H2O磺化反应也是亲电取代反应,通常认为亲电试剂是三氧化硫。
4.5 苯环上亲电取代反应定位规则解析

且为邻位或对位。
OCH3
OCH3
HNO3
85% 4-硝基-1-萘甲醚
NO2
NHCOCH3 HNO3, CH3COOH
NO2 NHCOCH3
47-49%
N-乙酰基-1-硝基-2-萘胺
原取代基为致钝基,亲电试剂进异环α-位。
NO2
NO2
HNO3 H2SO4
SO3H HNO3 H2SO4
+
NO2 45%
SbF6-
Ph
Ph
mp=221℃
4.10 芳烃的工业来源
1、从煤焦油中分离 2、从石油裂解产物中分离 3、芳构化
4.10.1 从煤焦油中分离:
•轻油<170℃: 苯、甲苯、二甲苯
H3C
CH3
•酚油170-210℃:异丙苯、均四甲苯
H3C
CH3
•萘油210-230℃:萘、甲基萘、二甲基萘等
CH3
CH3
..
H
E
Z E H
Z
Z E H
Z E H
不稳定极限结构
Z
Z
EH Z
EH
EH
不稳定极限结构
Z
Z
H
H
H
E
E
E
进攻邻位
NO2 E
H
NO2
NO2
E+ 进攻对位
EH
进攻间位
NO2
H E
NO2 E H
NO2
NO2 E
H
NO2 E H
极不稳定极限结构
NO2
NO2
EH
EH
EH
极不稳定极限结构
NO2
H E
NO2
H E
苯环上取代反应的定位规律

AAA
结论:一元取代苯发生取代反应时,反应 是否容易进行,新基团进入环上的哪个位 置,主要取决于苯环上原有的 取代基 的 性质。
第五节 苯环上取代反应的定位规律
一、一元取代苯的定位规律
1.定位基:苯环上原有的取代基。 2. 定位效应: ⑴影响取代反应进行的难易; ⑵决定新基进入苯环的位置。
AAA
3. 定位基的分类:
CH3
COOH
NO2
NH2
AAA
SO3H
2. 两个定位基的定位效应不一致
(1)两个定位基属于同一类
两个同类定位基的定位作用发生矛盾时,一般由定位能力强 的(排在前面的)定位基决定新基进入环
COOH
Cl
AAA
(2)两个定位基不是同一类
两类不同的定位基定位作用发生矛盾时,一般由邻、对位 定位基决定新基团进入环上的位置。
AAA
三、定位规律的应用
1.预测反应的主产物 例1:写出下列化合物发生硝化反应时的主要产物。 (1) OCH3 (2) NO2 (3) CH3
SO3H
AAA
练习:下列化合物进行硝化时,硝基将主要进入苯环的什 么位置?试用箭头标出。
COOH
CH3
OCH3
Cl
Br
NO2
COCH3
Br
CH3
NO2
SO3H
CH3 (少)
NHCOCH3 (少)
NO2
COOH
苯环上的取代反应是离子型反应。由于苯环上电子云密 度较大,与苯环发生取代反应的试剂都是亲电试剂,因 此苯环上的取代反应是亲电取代反应。
AAA
亲电取代反应分成三步进行: 1. 试剂在催化剂的作用下离解成亲电性的正离子(用E+表示)
苯环上亲电取代反应的定位规律

苯环上亲电取代反应的定位规律苯环上亲电取代反应的定位规律基本概念:定位基:在进行亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第二个取代基进入苯环的位置,即决定取代反应的位置。
原有取代基称做定位基。
一、两类定位基在一元取代苯的亲电取代反应中,新进入的取代基可以取代定位基的邻、间、对位上的氢原子,生成三种异构体。
如果定位基没有影响,生成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。
实际上只有一种或二种主要产物。
例如各种一元取代苯进行硝化反应,得到下表所示的结果:1.第一类定位基对苯环的影响及其定位效应以甲基、氨基和卤素原子为例说明。
甲基在甲苯中,甲基的碳为sp3杂化,苯环碳为sp2杂化,sp2杂化碳的电负性比sp3杂化碳的大,因此,甲基表现出供电子的诱导效应(A)。
另外,甲基C—H σ 键的轨道与苯环的π 轨道形成σ—π 超共轭体系(B)。
供电诱导效应和超共轭效应的结果,苯环上电子密度增加,尤其邻、对位增加得更多。
因此,甲苯进行亲电取代反应比苯容易,而且主要发生在邻、对位上。
亲电试剂E+进攻甲基的邻、间、对位置,形成三种σ 络合物中间体,三种σ 络合物碳正离子的稳定性可用共振杂化体表示:进攻邻位:进攻对位:进攻间位:亲电试剂进攻苯生成的σ 络合物的碳正离子也可以用共振杂化体表示:苯环上亲电取代反应的定位规律显然,共振杂化体Ⅰ和Ⅱ比Ⅲ稳定,因为Ⅰc和Ⅱb的正电荷在有供电基的叔碳上,较分散。
而在Ⅲ中,正电荷都分布在仲碳上,不稳定。
所以甲基是邻对位定位基。
共振杂化体Ⅲ比Ⅳ稳定,虽然在Ⅲ和Ⅳ中的共振极限结构式都是正电荷分布在仲碳上,但甲基有供电性,使Ⅲ的正电荷可以分散在环和甲基上,因此,甲基活化了苯环。
从共轭效应和共振论两种观点分析、考察甲苯的亲电取代反应,都得出甲基是第一类定位基、有活化苯环作用的一致结论。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对芳环上 的亲电取代反应来说 , 环上电子云密度高 , 芳 有 利 于 亲 电试 剂 的进 攻 . 环 上 取 代 基 的 电 子 效 应 直 接 影 响 了 芳 芳 环 上 电子 云 密 度 , 代 基 通 常 通 过 诱 导 效 应 和 共 轭 效 应 两 取 种 方 式 来 影 响芳 环上 的 电 子 云 密 度 . 如 果 直 接 与 芳 环 相 连 的 原 子 或 原 子 团 有 比碳 原 子 更 强 的 电 负性 , 通 过 键 传递 表 现 为 吸 电 子 诱 导 效 应 . 原 子 或 原 则 如 子 团 的 电负 性 比碳 原 子 小 , 表 现 为给 电子 的诱 导 效 应 . 则 共 轭 效 应 是 指 当 取 代 基 上 的 P 或 ) 道 和 苯 环 上 的 P ( 轨
两大类 : ( ) 、 位 定 位 基 , 称 为 O oto 、 ( ga 定 位 基 , 1邻 对 又 (rh ) p p r) 它 使 新 基 主要 进 入它 的 邻 位 和 对 位 ( p 6 ) o-> O . g
一
般使 苯 环活 化 , 电取 代 反应 易 于进行 , 卤素 等例 外 . 亲 但
浅 谈 苯 环 的亲 电取 代 定 位 效 应
■ 于 富 门
芳 香 族 化 合 物 是 高 考 的 重 点 , 中 苯 环 的 取 代 反 应 比 较 其 常 见 , 文 对 苯 环 的 取 代 反 应 做 } 总 结 与 概 括 , 出 定 位 效 本 j j 给 应 , 对 其的应用进行 了阐述. 并 具 有 亲 电性 的 缺 电 子 的 物 种 如 正 离 子 , 被 极 化 的 双 原 易 子 分 子 如 卤素 X 一 X 一等 称 为 亲 电 试 剂 , 环 上 的 H 被 亲 汁 。 苯 电试剂( 下称 取 代 基 ) 代 的 反 应 称 为 亲 电 取 代 . 环 上 新 导 取 苯
得多些.
卤素 因 P 道 上 的 未 共 电 子 对 能 分 散 1络 合 物 中碳 正 离 轨 3 " 子 的正 电荷 , 属 邻 、 位 定位 基 团 ( 属 弱 钝 化 基 团 ) 也 对 但 .
一
一
当 R为 吸 电子 的钝 化 基 团 时 , 电 试 剂 进 攻 R 的 间 位 所 亲 第 一 类 邻 、 位 定 位 基 , 要 使 反 应 易 于 进 行 , 使 新 导 对 主 并 入 基 进 入 苯 环 的邻 位 和 对 位 .
一
NH2 ( NHR, 2 ,一 NHC NR ) 0R ,一 O 0R ,一 R 等 . C
, ~ S)H , (3
钝 化 基 团 有 : 一 NO , 一 CN , 一 N十
一
C H O , 一 C0R , 一 C0 0 H , 一 C00 R , 一 CCl ,
一
C 1等 . 般 而 言, 接 与 芳 环 相 连 的原 子 上 带 正 电荷 或 具 一 直 般 来 说 , 对 位 定 位 基 都 是 推 电子 的 活化 基 团 ( 素 除 邻 卤
有 重 键 的杂 原 子 基 团 均属 钝 化 基 团 .
一
外 )可 向苯 Байду номын сангаас 供 电子 使 苯 环 的 电子 云 密 度 增 加 , 利 于 亲 , 有 电 取 代 反 应 的进 行 , 邻 位 和 对 位 的 电 子 云 密 度 比 间 位 增 加 但
通 常 , 接 与 芳 环 相 连 的 原 子 是 具 有 未 共 用 电 子 对 的 取 直
代 基 或 烷 基 时 , 现 为 邻 、 位 定 位 基 , 些 定 位 基 团 活 化 苯 表 对 这 环 的强 弱顺 序 大 体 上为 : 而直 接与 芳 环 相 连 的 基 团 ( - ) 由具 有 较 大 的 电 如 _C 是 负性 , 或具 重键 的 杂原 子 , 或带 正 电荷 的原子 构 成 的取 代基 时 , 表
现 为间位 定位 基 , 这类 定位 基 团钝 化苯 环 的强弱顺 序大 体上 为 :
OCH3 h02 1
第 三 类 定 位 基 , 使 反 应 较 难 进 行 , 使 新 基 导 入 邻 位 和 既 又
对位.
根 据 原有 取 代 基 对 新 基 的 定 位 作 用 , 把 定 位 基 归 纳 为 可
作 用 使 苯环 上 电 子 云 密 度 增 加 , 现 为 给 电 子 共 轭 效 应 , 使 表 如
苯 环 电子 云 密 度 降 低 , 现 为 吸 电 子共 轭 效 应 . 表
生的信息处理 、 移应 用的能力. 迁
一
取 代 基 往往 同 时 既 具 有 诱 导 效 应 , 具 有 共 轭 效 应 . 导 又 诱 效 应 的方 向 和共 轭效 应 的 方 向 可 以 相 同 , 可 以 相 反 , 们 作 也 它 用 的 总结 果 直 接 与 芳 环 上 亲 电 取 代 反 应 的 反 应 活 性 有 关 . 取
第 二 类 间 位 定 位 基 。 要 使 反 应 难 于 进 行 , 使 新 导 入 基 主 并
进入苯环 的间位.
中学鸯数理亿. 掌矫版
生 成 的 中 间 体 a络 合 物 相 对 比较 稳 定 , 中 没 有 吸 电 子 的 R 其 与 带 正 电荷 的碳 原 子 直 接 相 连 的 极 限 式 . 以吸 电 子 取 代 基 所 ( 卤素外) 除 在芳 环 的 亲 电 取 代 反 应 中表 现 为 间位 定 位 基 .
、
定 位 基 的 分 类
根 据 原 有 取 代 基 对 苯 环 亲 电取 代 反 应 的 影 响 , 即新 基 导
人 的 位 置 和反 应 的 难 易 , 其 分 成 三 类 ( 率 比来 自大 量 的 科 将 速
学实验)见表 1 , .
表 1
代基使芳环上 的电子云密度增加的 , 利 于亲电取代反应 , 有 反
在 每 年 的 高考 中 也 总 能 见 到 定 位 基 团 应 用 的 影 子 , 见 于 选 常
择 、 验 、 成 等题 型 中 . 类 知 识 点 的 考 察 不 拘 泥 于 课 本 , 实 合 这 以
教 材 中 的 内容 为 自然 生 长 点 , 大 学 教 材 相 接 轨 , 合 考 查 学 与 综
( ) 位 定 位 基 , 称 为 m( t ) 位 基 , 使 新 基 主 要 2间 又 mea 定 它
Y / \ oH \/ c o
No 2
进 入 它 的 间位 ( m) 4 ) 同 时 使 苯 环 钝 化 , 电 取 代 反 应 较 0 , 亲
作 者 单 位 : 苏 省 盱眙 中学 江
应 活 性 比苯 环 大 , 类 取 代 基 称 为 致 活 基 团 . 取 代 基 使 芳 环 这 若 上 的 电子 云 密 度 降 低 的 , 不 利 于 亲 电 取 代 反 应 , 则 反应 活 性 比
苯 环 小 , 类 取 代 基 称 为致 钝 基 团. 这 常 见 的 活 化 基 团 有 : 一 0 ‘ , ~ 0H , 一 0R ,
轨 道 交 盖形 成 更 大 的 共 轭 体 系 时 , 原 子 或 原 子 团 通 过 共 轭 如
入 的 取 代 基 的位 置 主 要 与 原 有 取 代 基 的 性 质 有 关 , 们 把 原 我
有 的 取 代 基 称 为定 位 基 , 一性 质称 为 定 位 效 应 . 中 化 学 中 这 高 有 很 多 有 关 苯 环 上 亲 电 取 代 定 位 效 应 的 例 子 , 苯 酚 和 液 溴 如 反 应 生 成 2 4 6 溴 苯 酚 , , ,一 甲苯 和 浓 硝 酸 反 应 制 取 TNT 等 ;
