苯环上亲电取代反应的定位规律
苯环上亲电取代反应的定位规律
定位规律的理论解释
H 是交替极化, 是交替极化,即使甲基的邻位和对位上 H C H 电子云密度增加的更多些, 电子云密度增加的更多些,量子化学计 甲苯中各碳上电子云密度分布如图。 算,甲苯中各碳上电子云密度分布如图。 O 甲苯中各碳上电子云密度分布如图 O 所以亲电试剂主要进攻邻位和对位。 所以亲电试剂主要进攻邻位和对位。 从反应历程和σ 络合物的稳定性看: 从反应历程和σ-络合物的稳定性看: O H H H 慢 δ E E E +E
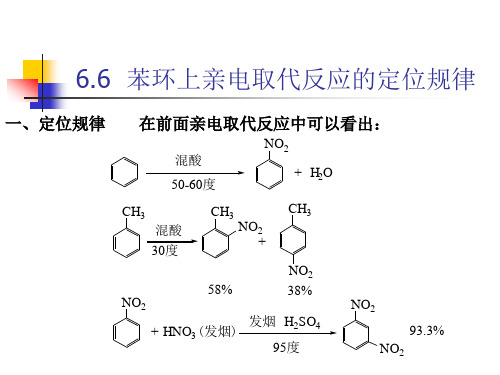
一、定位规律
由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 由此可以看出,当芳环上已有取代基时,新引入基团是否容易, 进入哪个位置,主要由芳环原来取代基的性质所决定。 进入哪个位置,主要由芳环原来取代基的性质所决定。我们把 芳环上原来的取代基叫做定位基 定位基。 芳环上原来的取代基叫做定位基。而把定位基支配新引入基团 进入芳环的位置和定位能力的大小称为定位规律或定位效应 定位规律或定位效应。 进入芳环的位置和定位能力的大小称为定位规律或定位效应。 第一类定位基称为邻 对位定位基, 第一类定位基称为邻、对位定位基,它使新引入的基团主要进入 定位基的邻、对位。除卤素之外,它们都是供电子基, 定位基的邻、对位。除卤素之外,它们都是供电子基,使芳环 上电子云密度增加,活化芳环,亲电取代活性大于苯。 上电子云密度增加,活化芳环,亲电取代活性大于苯。它们定 位能力强弱的次序为: >-OH> 位能力强弱的次序为:-O->-N(CH3)2>-NH2>- > >-NHCOCH3>-R>- >-OCOCH3>- 6H5>-F> >-C -OCH3>- >- > >-Br>- -Cl>- >- >- >-I 可以看出,这些基团与芳环相连的原子(除 和 外 都有未共用 可以看出,这些基团与芳环相连的原子 除R和Ph外)都有未共用 电子对,可以芳环发生P- 超共轭,使芳环上电子云密度增加。 电子对,可以芳环发生 -π超共轭,使芳环上电子云密度增加。
苯环亲电取代反应的定位规律和理论解释

苯环亲电取代反应的定位规律和理论解释
苯环亲电取代反应是一种常见的有机化学反应,它指的是苯环上的一个电子富位碳原子被其他物质的电子富位原子所取代的反应。
这种反应可以通过电离平衡和等温线来解释。
苯环亲电取代反应的定位规律是,取代反应的定位总是优先发生在苯环上最容易被取代的位置。
在二甲苯和苯乙烯这类苯环中,电子富位碳原子多半是取代反应的首选目标;而在苯并环烷和苯并三唑这类苯环中,取代反应更多地会发生在含氧原子的位置。
苯环亲电取代反应的理论解释可以通过极化和电离平衡来进行。
极化是指分子内部电荷分布的不均匀现象,它会导致分子内部电子密度的不均匀分布,从而使得某些原子或基团更容易被
取代。
电离平衡则是指反应中电子富余和电子缺乏的均衡状态,它决定了反应的方向和速率。
苯环亲电取代反应的定位规律可以通过电离平衡来解释。
由于苯环上某些原子的电离能更高,因此它们更容易被取代。
而由于苯环上某些原子的电离能更低,因此它们更难被取代。
这就是为什么苯环亲电取代反应的定位总是优先发生在苯环上最容易被取代的位置的原因。
通过对苯环亲电取代反应的定位规律和理论解释的研究,我们可以更好地理解和掌握这种常见的有机化学反应,并运用到实际应用中。
苯环定位规则

苯环上原有的取代基对新导入取代基有影响,这种影响包括反应活性和进入位置两个方面。
通常,苯环上原有的第一取代基称为定位基,从大量实验事实的分析总结中发现,定位基的定位作用遵循一定的规律,这一规律称为苯环上亲电取代反应定位规律(又称定位规则)。
下面分别讨论定位基的类型;定位规则的理论解释;二元取代苯的定位规律;定位规律的应用。
(一)定位基的类型1.邻、对位定位基。
这类定位基的结构特征是定位基中与苯环直接相连的原子不含不饱和键(芳烃基例外),不带正电荷,且多数具有未共用电子对。
常见的邻、对位定位基及其反应活性(相对苯而言)如下:强致活基团:―NH2(―NHR,―NR2),―OH中致活基团:―OCH3(―OR),―NHCOCH3(-NHCOR)弱致活基团:―ph(―Ar),―CH3(-R)弱致钝基团:―F,―Cl,―Br,―I这类定位基多数使亲电取代反应较苯容易进行,但卤素例外。
2.间位定位基。
这类定位基的结构特征是定位基中与苯环直接相连的原子一般都含有不饱和键(-CX3例外)或带正电荷。
常见的间位定位基及其定位效应从强到弱顺序如下:―N+H3,―N+R3,―NO2,―CF3,―CCl3,―CN,―SO3H,―COH,―COR,―COOH,―COOR,―CONH2等。
这类定位基属致钝基团,通常使苯环上亲电取代反应较苯难进行,且排在越前面的定位基,定位效应越强,反应也越难进行。
(二)定位规则的理论解释苯环上的取代反应是亲电取代反应。
因此,从反应活性的角度分析,凡有助于提高苯环上电子云密度的基团,就能使苯环活化,反应活性提高;反之,凡是使环上电子云密度降低的基团,就能使苯环钝化,反应活性降低。
从反应位置的角度分析,当苯环上没有取代基时,环上六个碳原子的电子云密度是均等的;但当苯环上有取代基时,由于取代基的电子效应沿着苯环共轭体系传递。
在环上出现了出现了电子云密度的疏密交替分布现象。
第二个取代基总是进入苯环上电子云密度相对较大的部位,从而使这些碳原子上的取代物占了多数。
苯环上亲电取代反应的定位规律

之阳早格格创做苯环上亲电与代反应的定位程序基础观念:定位基:正在举止亲电与代反当令,苯环上本有与代基,不但是效率着苯环的与代反应活性,共时决断着第二个与代基加进苯环的位子,即决断与代反应的位子.本有与代基称干定位基.一、二类定位基正在一元与代苯的亲电与代反应中,新加进的与代基不妨与代定位基的邻、间、对于位上的氢本子,死成三种同构体.如果定位基不效率,死成的产品是三种同构体的混同物,其中邻位与代物 40%(2/5)、间位与代物 40%(2/5)战对于位与代物 20%(1/5).本量上惟有一种或者二种主要产品.比方百般一元与代苯举止硝化反应,得到下表所示的截止:排正在苯前里的与代硝化产品主假如邻位战对于位与代物,除卤苯中,其余与代苯硝化速率皆比苯快;排正在苯后里与代硝化产品主假如间位与代物,硝化速率比苯缓得多.归纳洪量真验截止,根据苯环上的与代基(定位基)正在亲电与代反应中的定位效率,普遍分为二类:第一类定位基又称邻对于位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等.第二类定位基又称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等.二类定位基的结构特性:第一类定位基与苯环间接贯串的本子上惟有单键,且普遍有孤对于电子或者是背离子;第二类定位基与苯环间接贯串的本子上有沉键,且沉键的另一端是电背性大的元素或者戴正电荷.二类定位基中每个与代基的定位本领分歧,其强度序次近似如上列程序.苯环上亲电与代反应的定位程序二、定位程序的电子表里阐明正在一与代苯中,由于与代基的电子效力沿着苯环共轭链传播,正在环上出现了电子云稀度较大战较小的接替分集局里,果而环上诸位子举止亲电与代反应的易易程度分歧,出现二种定位效率.也不妨从一与代苯举止亲电与代反应死成的中间体σ络合物的相对于宁静性的角度举止观察,当亲电试剂 E+打击一与代时,死成三苯σ络合物:Z 分歧,死成的三种σ 络合物碳正离子的宁静性分歧,出现了二种定位效率.1.第一类定位基对于苯环的效率及其定位效力以甲基、氨基战卤素本子为例证明.甲基正在甲苯中,甲基的碳为 sp3纯化,苯环碳为 sp2纯化,sp2纯化碳的电背性比 sp3纯化碳的大,果此,甲基表示出供电子的诱导效力(A).其余,甲基 C—H σ 键的轨讲与苯环的π 轨讲产死σ—π 超共轭体系(B).供电诱导效力战超共轭效力的截止,苯环上电子稀度减少,更加邻、对于位减少得更多.果此,甲苯举止亲电与代反应比苯简单,而且主要爆收正在邻、对于位上.亲电试剂 E+打击甲基的邻、间、对于位子,产死三种σ 络合物中间体,三种σ 络合物碳正离子的宁静性可用共振纯化体表示:打击邻位:打击对于位:打击间位:亲电试剂打击苯死成的σ 络合物的碳正离子也不妨用共振纯化体表示:苯环上亲电与代反应的定位程序隐然,共振纯化体Ⅰ战Ⅱ比Ⅲ宁静,果为Ⅰc战Ⅱb的正电荷正在有供电基的叔碳上,较分别.而正在Ⅲ中,正电荷皆分集正在仲碳上,不宁静.所以甲基是邻对于位定位基.共振纯化体Ⅲ比Ⅳ宁静,虽然正在Ⅲ战Ⅳ中的共振极限结构式皆是正电荷分集正在仲碳上,但是甲基有供电性,使Ⅲ的正电荷不妨分别正在环战甲基上,果此,甲基活化了苯环. 从共轭效力战共振论二种瞅面分解、观察甲苯的亲电与代反应,皆得出甲基是第一类定位基、有活化苯环效率的普遍论断.氨基正在苯胺中,N—C 键为极性键,N有吸电子的诱导效力(C),使环上电子稀度缩小;但是共时氮本子有孤对于电子,与苯环产死供电的p—π共轭效力(D),使环上电子稀度减少:正在那里,共轭效力大于诱导效力,所以概括效力使是环上电子稀度减少,更加是氨基的邻位战对于位减少更多.果此,苯胺举止亲电与代反应比苯更简单,且主要爆收正在氨基的邻、对于位上.观察死成的中间体σ络合物碳正离子的宁静性也得到共样的论断.(3)卤本子卤本子比较特殊,是一类使苯环钝化的第一类定位基.以氯苯为例,正在氯苯中氯本子是强吸支电子基,强的吸电子诱导效力使苯环电子稀度落矮,比苯易举止亲电与代反应.但是氯本子与苯环又有强的供电的 p-π 共轭效力(C的2p轨讲与 Cl 的 3p 轨讲产死 p-π 共轭体系,不 C 的 2p 轨讲与 N 的 2p 轨讲产死的 p-π 共轭体系灵验),使氯本子邻、对于位上电子稀度缩小得已几,果此表示出邻对于位定位基的本量.2.第二类定位基对于苯环的效率及其定位效力以硝基苯为例证明.正在硝基苯中,硝基存留着吸电子的诱导效力(E),还存留着吸电子的π-π共轭效力(F):那二种电子效力皆使苯环上电子稀度落矮,亲电与代反应比苯易;共轭效力的截止,使硝基的间位上电子稀度落矮得少些,表示出间位定位基的效率.亲电试剂打击硝基苯时,产死邻、间、对于三种σ 络合物中间体:打击邻位:打击对于位:打击间位:共振纯化体Ⅲ比Ⅰ战Ⅱ宁静,果为正在Ⅰ战Ⅱ中有正电荷分集正在有强吸电子基团的叔碳上的极限结构式Ⅰc战Ⅱb不宁静.果此,硝基是第二类定位基,与代反应爆收正在间位上.共振纯化体Ⅲ有强吸电子基团,与相映的苯的共振纯化体相比,Ⅲ不宁静.果此,硝基表示出钝化苯环的效率.苯环上亲电与代反应的定位程序三、对于邻、对于位产品比率的效率果素1.空间效力环上有邻对于位定位基存留时,死成邻位战对于位产品的比率与定位基战新加进基团的体积有闭系.那二种基大众积越大,空间位阻越大,邻位产品越少.烷基苯的硝化反应随着烷基的体积删大,邻位硝基苯的比率缩小.烷基硝化反当令同构体分集苯环上本有定位基稳定,随着加进基大众积删大,邻位同构体的比率也缩小.如表所示.甲基苯烷基化时同构分集2.反应温度的效率反应温度分歧,邻、对于位同构体的比率分歧.如3.催化剂的效率利用新颖催化技能,不妨统造与代基的定位效率,如使用有择型催化效率的分子筛催化乙苯的乙基化,不妨得到下采用性的对于二乙苯.工业上便是用分子筛催化合成对于二乙苯.后者催化脱氢,得到接联散苯乙烯的共散单体对于二乙烯基苯:甲苯与丙烯烷基化反应,使用分歧孔径的分子筛催化剂,分别得到间甲基同丙苯战对于甲基同丙基苯.已应用于工业死产拆置上.间甲基同丙基苯战对于甲基同丙基苯分别是造备间甲基苯酚战对于甲基苯酚的本料.四、二元与代苯的定位程序当苯环上有二个与代基时,第三个与代基加进苯环的位子,主要由本去的二个与代基的本量决断.大概上道,苯环上有二个与代基时,有三种定位情况.苯环上亲电与代反应的定位程序1.苯环上本有二个与代基对于引进第三个与代基的定位效率普遍,第三个与代基加进苯环的位子便由它们共共定位.比方,下列化合物引进第三个与代基时,第三个与代基主要加进箭头所示的位子:2.苯环上本有二个与代基,对于加进第三个与代基的定位效率纷歧致,二个与代基属共一类定位基,那时第三个与代基加进苯环的位子主要由定位效率强的与代基所决断.如果二个与代基定位效率强度较小时,得到二个定位基定位效率的混同物:3.苯环上本有二个与代基对于引进第三个与代基的定位效率纷歧致,二个与代基分歧类定位基时,那时第三个与代基加进苯环的位子主要由第一类定位基定位:正在思量第三个与代基加进苯环的位子时,除思量本有二个与代基的定位效率中,还该当思量空间位阻,如3-乙酰氨基苯甲酸的 2 位与代产品很少.五、定位程序正在有机合成上的应用应用定位程序不妨采用可止的合成门路,得到较下的产率战预防搀纯的分散历程.比方由甲苯合成间硝基苯甲酸,应采与先氧化后硝化的步调:由对于硝基甲苯合成2,4-二硝基苯甲酸,其合成门路犹如下二条:隐然第一条合成门路较合理,不妨简化分散步调,共时硝化一步反应较第二条门路的硝化一步反应易举止,果为二个与代基(—CH3,—NO2)的定位效率是普遍的. 定位程序只适用于能源教统造的反应.比方,叔丁苯正在FeCl3 催化下,与叔丁基氯反应死成对于二叔丁基苯:苯环上亲电与代反应的定位程序那与定位程序普遍,但是用过量的AlCl3为催化剂,则死成1,3,5-三叔丁基苯:那是果为正在过量强酸效率下,烷基化战脱烷基化完毕仄稳,邻、对于位烷基化快,脱烷基化也简单;间位烷基化缓,脱烷基化也较易,末尾形成热力教上宁静的均三叔丁基苯.六、闭键词汇定位基,定位程序,二类定位基,定位程序的本量阐明,二元与代苯的定位程序,定位程序的应用。
4.5 苯环上亲电取代反应定位规则解析

且为邻位或对位。
OCH3
OCH3
HNO3
85% 4-硝基-1-萘甲醚
NO2
NHCOCH3 HNO3, CH3COOH
NO2 NHCOCH3
47-49%
N-乙酰基-1-硝基-2-萘胺
原取代基为致钝基,亲电试剂进异环α-位。
NO2
NO2
HNO3 H2SO4
SO3H HNO3 H2SO4
+
NO2 45%
SbF6-
Ph
Ph
mp=221℃
4.10 芳烃的工业来源
1、从煤焦油中分离 2、从石油裂解产物中分离 3、芳构化
4.10.1 从煤焦油中分离:
•轻油<170℃: 苯、甲苯、二甲苯
H3C
CH3
•酚油170-210℃:异丙苯、均四甲苯
H3C
CH3
•萘油210-230℃:萘、甲基萘、二甲基萘等
CH3
CH3
..
H
E
Z E H
Z
Z E H
Z E H
不稳定极限结构
Z
Z
EH Z
EH
EH
不稳定极限结构
Z
Z
H
H
H
E
E
E
进攻邻位
NO2 E
H
NO2
NO2
E+ 进攻对位
EH
进攻间位
NO2
H E
NO2 E H
NO2
NO2 E
H
NO2 E H
极不稳定极限结构
NO2
NO2
EH
EH
EH
极不稳定极限结构
NO2
H E
NO2
H E
苯环上亲电取代反应的定位规律

苯环上亲电取代反应的定位规律基本概念:定位基:在进行亲电取代反应时,苯环上原有取代基,不仅影响着苯环的取代反应活性,同时决定着第二个取代基进入苯环的位置,即决定取代反应的位置。
原有取代基称做定位基。
一、两类定位基在一元取代苯的亲电取代反应中,新进入的取代基可以取代定位基的邻、间、对位上的氢原子,生成三种异构体。
如果定位基没有影响,生成的产物是三种异构体的混合物,其中邻位取代物40%(2/5)、间位取代物40%(2/5)和对位取代物20%(1/5)。
实际上只有一种或二种主要产物。
例如各种一元取代苯进行硝化反应,得到下表所示的结果:排在苯前面的取代硝化产物主要是邻位和对位取代物,除卤苯外,其它取代苯硝化速率都比苯快;排在苯后面取代硝化产物主要是间位取代物,硝化速率比苯慢得多。
归纳大量实验结果,根据苯环上的取代基(定位基)在亲电取代反应中的定位作用,一般分为两类:第一类定位基又称邻对位定位基:—O-,—N(CH3)2,—NH2,—OH,—OCH3,—NHCOCH3,—OCOCH3,—F,—Cl,—Br,—I,—R,—C6H5等。
第二类定位基又称间位定位基:—N+(CH3)3,—NO2,—CN,—SO3H,—CHO,—COCH3,—COOH,—COOCH3,—CONH2,—N+H3等。
两类定位基的结构特征:第一类定位基与苯环直接相连的原子上只有单键,且多数有孤对电子或是负离子;第二类定位基与苯环直接相连的原子上有重键,且重键的另一端是电负性大的元素或带正电荷。
两类定位基中每个取代基的定位能力不同,其强度次序近似如上列顺序。
苯环上亲电取代反应的定位规律二、定位规律的电子理论解释在一取代苯中,由于取代基的电子效应沿着苯环共轭链传递,在环上出现了电子云密度较大和较小的交替分布现象,因而环上各位置进行亲电取代反应的难易程度不同,出现两种定位作用。
也可以从一取代苯进行亲电取代反应生成的中间体σ络合物的相对稳定性的角度进行考察,当亲电试剂E+进攻一取代时,生成三苯σ络合物:Z 不同,生成的三种σ 络合物碳正离子的稳定性不同,出现了两种定位作用。
苯及苯环上的亲电取代反应
五、定位规则在有机合成上的应用
CH3 NO2
例一:由
合成
CH3 CH3Cl AlCl3 con H2SO4 100 。 C
CH3 混酸 SO3H
CH3 NO2
SO3H
CH3 dil H2SO4 NO2
例二: 由 O2N
路线一:
O2N CH3 混酸 O2N
CH3 合成 O2N
COOH NO2
CH3 NO2
Cl2 h
CH2CH3
Br2 h
CHCH3 + Cl 56%
CH2CH2Cl 44%
CHCH3 (用NBS / CCl4亦可) Br 100%
溴代比氯代的选择性更高
注意α-H的卤代反应条件与苯环上的卤代反应条件 是不相同的,不可混淆。
四、取代苯的亲电取代反应的活性和定位规律
1、取代基定位及活化、钝化作用 *** 第一类定位基
HOOC NO2 COOH O2N
三、非苯系芳香烃
C H3 C H2C H2C C H 3 C l C HC H 3 C H3
AlCl 3
C H3 C H3
分子内烷基化
C H2C H2C H2 C C l
=
O
AlCl 3
分子内酰基化
=
O
不同点
a. 烷基化反应难停留在一取代阶段,而 酰基化反应却可以停留在一取代阶段。
C H3
CH3Cl AlCl 3 CH3Cl AlCl 3
在极性溶剂中,萘的酰基化产物以β-异构体为主;在非 极性溶剂中以α-异构体为主。
CH2COOH + ClCH2COOH FeCl3 KBr 。C 200-218
工业上用于制备α-萘乙酸(一种植物生长激素)
苯环上亲电取代反应的定位规律
A
A
1b
1c
A
A
+ E≡ + E
H
H
2
2a
A
A
+ ≡+
+
E
H
2b
A
+
+
E H
2c
A
+
HE
3
HE
3a
HE
3b
HE
3c
①甲苯 —CH3 供电,稳定的共振式
CH3 E
CH3 E
CH3 E
+ H≡ + H
+H
4
CH3
4a
CH3
4b
CH3
+ E≡
H
5
CH3
+E H
5a
CH3
+
E
H
5b
CH3
+
≡
+
+
HE
6
HE
单环芳烃亲电取代反应的定位规律
甲苯 硝化
CH3
HNO3+H2SO4 30℃
CH3
具有定位和活性影响
理论产率:40% 实际产率:58%
CH3
20% 38%
CH3
40% 4%
硝基苯 硝化
NO2
HNO3+H2SO4 (发烟) 95~100℃
NO2
理论产率: 40% 实际产率: 6.4%
NO2
20% 0.3%
12b
HE
12c
HE
12d
3.二取代苯的定位规律
OH
CH3
CHO
空间阻位
苯环的定位规则概要
苯环的定位规则学习目标掌握亲电取代反应的定位规则 了解定位规则的应用一、苯环的定位规则一元取代苯再进行取代反应时,新引进的基团在理论上讲应该进入原有基团的邻位、间位和对位,应该有3种不同的异构体。
但实际情况并不是这样。
例如硝化反应:CH 3HNO 3 (浓) ?+NO 2CH 3+浓H 2SO 420℃~30℃CH 3NO 2+CH 3NO 262% 33% 5%NO 2HNO 3(发烟)+NO 2NO 2+ 浓H 2SO 4NO 22NO 2NO 2+6% 1% 93%可以看出,甲苯的硝化主要生成邻对位产物,而且反应比较容易进行;硝基苯硝化主要生成间位产物,而且反应比较难以进行。
由此可见,第二个取代基进入的位置是受苯环上原有基团的影响,这种现象称为定位效应。
苯环上原有基团称为定位基。
人们根据大量实验事实,总结归纳出下面的定位规律。
1、第二个取代基在苯环上取代的位置由苯环上原有基团的性质决定,与第二个取代基的性质无关。
2、定位基分为两类:邻对位定位基,这一类基团大部分使苯环活化,致使苯环取代反应容易进行,HNO 3(浓) ?+ 浓H SO 55℃~60℃NO 2+H 2O硝基苯故又称致活基团;能支配第二个取代基在苯环上主要取代在它的邻位和对位。
常见的邻对位定位基按定位效应强弱次序排列如下:一NR 2、一NHR 、一NH 2、一OH 、一OR 、一NHCOR 、一R 、一X 间位定位基,这一类基团大部分使苯环钝化,致使苯环取代反应较难进行,故又称致钝基团;能支配第二个取代基在苯环上主要取代在它的间位。
常见的间位定位基按定位效应强弱次序排列如下:3、在苯环上有两个取代基,欲引入第三个取代基时,第三个取代基所进入的位置,取决于苯环上原有两个基团的综合效应。
当苯环上原有两个定位基的定位作用一致时,第三个取代基进入的位置由原有两个取代基共同决定。
例如:3H232当苯环上原有两个定位基的定位作用不一致时,有两种情况:一是两个定位基为同一类时,则第三个取代基进入的位置由定位效应强的取代基决定。
苯环上亲电取代反应的定位规律
HNO3 , H2SO4 30℃ ~60℃
NO2
•磺化 低温(80℃)与浓硫酸生成﹣萘磺酸;高温(165℃)
生成﹣萘磺酸。 ﹣萘磺酸与硫酸共热,也转变为﹣萘磺酸。
+ H 2SO4
80℃ 165℃
SO3H (>95 %)
SO3H (>85 %)
原因:磺酸基体积大,与8位氢原子间距小于其范德华半径之和
•分子式:C10H8;由两个苯环共用两个碳原子并联而成。
•结构:
0.142 0.136
0.1390.140
( 单 位n:m)
8α 7β
6β 5α
1α 2β
3β 4α
——两个苯环共平面;C—C键长介于C—C单键和C = C双键之间 (碳碳单键154pm长,双键134pm长);C—C键键长并不完全相同;
,故﹣萘磺酸稳定性小于﹣萘磺酸。
空间作用大(不稳定) H SO3H
空间作用小(稳定) H
SO3H
H
﹣萘磺酸动力学,﹣萘磺酸热力学控制。﹣萘磺酸是重要的
有机合成中间体,可转化为﹣萘酚、 2020/3/11
﹣萘胺等(合成偶氮染料13的
中间体)。
•酰基化(傅﹣克反应)
——概况 萘的酰基化反应产物与温度和溶剂的极性有关。低温和
NO2 还原
氧化
NO2 COOH COOH
2020/3/11
17
(c)还原反应
用金属钠在液氨和乙醇的混合液中还原生成1,4﹣二氢萘。产物中 的一个孤立双键不被还原。
Na , C2H5OH NH3 (液 )
催 化 加 氢 时 , 可 生 成 1,2,3,4 四 氢 化 萘 ( 又 称 萘 满 ) 或 十 氢 化 萘 (又称萘烷)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E
+ H≡ + H
E +H
+
E H
离域式1 共振式 1a
A
A
1b
1c
A
A
+ E≡ + E
H
2
H
2a
A
A
+ ≡+
+
E
H
2b
A
+
+
E H
2c
A
+
HE
3
HE
3a
HE
3b
HE
3c
①甲苯 —CH3 供电,稳定的共振式
CH3 E
+ H≡
CH3 E
+H
CH3 E
+H
4
CH3
4a
CH3
4b
CH3
+ E≡
H
5
CH3
氰基
–SO3H 磺酸基
–COOCH3 甲氧羰基
–COOH 羧基
–CONH2 氨甲酰基
–CHO 醛基
–COCH3 乙酰基
2. 定位规律的解释
使苯环活化 使苯环钝化
(1)反应的难易 ——由定位基的电子效应解释
电子效应通过诱导、共轭、超共轭方式产生影响。 最终结果只有两种:供电和吸电
①单项影响: —CCl3 通过诱导效应吸电
–N(CH3)2 –NHCH3
氧负离子 二甲氨基 甲氨基
–NH2 氨基
–OH 羟基
–C6H5 芳基
–OR 甲氧基
–R 甲基
–NHCOCH3 –OCOCH3
乙酰氨基
乙酰氧基
–X 弱钝化 卤素
第二类定位基:——间位定位基、钝化基(按能力排序)
+ –N(CH3)3
–NO2
–CCl3
–CN
三甲铵离子 硝基
三氯甲基
②多项影响:
—CH3 诱导:供电;超共轭:供电
方向一致: + O
—N
诱导:吸电;共轭:吸电 O-
方向不一致: 诱导:吸电;共轭(p-):供电
–C··l、–B··r 诱导>共轭,总结果:吸电
–O··H、–N··H2 诱导<共轭,总结果:供电
(2)反应的位置 ——由正碳离子共振式的稳定性解释
A
A
A
A
E
9a
HE
9b
NO2 +E
H
7c
NO2
+
E H
8c
NO2
+
HE
9c
③氯苯(p-共轭)
Cl·
Cl
+ EH≡
E +H
10
10a
Cl
Cl
—Cl 诱导(吸电)>共轭(供电)
Cl
Cl·
Cl+
E +E
E
+H
H
H
10b
10c
10d
Cl
Cl
+ E≡ + E + E
H
11
H
11a
H
11b;
+
+
E H
11c
Cl ·
+
×
Cl+
HE
12
HE
12a
HE
12b
HE
12c
HE
12d
3.二取代苯的定位规律
OH
CH3
CHO
空间阻位 产率很小 CH3
NO2
OCH3
SO3H 若定位作用不一致
SO3H
同类基团——由强者决定 不同基团——由活化基决定
OH CH3
NO2
CH3
CHO
NO2
NO2
40% 93.3%
1. 定位规律
定位 基团
A
A
B
B +
理论平均值:40%
A +
B 40%
A
B 20%
①决定反应的位置——以邻对位产率60%为标准, 分为邻对位基和间位基
②决定反应的难易——以苯的相对反应速率为标准, 分为活化基和钝化基
第一类定位基:——邻对位定位基、活化基(按能力排序
) –O-
+E H
5a
CH3
+
E
H
5b
CH3
+
≡
+
+
HE
6
HE
6a
HE
6b
CH3 +E
H
4c
CH3
+
E H
5c
CH3
+
HE
6c
②硝基苯 —NO2 吸电,不稳定的共振式
NO2 E
+ H≡
NO2 E
+H
NO2 E
+H
7
NO2
+ E≡
H
8
NO2
7a
NO2
+E H
8a
NO2
7b
NO2
+
E
H
8b
NO2
+
≡
+
+
HE
9
HE
单环芳烃亲电取代反应的定位规律
甲苯 硝化
CH3
HNO3+H2SO4 30℃
CH3
具有定位和活性影响实理际论产产率率::5480%%
CH3
CH3
20% 38%
40% 4%
硝基苯 硝化
NO2
HNO3+H2SO4 (发烟) 95~100℃
NO2
理论产率: 40% 实际产率: 6.4%
NO2
20% 0.3%
